1
A importância dos canais de aquaporinas na hidratação da pele
Ana Maria Alves Ribeiro1
[email protected]
Dayana Priscila Maia Mejia²
Pós – graduação em Estética e Cosmetologia – Faculdade Sul Americana/FASAM
Resumo
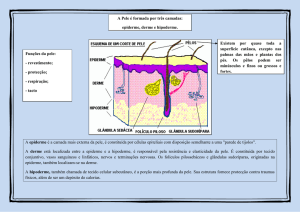
A pele é um órgão vital para o organismo humano, consiste em duas partes: a epiderme e a
derme. A epiderme é constituída de quatro ou cinco camadas e a derme de duas camadas. As
aquaporinas (AQP’s) são encontradas em todos os organismos vivos, onde permite o
transporte bidirecional de água rápido, seletivo e regulado da derme para a epiderme, sendo
que na atualidade já é conhecida no total 13 canais de AQP’s que vai da AQP0 a AQP12.
Tendo a pesquisa bibliográfica o objetivo de verificar a importância dos canais de
aquaporinas na hidratação da pele, sabem-se que canais de AQP’s são importantes sistemas
que regulam o transporte de água, assim, elas bombeiam a água da camada basal da
epiderme até o estrato córneo. O trabalho foi realizado com base de revisão bibliográfica de
caráter descritivo, cujo aporte teórico, constitui de livros, artigos de revistas, trabalho de
conclusão de curso sobre o referido assunto. Os canais de AQP’s são responsáveis pela boa
aparência de uma pessoa, por permitir mais irrigação na pele pela capacidade de absorver a
água de forma bidirecional.
Palavras-chave: Pele; Aquaporinas; Hidratação.
Introdução
A pele é um órgão vital para o organismo humano, a qual possui uma complexa estrutura de
tecidos das mais variadas naturezas, com aproximadamente 3 cm de diâmetro contém mais de
3 milhões de células, 50 terminações nervosas. A pele consiste em duas partes principais: a
epiderme, a parte superficial e a derme, a parte mais profunda. A hipoderme não faz mais
parte da pele, porem atua como sustenção para as camadas anteriores.
A epiderme é constituída de quatro ou cinco camadas, devido ao fato da camada lúcida estar
ou não incluída, sendo somente encontrada em regiões de pele espessa. Fazem parte da
epiderme as camadas germinativa (basal), espinhosa, granulosa, lúcida e córnea. A derme é
dividida em derme papilar constituída de tecido conjuntivo frouxo e reticular mais profunda e
espessa.
A pele atua protegendo a integridade física e bioquímica do corpo, mantém a temperatura
corpórea constante e fornece informações sensoriais sobre o ambiente circundante. Para a
regulação da temperatura corporal.
As aquaporinas são encontradas em todos os organismos vivos dos vários reinos devido à
extrema necessidade da regulação da homeostase celular, onde o transporte de água apenas
ocorre por difusão simples através da camada bilipídicas e/ou por transporte associado a
outros solutos. As aquaporinas permitem um transporte bidirecional de água rápido, seletivo e
regulado, em resposta a gradientes osmóticos. As aquaporinas são importantes sistemas que
regulam o transporte de água da derme para a epiderme. Na atualidade já foram descoberto 13
canais, que vai de AQP0 a AQP12.
_________________________________________
1 Pós-graduada em Estética e Cosmetologia.
2 Graduada em Fisioterapia, Especialista em Metodologia do Ensino Superior, mestrado em bioética e direito em
saúde.
2
O trabalho proposto teve como objetivo geral verificar a importância dos canais de aquaporina
na hidratação da pele, devido à capacidade de permitir a entrada e saída de água e glicerol na
célula.
1. Pele
Segundo Bérard (2006), a pele é o principal órgão tátil humano e possui várias terminações
nervosas sensíveis à dor.
A pele, também chamada de cútis, é um órgão vital para o organismo humano, a qual possui
uma complexa estrutura de tecidos das mais variadas naturezas, que são inter-relacionados
harmonicamente (SAMPAIO, 2008).
Um pedaço de pele com aproximadamente 3 cm de diâmetro contém mais de 3 milhões de
células, entre 100 e 340 glândulas sudoríparas, 50 terminações nervosas e 90 cm de vasos
sanguíneos (GUIRRO; GUIRRO, 2004).
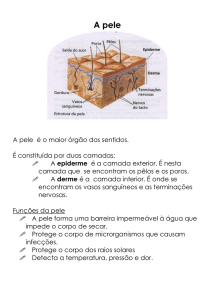
A pele consiste em duas partes principais: a epiderme, a parte superficial e a derme, a parte
mais profunda (TORTORA; GRABOWSKI, 2002).
1.1 Epiderme
A pele se compõe de uma camada epitelial pavimentosa estratificada avascular (epiderme).
Em cada camada existe considerável variação. A camada epitelial consiste em quatro a cinco
níveis de células epiteliais produtoras de queratinas (queratinócitos). Com a ausência de
capilares, as camadas do epitélio recebe nutrição por difusão. As camadas mais externas da
epiderme refletem os efeitos da desidratação (KAPIT, 2004).
As células da epiderme obtêm alimento através da difusão dos leitos capilares da derme,
sendo suficiente para estas células, que estão mais próximas, mas à medida que as células se
dividem e vão para superfície, ficam longe da fonte de alimento e morrem (GUIRRO;
GUIRRO, 2004).
Segundo Guirro; Guirro (2004) citam que a epiderme é constituída de quatro ou cinco
camadas ou estratos, devido ao fato da camada lúcida estar ou não incluída, sendo somente
encontrada em regiões de pele espessa. Fazem parte da epiderme as camadas germinativa
(basal), espinhosa, granulosa, lúcida e córnea.
Camada basal - Segundo Bath-Baloch (2012), a camada basal, ou estrato basal, é mais
profunda e está formada por uma única camada de células cúbicas sobre a membrana basal
que, por sua vez está situada em posição superior em relação a lâmina própria. A camada
basal forma a lâmina basal da membrana basal ela é também considerada como a germinativa,
pois nela ocorre a mitose das células epiteliais.
Camada espinhosa - A camada espinhosa, ou estrato espinhoso, que recebe essa denominação
pelo aparecimento de um artefato decorrente da desidratação de suas células epiteliais,
durante a preparação do tecido para o microscópio. Essas células encolhem como resultado da
perda do conteúdo líquido de seu citoplasma, porém mantem suas junções com células
adjacentes, por meio de seus desmossomos, resultando em processos pontiagudos na periferia
celular que conferem a aparência espinhosa (AZULAY, 2008).
Camada granulosa - Para Bath-Baloch (2012), a camada granulosa ou estrato grânulos, situase superficialmente à camada espinhosa. Suas células são achatadas e empilhadas em camadas
de três a cinco células ao longo de suas espessuras. No citoplasma dessas células, encontramse grânulos de querato hialina, que se destacam como pontos negros e constituem o precursor
químico da queratina encontrada nas camadas mais superficiais. A natureza química da
3
camada granulosa é precursora do material interfilamentoso da camada mais superficial:
córnea, e atua na formação do material extracelular (JUNQUEIRA; CARNEIRO, 2008).
Camada lúcida - Segundo Kapit (2004), a camada lúcida só é vista em pele espessa glabra
(desprovida de pelos). Seus queratinócitos pavimentosos são preenchidos por filamentos, os
núcleos dessas células desaparecem em grande parte.
Camada córnea - O estrato córneo apresenta células cimentadas entre si pelos lipídeos
epidérmicos e água que são liberados conforme a divisão celular. Eles retêm água e mantêm
as células hidratadas até que se desprendam (AZULAY, 2008).
Segundo Bérard (2006), a camada córnea barreira física, situada na superfície da
epiderme, está em contato direto com meio exterior e desempenha papel
essencial na defesa da pele contra as agressões. Constituída de fragmentos de
queratinócitos cimentados por vários tipos de queratina e lipídios, ela permite
que a pele absorva os choques, deixando-a impermeável e mantendo a hidratação
da epiderme (principalmente graças à ação das ceramidas, moléculas complexas
formadas de glicídios e lipídios).
A barreira natural formada pelo estrato córneo depende criticamente da sua composição,
representada pelas proteínas (75-80%), lipídeos (5-15%) e demais constituintes (KALININ,
2001). A barreira cutânea promove proteção eficaz contra microrganismo patogênicos e
regula a perda de água e de solutos. A barreira física localiza-se no estrato córneo e é
constituída por células envoltas por proteína (corneócitos com envelopes cornificados e
elementos do citoesqueleto, como por exemplo, os corneodesmossomos) (JENSEN, 2009).
Este complexo sistema proteico é formado por um conjunto de proteínas altamente insolúveis
e resistentes, que envolvem externamente os ceratinócitos e desempenham um papel
fundamental na estruturação e organização dos lipídeos intercelulares (KALININ, 2001).
Segundo Borges (2006), o estado da pele desidratada é ocasionado pela diminuição da função
da barreira do estrato córneo, consequentemente havendo o aumento da taxa de perda
transepidérmica de água. A falta de água na pele também pode modificar o cimento
intracelular, alterando a permeabilidade cutânea e promovendo tendência à descamação.
1.2 Derme
A derme localizada logo abaixo da epiderme e suas camada, tem a consistência de um gel. É
rica em diferentes estruturas: vasos sanguíneos que transportam oxigênio e nutrientes,
folículos pilossebáceos, glândulas sudoríparas e terminações nervosas. É precisamente na
derme que acontece a produção pelos fibroblastos dos dois nomes mais famoso da
dermatologia: Colágeno e Elastina (SAMPAIO, 2008).
A derme é constituída por tecido conjuntivo e apresenta papilas que se projetam para a
epiderme, apresentando função primordial relacionada à resistência e a elasticidade
(JUNQUEIRA; CARNEIRO, 2008).
Segundo Ross (2007), nesta camada é encontrado os capilares sanguíneos e também estão
presentes os apêndices da pele, como os folículos pilosos e as glândulas sebáceas e
sudoríparas. Histologicamente a derme é dividida em derme papilar, constituída de tecido
conjuntivo frouxo e localizada imediatamente abaixo da epiderme, contendo prolongamentos
nervosos e vasos sanguíneos que irrigam a epiderme, mas não penetram nela, a derme
reticular, mais profunda e espessa, constituída por tecido conjuntivo denso. Apresenta fibras
colágenas mais espessas e menor quantidade de células que a camada papilar.
4
1.3 Hipoderme
A hipoderme não faz mais parte da pele, é formada por tecido conjuntivo frouxo, responsável
pelo deslizamento da pele sobre as estruturas onde se apoia, além de servir como depósito de
gordura (JUNQUEIRA; CARNEIRO, 2008).
O tecido adiposo exerce várias funções, tais como: reservatório energético, isolamento
térmico, modela a superfície corpórea, os coxins adiposos, tecidos de preenchimento e
auxiliar na fixação de órgãos (GUIRRO; GUIRRO, 2004).
Ainda de acordo com Guirro; Guirro (2004), seu metabolismo produz hormônio de
crescimento, glicocorticóides, insulina e hormônio tiroideano. A porção mais superficial do
tecido adiposo é areolar, composta por adipócitos volumosos em disposição vertical, onde os
vasos sanguíneos são numerosos e delicados.
Camada da pele
Fonte: http://enfermeiropsf.blogspot.com.br/2013/01/feridas-e-curativos
2. Fisiologia da pele
A pele atua protegendo a integridade física e bioquímica do corpo, mantém a temperatura
corpórea constante e fornece informações sensoriais sobre o ambiente circundante. Para a
regulação da temperatura corporal, a pele conta com alterações vasomotoras como
vasoconstrição e vasodilatação das arteríolas presentes na derme e com a produção do suor
pelas glândulas sudoríparas. Quanto à manutenção da integridade bioquímica, a pele também
conta com a excreção das glândulas sudoríparas produtoras de suor, o qual contém cloretos. Já
as informações sensoriais ocorrem através de terminações nervosas que informam ao cérebro
sobre alterações de temperatura, toque, pressão, traumas e dor (GUYTON, 2012).
3. Canais de aquaporinas
As aquaporinas são encontradas em todos os organismos vivos dos vários reinos (archaea,
eubacteria, fungi, plantae e animalia) devido a extrema necessidade da regulação da
homeostase celular (KRUSE, 2006).
As aquaporinas pertencem à família de proteínas MIP (majorintrinsicprotein), encontram-se
presentes em todas as formas de vida (GOMES, 2008).
5
Atualmente sabe-se que a maioria das células de um organismo possui proteínas específicas –
as aquaporinas – que conferem à membrana uma permeabilidade à água de cerca de 5 a 10
vezes superior às membranas que não possuem estas proteínas, onde o transporte de água
apenas ocorre por difusão simples através da camada bilipídica e/ou por transporte associado
a outros solutos (ZEUTHEN, 2010). As aquaporinas permitem um transporte bidirecional de
água rápido, seletivo e regulado, em resposta a gradientes osmóticos (KRANE, 2003).
Canal de água
Fonte: EDITORA ABRIL, 2010
Segundo Rocha-Filho (1997), todo ser vivo é feito de células. No caso do corpo humano, elas
são tantas quantas as estrelas em uma galáxia: cerca de cem bilhões. Nossas células
(musculares, renais e nervosas, por exemplo) agem juntas em um complexo e delicado
sistema, cujo funcionamento envolve fantástica família de engenhos moleculares, como os
canais de água e os canais de íons. A parede celular, uma membrana composta por uma
bicamada de lipídeos, separa a célula de outras células e do meio extracelular; as células
também contêm organelas envoltas em membranas, como o núcleo, a mitocôndria e o
cloroplasto. Normalmente, essas paredes são impermeáveis a água, íons e outras moléculas
polares, mas, em muitos momentos, estas entidades têm que ser rapidamente transportadas
através das membranas, em geral em resposta a um sinal extra ou intracelular, neste momento
entram em cena diferentes canais. As aquaporinas são importantes sistemas que regulam o
transporte de água da derme para a epiderme. Assim, elas ‘bombeiam’ a água das camadas
basais da epiderme até o estrato córneo (DPD).
3.1 Descobrimento e características biológicas e moleculares dos canais de água
A descoberta das AQPs como canais que aumentam de 10 a 100 vezes a permeabilidade da
membrana à água, é relativamente recente e conduziu à atribuição do prêmio Nobel da
Química a Peter Agre em 2003 ‘For discoveries concerning channels in cell membranes’. As
aquaporinas pertencem à família de proteínas MIP (major intrinsic protein), e encontram-se
presentes em todas as formas de vida (GOMES, 2008).
Durante muito tempo, considerou-se que o transporte de água ocorria por simples difusão
entre as moléculas lipídicas das membranas celulares, sem intervenção de um sistema de
transporte específico. No entanto, as elevadas taxas de permeabilidade hídrica de algumas
6
membranas, como as dos glóbulos vermelhos e células do epitélio renal, não poderiam ser
explicadas somente por difusão (VERKMAN, 2000).
Em 1991, Preston & Agre isolaram a partir de glóbulos vermelhos uma proteína de massa
molecular 28 kDa, denominada CHIP28 (Channel Forming Intrinsic Protein of 28 kDa)
(PRESTON, 1992).
Esses autores demonstraram que a permeabilidade dos ovócitos que expressavam CHIP28 era
cinco a oito vezes maiores que aquela dos ovócitos controle e podia ser inibida De maneira
reversível por HgCl2. Esses resultados foram confirmados pela reconstituição de canais de
água funcionais em lipossomos contendo a proteína CHIP28 purificada (VERKMAN, 2005).
O primeiro canal de água descoberto foi o CHIP28, denominado posteriormente de
aquaporina 1 (AQP1). Consiste de uma proteína altamente hidrofóbica cujo peso molecular
varia de 28 kDa na forma não-glicosilada e 40 a 50 kDa na forma glicosilada. Possui seis
domínios localizados na camada bilipídica da membrana com NH2- intracelular e COOHterminal (MARPLES, 2001). Sua estrutura é assimétrica tridimensional com uma superfície
plana externa e uma protuberância citoplasmática dominante7. Repetições internas foram
previamente reconhecidas em proteínas homólogas nas quais a estrutura molecular do NH2 intracelular e do COOH - terminal é idêntica em aproximadamente 20% das moléculas,
presumivelmente devido à duplicação gênica (KWON, 2001). Os domínios mais conservados
são duas conecções hidrofóbicas: alça B (face citoplasmática) e alça E (face extracelular),
cada uma contendo uma estrutura de Asn-Pro-Ala (NPA). Para Verbavatz (2009), essa
proteína forma um tetrâmero com quatro subunidades idênticas de polipeptídios, com um
grande glycan atado em somente uma subunidade.
3.2 Distribuição dos canais de aquaporinas e a importância da aquaporina 3
Em mamíferos são conhecidas treze isoformas diferentes desta família (AQP0-AQP12), entre
elas aquaporinas ortodoxas e aquagliceroporinas, sendo diferencialmente expressas em
diferentes células e tecidos (VERKMAN, 2000).
A AQP0 É encontrada nas Células fibrosas do cristalino. Sua permeabilidade é H2O
(VERKMAN, 2005).
A AQP1 foi a primeira AQP descoberta, inicialmente denominada de CHIP28. Encontrada em
vários órgãos do trato gastrointestinal, no plexo coroide associado ao processo de secreção do
líquor, no endotélio corneano, nos eritrócitos, no rim predominantemente na membrana
plasmática basolateral do túbulo contornado proximal, além da expressão no endotélio dos
capilares glomerulares, na região mesangial e na membrana plasmática apical e basolateral da
porção delgada descendente da AH, na vasa recta e nos eritrócitos, H2O é sua permeabilidade
(PRESTON, 1992).
Em 2000 e 2001, Agre e outras equipes de pesquisa relataram as primeiras imagens de alta
resolução da estrutura tridimensional da AQP1. Com esses dados, foi possível estabelecer
modelos detalhados para explicar algumas de suas características: alta taxa de permeação,
estrita seletividade à água e a habilidade de evitar vazamento de prótons. Esta última
propriedade é crucial porque a diferença de concentração hidrogeniônica entre o interior e o
exterior da célula é a base para o sistema celular de armazenamento de energia. Em resumo, a
arquitetura dos canais permite que somente moléculas de água passem em fila indiana, sendo
que resíduos positivamente carregados presentes no canal repelem os íons h3O+. Além disso,
o campo eletrostático local gerado pela proteína muda de polaridade no meio do canal, o que
obriga as moléculas de água a fazerem uma rotação de tal modo que seus dipolos ficam
orientados em direções diferentes na parte inferior e na parte superior do canal. Isso evita a
formação de uma cadeia contínua de moléculas de água conectadas por pontes de hidrogênio,
7
desse modo bloqueando a passagem de prótons via o mecanismo de “salto de prótons’’,
conhecido como mecanismo de Grotthuss (ROCHA-FILHO, 2003).
A AQP2 é também conhecida como WCH-CD e aparentemente é o único canal de água cuja
função é regulada. Parece estar localizada exclusivamente no ducto coletor renal,
predominantemente na membrana plasmática apical, além da membrana plasmática
basolateral da porção intramedular do ducto coletor (FUSHIMI, 1993).
A AQP3 está presente no Ducto coletor renal, epiderme, epitélio das vias respiratórias e
bexiga, sua permeabilidade é H2O e glicerol (VERKMAN, 2005).
A AQP3 ou aquagliceroproteína é uma proteína transmembranar encontrada na pele,
principalmente nos queratinócitos suprabasais e basais. Essas proteínas têm uma diminuição
gradativa nas células córneas, em exposição ao sol e no envelhecimento, até seu total
desaparecimento. Esta redução tem sugerido ser responsável pela diminuição da hidratação da
camada córnea e a homeostasia cutânea. É permeável à água e ao glicerol (PRESTON, 1992).
3.3 Filtro de exclusão de tamanho (AR/R) é responsável pela entrada do glicerol na
aquaporina.
Filtro de exclusão
Fonte: PUPO, 2012.
Este filtro é constituído fundamentalmente por resíduos aromáticos e argininas e forma a
região mais estreita do poro. A existência de aquaporinas que conseguem transportar
diferentes moléculas, como o glicerol (aquagliceroporinas) está diretamente relacionada com
as diferenças estruturais do filtro ar/R (BERTZ, 2009).
Na pele, a AQP mais importante é a AQP - 3, um membro de um subgrupo da família das
aquaporinas chamadas aquagliceroporinas, a qual é responsável pelo transporte tanto de água
quanto de glicerol (BELLEMÈRE, 2007).
Desta forma, a importância do glicerol na função da epiderme proporciona uma base racional
e científica para a antiga prática de incluir o glicerol em cosméticos e preparações
farmacêuticas para o tratamento da pele (VERKMAN, 2005).
Além disso, o conteúdo de glicerol está diretamente associado a síntese de lipídeos o que
contribui para manutenção das funções cutâneas através da formação de um filme protetor na
superfície do estrato córneo (HARA, 2002).
O aumento da presença da aquaporina 3 na pele facilita a presença de água e melhora a
hidratação na camada córnea deixando macia e suave (BIOTEC 2010). Tem sido reportado
que a AQP3 e expressa em células epiteliais do rim, vias respiratórias e pele (JUNG, 1994).
8
Para Nielson (2001), o papel da AQP3 na reabsorção de agua e hidratação da pele têm sido
amplamente discutidos após ter sido observado que a expressão da AQP3 em ratinhos
favorece a hidratação e elasticidade da pele, bem como a cicatrização de feridas.
Porém, no processo natural de envelhecimento, as aquaporinas perdem seus efeitos e fazem
com que as células fiquem menos irrigadas. Cientistas das indústrias de cosméticos estão
trabalhando em prolongar o funcionamento perfeito desse tipo de aquaporina e, assim, adiar o
envelhecimento da pele através do uso de cosméticos que contém ativos que aumentam as
expressões da aquaporina com isso obtendo uma ótima hidratação na pele.
Atualmente vivenciamos um grande avanço na área cosmética e dermatológica voltadas ao
desenvolvimento de novas tecnologias, novos mecanismos de hidratação têm sido propostos,
buscando uma hidratação mais eficaz e com maior manutenção. Os ativos comprovados com
teste que estimulam aquaporina 3 são Aquasense, Aquaporina Active AQP3, Hyaloporine,
Amiporine e skin Minics (PUPO, 2012).
3.4 Aquasense
Extrato hidroglicólico da pipetadenia columbrina, planta brasileira conhecida como angico
branco tem a capacidade de aumentar a expressão da aquaporina 3, restabelecendo o
equilíbrio hídrico estão presente nos cosméticos antienvelhecimento e hidratante (FAPESP,
2011).
O teste de eficácia IN VIVO - O ativo Aquasense aumenta a Hidratação e diminui TEWL.
No índice corneométrico - Indica o aumento da hidratação por até 120 minutos.
Na cinética TEWL EM D14 (14%) - Indicou a redução TEWL por até 60 minutos
promovendo uma hidratação de maneira imediata e progressiva, sendo utilizado na pesquisa o
gel 5% de Aquasense (PUPO, 2012).
3.5 Aquaporine Active AQP3
O ativo e composto por bio-peptídeo exclusivo derivado de ácido glutâmico associado a um
dissacarídeo de plantas do deserto, Atua diretamente sobre os queratinócitos, aumentando a
produção dos genes da aquaporinas-3 e de outras moléculas envolvidas na função barreira
(derme e epiderme), possibilitando um transporte de água através das diferentes camadas.
(BIOTEC, 2010).
A comprovação da eficácia de aquaporina Active Aqp3 foi estudo IN VIVO. Foi utilizada
uma emulsão cosmética Aquaporine Active Aqp3 na pele durante 14 dias melhorando a pele
seca e sensível. Os dados para melhoria da pele ressecada 60% - sensação de
desidratação100% - coceira 33% - descamação 40%.
3.6 Hyaloporine
Violeta tricolor extrat encontrada em países da Europa, ativa a produção das AQP.
Encontrados nos cosmético antienvelhecimento, hidratante e bases (VALÉRIA, 2013).
Para comprovação de sua eficácia foi observada através da comparação do controle biológico
de 30 ng/ml de EGF e HYALORIPORINE nas concentrações 0,25% e 0,50% em células
ceratonócitos humanos, em estímulos da produção das AQP3.
Os resultados foram positivos para o aumento da síntese das AQP3 havendo uma hidratação
cutânea, tendo a possibilidade deter o aumento de ósmolise entre a derme e o estrato córneo.
Houve o estudo IN VITRO para o efeito da HYALOPRINE na expressão HAS-2. Tento o
resultado do aumento das (HAS-2) em quase 60% aumentando a hidratação (PUPO, 2012).
9
3.7 Amiporine
É um extrato de Romã purificado capaz de estabelecer o fluxo de água com o estimulo da
AQP3, encontrados no cosmético de hidratante gel creme (VALÉRIA, 2013).
O teste foi IN VIVO para avaliar o efeito de amiporine durante 1 a 3 meses com um creme a
5%. Foi observado no 1 mês de tratamento estímulos da expressão das aquaporinas no 3 mês
promoveu o aumento dos estímulos. Também foi avaliado a Amiporine nas sínteses de
colágeno através da cultura de fibroblastos humanos em condicionado de ceratinócitos, tendo
o aumento do colágeno I e III (PUPO, 2012).
3.8 Skin Mimics
É uma mistura de colesterol e ceramidas e ácidos graxos, tem a função de reparação e
encontrados na pele e estimulam as AQP3 (JESEN, 2009).
O teste feito com voluntários houve estimulação na AQP3 a nível genético, sendo que as
voluntárias que tinham mais de 50 a expressão foram maiores do que as voluntárias de idade
menor que 50.
A AQP4, isolada inicialmente no cérebro; nas células de revestimento dos ventrículos e
espaço subaracnóide, aparentemente envolvida no processo de reabsorção do líquor,
inicialmente denominada Mercurial - Insensitive Water Channel (MIWC) (JUNG, 1994).
Devido a particular característica de insensibilidade ao mercúrio conferida p9, ela presença da
alanina ligada à cisteína na posição do sítio de ligação do HgCl2 (SHI, 1996). Foi também
localizada em pulmão, principalmente traqueia e brônquios, olho, nas glândulas salivares, nas
células parietais gástricas, na glândula lacrimal, no fígado e na medula renal e na membrana
basolateral das células principais dos ductos coletores medulares (IMDC), principalmente na
porção inicial da IMDC com pequena fração presente em vesículas intracelulares distribuídas
no citoplasma das células do DC (TERRIS, 1995).
A AQP5, a última AQP clonada e identificada até o momento, foi localizada na glândula
salivar de rato, glândulas lacrimais, córnea e fígado (RAINA, 1995) e, recentemente, isolada
em glândula submaxilar de humanos, sua permeabilidade é H2O (LEE, 1996).
AQUAPORINAS
PERMEABILIDADE
AQP6
H2O e aniões
AQP7
H2O e glicerol
AQP8
H2O
AQP9
H2O
TECIDO/LOCALIZAÇÃO
CELULAR
Rim (células intercaladas do
ducto
coletor;
vesículas
intracelulares).
Testículo, espermatozoides, rim
(túbulo
proximal),
tecido
adiposo.
Testículo,
esperma,
trato
gastrointestinal, placenta, rim
(túbulo proximal e ducto de
coleta),
fígado,
glândulas
salivares, fígado, pâncreas,
intestino, coração.
Fígado, testículos, esperma,
baço,
cérebro,
leucócitos,
cérebro.
10
AQP10
H2O e glicerol
AQP11
Duodeno, jejuno,
delgado.
Rim, fígado.
Intestino
AQP12
Células acinares pancreáticas.
Fonte: adaptação de (VAN, 2000). Obs: as AQP 11 e 12 (VERKMAN, 2005).
Tabela 1 – Aquaporinas de mamífero e sua classificação de acordo com a seletividade.
Devido as aquaporinas serem encontradas em vários tecidos elas são responsável pelo
transporte de água e outros solutos, com isso se tornam importantes em vários processos
fisiológicos como: fluído glamular, mecanismo de concentração urinário, hidratação
epidérmica entre outros (SHI, 1996). A água possui um papel crucial para a vida devido as
suas propriedades físicas e químicas únicas. Todos os processos bioquímicos e fisiológicos de
um organismo dependem da presença de água, sendo está o componente fundamental na
manutenção da sua homeostase (VERBAVATZ, 2009).
Metodologia
A metodologia aplicada na realização deste estudo foi uma revisão bibliográfica de caráter
descritivo, baseada em pesquisa em livros, artigos e sites da internet, como Scielo, Bireme,
Lilacs e Medline.
Para a pesquisa dos artigos foram utilizadas as seguintes palavras-chave: pele, aquaporinas e
hidratação, sendo realizado o cruzamento posterior entre as mesmas. Os artigos foram
pesquisados na língua portuguesa, inglesa (com tradução no Google Tradutor) compreendidos
entre o período de 1992 a 2012, visando um amplo estudo sobre a importância dos canais de
aquaporinas na hidratação da pele.
Resultados e Discussão
A presente revisão bibliográfica objetivou-se estudar a importância dos canais de AQP na
hidratação da pele descrevendo os benefícios com estimulação de ativos na AQP3 que trazem
muita irrigação em sequência deixando a pele hidratada com essa descoberta das aquaporinas
e sua ativação e uma força à mais que os profissionais ganharam para combater a desidratação
da pele e entre outros.
Todo o ser vivo é feito de células no caso do corpo humano são cerca de bilhões nossas
células agem juntas em um complexo e delicado sistema com isso envolve fantásticas família
de engenhos moleculares, como os canais de água. As aquaporinas permite um transporte de
água rápida (ROCHA-FILHO, 1997).
Nos mamíferos são conhecidos 13 que vai da AQP0 Á AQP12. O papel crucial das AQP3 na
hidratação do estrato córneo é determinante na aparência e nas propriedades físicas da pele
(VERKMAN, 2005).
A presença das AQP3 diminui gradativamente até o completo desaparecimento na camada
queratinizada da pele. Da mesma maneira, o conteúdo de água é excepcionalmente alto nas
camadas basais da epiderme aproximadamente 75% e reduz gradativamente no estrato córneo,
o qual contém somente 10-15% de água (BOURY 2006).
Estudos tem demostrado que a não-expressões dos canais de AQP3 na pele levam a uma
redução da hidratação do estrato córneo e da elasticidade da pele (HARA, 2002).
11
Segundo Valéria (2013) novos mecanismo de hidratação tem sido propostos como os ativos
Aquasense, Aquaporine Active AQP3, Hyalopine, Amiporine e Skin Mimics que são
responsáveis por estimular o aumento das expressões das AQP3.
Havendo o aumento das expressões favorece a hidratação da pele. As aquaporinas são
responsáveis pela hidratação epidérmica (VERKMAN, 2012).
Conclusão
Para pesquisar a importância dos canais de AQP na hidratação da pele foi preciso conhecer
sobre a pele, como ela se divide e como é feita sua fisiologia. Dentro das camadas a existência
de canais de AQP’s com suas estruturas capazes de identificar uma molécula de água e
permitindo o seu transporte, com isso causando hidratação na pele, ressaltando os grandes
resultados positivos dos ativos na AQP3 que resulta no seu aumento de quantidade de canais
permitindo mais irrigação na pele.
Apesar de não se encontrarem em todas as células, as aquaporinas desempenham um
importante papel e estão presentes nas membranas onde é necessária uma passagem rápida
das moléculas de água de modo a que essas células possam desempenhar as suas funções.
Para além de transportarem água, algumas destas proteínas podem transportar glicerol,
contribuindo, por exemplo, para o metabolismo dos lipídeos nos mamíferos.
Os canais de AQP são responsáveis pela boa aparência de uma pessoa, por ter a capacidade de
absorver a água de forma bidirecional conduzindo-as até a camada da epiderme dando-lhe um
aspecto hidratado. A agua é a substância mais importante em células e indispensáveis à vida.
Referências Bibliográficas
AZULAY, David. Dermatologia. 5ª Ed. São Paulo: Guanabara, 2008.
BATH-BALOCH, Mary; FEHRENBACK, Margareth. Anatomia, Histologia e Embriologia dos Dentes e das
Estruturas Orofaciais. 3ª Ed. Rio de Janeiro: Elsevier, 2012.
BELLEMÈRE G, VON S. Retinoic Acid Increases Aquaporin 3 Expression in Normal Human Skin. J
Invest Dermatol, 2008.
BÉRARD, Frédéric. Pele e Sol. São Paulo: Larousse, 2006.
BERTZ, E; BECKER, D. In Vitro Analysis and Modification of Aquaporin Pore Selectivity. Handbook of
Experimental Pharmacology, 2009.
BORGES, Fábio. Dermato Funcional - Modalidades Terapêuticas nas Funções Estéticas. São Paulo: Phorte,
2006.
BOURY- JAMOT M; SOUGRAT R; TAILHARDAT; LE VARLERT B; BONTÉ F; DUMAS M;
VERBAVATZ JM. Expression and Function of Aquaporins in Human Skim : Is a Aquaporins Just a
Glicerol Taransporter. Biochim Bioph Acta (2006).
12
DPD, Departamento de Pesquisa e Desenvolvimento, Consulfarma.
FUSHIMI K; UCHIDA S. Cloning and Expression of Apical Membrane Water Channel of Rat Kidney
Collecting Tubule. Nature, 1993.
GOMES, Dulcineia Maria Eugênia. Expressão e Localização Subcelular de Aquaporinas. Dissertação de
Mestrado em Genética Molecular. Universidade o Minho, 2008.
GUIRRO, Elaine; GUIRRO, Rinaldo. Dermatologia Funcional. 3ª Ed. São Paulo: Manole, 2004.
GUYTON, Arthur. Energia, Metabolismo e Regulação da Temperatura Corporal: Fisiologia e Mecanismos
das Doenças. 12ª Ed. Rio de Janeiro: Elsevier, 2012.
HARA, M; MA, T; VERKMAN, A.S. Selectively reduced glycerol in Skin Aquaporina-3-Deficiente Mice
May Account for Impaired Skin Hydration, Elasticity, Andbarrier Recovery. The Journal of Biological
Chemistry, Vol.277 (2002).
http://www.revistapesquisa.fapesp.br/2011/12/26/beleza-retocada/REVISTACIENTIFICA(AQUASENSE)
http://www.biotecdermo.com.br/pdf/Revista%20Biotec%2005.pdf.Ano2-n.5-2010.
JESEN, J. M; PROKSCH, E. The Skin’s Barrier. G. Ital Dermatol Venereol, 2009.
JUNG J. S; BHAT V. Preston GM et al. Molecular Characterization of an Aquaporin cDNA From Brain:
Candidate Osmoreceptor and Regulator of Water Balance. Proc Natl Acad Sci USA, 1994.
JUNQUEIRA, Luiz; CARNEIRO José. Pele e Anexos: Histologia Básica. 11ª Ed. Rio de Janeiro: Guanabara,
2008.
KALININ, A; STEINERT, P. M. Assembly of the Epidermal Conified Cell Envelope. Journal of Cell Science,
2001.
KAPIT, Wynn; LAWERENCE, Elson. Anatomia: Um Livro Para Colorir. 3ª Ed. São Paulo: Roca, 2004.
KAUSE, E. The Aquaporins Proteins Family Review. Vol. 7. Genome Biology, 2006.
KRANE, C. M; KISHORE, B. K. Aquaporins: The Membrane Water Channels of the Biological Word.
Biogist, 2003.
KWON, T.H; HAGER, H. Physiology and Pathophysiology of Renal Aquaporins. Semin Nephrol, 2001.
13
LEE, M. D; BHAKTA K. Y. The Human Aquaporin-5 Gene. Molecular Characterization and
Cromossomal Localization. J Biol Chem, 1996.
MARPLES, D. Roles in Renal Function and Peritoneal Dialysis. Perit Dial, 2001.
NIELSON, S; FROKIAER, J. Aquaporins in the Kidney: From Molecules to Medicine. Physiological
Reviews, 2001.
PRESTON, G. M.; CAROLL, T .P. Appearance of Water Channels in Xenopus Oocytes Expressing Red
Cell CHIP28 Protein. Science, 1992.
PUPO, Mauricio. Aquaporinas – Bases Científicas e Regulação da Hidratação Cutânea. São Paulo:
Associação Médica Brasileira, 2012.
RAINA S.; PRESTON G. M. Molecular Cloning and Characterization of an Aquaporin cDNA From
Salivary, Lacrimal and Respiratory Tissues. J Biol Chem, 1995.
ROCHA – FILHO, Romeu. Prêmio Nobel97 e a Decisão Sobre os Nomes dos Elementos Químicos.
Química Nova na Escola, 1997.
ROCHA – FILHO R.C. Nobel 2003 Canais de Agua e de Íons. Química Nova na Escola, 2003.
ROSS, Michael; PAWLINA, Wojciech. Histologia: Texto e Atlas. 5ª Ed. São Paulo: Panamericana, 2007.
SAMPAIO, P. A.S; RIVITTI A. E. Dermatologia 3ª Ed. São Paulo: Artes Médicos, 2008.
SHI, L. B. Selected Cysteine Point Mutations Confer Mercurial Sensitivity to the Mercurial-insensitive
Water Channel MIWC/AQP4. Biochemistry, 1996.
TERRIS, J.; ECELBARGER, C. A. Distribution of Aquaporin-4 Water Channel Expression Within Rat
Kidney. Am J Physiol, 1995.
TORTORA, Gerard; GRABOWSKI, Sandra. Princípios de Anatomia e Fisiologia. 9ª Ed. Rio de Janeiro:
Guanabara, 2002.
VALERIA, Maria de Souza. Ativos Dermatológicos: Dermocosméticos e Nutracêuticos. 10ª Ed. São Paulo:
Pharmabooks, 2013.
14
VAN, O. S; KAMSTEEG, E. J. Physiological Relevance of Aquaporins: Luxury or Necessity? European
Journal of Physiology, 2000.
VERBAVATZ, JM; BOURY-JAMOT, M. Skin Aquaporins: Function in Hydration, Wound Healing and
Skin Epidermis Homeostasis. Handb Exp Pharmacol, 2009.
VERKMAN, A. S. Aquaporins in clinical medicine. Rev. Med, 2012.
VERKMAN, A. S. More Than Just Water Channels: Unexpected Cellular Roles of Aquaporins. Journal of
Cell Science, 2005.
VERKMAN, A. S; MITRA, A. K. Structure and Function of Aquaporin Water Channels. Am J Physiol
Renal Physiol, 2000.
VERKMAN ,A.S. Aquaporine in Clinical Medicine. Annu. Rev. 63 (2012).
ZEUTHEN, T. Water Transporting Proteins. Membran e Biol, 2010.