QUÍMICA
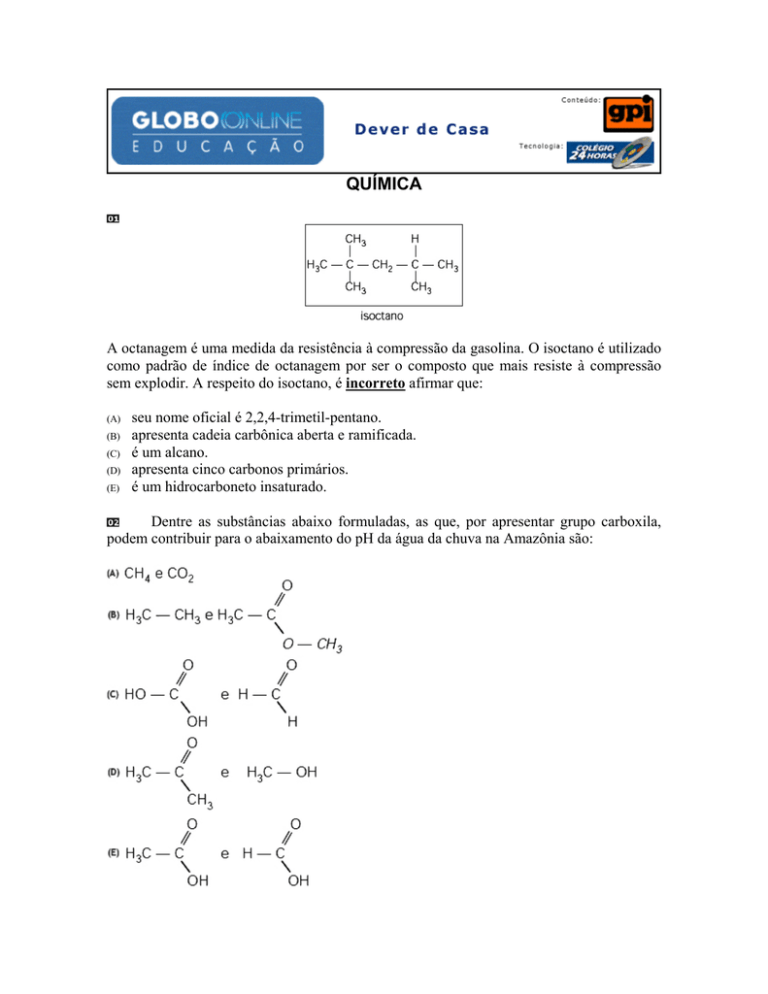
A octanagem é uma medida da resistência à compressão da gasolina. O isoctano é utilizado
como padrão de índice de octanagem por ser o composto que mais resiste à compressão
sem explodir. A respeito do isoctano, é incorreto afirmar que:
(A)
(B)
(C)
(D)
(E)
seu nome oficial é 2,2,4-trimetil-pentano.
apresenta cadeia carbônica aberta e ramificada.
é um alcano.
apresenta cinco carbonos primários.
é um hidrocarboneto insaturado.
Dentre as substâncias abaixo formuladas, as que, por apresentar grupo carboxila,
podem contribuir para o abaixamento do pH da água da chuva na Amazônia são:
Do xilitol, substância utilizada em determinadas gomas de mascar, que evita as
cáries dentárias, é incorreto afirmar que:
(A)
(B)
(C)
(D)
(E)
é um álcool.
tem fórmula molecular C5H12O5.
tem cadeia carbônica normal.
possui somente carbonos primários e secundários.
tem massa molar igual a 29g/mol.
O número de substâncias pertencentes às funções aldeído e cetona, que apresentam
fórmula molecular C4H8O, é:
(A)
(B)
(C)
2.
3.
4.
(D)
(E)
5.
6.
Uma substância que já foi utilizada em protetores solares é o ácido-para-aminobenzóico (PABA), cuja fórmula estrutural é:
Compostos que apresentam pelo menos um grupo hidroxila ligado diretamente a
átomo de carbono saturado ou são álcoois, ou têm o grupo funcional dos álcoois. A única
fórmula que não se encaixa na informação acima é:
Os derivados carbonilados constituem uma das mais importantes classes de
compostos na Química Orgânica:
Analisando os compostos acima, a opção que apresenta a classificação correta para as
funções químicas presentes em cada um deles é:
(A)
(B)
(C)
(D)
(E)
I — amida; II — aldeído; III — éster; IV — cetona; V — anidrido;
carboxílico.
I — cetona; II — aldeído; III — anidrido; IV — amida; V — éster;
carboxílico.
I — cetona; II — ácido carboxílico; III — anidrido; IV
V — éster; VI — aldeído.
I — cetona; II — aldeído; III — anidrido; IV — éster; V — amida;
carboxílico.
I — ácido carboxílico; II — éster; III — anidrido; IV
V — aldeído; VI — cetona.
VI — ácido
VI — ácido
— amida;
VI — ácido
—
amida;
Sempre que houver carbono hibridizado sp, deverão aparecer nesse carbono:
(A)
(B)
(C)
(D)
(E)
2 ligações pi e 2 ligações sigma.
3 ligações pi e 1 ligação sigma.
1 ligação sigma e 3 ligações pi.
4 ligações sigma.
3 ligações pi e 2 ligações sigma.
A proteína dentina, presente no esmalte externo dos dentes, contém o ácido
aminobutanodióico, que é uma mistura racêmica do ácido I-aspártico e d-aspártico. Os
números de ligações sigma (σ) e pi(π) existentes no ácido aminobutanodióico (C4O4H7N)
são, respectivamente:
(A)
(B)
(C)
15 e 4.
8 e 2.
13 e 2.
(D)
15 e 2.
(E)
8 e 4.
As nomenclaturas oficiais dos compostos representados pelas fórmulas estruturais a
seguir são, respectivamente:
(A)
(B)
(C)
(D)
(E)
I, 5-metil-hexeno-2; II, 2-etil-butanol-4; III, 4-metil-pentanona-2.
I, 5-metil-hexeno-2; II, 3-metil-pentanol-1; III, 4-metil-pentanona-2.
I, 2-metil-hexeno-4; II, 2-etil-butanol-4; III, 2-metil-pentanona-4.
I, 5-metil-hexeno-2; II, 3-etil-butanol-1; III, 4-metil-pentanona-2.
I, 5-metil-hexeno-3; II, 2-etil-butanol-4; III, 2-metil-pentanona-4.
Em um laboratório químico, um aluno identificou três recipientes com as letras A, B e C.
Utilizando água destilada (pH = 7), o aluno dissolveu quantidades suficientes para obtenção de
soluções aquosas 0,1 mol/L de cloreto de sódio, NaCl, acetato de sódio, CH3COONa, e cloreto de
amônio, NH4Cl, nos recipientes A, B e C, respectivamente. Após a dissolução, o aluno mediu o
pH das soluções dos recipientes A, B, C. Os valores corretos obtidos foram, respectivamente:
(A)
(B)
(C)
= 7, > 7 e < 7.
= 7, < 7 e > 7.
> 7, > 7 e > 7.
(D)
(E)
< 7, < 7 e < 7.
= 7, = 7 e < 7.
Uma das aplicações nobres da energia nuclear é a síntese de radioisótopos que são
aplicados na Medicina, no diagnóstico e tratamento de doenças. O Brasil é um país que se
destaca na pesquisa e fabricação de radioisótopos. O fósforo-32 é utilizado na Medicina
nuclear para tratamento de problemas vasculares. No decaimento deste radioisótopo, é
formado enxofre-32, ocorrendo emissão de:
(A)
(B)
(C)
partículas alfa.
partículas beta.
raios gama.
(D)
nêutrons.
(E)
raios X.
A equação acima representa a desintegração do 23892U, radioisótopo usado na datação de
fósseis. Os valores do número atômico e do número de massa do chumbo são,
respectivamente:
(A)
(B)
(C)
70 e 200.
90 e 234.
89 e 234.
(D)
(E)
82 e 206.
76 e 200.
Dados os potenciais de redução das semi-reações, I e II:
III -
Cu2+ + 2e— → Cu0
Al3+ + 3e— → Al0
E0 = +0,34V
E0 = —1,66V
o valor da ddp da pilha Al / Al3+ // Cu / Cu2+ é:
(A) +4,30V.
(B) —2,00V.
(C) +1,32V.
(D)
(E)
+2,00V.
—1,32V.
pH de algumas soluções a 25°C
2,0 suco gástrico
10,0 preparado para tintura de
cabelos
5,0 urina
8,0 solução aquosa de bicarbonato
de sódio
Consultando a tabela de pH, verifica-se que:
(A)
(B)
(C)
a urina é mais ácida que o suco gástrico.
a concentração de íons OH1— é igual a 10—6 mol/L na solução de bicarbonato de sódio.
o preparado usado na tintura de cabelos é neutro.
(D)
(E)
a urina é neutra.
a solução de bicarbonato de sódio é mais ácida que a do suco gástrico.
Na combustão de uma fita de magnésio, é produzido um sólido branco A. Este reage
com a água, formando uma substância B, que provoca mudança de cor do tornassol, de
vermelho para azul. As substâncias A e B:
_Dados : Mg (2 A ou 2) ; O (6 A ou 16) ; H (Z=1)_
(A)
(B)
(C)
(D)
(E)
têm fórmula MgO2 e MgOH, respectivamente.
são dois óxidos.
são um hidróxido e um ácido, respectivamente.
têm fórmula MgO e Mg(OH)2, respectivamente.
são um hidróxido e um sal, respectivamente.
Um copo contém, inicialmente, 20mL de uma solução aquosa 0,1 molar de uma
substância desconhecida. De uma bureta se deixa cair, gota a gota, uma solução aquosa, 0,1
molar, de outra substância, também desconhecida. Sabe-se que uma das substâncias em
questão é um ácido e a outra é uma base. Após a adição de cada gota da bureta, o pH do
conteúdo do copo é monitorado e o resultado desta monitoração do pH é mostrado no
gráfico a seguir:
Da observação do gráfico, qual era a natureza das soluções iniciais no copo e na bureta?
Substância
no copo
(A) ácido forte
(B) base forte
(C) ácido fraco
(D) ácido forte
(E) base fraca
Substância
na bureta
base forte
ácido fraco
base forte
base fraca
ácido fraco
Observe a tabela a seguir:
Ácidos
Fluorídrico, HF
Ka(25ºC)
6,5 x 10—
4
Nitroso, HNO2
Benzóico, C6H5 —
COOH
Acético, CH3 —
COOH
Propiônico, C2H5
— COOH
Hipocloroso,
HOCl
Cianídrico, HCN
4,5 x 10—
4
6,5 x 10—
5
1,8 x 10—
5
1,4 x 10—
5
3,1 x 10—
8
4,9 x 10—
10
Das soluções aquosas de concentração 0,1mol/L dos seguintes ácidos:
III III IV V-
fluorídrico;
benzóico;
acético;
propiônico;
cianídrico.
a que apresenta menor pH é:
(A)
(B)
(C)
I;
II;
III;
(D)
(E)
IV;
V.
Observe as seguintes semi-reações:
Zn+2 + 2e— Zn0
Fe+2 + 2e— Fe0
E0 = —0,75V
E0 = —0,44V
Assinale a opção que contém a afirmativa correta:
(A)
(B)
(C)
(D)
(E)
O eletrodo de zinco é o agente redutor.
O eletrodo de ferro sofrerá corrosão.
Os elétrons migrarão do eletrodo de ferro.
O eletrodo de zinco terá a sua massa aumentada.
A solução da semicélula de ferro terá excesso de íons ferro.
A partir do momento em que uma planta ou animal morrem, deixam de incorporar
átomos de carbono. O teor do isótopo 14C decai com o tempo, de acordo com o gráfico:
Qual a meia-vida do 14C?
(A)
(B)
(C)
5600 anos.
56 anos.
8400 anos.
(D)
(E)
11200 anos.
7 anos.