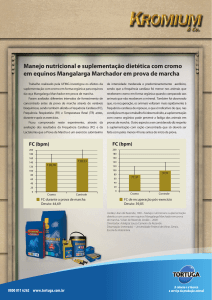
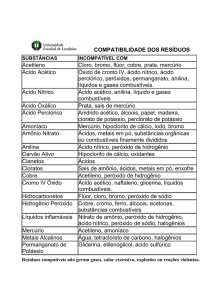
Poluentes inorgânicos
Fontes de emissão
Química das águas QFL 3201
Aline Nardi
Aline Soreira
Camila Gabani
Fernando Pereira
Gabriel Martins
Gabriel Psendziuk
Fontes de poluição da água
Poluentes inorgânicos
Agrotóxicos: inseticidas, herbicidas e
fungicidas;
Fertilizantes: nitrogênio e fosfóro;
Metais pesados: mercúrio, arsênio,
chumbo, cromo, cobre, cádmio, etc.
Metais pesados
Fontes de emissão, toxicidade,remediação e
limites no ambiente
Mercúrio, Hg
Conduz muito bem eletricidade
Líquido a T ambiente
Extremamente volátil
Mercúrio, Hg
Principais fontes:
•
•
•
•
•
•
•
•
•
lâmpadas fluorescentes e de mercúrio;
combustão de carvão e óleo combustível;
incineração de lixo (o quais contêm produtos de uso doméstico,
tais como baterias e lâmpadas);
indústria de cloro-álcalis;
mineração de metais como ouro e prata;
amálgamas dentários;
manufatura de inseticidas;
fábrica de tintas;
lixiviação de rochas e do solo.
Mercúrio - Fontes
Fontes de mercúrio
http://www.horta.uac.pt/port/pesquisa/marine_ecology
Indústria cloro-ácalis
O Hg líquido é usado como cátodo da célula
eletrolítica. O sódio metálico produzido na eletrólise
por redução combina-se com o mercúrio, sendo
removido da solução de cloreto de sódio sem reagir
com o meio aquoso.
Na+(aq) + e- → Na (em amálgama Na/Hg)
Contaminação
Nem todo o mercúrio é reciclado, sendo que
uma pequena parte é lançada ao ar e vertida
no rio do qual é obtida a água de refrigeração.
O mercúrio é oxidado até formas solúveis por
bactérias presentes nas águas naturais,
tornando-se acessível aos peixes.
Derivados de metilmercúrio
Compostos mistos menos voláteis: CH3HgX;
Solúvel no tecido gorduroso dos animais;
Bioacumulação e biomagnificação
Formação de Metilmercúrio
http://www.unites.uqam.ca/gmf/caruso/doc/pdf/Mauro_1999.pdf
Toxicidade de Metilmercúrio
Tem grande afinidade por átomos de
enxofre dos grupos sulfidrila de
proteínas e alta solubilidade em
ambientes lipídicos.
Remediação
As técnicas correntes de remediação de
mercúrio utilizam processo físico-químicos,
extremamente dispendiosos, perturbadores
do ambiente e ineficazes. Um sistema de
fitorremediação, em que as plantas
extraem, sequestram ou desintoxicam o
mercúrio dos sedimentos poderá ser uma
solução mais atraente.
Padrões de Mercúrio para água potável
OMS: Organização Mundial da Saúde
Cobre, Co
Coloração avermelhada
Dúctil
Maleável
Bom condutor de eletricidade
Cobre, Co
O cobre é um elemento essencial a vida
e uma pessoa adulta tem cerca de
100mg de cobre no organismo.
No entanto, acima de um determinado
limite é considerado tóxico.
Padrões de Cobre para água potável
A água com conteúdo superior a 5 ppm tem sabor desagradável.
Curva dose-resposta
Fontes de contaminação
O derramamento
mostrado na foto provem
de uma mina abandonada
em Idaho. A coloração
turquesa da água e
rochas se deve a
presença de precipitados
de cobre.
Fontes de contaminação
No rio Iguaçu (Curitiba), devido ao
lançamento de resíduos industriais, foi
encontrado um acúmulo anual de
aproximadamente 900 kg de cobre, em
uma área de drenagem de 30 km2.
Coleta no rio Iguaçu
Pesquisador coletando amostra de água do rio Iguaçu na
divisa dos municípios de Curitiba e São José dos Pinhais
(foto: Grupo de Química Ambiental / UFPR)
Aguardente contaminada
De acordo com um estudo coordenado
pela UFLA, 6,7% das amostras de
cachaça de alambique coletadas
estavam com limites de [Cu2+] acima dos
permitidos pelo MAPA.
ARSÊNIO, As
Semi-metal ou Metalóide
Negro
(forma α)
Vapor de arsênio
esfriado lentamente
Cinza ou metálico
(forma α)
Densidade é de 5,73
g/cm³,
Estrutura
romboédrica
Amarelo
(forma γ)
Vapor de arsênio
esfriado
rapidamente
Fontes
Volatilização – 26.000 t As/ano;
Atividades vulcânicas – 17.000 t As/ano;
Erosão do solo;
20º elemento mais abundante na crosta
terrestre; 14º na água do mar e 12º no
nosso organismo;
Aplicações
Produção mundial estimada entre 750 – 1000 t
As/ano;
Refino de rochas, fusão Fe e Pb, produção de
vidro, tintas, corantes, fabricação de ligas não
ferrosas, gás arsina (AsH3) - ind. de
microeletrônicos, conservante de madeira, uso
veterinário – anti parasitário, ração animal,
pesticidas, inseticidas, herbicidas...
Trióxido de arsênio para tratamento de leucemia
promiocelítica aguda
Toxicidade
Maioria dos compostos orgânicos e
inorgânicos são um pó branco-sem cor e
odor;
Compostos inorgânicos são quase 100
vezes mais tóxicos que os orgânicos, sendo
os primeiros eliminados na urina e os
últimos fixados nos órgãos;
O contato com As pode ser letal;
Toxicidade
Exposição em doses orais de 3 a 30 mg As
/ kg massa corpórea pode causar irritação
estomacal e intestinal, dor, náusea vômito,
diarréia, diminuição na produção de células
brancas e vermelhas causando fadiga,
alteração de batimentos cardíacos e
funções nervosas.
Padrões de Arsênio para água potável
NA: Nível de ação
Toxicidade
Casos
Quadrilátero ferrífero – MG – mineração;
Chile, Argentina, Índia, Ásia – altos teores
de arsênio natural – mais de 140 milhões
de pessoas em risco se verificarmos níveis
de potabilidade da Europa ou América do
Norte;
Amapá – Cidade de Santana, constatado
altos níveis de arsênio – 25 mortes por
câncer e 37 abortos naturais
Casos de contaminação por água
O. Selinus e A. Frank em Medical Geology
Remediação
Biológica: Plantas que têm alta captação de
metais – UFV - Azolla caroliniana, Salvinia
minima e Lemna gibba
Química: Remediação Eletrocinética –
UFPR – 2003 - eletroincrustração ao
eletrodo, precipitação ou co-precipitação ao
eletrodo, bombeamento da água próxima
ao eletrodo, ou complexação com resinas
de troca iônica.
Cádmio, Cd
Dúctil e maleável
Metal branco azulado
Cádmio, Cd
Podemos encontrar o cádmio em
diversos minérios, associado a outros
elementos.
Seu nome vem do antigo nome que
recebia, junto com carbonatos de zinco,
por ser um contaminante deste material.
Fontes
Indústria: 2000 ton ano-1 ;
34% do consumo total: revestimentos
metálicos;
23% do consumo total: pigmentos;
15% do consumo total: estabilizador
para plásticos (principalmente PVC)
Outros: fotografia, televisão, BATERIAS.
Toxicidade
Elemento altamente tóxico, vem sendo
descrito como um dos elementos traços
mais perigosos de todos os metais
contaminantes presentes nos alimentos
e no ambiente do homem, por sua ampla
distribuição.
Padrões de Cádmio para água potável
Acima disso do limite estabelecido de 5 ppb há efeitos de curto e
longo prazo de exposição.
Efeitos a curto prazo
Náuseas, vomito, diarréia, paralisia
muscular, salivação excessiva,
distúrbios sensoriais, convulsões,
choque e falhas no sistema renal.
Efeitos a longo prazo
Exposições prolongadas ao cádmio,
podem causar danos ao fígado, ossos e
sangue.
Absorção
Entra na corrente sanguínea por absorção no estomago ou nos
intestinos;
1 a 5% ingerido por via oral absorvido pelo sangue;
É transportado pela corrente sanguínea até o fígado;
Absorvido e armazenado nas células tubulares dos rins.
Rins excretam de 1 a 2% do cádmio obtido diretamente das fontes
ambientais.
Concentração nos rins 10 mil vezes maior que no sangue.
A vida biológica do cádmio nos humanos varia de 13 a 40 anos.
Não se sabe que o cádmio tenha algum efeito benéfico, porém pode
causar alguns efeitos adversos para a saúde. Embora as exposições
prolongadas sejam extremamente raras atualmente, a ingestão de altas
doses é causa de severas irritações no estomago provocando vômitos e
diarréias, e sua inalação causa graves irritações nos pulmões
Remediação
Há vários estudos que utilizam biomassa (biossorção);
Saccharomyces cerevisiae;
Variam, desde estudos do pH ótimo para biossorção
até a melhor temperatura para que o processo ocorra.
Biomassa inativa Saccharomyces cerevisiae foi
utilizada para adsorver íon cádmio de efluentes
sintéticos, preparados a partir de dissolução de um
preparado comercial de cádmio.
Método de remediação
Efluentes sintéticos, preparados a partir de
dissolução de um preparado Merck (titrisol) em
diversas concentrações (de 30 e 175 mg L-1)
mantidas condições como pH (em torno de 6),
temperatura (30°C), condição da biomassa (inativa
após 24 horas em estufa à 70°C, seca em estufa
por 24 horas à 105°C e com concentração fixa de
0,01g L-1)
Resultado da remediação
Observou-se bons níveis de adsorção em
relação a outros tipos de biomassa tais como o
do Sargassum sp.(com 120 mg g-1), chegando
se a níveis de adsorção de 97,87 mg g-1
observados para a amostra de maior
concentração de cádmio (175 mg L-1) sob agitação
de 70 RPM.
Conclusão
Apesar da situação em que se realizou o teste,
pode-se prever um método com potencial para
melhor acondicionamento de dois tipos de
resíduo, embora sempre seja melhor evitar a
produção de resíduos por mudanças de
processo ou mesmo por extinção de processos.
Chumbo, Pb
Baixo Ponto de Fusão
Maleável
Mal condutor de eletricidade
Pb, Histórico
O usado desde de a antiguidade
A produção mundial de chumbo e seus
compostos é da ordem de milhões
toneladas/ano
Eles estão no nosso dia-a-dia.
Ex:Baterias de carros e o “zarcão”
Características
Elemento não essencial
Bioacumulativo
Não Biomagnificativo
Fontes
Decorrentes do uso “doméstico”
Profissional
Toxicidade
Independe da rota de entrada
(inalação/ingestão)
Está associada as formas iônicas(Pb2+ e Pb4+)
e ao chumbo orgânico tetravalente
Acontece através de 2 processos principais:
1. Mimese da Ca2+
2. Reação grupos funcionais, em especial o
enxofre dos grupos sulfidrilas
Padrões de Chumbo para água potável
NA: nível de ação
Tratamento Clínico
Principalmente através de quelantes,
sendo os mais usados EDTA,
penicilamina e dimercaprol.
Cromo, Cr
Cromo Nativo
Fontes
Este elemento químico se encontra naturalmente
no solo, em rochas, na poeira e gases de vulcões.
São quatro os números de oxidação do metal:
cromo(0), cromo(II), cromo(III) e cromo(VI).
Cromo(III) tem ocorrência natural no meio
ambiente, enquanto cromo(VI), cromo(II) e
cromo(0) são geralmente produzidos por
processos industriais.
Aplicações
O cromo é empregado principalmente para fazer aços
inoxidáveis e outras ligas metálicas.
O mineral cromita, é empregado na indústria de
refratários para fazer tijolos de fornos metalúrgicos.
Tratamentos superficiais como a galvanoplastia.
Manufatura de pigmentos, curtume de couro, que é a
principal responsável pela contaminação de cromo.
Contaminação por curtume
Agentes usados: dicromatos e sulfatos
de cromo.
Emissões podem chegar a 1,6 mg/mL.
Toxicidade
Solúvel em pH fisiológico, Cromo (VI) é o mais
perigoso;
Quando no organismo, são reduzidos a
Cromo (III);
Causa danos às estruturas celulares;
Por ser acumulativo, ao longo dos anos,
ocorre a falência dos orgãos, levando à morte;
Padrões de Cromo para água potável
Remediação
Remoção por flotação de precipitados a
partir de cloreto de cromo hexahidratado
e dodecilsulfato de sódio (DSS).
Bibliografia
Shriver & Atkins, Química Inorgânica p. 457.
BIRD C. Química ambiental 2ªed -.p. 417 a 430
Moreira FR, Moreira JC. Os efeitos do chumbo sobre o organismo humano e seu significado para a saúde. Rev. Panan Salud Publica. 2004;
15 (2):119-29.
AZEVEDO FA, CHASIN AAM. As bases toxicológicas da ecotoxicologia São Carlos : Rima, 2003 São Paulo
http://www.rbo.org.br/materia.asp?mt=1375&idIdioma=1 consultado em 20/04/2008
http://www.christus.com.br/infochristus/tabperiodica/elementos/cromo/cromo.htm
http://www.hottopos.com.br/regeq8/biaggio.htm
http://www.webelements.com/webelements/elements/text/Cr/index.html
http://www.merck.com/mmpe/sec01/ch005/ch005a.html#tb005_1
http://environmentalchemistry.com/yogi/periodic/Cr.html
http://www.icdachromium.com/
http://www.cnpma.embrapa.br
S. ALBERTINI, L. F. do CARMO, L. G. do PRADO FILHO: ISOTERMAS DE ADSORÇÃO DE CÁDMIO POR Saccharomyces cerevisiae
M. F. C. S. CANUTO, J. M. FERREIRA , F. L. H. da SILVA, O. L. S. ALSINA, L. S. C. OLIVEIRA. E. B. Cavalcante, W. C. GOMES, M. R.
MEDEIROS : REMOÇÃO DO ÍON METÁLICO CÁDMIO (Cd2+) UTILIZANDO RESÍDUO DA INDÚSTRIA ALCOOLEIRA.
http://www.freedrinkingwater.com/water-contamination/cadmium-contaminants-removal-water.htm
FERREIRA, J. M; MELO, J. C. S ; CONRADO, L .S; VILAR, E. O; CAVALCANTI, E .B; ALSINA; O. L.S; SILVA, F. L .H: ESTUDO DA
REMOÇÃO DO CÁDMIO EM EFLUENTES DE INDÚSTRIAS PETROQUIMICAS UTILIZANDO A SACCHAROMYCES CEREVISIAE
http://biblioteca.universia.net/html_bura/ficha/params/id/16031860.html
http://www.geologiabr.hpgvip.ig.com.br/index_noticias/Atividademine07do10.htm
http://www.tede.ufv.br/tedesimplificado/tde_busca/arquivo.php?codArquivo=55
http://www.ekosbrasil.org/anexos/ekos/10_Proposta_de_revitalizacao_do_brownfield_na_area_do_antigo_incinerador_de_pinh
eiros.pdf
http://www.maxwell.lambda.ele.puc-rio.br/cgi-bin/PRG_0599.EXE/10019_5.PDF?NrOcoSis=31975&CdLinPrg=pt
http://noticias.terra.com.br/ciencia/interna/0,,OI1869445-EI298,00.html
http://www.mundodoquimico.hpg.ig.com.br/toxicologia_dos_metais_pesados.htm
http://nautilus.fis.uc.pt/cec/hiper/sonia%20rocha/hipertexto/arsenio/arseniosaude.htm
http://www.maxwell.lambda.ele.puc-rio.br/cgi-bin/PRG_0599.EXE/7980_8.PDF?NrOcoSis=23548&CdLinPrg=pt
http://www.gea.ufpr.br/Projetos/Planos/PlanoTrabalho-Carina.pdf
http://www.editora.ufla.br/revista/27_3/art17.PDF. Acessado em 21/04/2008