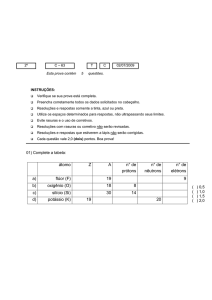
LISTA DE RECUPERAÇÃO PARALELA 1a UNIDADE – QUÍMICA
Professores: Vicente, Fábio e Cláudio
CONCEITOS BÁSICOS
01. Um químico aqueceu no laboratório uma amostra
desconhecida e construiu o diagrama a seguir, onde
relacionou temperatura, em graus centígrados, e
tempo, em segundos.
03. Com relação ao número de fases, os sistemas podem
ser classificados como homogêneos ou heterogêneos.
Todas as alternativas correlacionam adequadamente
o sistema e sua classificação, exceto:
01) água de coco / heterogêneo.
02) leite / homogêneo.
03) água do mar filtrada / homogêneo.
04) laranjada / heterogêneo.
05) poeira no ar / heterogêneo.
Das alternativas abaixo indique aquela que apresenta
o comportamento descrito pelo gráfico anterior:
01)
04)
04. O ar atmosférico, seco e isento de impurezas, é composto basicamente de 78% de nitrogênio, 20,9% de
oxigênio e 0,9% de argônio, além de outros gases em
quantidades menores. Pode-se, então, afirmar que:
I. O ar atmosférico é uma solução, já que é constituído apenas por gases.
02)
05)
II. O ar atmosférico, por ser uma mistura homogênea, apresenta propriedades constantes por toda a
sua extensão.
III. O ar atmosférico é formado apenas por substâncias simples diatômicas.
IV. A forma alotrópica do oxigênio que existe no ar
atmosférico é a menos estável.
03)
Identifique, a seguir, a alternativa correta:
01) apenas I, II e IV são corretas.
02) apenas I e IV são corretas.
03) apenas I e II são corretas.
02. Uma amostra foi aquecida e, durante a ebulição, a
temperatura do sistema permaneceu inalterada. Esta
amostra pode ser uma:
I. mistura eutética.
II. mistura azeotrópica.
III. substância pura.
Está(ao) correta(s) apenas:
04) apenas II, III e IV são corretas.
05) apenas III e IV são corretas.
05. Qual dos fenômenos a seguir NÃO envolve um fenômeno químico?
01) sublimação da naftalina.
02) digestão de alimentos.
03) queima da gasolina.
01) II
04) enferrujamento de um prego.
02) I e II
05) explosão da dinamite.
03) I e III
04) II e III
05) III
2
06. Os carrinhos de sorvetes, as geladeiras que armazenam sorvetes nos bares e padarias, os carros frigoríficos que transportam produtos perecíveis utilizam
“gelo seco” (CO2 sólido), entre outras razões, porque
não deixa resíduo. Por que isso acontece?
01) O CO2 possui elevados pontos de ebulição.
02) O “gelo seco” sublima.
03) O “gelo seco” condensa.
04) O “gelo seco” funde.
05) O “gelo seco” se decompõe.
07. Considere a tabela abaixo:
PONTO DE EBULIÇÃO
(oC) *
I
PONTO DE FUSÃO
(oC) *
- 23
II
125
226
III
38
118
IV
- 25
40
SUBSTÂNCIA
09. Julgue as proposições a seguir:
(01) A água é uma mistura de hidrogênio e oxigênio.
(02) O ar puro da montanha é uma substância pura.
(04) Em alimentos naturais não existem elementos
químicos.
(08) Um sistema bifásico pode ser formado por apenas uma substância.
(16) O oxigênio gasoso e o ozônio são substâncias
simples formadas por moléculas de mesma
atomicidade.
(32) Num copo contendo água líquida e gelo, o gelo
fica na superfície por apresentar menor massa
específica.
(64) Em quaisquer condições de temperatura e pressão a água é líquida.
10
* temperaturas determinadas à pressão de 1 atm.
Qual(is) substância(s) é(são) líquida(s) nas condições
ambiente?
01) I e IV apenas.
02) I apenas.
03) II apenas.
04) III apenas.
05) IV apenas.
10. Sobre as propriedades da matéria, identifique as proposições verdadeiras:
(01) Ponto de fusão, ponto de ebulição e densidade
são propriedades que identificam as substâncias
puras.
(02) Cor, sabor e cheiro são propriedades organolépticas da matéria.
(04) Água do mar é uma substância composta.
(08) Ozônio é uma substância simples.
(16) A glicose, C6H12O6, é uma molécula ternária de
atomicidade 24.
08. “Um índio preservado em pleno corpo físico
Em todo sólido, todo gás e todo líquido
Em átomos, palavras, alma, cor,
Em gesto, em cheiro, em sombra,
Em luz, em som magnífico...”
(Caetano Veloso)
Analise as proposições seguintes e identifique as
verdadeiras:
(01) O cheiro e a cor de uma dada substância são
propriedades organolépticas.
(02) Toda mistura homogênea, quando aquecida, passa do estado sólido para o estado líquido à temperatura constante.
(04) Um sistema formado por vários tipos de átomos
é obrigatoriamente uma mistura.
(08) Quando um elétron salta de uma camada mais
interna para uma camada mais externa, este emite um quantum de energia que é percebido sob
forma de luz.
(16) A ebulição de uma substância é a passagem do
estado líquido para o estado gasoso com o aparecimento de bolhas. Durante esse processo,
duas fases coexistem.
(32) Os átomos de um mesmo elemento químico possuem propriedades físicas sempre iguais.
11. A amostra de uma substância pura X teve algumas de
suas propriedades determinadas.
A seguir, todas as alternativas apresentam propriedades que são úteis para identificar essa substância, exceto:
01) densidade.
02) massa da amostra.
03) solubilidade em água.
04) temperatura de fusão.
05) reatividade química com certas substâncias.
12. Uma coroa contém 579 g em ouro (d = 19,3 g/cm3),
90 g de cobre (d = 9 g/cm3) e 105 g de prata
(d = 10,5 g/cm3). Se o volume final dessa coroa corresponde à soma dos volumes de seus componentes,
a densidade da coroa, em g/cm3, será igual a:
01) 10,5
02) 12,9
03) 15,5
04) 19,3
05) 38,8
3
13. Observe a tabela a seguir:
SUBSTÂNCIA
P.F.
P.E.
I
– 94,3
+ 56,7
II
– 54,9
+ 357
III
+ 56,6
+ 141,4
Os sistemas abaixo têm seus átomos apresentados
por esferas, baseados em cada sistema representado
por seus respectivos números, responda o que se pede nas questões 16, 17 e 18.
Sobre pressão de 1 atm e temperatura de 55 oC,
é(são) líquido(s):
01) apenas I
02) apenas II
03) apenas III
04) I e II
05) II e III
14. Considere os seguintes fenômenos:
I. Combustão da gasolina por veículos automotores.
II. Derretimento de uma barra de ferro.
16. Podemos classificar como substância pura e simples
apenas:
III. Preparação do soro caseiro.
IV. Fermentação do caldo de cana para produção de
álcool.
01) V
São fenômenos químicos apenas:
03) IV
01) I, II e III
04) III
02) II, III e IV
03) II e VI
04) I e III
05) I e IV
15. O gás ozônio é um “herói” quando protege o homem
da radiação ultravioleta do sol, porém um grande vilão, pois quando respirado em determinadas concentrações, é nocivo ao ser humano.
A partir dos seus conhecimentos sobre o gás acima e
propriedades da matéria, identifique a alternativa
verdadeira:
01) O gás ozônio é a forma alotrópica mais estável do
oxigênio, por isso a heróica resistência da camada
de ozônio as investidas antiecológicas do homem.
02) A mistura dos dois alótropos, oxigênio e ozônio,
será heterogênea, sendo que o ozônio, mais denso,
ocupará a base do sistema.
03) O gás ozônio é um alótropo do gás oxigênio, a diferença básica entre suas moléculas está somente
na arrumação dos seus átomos.
04) O gás ozônio é um excelente comburente, essencial à queima dos derivados de petróleo, excelentes combustíveis.
05) O ozônio é um gás levemente azulado, de cheiro
característico, bactericida, substância simples,
formado por moléculas triatômicas.
02) IV e V
05) III e IV
17. O sistema que apresenta uma mistura de duas substâncias, uma simples e uma composta é o:
01) III
02) V
03) II
04) I
05) IV
18. Em relação aos cinco sistemas apresentados é verdade afirmar que:
01) III é uma mistura formada por nove átomos.
02) V representa uma mistura de dois tipos de substâncias simples.
03) II é formado por 8 substâncias diferentes.
04) I apresenta 18 elementos químicos.
05) IV pode ser a representação microscópica de um
balão de oxigênio.
4
19. Considere as informações a seguir e assinale a opção
verdadeira.
AMOSTRA
DENSIDADE
(g/mL)
PONTO DE
FUSÃO (oC)
PONTO DE
EBULIÇÃO (oC)
A
4,8
221
688
B
2,0
112
444
C
13,6
38
*
* temperatura varia durante a ebulição.
01) A água líquida é 4,8 vezes mais densa que a
amostra A.
o
ESTRUTURA ATÔMICA
21. Num exercício escolar, um professor de química
pediu a seus alunos que imaginassem um átomo que
tivesse o número atômico igual ao seu número de
chamada e o número de nêutrons quatro unidades a
mais que o número de prótons. O aluno de número
23 esqueceu de somar quatro para obter o número
de nêutrons e, consequentemente, dois alunos imaginaram átomos isóbaros. Os números de chamada
dos alunos em que este fato ocorreu eram:
01) 23 e 24
02) A 150 C B é líquido.
02) 23 e 19
03) A tabela caracteriza as amostras através de propriedades organolépticas.
03) 23 e 27
04) A, B e C são substâncias puras.
05) 23 e 28
05) Nas condições ambiente A é líquido.
20. O relógio abaixo, vendido na Europa por 5.000,00
euros, é de ouro 18 K e possui o vidro de safira,
substância que apresenta dureza 9, na escala onde o
diamante tem dureza 10.
04) 23 e 21
22. Um cátion metálico trivalente tem 76 elétrons e 118
nêutrons. O átomo do elemento químico, do qual se
originou, tem número atômico e número de massa,
respectivamente:
01) 73 e 191
02) 73 e 194
03) 79 e 197
04) 79 e 194
05) 76 e 191
Com base nos seus conhecimentos sobre as substâncias e suas propriedades, julgue as proposições a seguir:
(01) A diferença entre as formas alotrópicas mais
comuns do carbono, o grafite e o diamante, está na atomicidade.
(02) A finalidade de se fabricar um relógio com o vidro de safira, substância muito dura, é preservar
esse objeto caso o seu dono deixe-o cair no chão.
(04) Esfregando uma amostra de diamante em uma
amostra de safira, a safira arranha o diamante.
(08) Aquecendo-se uma amostra de ouro 18 K, desde
o estado sólido até o estado líquido, nota-se que
a temperatura do sistema varia durante a fusão.
(16) Pode-se distinguir o diamante dos outros sólidos
pelo seu ponto de fusão e de ebulição.
(32) O grafite, substância muito mais mole e mais barata que o diamante, tem a mesma composição
química do diamante.
(64) O diamante sendo muito duro é também muito
tenaz.
23. Sobre os íons pode-se afirmar:
I. A quantidade de carga elétrica de um íon é conseqüência da variação do número de elétrons.
II. Um cátion trivalente é originado quando o átomo
ganha três prótons.
III. Um ânion apresenta números atômico e de massa
idênticos ao átomo neutro que o originou.
Está(ão) correta(s):
01) Todas.
02) I e II apenas.
03) I e III apenas.
04) II e III apenas.
05) I apenas.
24. O silício, elemento mais abundante da natureza depois do oxigênio, tem grande aplicação na indústria
eletrônica. Por outro lado, o enxofre é de importância
fundamental na obtenção do ácido sulfúrico. Sabendo que o átomo 14Si28 é isótono do enxofre, 16S, pode-se afirmar que este átomo tem número de massa:
01) 14
02) 16
03) 30
04) 32
05) 34
5
25. Os íons Ca+2 e Pb+2 possuem:
Com relação aos modelos atômicos pode-se afirmar:
01) mesma carga nuclear e diferentes massas atômicas.
02) igual diferença entre número de prótons e elétrons.
03) igual número de prótons.
04) mesmo número de prótons e elétrons.
05) mesmo número de elétrons.
26. A espécie química formada por 30 prótons, 33 nêutrons e 28 elétrons constitui um:
01) cátion bivalente.
02) ânion bivalente.
(02) Thomson propôs um átomo semelhante a um pudim de passas que não apresentava partículas
com cargas elétricas.
(04) O átomo de Rutherford não era maciço e apresentava uma região central, muito densa, denominada núcleo e uma região periférica chamada
eletrosfera.
(08) Segundo Böhr o átomo apresentava a eletrosfera
dividida em níveis de energia crescente a partir
do núcleo.
(16) Sabe-se, atualmente, que prótons e nêutrons são
partículas muito pequenas de massa igual a um
grama.
03) cátion monovalente.
04) ânion monovalente.
05) átomo neutro.
27. Considerando a seqüência de espécies químicas a
seguir, assinale a alternativa que contém aquela que
possui o maior raio.
Br– , Se–2, Rb+ , Sr+2 , Kr
01) Br–
(32) Se colocarmos no lado direito de uma balança de
pratos hipotética um elétron; para equilibrar a
balança, no lado esquerdo deveríamos colocar,
aproximadamente, 1840 nêutrons.
(64) O próton é a menor porção de matéria conhecida
até hoje.
29. O óxido de deutério, D2O, é encontrado em soluções
utilizadas com moderadores em reatores nucleares e para determinação de mecanismos de reações.
O óxido de trítio não é assim usualmente utilizado, porque seu custo é altíssimo.
02) Se–2
03) Rb+
04) Sr
(01) Até 100 anos atrás, a menor porção de matéria
conhecida pelos cientistas era o átomo – cuja
existência foi imaginada pela primeira vez antes de Cristo pelos filósofos gregos.
Sobre as substâncias tratadas no texto suas propriedades
e aplicações, são verdadeiras:
+2
(01) Água rica em deutério é comumente conhecida
como água pesada.
05) Kr
28.
CAÇULA ATÔMICO
Físicos buscam a menor partícula da matéria
“Uma novidade anunciada por físicos americanos no ano passado mostra que o mundo invisível
das partículas subatômicas é uma fronteira tão surpreendente do universo quanto as estrelas e galáxias
mais distantes. Num artigo publicado na revista
Science, um grupo de cientista propõe que a matéria
se divide em unidades menores do que se imaginava. Há dois anos, esse mesmo grupo havia comprovado, depois de 17 anos de pesquisa, a existência
do Quark. (...) Ao estudar o comportamento dos
Quarks, no entanto, os físicos chegaram à conclusão de que eles podem conter unidades ainda menores. (...)”.
(Extraído da revista Veja)
(02) Como A (No de massa) é igual a soma de Z (No
de prótons) com N (No de nêutrons), então, para
qualquer átomo natural, A > Z.
(04) O deutério e o trítio são alótropos do Hidrogênio.
(08) No deutério 1H2, o número 2 representa uma média ponderada.
(16) Deutério e trítio são átomos diferentes, porém,
quimicamente iguais.
(32) Hidrogênio comum, deutério e trítio, são encontrados, em qualquer parte do mundo, sempre em
uma mesma proporção.
6
30. A figura abaixo representa o salto de um elétron entre níveis de energia.
E
Sobre o elétron representado e a teoria que rege este
seu movimento pode-se afirmar:
34. Considere as seguintes afirmações sobre átomos.
I. Segundo Thomson, o átomo é uma esfera maciça e
positiva incrustada de partículas pequenas e negativas.
II. No modelo proposto por Rutherford, o átomo tem
praticamente toda sua massa concentrada num núcleo pequeno e positivo e os elétrons estão girando
em torno e, a uma grande distância do núcleo.
III. No modelo proposto por Böhr, os elétrons se movem em órbitas quânticas e circulares, cujas suas
energias podem assumir quaisquer valores.
Está(ão) correta(s):
01) apenas I.
01) Para desempenhar o movimento acima, o elétron,
libera energia.
02) apenas II.
02) Para ocorrer o salto acima, o elétron, tem que absorver uma certa quantidade de luz.
04) apenas I e II.
03) O elétron descrito é chamado de excitado ou ativado.
04) Depois do salto, o elétron se encontra mais estável
que antes.
05) O salto acima contraria os postulados de Böhr.
31. Para o elemento químico localizado no grupo 12 e 4o
período são feitas algumas afirmações, todas verdadeiras, EXCETO:
03) apenas III.
05) apenas II e III.
35. As densidades da água comum (H2O) e da água pesada
(D2O), medidas nas mesmas condições de temperatura e
pressão, são diferentes. Isto porque os átomos de hidrogênio e deutério diferem quanto ao:
01) número de nêutrons.
02) número de prótons.
03) número de elétrons.
01) É um metal, natural, sólido à temperatura ambiente.
04) número atômico.
02) Tem raio atômico maior que o césio.
05) número de carga nuclear.
03) Possui 4 camadas eletrônicas.
Para responder as questões 36 e 37 utilize o seguinte
código:
04) É mais eletronegativo que o frâncio.
05) Possui, como subnível mais energético, 3d10.
Para responder as questões 32 e 33 utilize o seguinte
código:
01)
02)
03)
04)
05)
Se apenas uma proposição for verdadeira.
Se apenas as proposições I e II forem verdadeiras.
Se apenas as proposições I e III forem verdadeiras.
Se apenas as proposições II e III forem verdadeiras.
Se todas as proposições forem verdadeiras.
01) Se apenas as proposições I e III forem verdadeiras.
02) Se todas as proposições forem verdadeiras.
03) Se apenas as proposições I e II forem verdadeiras.
04) Se apenas uma proposição for verdadeira.
05) Se apenas as proposições II e III forem verdadeiras.
36.
I. A abundância dos isótopos de um determinado
elemento na natureza varia bastante, a depender
das condições de clima, composição do solo, etc.
de cada lugar.
32.
I. O Al+3 deriva de um átomo que ganhou três prótons.
II. Espécies isoeletrônicas são obrigatoriamente isótopos.
III. O argônio, Ar, apresenta a mesma distribuição
eletrônica que o K+.
II. O oxigênio-16 apresenta idênticas propriedades
químicas ao oxigênio-17.
III. Um átomo de oxigênio-16 (8O16) apresenta a
mesma carga nuclear que um átomo de oxigênio17 (8O17).
33.
I. O Mercúrio é o único metal líquido à temperatura
ambiente.
II. Os ametais são bons condutores de calor, porém
maus condutores de eletricidade.
III. O Tecnécio e Promécio não são transurânicos,
mas são elementos artificiais.
37.
I. A região maciça de um átomo é praticamente do
mesmo tamanho que espaços vazios ali existentes.
II. O cátion bivalente do cálcio (20Ca) é isoeletrônico
do ânion monovalente do cloro (17Cl).
III. O U235 e U238 têm diferentes números atômicos.
7
38. Relacione corretamente o modelo atômico e a novidade
trazida por cada um dele:
1. Dalton
(
) maciço e indivisível
2. Thomson
(
) níveis de energia quântica
3. Rutherford
(
) cargas elétricas
4. Böhr
(
) núcleo maciço e positivo
A seqüência correta de cima para baixo é:
01)
02)
03)
04)
05)
2, 4, 3 e 1.
1, 4, 2 e 3.
1, 4, 3 e 2.
1, 3, 2 e 4.
2, 1, 3 e 4.
39. O íon 40Zr
igual a:
++
42. Considere as seguintes afirmações sobre átomos e moléculas.
I. No modelo atômico de Bohr, os elétrons giram de
forma desordenada alimentados pela força eletrostática exercida pelo núcleo.
II. No modelo atômico de Thomson, os prótons positivos estão imersos em uma esfera maciça e negativa.
III. O átomo de Dalton, esférico, maciço e indivisível, foi o primeiro modelo atômico proposto pelo
homem.
Está(ão) correta(s):
01) apenas III.
02) apenas I e III.
tem distribuição eletrônica por camadas
01) K- 2, L- 8, M- 18, N-12, O- 2.
03) apenas II.
04) apenas I.
05) apenas I e II.
02) K- 2, L- 8, M- 18, N-10.
03) K- 2, L- 8, M- 18, N-12.
04) K- 2, L- 8, M- 18, N- 8, O- 2.
05) K- 2, L- 8, M- 18, N-10, O- 2.
40. Sendo o subnível mais energético de um determinado
átomo 4d4. Para este átomo podemos afirmar:
01) seu subnível mais energético é o 5s2.
02) seu cátion bivalente apresenta 40 elétrons.
03) possui 4 elétrons de valência.
04) apresenta 42 nêutrons.
05) apresenta quatro camadas.
41. “Na célebre experiência de Rutherford, foi verificado
que, para cada 155 partículas α desviadas de sua direção, havia aproximadamente 1550000 partículas α que
atravessavam a fina lâmina de ouro sem se desviar.”
Comparando a experiência de Rutherford aos demais
modelos atômicos, pode-se afirmar:
01) O modelo de Rutherford, por apresentar os elétrons
dispersos pela superfície do átomo foi comparado a
um pudim com passas.
02) Segundo a experiência de Rutherford, os elétrons
giravam em níveis quânticos de energia, e o salto
entre esses níveis envolve absorção ou liberação da
mesma.
03) Rutherford foi quem introduziu a carga elétrica ao
modelo atômico.
04) Pela experiência narrada acima é possível concluir
que o núcleo de um átomo chega a ser 10 vezes
menor que o átomo.
05) Rutherford descreveu o átomo como um núcleo
denso, positivo e extremamente pequeno rodeado
por elétrons em órbitas circulares.
43. Os letreiros luminosos, muito usados em publicidade,
utilizam principalmente gás neônio e, por isso, são conhecidos por luminosos de néon. O funcionamento desses luminosos é semelhante ao de uma lâmpada fluorescente, ou seja, os elétrons são excitados e posteriormente emitem luz.
Com base nos seus conhecimentos, julgue as proposições a seguir:
(01) A excitação de um elétron ocorre quando este
absorve uma quantidade qualquer de energia.
(02) A emissão de luz ocorre quando os elétrons retornam de uma camada mais externa para uma
camada mais interna.
(04) O neônio é uma substância simples encontrada
facilmente na forma de moléculas diatômicas.
(08) Nas condições ambiente, se misturarmos neônio
e oxigênio, obteremos uma solução.
(16) O neônio possui subnível de maior energia do
tipo 2p6.
(32) Pode-se identificar um determinado elemento
químico analisando a cor da luz emitida quando
este perde a sua excitação.
44. Defina dureza.
45. Defina tenacidade.