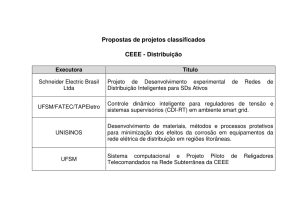
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
A Reação de Diels-Alder
Método sintético para a preparação de
compostos contendo
o anel Cicloexeno
www.ufsm.br/quimica_organica
1
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Reação Geral
+
Dieno
alceno
conjugado (dienófilo)
www.ufsm.br/quimica_organica
cicloexeno
2
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Caminho reacional
Estado de transição
nova ligação
dieno
4 elétrons
dienófilo
2 elétrons
Estado de transição
6 elétrons
www.ufsm.br/quimica_organica
nova ligação
3
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Reação de Diels-Alder.
Reação D-A é quando
(1) forma anel de 6 membros
(2) forma 2 novas ligações s C-C ao mesmo que 1
(3) é estereospecifica e regiosseletiva.
Caminho reacional
dieno
dienófilo
4 elétrons
2 elétrons
Estado de transição
6 elétrons
www.ufsm.br/quimica_organica
novas ligações
2se1
4
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Reação de Diels-Alder.
adição 1,4 ao 1,3-butadieno
www.ufsm.br/quimica_organica
O reagente contendo a dupla
ligação (conhecido como
dienófilo) deve estar ligado a
um grupo retirador de
elétrons ligado ao Csp2 de
maneira a polarizar a dupla
ligação (diminui a EHOMO).
5
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Estabilidade de olefinas.
Nome
Name
Fórmula
estrutural
Formula
Structural
Ho
kJ (kcal)/mol
1-Butene
1-Buteno
-127 (-30.3)
1-Pentene
1-Penteno
-126 (-30.1)
cis-1-Buteno
cis-2-Butene
-120 (-28.6)
trans-1-Buteno
trans-2-Butene
-115 (-27.6)
1,3-Butadieno
1,3-Butadiene
-237 (-56.5)
trans-1,3-Pentadieno
trans-1,3-Pentadiene
-226 (-54.1)
1,4-Pentadieno
1,4-Pentadiene
-254 (-60.8)
www.ufsm.br/quimica_organica
6
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Dienos
Dienófilos
H H
H
C
C
H
O
O
N
C
N
H
C
N
C
C
C
H H
H
C
N
H
C
C
H
H
C
C
C
H
C
C
C
N
H
N
O
C
N
O
F
OCH3
O
www.ufsm.br/quimica_organica
7
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Orbitais Moleculares do
Etileno e 1,3-Butadieno
www.ufsm.br/quimica_organica
8
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Orbitais e Reações Químicas
• Uma compreensão mais profunda da
reatividade química pode ser adquirida
enfocando os orbitais de fronteira dos
reagentes.
• Fluxo de elétrons do orbital molecular mais
alto ocupado (HOMO) de um reagente para
o mais baixo orbital molecular desocupado
(LUMO) do outro.
www.ufsm.br/quimica_organica
9
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Orbitais e Reações Químicas
• As interações HOMO-LUMO, por meio da
reação de Diels-Alder entre etileno e 1,3butadieno.
• Consideramos só os elétrons de etileno e
1,3-butadieno. Podemos ignorar as ligações s
em cada molécula.
www.ufsm.br/quimica_organica
10
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
OM do 1,3-butadieno.
f4
o sistema pi do butadieno é
obtido pela combinação de
quatro orbitais atômicos 2p;
há dois OM ligantes e dois
OM antiligantes.
f3
f2
f1
www.ufsm.br/quimica_organica
11
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
OMs do Etileno
• cores vermelho e azul distinguem o sinal da
função de onda
• OM são antissimétrico em relação ao plano da
molécula
Orbital da ligação do etileno;
dois elétrons no orbital.
www.ufsm.br/quimica_organica
12
OMs do Etileno
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
orbital antiligante do etileno;
não tem elétrons no orbital *
•* LUMO
• HOMO
orbital ligante do etileno;
dois elétrons neste orbital
www.ufsm.br/quimica_organica
13
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
OMs do 1,3-Butadieno
• Quatro Orbitais contribuem com o
sistema do 1,3-butadieno; Portanto,
existem 4 orbitais moleculares.
• Dois destes orbitais são ligantes; e dois
são antiligantes.
www.ufsm.br/quimica_organica
14
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Dois OMs antiligantes do 1,3-Butadieno
f4
Orbital de maior energia
Os dois orbitais
antiligantes estão vazios
f3
f2
f1
LUMO
HOMO
4 elétrons ;
2 em cada orbital
Orbital de menor energia
www.ufsm.br/quimica_organica
15
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Reação de Diels-Alder.
LUMO
HOMO
www.ufsm.br/quimica_organica
16
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Análise dos Orbitais Moleculares
da Reação de Diels-Alder
www.ufsm.br/quimica_organica
17
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
OM: Análise da Reação de Diels-Alder
• Na medida em que grupos retiradores de elétrons
aumentam a reatividade de um dienófilo,
assumimos o fluxo de elétrons do HOMO do dieno
para o LUMO do dienófilo.
www.ufsm.br/quimica_organica
18
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
OM: Análise da Reação de Diels-Alder
HOMO do 1,3-butadieno
• HOMO de 1,3-butadieno e
LUMO de etileno estão em
fase um com o outro
• Permite ligação s entre o
alceno e o dieno
LUMO do etileno (dienófilo)
www.ufsm.br/quimica_organica
19
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
OM: Análise da Reação de Diels-Alder
HOMO do 1,3-butadieno
LUMO do etileno (dienófilo)
www.ufsm.br/quimica_organica
20
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Reação de Diels-Alder.
dieno
dieno
dienófilo
HOMO
dienófilo
LUMO
Overlap dos OM tendo a
Mesma fase (orbital em fase)
www.ufsm.br/quimica_organica
21
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Estereoquímica do produto
e,e
O
i
endo
i
O
+
syn
exo
i
endo
O
+
exo
endo
exo
exo
endo
i
O
z,z
syn
+
e,z
anti
+
z,e
anti
+
www.ufsm.br/quimica_organica
22
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Entre as estruturas, Qual o par mais reativo?
O
LUMO:
0.1212
HOMO: -0.32348
0.10006
0.19862
0.14441
-0.38622
-0.34261
-0.29698
www.ufsm.br/quimica_organica
23
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Energia dos OM
LUMO: 0.10006
HOMO: -0.29698
E = 0.10006 – (- 0.29698)
= 0.39704 Hartree
= 246.76 kcal / mol
HOMO
0.20
0.20
0.10
0.10
0.00
0.00
- 0.10
- 0.10
- 0.20
- 0.20
- 0.30
- 0.30
- 0.40
- 0.40
dienos
LUMO
O
dienófilos
www.ufsm.br/quimica_organica
24
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
N
Energia dos OM
H
C
C
0.20
C
0.20
H
C
N
0.10
0.10
O
LUMO
O
0.00
0.00
O
N
- 0.10
N
C
C
C
- 0.10
C
C
N
- 0.20
- 0.20
- 0.30
- 0.30
- 0.40
- 0.40
C
N
HOMO
dienos
www.ufsm.br/quimica_organica
dienófilos
25
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Regioquímica da reação DA
O
O
O +
O
O
O
O
C
O
Produto exo
O
O
C
O
O
O
O
O
O + O
O
O
O
O
C O
C O
O
Produto endo
Dados Experimentais:
produto exo mais estável por 1,9 kcal/mol
Ea menor para a rota do produto endo por 3,8 kcal/mol
www.ufsm.br/quimica_organica
26
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Regioquímica da reação DA
E
O O
O
3.8 kcal/mol
O
O
O
O
O
O
O
O +
C O
C
O O
O
O
O
C
O
O
www.ufsm.br/quimica_organica
C
O
1.9 kcal/mol
Reaction progress
27
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Regioquímica da reação DA
ET endo
Furano
Anidrido Malonico
www.ufsm.br/quimica_organica
28
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Regioquímica da reação DA
-609.07
B3LYP/6-31G
0.51 kcal/mol
-609.08
-609.09
O
O
-609.10
O
O
-609.11
1.89 kcal/mol
www.ufsm.br/quimica_organica
29
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Reação de DA requer conformação s-cis
C pertence aos 2 anéis
s-Cis
s-Trans
Conformação s-Cis
Conformação
conformation s-trans conformation
(maior
energia)
(higher
in energy)
(maior
energia)
(lower
in energy)
1,3-Ciclopentadieno
Bicíclico em ponte
1,3-Cicloexadieno
Bicíclico em ponte
Não
Reage
Conformação s-trans
www.ufsm.br/quimica_organica
30
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Estereosseletividade
a reação é estereosseletiva porque diferentes reagentes
estereoisoméricos dão diferentes produtos estereoisoméricos
dienófilo cis
dienófilo trans
produtos cis
produtos trans
www.ufsm.br/quimica_organica
31
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Estereosseletividade
Carbono cabeça
de ponte
2 carbono em
ponte
www.ufsm.br/quimica_organica
32
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
ou
Estruturas de ressonância do Dieno
Estruturas de ressonância do dienófilo
www.ufsm.br/quimica_organica
33
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Estereosseletividade
• Quando o Dieno é cíclico,
o produto endo é o
preferencial
Novas
ligações
Interações
secundárias
Produto endo
Interações secundárias
no ET endo
Novas
ligações
Produto exo
Sem Interações secundárias ET exo
www.ufsm.br/quimica_organica
34
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Regiosseletividade
ou
Estruturas de ressonância do dieno
dieno
Estruturas de ressonância do dienófilo
dienófilo
Overlap de Orbitais
em Fase
www.ufsm.br/quimica_organica
35
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Características mecanicistas
• mecanismo concertado
• Cicloadição
• Reação periciclica
• Reação concertada: reação procede
através de estado de transição cíclico
www.ufsm.br/quimica_organica
36
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
O que torna Dienófilos reativos?
Os mais reativos de enófilos se ligam a grupos elétronretiradores (EWG) diretamente ligado a dupla ligação.
EWG
C
C
www.ufsm.br/quimica_organica
Típicos EWGs
C
O
C
N
37
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
O que torna Dienófilos reativos?
Grupo e- doador
(aumenta EHOMO)
Grupo e- retirador
(diminui ELUMO)
- CH3 (gr. Alquila)
- CHO (aldeído, cetona)
- OR (éter)
- COOH (carboxila)
- OCOR (éster)
- COOR ( éster)
- NHR (amina)
- NO2 (nitro)
- C=N (ciano)
www.ufsm.br/quimica_organica
38
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Exemplo
H2C
O
CH-CH
CH2 + H2C
benzeno
CH
CH
100°C
O
CH
(100%)
www.ufsm.br/quimica_organica
39
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Exemplo
O
H2C
CHCH
CH2 + H2C
benzeno
via:
CH
CH
100°C
O
O
CH
CH
(100%)
www.ufsm.br/quimica_organica
40
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Exemplo
H2C
O
CHC
CH2
+
O
CH3
100°C
benzeno
O
O
H3C
O
(100%)
O
www.ufsm.br/quimica_organica
41
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Exemplo
H2C
O
CHC
CH2
+
CH3
via:
H3C
benzeno
100°C
O
O
H3 C
O
O
O
O
O
(100%)
www.ufsm.br/quimica_organica
42
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Dienófilo Acetilênico
O
H2C
CHCH
CH2 + CH CH OCC
3
2
benzeno
100°C
O
CCOCH2CH3
O
COCH2CH3
(98%)
COCH2CH3
O
www.ufsm.br/quimica_organica
43
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
A Reação de Diels-Alder é estereoespecífica *
• adição syn de alceno
• substituintes E (
) e Z ( ) no alceno ficam
retidas no produto - Cicloexeno
* Uma reação estereoespecíficaé quando matérias-primas estereoisoméricas dão
produtos estereoisoméricos;
caracteriza-se por termos reações como adição syn,
eliminação anti, inversão de configuração, etc...
www.ufsm.br/quimica_organica
44
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Exemplo
H2C
CHCH
O
CH2
+
C6H5
COH
C
H
H
C
H
C6H5
Único produto
(+ enantiômero)
COH
H
O
www.ufsm.br/quimica_organica
45
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Exemplo
H2C
O
H
CH2 +
CHCH
COH
C
C6H5
C6H5
C
H
H
Único produto
(mais enantiômero)
COH
H
www.ufsm.br/quimica_organica
O
46
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Diels-Alder em sistemas bicíclicos
+
?
Carbono cabeça
de ponte
2 carbono em
ponte
www.ufsm.br/quimica_organica
47
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
O
COCH3
H
+
C
CH3OC
C
H
H
O
O
COCH3
H
COCH3
www.ufsm.br/quimica_organica
O
48
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
H
O
O
COCH3
H
COCH3
H
É o mesmo que
COCH3
H
COCH3
O
O
www.ufsm.br/quimica_organica
49
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
A reação “proibida"
H2C
+
H2C
CH2
CH2
• A dimerização do etileno não deve formar ciclobutano
sob condições típicas da reações de Diels-Alder.
Por que não?
www.ufsm.br/quimica_organica
50
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
“A reação “proibida"
H2C
+
H2C
CH2
CH2
Incompatibilidade do HOMO-LUMO
HOMO do etileno
da molécula
de duas moléculas de etileno impede a
formação das duas novas Ligações s
LUMO da
em uma etapa única.
outra molécula de
etileno
www.ufsm.br/quimica_organica
51
Reação de Diels-Alder
Prof. Hugo Braibante-UFSM
Exemplos
COOEt
COOEt
COOEt
+
CHO
O
OCCH 3
(a)
COOEt
CHO
O
+ H
O
C
N
CH3
(b)
+
O
OCCH 3
O
C( CH3 ) 3
COOCH 3
O
(c)
+ N
N
(d)
N CH 3
O
(e)
O
N C
N
N
N
N
+ CH2 = CHCH 3
COOCH 3
H
+
H
C N
www.ufsm.br/quimica_organica
52