Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Curso Anual de Química
Prof. Alexandre Oliveira
Química Orgânica
Volume - 01
Assunto
Página
Módulo 01 - Introdução à Química Orgânica
03
Módulo 02 - Funções Orgânicas – I
63
Módulo 03 - Funções Orgânicas – II
97
Módulo 04 - Isomeria Constitucional e Estereoisomeria –
139
Isomeria cis-trans e E-Z
Módulo 05 - Estereoisomeria – Isomeria óptica
167
Módulo 06 - Isomeria Conformacional
213
Módulo 07 - Acidez e Basicidade de Compostos Orgânicos
235
Vestibular UFC 2010 - Resultado final
257
www.portalepisteme.com.br
www.cursoanualdequimica.com
Específico para Medicina!
–
1
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Específico para Medicina!
–
www.portalepisteme.com.br
2
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
MÓDULO 01
Introdução à Química Orgânica
Para se manterem vivos, desde cedo os seres humanos têm de ser capazes de distinguir entre dois tipos de
materiais em seu mundo. ―Você pode manter-se de raízes e grãos‖, alguém deve ter dito, ―mas você não pode
viver na sujeira. Você pode ficar aquecido queimando galhos de árvore, mas você não pode queimar pedras.’
Por volta do século XVIII, os cientistas pensaram ter entendido a essência dessa diferença, e, em 1807.
Jöns Jakob Berzelius deu nome aos dois tipos de materiais. Acreditava-se que substâncias derivadas de
organismos vivos continham uma força vital imensurável – a essência da vida. Estas foram denominadas
―orgânicas‖. Substâncias derivadas de minerais – e as quais faltava essa força vital – eram ―inorgânicas‖.
Específico para Medicina!
–
3
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Específico para Medicina!
–
www.portalepisteme.com.br
4
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Específico para Medicina!
–
www.portalepisteme.com.br
5
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Específico para Medicina!
–
www.portalepisteme.com.br
6
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Específico para Medicina!
–
www.portalepisteme.com.br
7
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
A ligação covalente
Específico para Medicina!
–
8
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Específico para Medicina!
–
www.portalepisteme.com.br
9
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Específico para Medicina!
–
www.portalepisteme.com.br
10
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
O carbono no Espaço
Específico para Medicina!
–
11
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Específico para Medicina!
–
www.portalepisteme.com.br
12
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Específico para Medicina!
–
www.portalepisteme.com.br
13
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Específico para Medicina!
–
www.portalepisteme.com.br
14
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Específico para Medicina!
–
www.portalepisteme.com.br
15
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Específico para Medicina!
–
www.portalepisteme.com.br
16
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Específico para Medicina!
–
www.portalepisteme.com.br
17
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Específico para Medicina!
–
www.portalepisteme.com.br
18
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Específico para Medicina!
–
www.portalepisteme.com.br
19
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Estruturas de Lewis, Kekulé e condensadas
Estruturas de Lewis
Os símbolos químicos que temos usado, nos quais os elétrons de valência são representados por pontos.
são chamados estruturas de Lewis. Essas estruturas são úteis porque nos mostram que átomos são ligados
juntos e nos deixam saber quando qualquer átomo possui pares de elétrons livres ou tem carga formal.
As estruturas de Lewis para H2O. H3O+. H3O+ e H2O2 são mostradas a seguir:
par de elétrons livres
H
H O
H
H O H
H O
água
íon hidrônio
íon hidróxido
H O O H
peróxido de hidrogênio
Ao desenhar uma estrutura de Lewis, tenha certeza de que os átomos de hidrogênio estejam rodeados por
apenas dois elétrons e que C, O, N e átomos de halogênio (F, Cl, Br. I) estejam rodeados por não mais que oito
elétrons – a regra do octeto deve ser obedecida. Elétrons de valência não utilizados em ligações são chamados
elétrons não-compartilhados ou pares de elétrons livres.
Uma vez que os átomos e elétrons estão no lugar, cada átomo deve ser examinado para ver quando urna
carga pode ser designada para ele. Uma carga positiva ou negativa designada a um átomo é chamada carga
formal; o átomo de oxigênio no íon hidrônio tem carga formal + 1, e o átomo de oxigênio no íon hidróxido tem
carga formal – 1 Uma carga formal é a diferença entre o número de elétrons de valência que um átomo tem
quando não está ligado a nenhum outro átomo e o número de elétrons que ―possui‖ quando está ligado. Um
átomo ―possui’ todos os seus pares de elétrons livres e metade de seus elétrons (compartilhados) em ligação.
Carga formal
= número de elétrons de valência –
(número de elétrons livres + 1/2 do número de elétrons em ligação)
Por exemplo, um átomo de oxigênio tem seis elétrons de valência. Na água (H2O), o oxigênio ―possui‖
seis elétrons (quatro elétrons livres e metade de quatro elétrons em ligação). Como o número de elétrons que ele
―possui’ é igual ao número de elétrons de valência (6 – 6 = 0), o átomo de oxigênio na água não tem carga
Específico para Medicina!
–
20
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
formal. No íon hidrônio (H3O+) ele ―possui‖ cinco elétrons: dois elétrons livres mais três (metade de seis)
elétrons ligantes. Como o número de elétrons que ele ―possui‖ é um a menos que o número de elétrons de
valência (6 – 5 = 1), sua carga formal é +1. O oxigênio no íon hidróxido (HO–) ―possui‖ sete elétrons: seis
elétrons livres mais um (metade de dois) elétron ligante. Como ―possui‖ um elétron a mais que seus elétrons de
valência (6 – 7 = –1), sua carga formal é – 1.
Sabendo que o nitrogênio tem cinco elétrons de valência, certifique-se de que a carga formal apropriada
foi designada ao átomo de nitrogênio nas estruturas de Lewis a seguir:
H N H
H
H N H
H
H
amônia
íon amônio
H N N H
H N
H H
H
ânion amideto
hidrazina
O carbono tem quatro elétrons de valência. Pense por que o átomo de carbono nas estruturas de Lewis
abaixo tem a carga formal indicada:
H
H C H
H
metano
H
H C
H
cátion metila
um carbocátion
H
H C
H
ânion metila
um carbânion
H
H C
H
radical
metila
H H
H C C H
H H
etano
Uma espécie que contém átomos de carbono carregados positivamente é chamada carbocátion, e uma
espécie que contém carbono carregado negativamente é chamada carbânion. (Relembre que um cátion é um íon
carregado positivamente e um ânion é um íon carregado negativamente.) Carbocátions eram formalmente
chamados íons carbônios; tal termo pode ser visto em livros de química antigos. Uma espécie que contém um
átomo com apenas um único elétron desemparelhado é chamada radical (também chamada radical livre). O
hidrogênio tem um elétron de valência, e cada halogênio (E Cl, Br, 1) tem sete elétrons de valência, ficando as
espécies a seguir com as cargas formais indicadas:
H
H
H
Br
Br
Br Br
Cl Cl
íon
hidrogênio
íon
hidreto
radical
hidrogênio
íon
brometo
radical
bromo
bromo
cloro
Estudando as moléculas nesta seção, note que, quando os átomos não carregam carga formal ou elétron
desemparelhado, o hidrogênio e os halogênios têm uma ligação covalente, o oxigênio sempre tem duas ligações
covalentes, o nitrogênio sempre tem três e o carbono, quatro. Note que (exceto pelo hidrogênio) a soma do
número de ligações e pares livres é quatro: os halogênios com uma ligação têm três pares livres; o oxigênio com
duas ligações tem dois pares livres; e o nitrogênio com três ligações tem apenas um par livre. Átomos que têm
mais ou menos ligações que o número necessário para um átomo neutro terão carga formal ou um elétron
desemparelhado. Esses números são muito importantes para se lembrar quando estamos desenhando estruturas
de substâncias orgânicas porque fornecem um método rápido para reconhecer se estamos cometendo um erro.
F
Cl
I
Br
O
H
uma ligação
uma ligação
Específico para Medicina!
duas ligações
–
N
C
três ligações
quatro ligações
21
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Nas estruturas de Lewis para CH2O, HNO3, CH2O, CO32– e N2, observe que cada átomo tem o octeto
completo (exceto o hidrogênio, que tem a última camada completa) e a carga formal apropriada. (Desenhando a
estrutura de Lewis para a substância que tem dois ou mais átomos de oxigênio, evite ligações simples oxigênio–
oxigênio. Essas são ligações fracas, e poucas substâncias as têm.)
O
HC O H
O
H O N O
O
O C O
O
H C H
N
N
Um par de elétrons compartilhados pode também ser mostrado como urna linha entre dois átomos.
Compare as estruturas anteriores com as seguintes:
O
H
O
C
O
H
H
O
O
N
O
H
C
O
H
O
C
O
N
N
Suponha que lhe foi pedido que desenhasse uma estrutura de Lewis. Neste exemplo vamos usar HNO2.
1. Determine o número total dos elétrons de valência (1 para H, 5 para N e 6 para cada O = 1 + 5 + 12 = 18).
2. Use o número de elétrons de valência para formar ligações e completar o octeto com elétrons livres.
3. Se depois que todos os elétrons tiverem sido designados algum átomo (outro que não o hidrogênio)
não tiver o octeto completo, use o elétron livre para formar dupla ligação.
4. Assinale a carga formal para qualquer átomo cujo número de elétrons de valência não seja igual ao
número de seus elétrons livres mais a metade de seus elétrons em ligação. (Nenhum dos átomos em
HNO2 tem carga formal.)
use um par de elétrons para
formar uma ligação dupla
N não tem um
octeto completo
H
O
N
O
ligação dupla
H
O
N
O
pelo uso de um par de elétrons livres
do oxigênio para formar uma ligação
dupla, N conseguiu um octeto completo
18 elétrons foram designados
Estrutura de Kekulé
Nas estruturas de Kekulé os elétrons em ligação são desenhados como linhas, e os pares de elétrons
livres são normalmente inteiramente omitidos, a menos que sejam necessários para chamar a atenção de alguma
propriedade química da molécula. (Apesar de os pares de elétrons livres não serem mostrados, é preciso lembrar
que átomos neutros de nitrogênio, oxigênio e halogênio sempre os têm: um par no caso do nitrogênio, dois no
caso do oxigênio e três no caso do halogênio.)
O
H
H
H
C
O
H
H
C
N
H
O
N
O
H
C
H
H
H
C
N
H
H
H
Estruturas condensadas
Frequentemente, estruturas são simplificadas pela omissão de alguma das ligações covalentes (ou todas) e
pela lista dos átomos ligados a um carbono particular (ou nitrogênio ou oxigênio) perto deste, com subscrição
para indicar o número daqueles átomos. Esse tipo de estrutura é chamada estrutura condensada. Compare as
estruturas anteriores com as seguintes:
Específico para Medicina!
–
22
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
HCO2H
HCN
HNO2
www.portalepisteme.com.br
CH4
CH3NH2
Mais exemplos de estruturas condensadas e convenções mais utilizadas para criá-las são encontrados
Tabela 1.1. Observe que desde que nenhuma das moléculas na tabela 1.1. tenha carga formal ou pares de
elétrons livres, cada C tem quatro ligações, cada N tem três, cada O tem duas e cada H ou halogênio tem uma
ligação.
Tabela 1.1 – Estruturas de Kekulé e condensadas
Estrutura de Kekulé
Estruturas condensadas
Átomos ligados ao carbono são mostrados à direita do carbono. Outros átomos que não sejam H podem ser
mostrados pendurados no carbono.
H
H
H
H
H
H
H
C
C
C
C
C
C
H
Br H
H
Cl H
H
CH3CHBrCH2CH2CHClCH3
ou
CH3CHCH2CH2CHCH3
Br
Cl
Grupos CH2 repetidos podem ser mostrados entre parênteses.
H
H
H
H
H
H
H
C
C
C
C
C
C
H
H
H
H
H
H
H
CH3CH2CH2CH2CH2CH3
ou
CH3(CH2)4CH3
Grupos ligados ao carbono podem ser mostrados (entre parênteses) à direita do carbono ou pendurados no
carbono.
H
H
H
H
H
H
H
C
C
C
C
C
C
H
H
CH3 H
H
CH3CH2CHCH2CHCH3
CH3CH2CH(CH3)CH2CH(OH)CH3
CH3
OH H
OH
Grupos ligados ao carbono à direita mais afastados não são postos entre parênteses.
H
H
H
CH3 H
H
C
C
C
C
H
H
CH3 H
C
CH3
H
CH3CH2C(CH3)2CH2CH2OH
OH
ou
CH3CH2CCH2CH2OH
CH3
Dois ou mais grupos considerados idênticos ligados ao ―primeiro‖ átomo à esquerda podem ser mostrados
(entre parênteses) à esquerda do átomo ou pendurado nele.
Específico para Medicina!
–
23
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
H
H
C
H
N
H
C
H
H
H
H
C
C
C
H
H
H
www.portalepisteme.com.br
(CH3)2NCH2CH2CH3
H
ou
CH3NCH2CH2CH3
CH3
H
H
H
H
H
H
H
C
C
C
C
C
H
H
H
H
H
C
H
(CH3)2CHCH2CH2CH3
H
ou
CH3CHCH2CH2CH3
CH3
H
Um oxigênio duplamente ligado a um carbono pode ser mostrado pendurado no carbono ou à direita dele.
O
CH3CH2CCH3
ou
CH3CH2COCH3
ou
CH3CH2C(
O)CH3
O
CH3CH2CH2CH ou
CH3CH2CH2CHO
ou
CH3CH2CH2CH
O
O
CH3CH2COH
ou
CH3CH2CO2H
ou
CH3CH2COOH
O
CH3CH2COCH3 ou CH3CH2CO2CH3 ou CH3CH2COOCH3
Orbitais atômicos e moleculares
Ligação no metano
Figura
Específico para Medicina!
–
24
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
(a) Os quatro orbitais sp3 são orientados na direção do canto de um tetraedro, levando cada ângulo a ter
109,5°.
(b) Um desenho do orbital do metano, mostrando a sobreposição de cada orbital sp3 do carbono com o orbital s
de um hidrogênio. (Para simplificar, os lobos menores do orbital sp3 não são mostrados.)
Ligação no etano
Figura
Ilustração do etano. A ligação C – C é formada pela sobreposição sp3 – sp3, e cada ligação C – H é formada
pela sobreposição sp3 – s. (Os lobos menores dos orbitais sp3 não são mostrados).
Ligação no eteno: uma ligação dupla
Figura
Carbono hibridizado em sp2. Os três orbitais sp2 degenerados ficam no plano. O orbital p não hibridizado é
perpendicular ao plano. (Os lobos menores dos orbitais sp2 não são mostrados.)
Específico para Medicina!
–
25
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
A Figura
(a) Uma ligação C – C no eteno e uma ligação a formada pela sobreposição de sp2 – sp2, e as ligações C – H
são formadas pela sobreposição sp2 – s. (b) A segunda ligação C – C é uma ligação formada pela
sobreposição lado a lado de um orbital p de um carbono com o orbital p do outro. (c) Há um acúmulo de
densidade eletrônica acima e abaixo do plano que contém os dois átomos de carbono e os quatro de
hidrogênio.
Quatro elétrons mantêm os carbonos unidos em uma ligação dupla C – C; apenas dois elétrons ligam os
átomos de carbono em uma ligação simples C – C. Isso significa que uma ligação dupla C – C é mais forte (174
kcal/mol ou 728 kJ/mol) e menor (1,33 A) que uma ligação simples C – C (90 kcal/mol ou 377 kJ/mol, e 1,54
A).
Ligação em etino: uma ligação tripla
Figura
Carbono hibridizado em sp. Os dois orbitais sp são orientados 180° distantes um do outro, perpendicular aos
dois orbitais p não hibridizados. (Os lobos menores do orbital sp não são mostrados.)
Específico para Medicina!
–
26
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
A Figura
(a) A ligação , C-C no etino é formada pela sobreposição sp – sp, e as ligações C – H são formadas pela
sobreposição sp – s. Os átomos de carbono e os átomos ligados a ele estão em linha reta. (b) As duas ligações
carbono-carbono são formadas pela sobreposição lado a lado do orbital p de um carbono com o orbital p do
outro carbono. (c) A ligação tripla tem região eletrônica densa acima e abaixo, e na frente e atrás do eixo
internuclear da molécula.
Como os dois átomos de carbono na ligação tripla são mantidos unidos por seis elétrons, uma ligação tripla é
mais forte (231 kcal/mol ou 967 kJ/mol) e menor (1,20 A) que uma ligação dupla.
O cátion metila (`CH3)
O carbono carregado positivamente no cátion metila é ligado a três átomos, de modo que ele hibridiza três
orbitais - um s e dois p. Portanto, ele forma suas três ligações covalentes usando orbitais sp2. Seu orbital p não
hibridizado fica vazio. O carbono carregado positivamente e os três átomos ligados a ele ficam no plano. O
orbital p fica perpendicular ao plano.
O radical metila (CH3)
O átomo de carbono no radical metila também é hibridizado em sp2. O radical metila difere do cátion metila por
um elétron desemparelhado. Tal elétron está no orbital p. Observe a semelhança nos modelos bola e vareta do
cátion metila e do radical metila. Os mapas potenciais, entretanto, são bem diferentes por causa da adição de um
elétron no radical metila.
Específico para Medicina!
–
27
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
O ânion metila (CH3)
O carbono carregado negativamente no ânion metila tem três pares de elétrons ligantes e um par livre. Os quatro
pares de elétrons estão bem distantes quando os quatro orbitais que contêm os elétrons ligantes e os livres
apontam para o canto de um tetraedro. Em outras palavras, um carbono carregado negativamente é hibridizado
em sp3. No ânion metila, três dos orbitais sp3 do carbono se sobrepõem cada um ao orbital s de um hidrogênio, e
o quarto orbital sp3 segura o par livre.
Compare os mapas do potencial para cátion metila, o radical metila e o ânion metila.
Ligação na água
O átomo de oxigênio na água (H2O) forma duas ligações covalentes. Como o oxigênio tem dois elétrons
desemparelhados na configuração eletrônica da sua camada de valência (Tabela 1.2), ele não precisa promover
um elétron para formar o número (dois) de ligações covalentes necessárias para alcançar uma camada de
valência de oito elétrons (isto é, completar seu octeto). Se presumirmos que o oxigênio que orbitais p para
formar duas ligações O – H, como predito pela configuração eletrônica da sua camada de valência, esperaríamos
um ângulo de ligação aproximadamente de 90°, porque os dois orbitais p estão em ângulo reto um do outro.
Entretanto, o ângulo observado experimentalmente é de 104,5°. Como podemos explicar o ângulo observado? O
oxigênio precisa usar orbitais híbridos para formar ligações covalentes, assim como o carbono. O orbital s e os
três orbitais p precisam hibridizar-se para produzir quatro orbitais sp3.
O ângulo de ligação em uma molécula indica quais orbitais são usados na formação da ligação.
Água - uma substância única
Água é a substância mais abundante encontra da em organismos vivos. Suas propriedades
inigualáveis permitiram à vida se originar e evoluir. Seu alto calor de fusão (o calor necessário para converter
um sólido em líquido) protege organismos de congelamento em baixas temperaturas porque muito calor precisa
ser removido da água para congelá-la. A alta capacidade de calor (o calor necessário para subir a temperatura de
Específico para Medicina!
–
28
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
uma substância em dada quantidade) minimiza a troca de temperatura nos organismos, e o alto calor de
vaporização (o calor necessário para converter um líquido em um gás) permite aos animais aquecerem-se com
uma perda mínima de fluido corporal. Como a água líquida é mais densa que o gelo, este é formado na
superfície da água, flutuando e isolando a água embaixo. Por isso oceanos e lagos não congelam de baixo para
cima. É também por isso que plantas e animais aquáticos podem sobreviver enquanto oceanos e lagos vivem
congelados.
Cada uma das duas ligações O – H é formada pela sobreposição de um orbital sp3 do oxigênio com o
orbital s de um hidrogênio. Um par livre ocupa cada um dos dois orbitais sp3 restantes.
O ângulo de ligação na água é um pouco menor (104,5°) que o ângulo de ligação tetraédrico (109,5°) no
metano, presumivelmente porque cada par livre "sente" apenas um núcleo, o que o faz mais difuso que o par
ligante, que "sente" dois núcleos e é, portanto, relativamente confinado entre eles. Consequentemente, há mais
repulsão entre pares de elétrons livres, causando a aproximação das ligações O – H e desta forma diminuindo o
ângulo de ligação.
Compare o mapa de potencial eletrostático da água com o do metano. Água é uma molécula polar; metano é
apolar.
Ligação na amônia e no íon amônio
Os ângulos de ligação observados experimentalmente na amônia são de 107,3°. Eles indicam que o nitrogênio
também usa orbitais híbridos quando forma ligações covalentes. Como carbono e oxigênio, os orbitais s e p da
segunda camada do nitrogênio hibridizam para formar quatro orbitais sp3 degenerados.
As ligações N – H na amônia são formadas pela sobreposição de um orbital sp3 do nitrogênio com o
orbital s do hidrogênio. O único par de elétrons livres ocupa um orbital sp 3. O ângulo de ligação (107,3°) é
menor que o ângulo de ligação tetraédrico (109.5°) porque a repulsão eletrônica entre o par livre relativamente
difuso e os pares ligantes é maior que a repulsão entre dois pares ligantes. Observe que os ângulos de ligação em
NH3 (107,3°) são maiores que os em H2O (104.5°) porque o nitrogênio só tem um par livre, enquanto o oxigênio
tem dois.
Específico para Medicina!
–
29
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Como o íon amônio (+NH4) tem quatro ligações N – H idênticas e nenhum par livre, todos os ângulos de
ligação são de 109,5° – como os ângulos de ligação no metano.
Hibridização de orbital, comprimento de ligação, força de
ligação e ângulos de ligação
Todas as ligações simples são ligações . Todas as ligações duplas são compostas por urna ligação e uma
ligação π. Todas as ligações triplas são compostas por uma ligação e duas ligações π. A maneira mais fácil para
determinar a hibridização do átomo de carbono, oxigênio ou nitrogênio é olhar o número de ligações π que ele
forma: se ele não forma ligação π, ele é hibridizado em sp3; se ele forma uma ligação π, ele é hibridizado em sp2;
se ele forma duas ligações π, ele é hibridizado em sp. As exceções são carbocátion e radicais alquila, que são
hibridizados em sp2 - não porque eles formem uma ligação π, mas porque eles têm um orbital p vazio ou meio
completo.
Comparando comprimentos e forças de uma ligação simples, dupla e tripla, vemos que quanto mais há
ligações segurando os dois átomos de carbono, menor e mais forte é a ligação carbono-carbono (Tabela).
Ligações triplas são menores e mais fortes que ligações duplas, que são menores e mais fortes que ligações
simples.
Uma ligação dupla (ligação mais uma ligação π) é mais forte que uma ligação simples (ligação ), mas não é
duas vezes mais forte. Podemos concluir, portanto, que uma ligação π é mais fraca que uma ligação . Isso é o que
esperaríamos, porque a sobreposição alinhada que forma a ligação é melhor que a sobreposição lado a lado que
forma uma ligação π.
Os dados na Tabela indicam que uma ligação C-H é menor e mais forte que uma ligação C-C. Isso ocorre
porque o orbital s do hidrogênio está mais perto do núcleo do que o orbital sp3 do carbono. Conseqüentemente, os
núcleos estão mais próximos em uma ligação formada pela sobreposição sp3-s do que em uma ligação formada pela
sobreposição sp3-sp3. Além disso, sendo rena ligação C-H menor, ela é mais forte que uma ligação C-C, uma vez que
há densidade eletrônica maior na região de sobreposição de um orbital sp3 com um orbital s do que na região de
sobreposição de dois orbitais sp3.
O comprimento e a força de uma ligação C-H dependem da hibridização do átomo de carbono a que o
hidrogênio está ligado. Quanto maior o caráter s do orbital usado pelo carbono para fazer a ligação, menor e mais
Específico para Medicina!
–
30
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
forte é a ligação - de novo, porque um orbital s está mais próximo do núcleo que um orbital p. Então uma ligação CH formada por carbono hibridizado em sp (50% s) é menor e mais forte que uma ligação C-H formada por um
carbono hibridizado em sp2 (33,3% s), que, enfim, é menor e mais forte que uma ligação C-H formada por um
carbono hibridizado em sp3 (25%).
O ângulo de ligação também depende do orbital usado pelo carbono para formar a ligação. Quanto maior a
quantidade do caráter s no orbital, maior o ângulo de ligação. Por exemplo, carbonos hibridizados em sp têm ângulos
de ligação de 180°. Carbonos hibridizados em sp2 têm ângulos de ligação de 120°, e carbonos hibridizados em sp3
têm ângulos de ligação de 109,5°.
Resumindo:
Uma ligação π é mais fraca que uma ligação ; Quanto maior a densidade eletrônica na região de sobreposição dos
orbitais, mais forte é a ligação; Quanto maior o caráter s, menor e mais forte é a ligação; Quanto maior o caráter s,
maior é o ângulo de ligação.
Classificação dos carbonos sp3
A classificação de determinado átomo de carbono sp3 (que faz 4 ligações simples) em uma cadeia
carbônica apresenta como único critério o número de carbonos que estão ligados ao carbono que será
classificado. Assim, temos:
Carbono primário (P)
É o átomo de carbono que está ligado a no máximo um átomo de carbono, como mostram os exemplos:
P
H
H
H
C
P
H
C
P
H
CH3
H
H3C N CH3
P
P
Carbono secundário (S)
É o átomo de carbono que está ligado a 2 outros átomos de carbono, como mostram os exemplos:
H H
H
H
H
S
C
P
P
H C C C H
H C C H
S
S
S
H
H
H
H
H
Específico para Medicina!
–
31
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Carbono terciário (T)
É o átomo de carbono que está ligado a 3 outros átomos de carbono, como mostram os exemplos:
H
H P
H
P
H C C C H
T
H
H
CP H
H
H
S
H
H
H
C
C
S
H
H
H C TC C H
S
P
H
H H
Carbono quaternário (Q)
É o átomo de carbono que está ligado a 4 outros átomos de carbono, como mostram os exemplos:
H
H
H
H
C
H C
H
C
H
Q
H
C H
H
C
H
H
H
H
S
C
H
S
C
H
H
C
S
HH
C
P
H
C P HH
Q C
C H H
S
H H
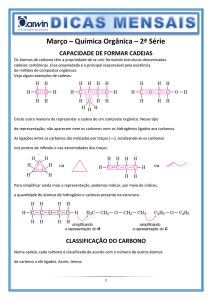
Cadeias Carbônicas
As cadeias carbônicas – estruturas formadas por átomos de carbono ligados entre si – recebem uma
classificação totalmente independente daquela atribuída ao composto orgânico. E importante não confundir a
classificação da cadeia carbônica com qualquer tipo de classificação dos compostos orgânicos.
Cadeias carbônicas abertas ou acíclicas ou alifáticas
As cadeias carbônicas acíclicas ou alifáticas são cadeias abertas (que apresentam no mínimo duas
extremidades distintas).
São classificadas de acordo com os seguintes critérios:
♦ Quanto ao tipo de ligação entre os carbonos, podem ser saturadas ou insaturadas.
Uma cadeia carbônica é saturada quando apresenta apenas ligações simples (do tipo ) entre carbonos,
independentemente do tipo de ligação que possa ocorrer entre o carbono e o átomo de um outro elemento
qualquer.
Exemplo: cadeia carbônica da molécula do propanonitrilo.
H3C C C N
H2
Note que as ligações do tipo não se localizam entre carbonos, mas sim entre um átomo de carbono e um
átomo de nitrogênio; portanto, a cadeia carbônica é de fato saturada.
Uma cadeia carbônica é insaturada quando apresenta pelo menos uma ligação dupla ou tripla (do tipo )
entre carbonos.
Exemplo: cadeia carbônica da molécula do 2-buteno.
H3C C C CH3
H H
♦ Quanto à presença de heteroátomo átomo diferente de carbono e hidrogênio a cadeia pode ser
homogênea ou heterogênea.
Uma cadeia carbônica é homogênea quando não apresenta heteroátomo entre carbonos
Específico para Medicina!
–
32
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Exemplo: cadeia carbônica da molécula do n-hexilamina.
H3C C C C C C NH2
H2 H2 H2 H2 H2
Observe que os átomos diferentes de carbono e hidrogênio não se encontram entre dois carbonos
Uma cadeia carbônica é heterogênea quando apresenta heteroátomo entre carbonos.
Exemplo: cadeia carbônica da molécula do éter dlietílico.
H3C C O C CH3
H2
H2
♦ Quanto ao tipo de carbono – primário, secundário, terciário ou quaternário –, a cadeia homogênea pode
ser normal ou ramificada.
Uma cadeia carbônica homogênea é normal quando apresenta apenas carbonos primários e secundários.
Exemplo: cadeia carbônica da molécula do 3-nitro-heptano.
H2 H 2 H
H2C C C C NO2
H3C
CH2
CH3
Note que a cadeia não precisa ser escrita necessariamente na horizontal para ser classificada como normal.
Uma cadeia carbônica homogênea é ramificada quando apresenta pelo menos um carbono terciário ou
quaternário.
Exemplo: cadeia carbônica da molécula do 3-metilpentano.
H
H3C C C C CH3
H2
H2
CH3
As cadeias carbônicas heterogêneas são consideradas ramificadas quando um dos carbonos da cadeia
(com exceção dos carbonos das extremidades) ou o heteroátomo estabelece ligação com um átomo de carbono.
Exemplo: cadeias carbônicas das moléculas da metil-isopropilamina, etil-dimelilamina, dietilamina.
H3C
H
C
N
CH3
H3C
CH3
ramificada
C N CH3
H2
CH3
ramificada
H3C
C N
H2 H
C CH3
H2
normal
Cadeias carbônicas cíclicas aromáticas
As cadeias carbônicas cíclicas (fechadas) são ditas aromáticas quando apresentam pelo menos um núcleo
aromático ou anel benzênico.
As cadeias aromáticas são classificadas segundo os critérios:
♦ Quanto ao número de núcleos aromáticos que apresentam, podem ser mononucleares e polinucleares.
Uma cadeia carbônica aromática é mononuclear quando possui um único núcleo aromático.
Exemplo: cadeia carbônica da molécula do vinilbenzeno.
CH2
CH2
O núcleo aromático é um ciclo formado por 6 átomos de carbono que estabelecem ligações intermediárias
entre simples e duplas, originadas teoricamente de ligações alternadas e ressonantes.
Específico para Medicina!
–
33
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Uma cadeia carbônica aromática é polinuclear quando possui mais de um núcleo aromático; nesse caso,
sofre uma subclassificação.
♦ Quanto à posição dos núcleos aromáticos na cadeia.
Se os núcleos aromáticos são formados a partir de dois carbonos comuns, dizemos que são núcleos
aromáticos condensados.
Exemplo: cadeia carbônica da molécula do naftaleno.
Observe que, pela própria definição, as cadeias carbônicas aromáticas são também insaturadas e
homocíclicas (cíclicas homogêneas).
Se os núcleos aromáticos não tiverem carbonos comuns, dizemos que são núcleos aromáticos isolados.
Exemplo: cadeia carbônica da molécula do peróxido de benzoíla.
O
O
C
C
O
O
Cadeias carbônicas cíclicas alicíclicas
Alicíclicas são cadeias carbônicas cíclicas que não possuem núcleo aromático.
Classificam-se do mesmo modo que as cadeias acíclicas.
♦ Quanto ao tipo de ligação entre os carbonos, podem ser saturadas ou insaturadas.
Uma cadeia carbônica cíclica alicíclica é saturada quando apresenta apenas ligações simples (do tipo )
entre carbonos, independentemente do tipo de ligação que possa ocorrer entre o carbono e o átomo de um outro
elemento qualquer.
Exemplo: cadeia carbônica de molécula do ciclobutanona.
O
H2C
C
H2C
CH2
Uma cadeia carbônica cíclica é insaturada quando apresenta pelo menos uma ligação dupla ou tripla (do
tipo ) entre carbonos.
Exemplo: cadeia carbônica da molécula do ciclopropeno.
CH2
HC
CH
♦ Quanto à presença de heteroátomo – átomo diferente de carbono e hidrogênio cadeia pode ser
homocíclica ou heterocíclica.
Uma cadeia carbônica é homocíclica quando não apresenta heteroátomo entre carbonos.
Exemplo: cadeia carbônica da molécula do ciclo-heptano.
Específico para Medicina!
–
34
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
H2
C
H2C
CH2
H2C
CH2
H2C
CH2
Uma cadeia carbônica é heterocíclica se apresenta heteroátomo entre carbonos.
Exemplo: cadeia carbônica da molécula do tiofeno.
S
HC
CH
HC CH
♦ Quanto ao tipo de carbono – primário, secundário, terciário ou quaternário –, a cadeia homocíclica pode
ser normal ou ramificada.
Uma cadeia carbônica homocíclica é normal quando apresenta apenas carbonos secundários.
Exemplo: cadeia carbônica da molécula do ciclopentano.
H2
C
H2C
CH2
H2C CH2
Uma cadeia carbônica homocíclica é ramificada se possui pelo menos um carbono terciário ou
quaternário.
Exemplo: cadeia carbônica da molécula do 1-etil-3,3-dimetil-hexano.
H2
H
CH3
C
C
C CH
3
H3C C
H2
H2C
CH2
C
H2
As cadeias carbônicas heterocíclicas são consideradas ramificadas quando um dos carbonos do ciclo ou
o heteroátomo estabelecer ligação com um átomo de carbono fora do ciclo.
Exemplos: cadeias carbônicas das moléculas do ciclo-1.2-propilenoamina, cicloetileno-metilamina e do
cicloetilenoamina.
NH
H2C
N
C CH3
H2
H2C
ramificada
CH3
CH2
ramificada
NH
H2C
CH2
normal
Cadeias carbônicas mistas
São cadeias carbônicas que possuem uma parte acíclica e uma parte cíclica que, por sua vez, pode ser
alicíclica e/ou aromática.
Observe os exemplos a seguir:
♦ Cadeia carbônica parte acíclica e parte cíclica alicíclica
Exemplo: cadeia carbônica da molécula do vinilciclopentano.
Específico para Medicina!
–
35
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
H2
C
H2C
www.portalepisteme.com.br
H
C
H2C CH2
C
H
CH2
♦ Cadeia carbônica parte aromática e parte acíclica.
Exemplo: cadeia carbônica da molécula do n-propilbenzeno.
C C CH3
H2 H2
♦ Cadeia carbônica parte aromática, parte alicíclica e parte acíclica.
Exemplo: cadeia carbônica da molécula do 1-etil-4-ciclopropilbenzeno.
H3C
C
H2
CH2
H2C
CH2
As tabelas a seguir trazem uma síntese do que foi visto a respeito da classificação de cadeias carbônicas.
Cadeias
carbônicas
Quanto ao tipo de
ligação entre carbonos.
Abertas ou acíclicas
(possuem no mínimo duas extremidades)
Saturada
Insaturada
Possui apenas ligações simples entre Possui pelo menos uma ligação dupla ou
carbonos.
tripla entre carbonos.
Exemplo:
Exemplo:
O
H3C C CH2
H
H
N C C C
H
CH3
Quanto à presença de
heteroátomo
Homogênea
Não possui heteroátomo entre carbonos.
Exemplo:
O
H3C
Quanto à classificação
dos carbonos.
C
C C NH2
H2 H2
Heterogênea
Possui heteroátomo entre carbonos.
Exemplo:
H3C O C CH3
H2
Normal e homogênea
Ramificada e homogênea
Possui apenas carbono primário e Possui pelo menos um carbono terciário
secundário.
ou quaternário.
Exemplo:
Exemplo:
H3C C C CH3
H H2
H2 H2
H3C C C CH3
CH3
Específico para Medicina!
–
36
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Cadeias
carbônicas
Quanto ao número de
núcleos aromáticos.
Aromáticas
(possuem pelo menos um núcleo aromático)
Mononucleares
Polinucleares
Possui apenas um núcleo aromático.
Possui mais de um núcleo aromático.
Exemplo:
Exemplo:
C
H2
Quanto à disposição dos
núcleos aromáticos.
Isolados
Condensados
Os núcleos aromáticos não possuem Os núcleos aromáticos possuem átomos
átomos de carbono comuns.
de carbono comuns.
Exemplo:
Exemplo:
O
C
Cadeias
carbônicas
Quanto ao tipo de
ligação entre carbonos.
Alicíclicas
(não possuem núcleo aromático)
Saturada
Insaturada
Possui apenas ligações simples entre Possui pelo menos uma ligação dupla ou
carbonos.
tripla entre carbonos.
Exemplo:
Exemplo:
H2
H
C
C
H2C
Quanto à presença de
heteroátomo
CH2
Homocíclica
Não possui heteroátomo entre carbonos.
Exemplo:
H2
C
H2C
CH2
HC
CH2
Heterocíclica
Possui heteroátomo entre carbonos.
Exemplo:
S
CH2
H2C
CH2
H2C CH2
Quanto à classificação
dos carbonos.
Normal e homocíclica
Ramificada e homocíclica
Possui apenas carbono primário e Possui pelo menos um carbono terciário
secundário.
ou quaternário.
Exemplo:
Exemplo:
H CH3
H2C
CH2
C
H2C
Específico para Medicina!
CH2
–
H2C
CH2
37
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Observe o resumo seguinte:
Nomenclatura de substituintes alquila
A retirada de um hidrogênio de um alcano resulta em um substituinte alquila (ou grupo alquila).
Substituintes alquila são nomeados pela troca do sufixo ―ano‖ do alcano por ―ila‖. A letra ―R‖ é usada para
indicar qualquer grupo alquila.
CH3
grupo metila
CH3CH2
CH3CH2CH2
grupo etila
grupo propila
CH3CH2CH2CH2
grupo butila
R
qualquer grupo alquila
Se um hidrogênio de um alcano é trocado por um OH, a substância se torna um álcool; se for trocado por
um NH2, a substância se torna uma amina; e se for trocado por um halogênio, se torna um haleto de alquila.
R
OH
álcool
R
NH2
amina
Específico para Medicina!
R
X
X = F, Cl, Br ou I
haleto de alquila
–
38
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Um nome de grupo alquila seguido pelo nome da classe da substância (álcool, amina etc.) produz o nome
comum da substância. Os exemplos seguintes mostram como os nomes dos grupos alquila são usados para
construir nomes comuns:
CH3OH
álcool metílico
CH3I
iodeto de metila
CH3CH2NH2
CH3CH2CH2Br
brometo de propila
etilamina
CH3CH2OH
álcool etílico
CH3CH2CH2CH2Cl
cloreto de butila
CH3CH2CH2NH2
CH3CH2CH2CH2OH
propilamina
álcool butílico
Observe que há um espaço entre o nome do grupo alquila e o nome da classe da substância, exceto no
caso de aminas.
Dois grupos alquila – um grupo propila e outro isopropila – contêm três átomos de carbono. Um grupo
propila é obtido quando um hidrogênio é removido de um carbono primário do propano. Carbono primário é
o carbono ligado a apenas um outro carbono. Um grupo isopropila é obtido quando um hidrogênio é removido
de um carbono secundário. Carbono secundário é o carbono ligado a dois outros carbonos. Note que um grupo
isopropila, como o nome indica, tem seus três átomos de carbono arranjados como uma unidade iso.
Estruturas moleculares podem ser desenhadas de maneiras diferentes. Cloreto de isopropila, por exemplo,
é desenhado aqui de duas maneiras. Ambas representam a mesma substância. À primeira vista, as
representações tridimensionais parecem ser diferentes: os grupos metila estão um ao lado do outro em uma
estrutura e em ângulos retos na outra. No entanto, as estruturas são idênticas porque o carbono é tetraédrico. Os
quatro grupos ligados ao carbono central – um hidrogênio, um cloro e dois grupos metila – apontam para o
canto de um tetraedro. Se rodarmos o modelo tridimensional 90° à direita no sentido horário, poderemos ver que
os dois modelos são os mesmos.
Um carbono primário é ligado a um carbono; um carbono secundário, a dois; e um carbono terciário, a
três carbonos.
Existem quatro grupos alquila que contêm quatro átomos de carbono. Os grupos butila e isobutila têm um
hidrogênio removido de um carbono primário. Um grupo sec-butila tem um hidrogênio removido de um
carbono secundário (sec-, geralmente abreviado s-, designado para carbono secundário), e um grupo terc-butila
tem um hidrogênio removido de um carbono terciário (terc-, também abreviado t-, designado para terciário).
Específico para Medicina!
–
39
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Um carbono terciário é o que está ligado a três outros carbonos. Observe que o grupo isobutila é o único grupo
com uma unidade iso.
Um nome de um grupo alquila linear geralmente tem prefixo ―n‖ (para ―normal‖), a fim de enfatizar que
seus carbonos estão em uma cadeia não ramificada. Se o nome não tem um prefixo como ―n‖ ou ―iso‖, presumese que o carbono esteja em uma cadeia não ramificada.
Como os carbonos, os hidrogênios em uma molécula também são referidos como primário, secundário e
terciário. Hidrogênios primários estão ligados a carbonos primários, hidrogênios secundários estão ligados a
carbonos secundários e hidrogênios terciários estão ligados a carbonos terciários.
Como o nome químico precisa especificar apenas uma substância, a única vez que veremos o prefixo
―sec‖ é em sec-butila. O nome ―sec-pentila‖ não pode ser utilizado porque tem dois átomos de carbono
secundários diferentes. Portanto, existem dois grupos alquila diferentes que resultam da remoção de um
hidrogênio de um carbono secundário do pentano. Como o nome especifica duas substâncias diferentes, ele não
é um nome correto.
O prefixo ―terc‖ é encontrado em terc-butila e terc-pentila porque cada um dos nomes de substituintes
descreve apenas um grupo alquila. O nome ―terc-hexila‖ não pode ser usado porque descreve dois grupos
alquila diferentes. (Em literatura antiga, talvez seja encontrado ―amua‖ no lugar de ―pentila‖ para designar
grupo alquila com cinco carbonos.)
Específico para Medicina!
–
40
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Se examinarmos as estruturas seguintes, veremos que, sempre que o prefixo ―iso‖ é usado, uma unidade
iso estará em uma extremidade da molécula e qualquer grupo substituindo um hidrogênio estará na outra
extremidade:
Observe que um grupo iso tem uma metila no penúltimo carbono da cadeia. Note também que todas as
substâncias isoalquila têm um substituinte (OH, Cl, NH2 etc.) em um carbono primário, exceto para o isopropila,
que tem um substituinte em um carbono secundário. O grupo isopropila poderia ser chamado grupo sec-propila.
Qualquer dos dois nomes seria apropriado porque o grupo tem uma unidade iso, e um hidrogênio foi removido
de um carbono secundário. Os químicos decidiram chamá-lo isopropila, entretanto, o que significa que ―sec‖ é
usado apenas para sec-butila.
Os nomes de grupos alquila são utilizados tão frequentemente que é preciso memorizá-los. Alguns dos
grupos alquila mais comuns estão compilados na abaixo.
Nomes de alguns grupos alquila
Classificação e nomenclatura de grupos
Como a cadeia principal é a que possui o grupo funcional, excetuando-se os casos de compostos de
função mista (com mais de um grupo funcional), os grupos geralmente são formados apenas de carbono e
hidrogênio e por isso são ditos derivados de hidrocarbonetos.
Específico para Medicina!
–
41
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Assim, uma vez escolhida a cadeia principal, as cadeias restantes são consideradas grupos ou
grupamentos. O nome dos grupos deve vir antes do nome da cadeia principal e irá depender de dois fatores: do
tipo de ligação entre carbonos e do tipo de carbono (primário, secundário ou terciário).
♦ Tipo de ligação entre carbonos.
Se o grupo for saturado (tiver apenas ligações simples entre carbonos), o nome será:
Prefixo que indica o número de carbonos + il (ou ila).
♦ Tipo de carbono onde se encontra a valência livre – valência que liga o grupamento à cadeia principal.
Estudaremos agora os grupos monovalentes – com apenas uma valência livre
A tabela a seguir fornece a estrutura e o nome dos principais grupos.
Veja na tabela que os grupos estão divididos em 5 grupos principais:
♦ Alquilas ou alcoílas: possuem apenas ligações simples.
♦ Alquenilas: possuem uma ligação dupla entre carbonos.
♦ Alquinilas: possuem uma ligação tripla entre carbonos.
♦ Cíclicos: a valência livre encontra- se no carbono de um ciclo saturado.
♦ Arilas: a valência livre encontra-se no carbono de um núcleo aromático.
Classificação e
no de carbonos
Alquila
1 carbono
Nome do grupo
Estrutura do grupo
Metil
––
H3C
H3C
C
H2
Alquila
2 carbonos
Etil
Alquila
3 carbonos
n-propil
Alquila
3 carbonos
s-propil ou sec-propil
ou isopropil
1-metiletil
Alquila
4 carbonos
n-butil
H3C
C C C
H2 H2 H2
Alquila
4 carbonos
s-butil ou sec-butil
1-metilpropil
H3C
C C
H2 H
Alquila
4 carbonos
t-butil ou terc-butil
1,1-dimetiletil
H3C
Alquila
4 carbonos
Isobutil
2-metilpropil
H3C
Alquila
5 carbonos
n-pentil
Específico para Medicina!
H3C
C C
H2 H2
H3C
C CH2
H2
C
CH3
CH3
CH3
H
C
CH3
H3C
–
Localização da valência livre
C
H2
C C C C
H2 H2 H2 H2
Como ambos os carbonos são
primários, nesse caso não
importa em qual deles se
localiza a valência livre.
Valência livre localizada no
carbono primário. A letra n
significa normal.
Valência livre localizada no
carbono secundário. A letra s ou
a palavra sec significa
secundário (sec está em desuso).
Valência livre localizada no
carbono primário do radical com
cadeia normal.
Valência livre localizada no
carbono secundário do radical
com cadeia normal.
Valência livre localizada no
carbono terciário. A letra t ou a
palavra terc significa terciário
(terc está em desuso).
Valência livre localizada no
carbono primário do radical com
cadeia ramificada.
Valência livre localizada no
carbono primário do grupo com
cadeia normal.
42
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Classificação e
no de carbonos
Nome do grupo
Alquila
5 carbonos
isoamil ou isopentil
3-metilbutil
H3C
Alquila
5 carbonos
s-amil ou sec-amil
1,2-dimetilpropil
H3C
Alquila
5 carbonos
t-pentil ou terc-pentil
1,1-dimetilpropil
www.portalepisteme.com.br
Estrutura do grupo
H
C
CH3
C C
H2 H2
H
C
C
H
CH3
CH3
H3C
C
CH3
C CH3
H2
Neopentil
2,2-dimetilpropil
H3C
C
CH3
Alquila
5 carbonos
1-metilbutil
H3C
C
H
C C CH3
H2 H2
1-etilpropil
Alquenila
2 carbonos
etenil ou vinil
Alquenila
3 carbonos
Propenil
Prop-1-enil
H3C
C
H
C
H
Alquenila
3 carbonos
Isopropenil
1-metilenil
H3C
C
H
CH2
Alquenila
3 carbonos
alil
H2C
C
H
C
H2
Alquinila
2 carbonos
etinil
Alquinila
3 carbonos
Propinil
Prop-1-inil
H3C
C
C
Alquinila
3 carbonos
Propargil
Prop-2-inil
HC
C
C
H2
C C
H2 H
H2C
C CH3
H2
Cíclico
4 carbonos
C
ciclopropil
ciclobutil
Específico para Medicina!
H2C
CH2
H2C
CH2
H
C
H2C
–
Valência livre localizada no
carbono primário do grupo com
uma ramificação no carbono 2.
Valência livre localizada no
carbono secundário (carbono 2)
do grupo com cadeia normal.
Valência livre localizada no
carbono primário que faz a
ligação dupla.
Valência livre localizada no
carbono secundário.
Valência livre localizada no
carbono primário, oposto à
ligação dupla.
—
C
H
Cíclico
3 carbonos
Valência livre localizada no
carbono terciário.
––
C
H
HC
Valência livre localizada no
carbono secundário do grupo
com cadeia ramificada.
C
H2
Alquila
5 carbonos
H3C
Valência livre localizada no
carbono primário do grupo com
uma ramificação no carbono 3.
Valência livre localizada no
carbono primário.
CH3
Alquila
5 carbonos
Localização da valência livre
Valência livre localizada no
carbono primário que faz a
ligação tripla.
Valência livre localizada no
carbono primário, oposto à
ligação tripla.
Valência livre localizada em
qualquer um dos carbonos do
ciclo.
Valência livre localizada em
qualquer um dos carbonos do
ciclo.
43
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Classificação e
no de carbonos
Nome do grupo
Arila
6 carbonos
fenil
Arila
7 carbonos
orto-toluil ou o-toluil
www.portalepisteme.com.br
Estrutura do grupo
CH3
H3C
Arila
7 carbonos
meta-toluil ou m-toluil
Arila
7 carbonos
para-toluil ou p-toluil
H3C
Arila
10 carbonos
Não se enquadra
em nenhuma
classificação
7 carbonos
Valência livre localizada em um
dos carbonos do núcleo
aromático.
Observação: o nome fenil deriva
de feno, benzeno em alemão.
Valência livre localizada no
carbono 2 em relação ao grupo
metil.
o = orto (posição 1-2 no anel).
Valência livre localizada no
carbono 3 em relação ao grupo
metil.
m = meta (posição 1-3 no anel).
Valência livre localizada no
carbono 4 em relação ao grupo
metil.
p = para (posição 1-4 no anel).
Valência livre localizada em
uma das posições .
-naftil
Arila
10 carbonos
Localização da valência livre
-naftil
C
H2
benzil
Valência livre localizada em
uma das posições .
Valência livre localizada em
carbono ligado a um núcleo
aromático.
Vejamos agora os grupos divalentes:
Os grupos divalentes que possuem as valências livres em carbonos diferentes são nomeados utilizando-se
o prefixo indicativo da quantidade de átomos de carbonos, seguido da terminação ileno.
Os grupos divalentes que possuem as valências livres no mesmo carbono são nomeados utilizando-se o
prefixo indicativo da quantidade de átomos de carbonos, seguido da terminação ilideno.
Classificação e
no de carbonos
Nome do grupo
Alquileno
2 carbonos
Etileno
Alquileno
3 carbonos
1,2-propileno
Alquileno
3 carbonos
1,3-propileno
Estrutura do grupo
H2C
Específico para Medicina!
–
CH2
Localização da valência livre
As duas valências livres se
encontram em cada um dos
átomos de carbono.
H2C
CH
CH3
As valências livres estão nos
átomos de carbono 1 e 2.
H2C
CH2
CH2
As valências livres estão nos
átomos de carbono 1 e 3.
44
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Classificação e
no de carbonos
Nome do grupo
Arileno
6 carbonos
orto-fenileno
ou
o-fenileno
As valências livre estão nos
carbonos 1 e 2.
Arileno
6 carbonos
meta-fenileno
ou
m-fenileno
As valências livre estão nos
carbonos 1 e 3.
Arileno
6 carbonos
para-fenileno
ou
p-fenileno
As valências livre estão nos
carbonos 1 e 4.
Estrutura do grupo
Localização da valência livre
H
Alquilideno
2 carbonos
Etilideno
Alquilideno
3 carbonos
n-propilideno
Alquilideno
3 carbonos
Isopropilideno
1-metil-etilideno
Alquilideno
1 carbono
metileno
Alquilideno
7 carbonos
Benzilideno
Fenil-metileno
H3C
As duas valências livres se
encontram no mesmo átomo de
carbono.
C
C
As duas valências livres se
encontram no átomo de carbono
1.
CH3
As duas valências livres se
encontram no mesmo átomo de
2.
H
H3C
CH2
H3C
C
As duas valências livres se
encontram no mesmo átomo de
carbono.
H2C
H
C
As duas valências livres se
encontram no mesmo átomo de
carbono.
Séries orgânicas
Um conjunto de compostos orgânicos constitui uma série orgânica quando a diferença entre cada dois
compostos consecutivos da série é fornecida por um termo constante.
Séries homólogas
Quando um conjunto de compostos orgânicos pode ser ordenado de que a diferença entre 2 compostos
consecutivos seja de apenas 1 grupo – CH2, dizemos que esses compostos constituem uma série homóloga.
Específico para Medicina!
–
45
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Exemplos:
As séries homólogas apresentam a seguinte fórmula geral:
Cn H2n a Eb Fc ...
Em que as letras E e F representam elementos diferentes de carbono e de hidrogênio,e as letras a, b e c
representam números inteiros.
Assim, teremos:
♦ a fórmula geral da série I, do metano, é CnH2n + 2 ;
♦ a fórmula geral da série II, do metanol é CnH2n + 2 O.
A partir desse raciocínio, são freqüentes indagações do tipo:
♦ Qual o nome do 8o composto da série do metano?
CnH2n+2
C8H2 . 8 + 2
C8H18
H3C
octano
C C C C C C CH3
H2 H2 H2 H2 H2 H2
♦ Qual a fórmula molecular do 20o composto da série do metanol?
CnH2n+2
C20H2 . 20 + 2
C20H42O ou C20H41OH
Série isóloga
Quando um conjunto de compostos orgânicos pode ser ordenado de modo que a diferença entre 2
compostos consecutivos seja de apenas um grupo H2, dizemos que esses compostos constituem uma série
isóloga. Exemplos:
H H
H H
H
C
C
H
H
C
C
H
+
etino
H
H
C
C
CH3
H
H
_
propano
+
eteno
H2
H
H
H
H
H
C
C
C
H
H
H
etano
H2
H
CH3
C
C
C
CH3
_
H2
H2
propeno
Específico para Medicina!
–
propino
46
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Séries heteróloga
Quando uma série de compostos orgânicos de funções químicas diferentes possui o mesmo número de
átomos de carbono, dizemos que esses compostos constituem uma série heteróloga.
A tabela a seguir fornece alguns exemplos de compostos que possuem 3 carbonos, mas apresentam grupos
funcionais diferentes.
Fórmula
estrutural
H3C C CH3
H2
H3C
Fórmula
molecular
Nome do
composto
Grupo
funcional
C3H8
Propano
Hidrocarboneto
C3H8O
Propanol
Álcool
C3H6O
Propanona
Cetona
C C
H2
H
C3H6O
Propanal
Aldeído
O
C C
H2
OH
C3H6O2
Ácido propanóico
Ácido carboxílico
C C OH
H2 H2
O
C
H3C
CH3
O
H3C
H3C
Específico para Medicina!
–
47
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Exercícios de Aprendizagem
1. (Pucrj 2013) Recentemente, os produtores
de laranja do Brasil foram surpreendidos com a
notícia de que a exportação de suco de laranja
para os Estados Unidos poderia ser suspensa
por causa da contaminação pelo agrotóxico
carbendazim, representado a seguir.
De acordo com a estrutura, afirma-se que o
carbendazim possui:
a) fórmula molecular C9H11N3O2 e um carbono
terciário.
b) fórmula molecular C9H9N3O2 e sete carbonos
secundários.
c) fórmula molecular C9H13N3O2 e três carbonos
primários.
d) cinco ligações pi π e vinte e quatro
ligações sigma σ .
e) duas ligações pi π e dezenove ligações
sigma σ .
2. (Ufsc 2013) O ácido fólico é uma vitamina
hidrossolúvel, obtida pela ingestão de
alimentos, pois não é sintetizada pelo
organismo humano. Atua em conjunto com a
vitamina B12, sendo essencial na multiplicação
celular de todos os tecidos, já que é
indispensável
à
síntese
do
DNA
e
consequentemente
à
divisão
celular.
Especialistas indicam a administração diária de
um comprimido contendo 0,005 g de ácido fálico
desde os três meses que antecedem a
concepção até o terceiro mês de gestação,
visando prevenir principalmente a incidência de
malformações no fechamento do tubo neural
dos bebês. O ácido fólico, fórmula molecular
C19H19O6N7, é constituído por três blocos
construtivos: I – deriva do composto
nitrogenado pteridina, II – deriva do ácido paminobenzoico e III – deriva do ácido glutâmico.
Segue abaixo a fórmula estrutural simplificada
do ácido fólico:
Específico para Medicina!
–
De acordo com as informações acima, assinale
a(s) proposição(ões) CORRETA(S).
01) O ácido fálico apresenta seis ligações
covalentes do tipo pi π .
02) As moléculas de ácido fólico são polares e
interagem com a água por ligações de
hidrogênio.
04) O bloco I apresenta uma hidroxila fenólica.
08) O bloco II apresenta um átomo de carbono
com hibridização sp2.
16) O bloco III apresenta um átomo de carbono
assimétrico.
32) A estrutura química do ácido fálico
apresenta quatro átomos de carbono com
hibridização sp.
3. (Enem 2013) As moléculas de nanoputians
lembram figuras humanas e foram criadas para
estimular o interesse de jovens na compreensão
da linguagem expressa em fórmulas estruturais,
muito usadas em química orgânica. Um
exemplo é o NanoKid, representado na figura:
Em que parte do corpo do NanoKid existe
carbono quaternário?
a) Mãos.
b) Cabeça.
c) Tórax.
d) Abdômen.
e) Pés.
48
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
4. (Ufpr 2013) O átomo de carbono sofre três
tipos de hibridação: sp3, sp2 e sp. Essa
capacidade de combinação dos orbitais
atômicos permite que o carbono realize ligações
químicas com outros átomos, gerando um
grande número de compostos orgânicos. A
seguir são ilustradas estruturas de dois
compostos orgânicos que atuam como
hormônios.
Acerca da hibridação dos átomos de carbono
nos dois hormônios, considere as seguintes
afirmativas:
1. A testosterona possui dois átomos de
carbono com orbitais híbridos sp2.
2. A progesterona possui quatro átomos de
carbono com orbitais híbridos sp2.
3. Ambos os compostos apresentam o mesmo
número de átomos de carbono com orbitais
híbridos sp3.
4. O número total de átomos de carbono com
orbitais híbridos sp3 na testosterona é 16.
Assinale a alternativa correta.
a) Somente as afirmativas 1 e 3 são
verdadeiras.
b) Somente as afirmativas 2 e 4 são
verdadeiras.
c) Somente as afirmativas 2, 3 e 4 são
verdadeiras.
d) Somente as afirmativas 1, 2 e 3 são
verdadeiras.
e) As afirmativas 1, 2, 3 e 4 são verdadeiras.
5. (Espcex
correta:
Dados:
Element
o
Químico
Número
Atômico
a)
O
www.portalepisteme.com.br
b) O butano e o metilpropano apresentam a
mesma fórmula molecular C4H10 e a
mesma massa molar de 58 g mol e, por
conseguinte, possuem iguais pontos de fusão
e ebulição.
c) Metano, etano e propano são constituintes de
uma série homóloga de hidrocarbonetos.
d) Uma cadeia carbônica homogênea é
ramificada quando apresenta somente
carbonos primários e secundários.
e) A união das estruturas dos radicais orgânicos
etil e t-butil (ou terc-butil) gera um composto
orgânico cuja estrutura é nomeada por 2metilhexano.
6. (Udesc 2012)
Um flavorizante muito
conhecido na indústria de alimentos é o
butanoato de etila, que, ao ser misturado aos
alimentos, confere a estes um sabor de abacaxi.
Com relação ao butanoato de etila, é correto
afirmar que:
a) é um éter e apresenta dois substituintes: uma
butila e uma etila.
b)
pode
ser
representado
por
H3C CH2 CH2 CO CH2 CH3 .
c) apresenta um carbono com hibridização sp
em sua estrutura.
d) apresenta carbonos primários, secundários e
terciários em sua estrutura.
e) não forma ligações de hidrogênio entre suas
moléculas.
7. (Feevale 2012) A celulose é um polímero
orgânico presente nas paredes das células
vegetais,
mais
especificamente
um
polissacarídeo da glicose, conforme mostra a
figura abaixo.
(Aman) 2013) Assinale a alternativa
H
C
(Hidrogênio (Carbono
)
)
O
(Oxigênio
)
Z=1
Z=8
metanol,
Z=6
cuja fórmula
estrutural
é
H3C — OH, apresenta quatro ligações do tipo
π (pi).
Específico para Medicina!
–
A cadeia carbônica da glicose pode ser
classificada como:
a) fechada, homogênea, ramificada e saturada.
b) aberta, heterogênea, simples e insaturada.
c) fechada, heterogênea, ramificada e saturada.
d) fechada, heterogênea, ramificada e
insaturada.
e) aberta, homogênea, ramificada e saturada.
8. (Unisc 2012) Analisando as estruturas dos
compostos orgânicos I- Eugenol, II- Mentona,
49
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
III- Vanilina, assinale a única alternativa em que
a característica é observada igualmente nos
três compostos.
a) Igual número de carbonos assimétricos
b) Número de carbonos hibridizados sp3
c) Igual número de carbonos terciários
d) Nenhum carbono hibridizado sp
e) Mesmo número de ligações π
9. (Udesc 2011)
Analise
representado na figura a seguir.
o
composto
Assinale a alternativa correta em relação ao
composto.
a) Este composto representa um alcano de
cadeia linear.
b) Este composto possui apenas três carbonos
terciários.
c) Este composto possui quatro insaturações.
d) Neste composto encontra-se apenas um
carbono assimétrico.
e) Este composto é representando pela forma
molecular C16H32.
10. (G1 - cftmg 2010) O antraceno, formado por
3 anéis benzênicos com todos os carbonos
híbridos do tipo sp2, é um composto orgânico de
cadeia aromática condensada. Além disso,
contém 4 carbonos terciários e os demais,
secundários. Portanto, sua fórmula molecular é
a) C14H10.
b) C14H14.
c) C16H12.
d) C18H14.
www.portalepisteme.com.br
suína) com potencial efeito fatal atemorizou
novamente a sociedade humana.
Para o combate dessa doença, um
medicamento foi bastante procurado, o
Tamiflu®.
Na estrutura apresentada estão assinalados
três núcleos que, por característica, são,
respectivamente, átomos de carbono:
a) Terciário, linear e híbrido sp3.
b) Alifático, acíclico e natural.
c) Carboxílico, neutro e iônico.
d) Carboxílico, híbrido sp2 e carbonílico.
e) Híbrido sp2, quiral e híbrido sp3.
12. (Mackenzie 2010) Cientistas “fotografam”
molécula individual
Os átomos que formam uma molécula foram
visualizados de forma mais nítida pela primeira
vez, por meio de um microscópio de força
atômica. A observação, feita por cientistas em
Zurique (Suíça) e divulgada na revista
“Science”, representa um marco no que se
refere aos campos de eletrônica molecular e
nanotecnologia, além de um avanço no
desenvolvimento e melhoria da tecnologia de
dispositivos eletrônicos. De acordo com o jornal
espanhol “El País”, a molécula de pentaceno
pode ser usada em novos semicondutores
orgânicos.
Folha Online, 28/08/2009
11. (Pucpr 2010) No início do século passado,
a chamada gripe espanhola foi responsável
pela morte de milhares de pessoas em todo o
mundo. Recentemente, uma nova gripe (gripe
Específico para Medicina!
–
50
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Acima, foto da molécula de pentaceno e, a
seguir, representação da sua fórmula estrutural.
A respeito do pentaceno, são feitas as
afirmações I, II, III e IV.
I. É uma molécula que apresenta cadeia
carbônica aromática polinuclear.
II. A sua fórmula molecular é C22H14.
III. O pentaceno poderá ser utilizado na
indústria eletrônica.
IV. Os átomos de carbono na estrutura acima
possuem hibridização sp3.
Estão corretas
a) I, II, III e IV.
b) II, III e IV, apenas.
c) I, II e III, apenas.
d) I, III e IV, apenas.
e) I, II e IV, apenas.
13. (Ufmg 2010) A estrutura dos compostos
orgânicos pode ser representada de diferentes
modos.
Analise estas quatro fórmulas estruturais:
A partir dessa análise, é CORRETO afirmar que
o
número
de
compostos
diferentes
representados nesse conjunto é
a) 1.
b) 2.
c) 3.
d) 4.
14. (Uece 2010) Uma revisão de estudos prova
que a vitamina K preserva a saúde dos ossos,
previne contra doenças do coração e pode até
Específico para Medicina!
–
www.portalepisteme.com.br
afastar tumores. A vitamina K1 (filoquinona,
fitonadiona) encontra-se principalmente nos
vegetais de folhas verdes, tais como folhas de
nabo, espinafres, brócolis, couve e alface.
Outras fontes ricas são as sementes de soja,
fígado de vaca e chá verde. Boas fontes
incluem a gema de ovo, aveia, trigo integral,
batatas, tomates, aspargos, manteiga e queijo.
Com respeito à filoquinona, cuja fórmula
estrutural se encontra a seguir, assinale a
afirmação verdadeira.
a) Possui em sua composição química 31
átomos de carbono.
b) Seis é o número de carbonos terciários em
sua estrutura.
c) É um composto aromático polinuclear
condensado com uma função mista de um
aldeído.
d) Possui 74 ligações sigma (ó) e 7 ligações pi (
π ).
15. (Mackenzie 2009) O mentol, usado na
fabricação de balas e chicletes para propiciar
uma sensação refrescante, afeta os sensores
responsáveis pela sensação de frio, tornandoos ativos a uma temperatura acima do normal.
A fórmula estrutural do mentol:
e nela é possível identificar:
a) um radical fenil.
b) os radicais metil e isopropil.
c) uma substância orgânica da função fenol.
d) um álcool aromático.
e) uma substância de fórmula mínima CHO.
51
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
Exercícios de Fixação
1. (Uff) A estrutura dos compostos orgânicos começou a
ser desvendada nos meados do séc. XIX, com os estudos
de Couper e Kekulé, referentes ao comportamento
químico do carbono. Dentre as idéias propostas, três
particularidades do átomo de carbono são fundamentais,
sendo que uma delas refere-se à formação de cadeias.
Escreva a fórmula estrutural (contendo o menor número
de átomos de carbono possível) de hidrocarbonetos
apresentando cadeias carbônicas com as seguintes
particularidades:
a) acíclica, normal, saturada, homogênea.
b) acíclica, ramificada, insaturada etênica, homogênea.
c) aromática, mononuclear, ramificada.
TEXTO PARA A PRÓXIMA QUESTÃO
(Ufpb) As funções orgânicas oxigenadas constituem uma
grande família de compostos orgânicos, uma vez que,
depois do carbono e do hidrogênio, o oxigênio é o
elemento químico de maior presença nesses compostos.
O comportamento químico e demais propriedades desses
compostos estão diretamente relacionados à maneira
como os elementos químicos citados se apresentam nas
moléculas das diferentes substâncias.
TEXTO PARA A PRÓXIMA QUESTÃO
(Ufes) Onde há cafeína, há esgoto: Novos poluentes
podem ser identificados para avaliar a qualidade da água.
Um estudo realizado pela Fundação Oswaldo Cruz
sugere um novo e inusitado indicador ambiental: a
cafeína. A cafeína é uma substância muito presente na
dieta humana, encontrada não só no café, mas também
em refrigerantes, massas, chocolates, chás e até em
alguns medicamentos. Entre 0,5 % e 3 % da cafeína
ingerida é excretada pelo organismo humano sem sofrer
alterações metabólicas - ou seja, a molécula é excretada
inalterada pelo corpo - e jogada na rede de esgotos
urbanos.
(Mattos, Rosa Maria. "Ciência Hoje On-line".
Disponível em: <www.cienciahoje.com.br>. Acesso em:
22 maio 2006. Adaptado.)
3. A cafeína é um composto químico classificado como
alcalóide do grupo das xantinas. Entre o grupo das
xantinas inclue-se a teofilina, presente nas folhas do Chá
('Camellia sinensis'), e a teobromina, encontrada no
chocolate.
2. A xilocaína, ou lidocaína, é um composto oxigenado
que apresenta a propriedade de atuar como anestésico
local. A fórmula estrutural desse anestésico é
representada a seguir.
Em relação à xilocaína, é INCORRETO afirmar que
a) apresenta fórmula molecular C„H‚‚ON.
b) apresenta sete átomos de carbono com hibridização do
tipo sp£.
c) tem quatro átomos de carbono primário.
d) tem quatro ligações ™.
e) possui cadeia carbônica mista e heterogênea.
Específico para Medicina!
–
A respeito dos compostos citados, É CORRETO afirmar
que
a) os três são isômeros.
b) os três são aminas heterocíclicas aromáticas.
c) a teobromina contém 33,7 % de nitrogênio.
d) em 100 mL de uma solução de cafeína 0,10 mol.L-¢,
há 1,80 g de cafeína.
e) a teofilina possui quatro átomos de carbono com
geometria trigonal planar.
TEXTO PARA A PRÓXIMA QUESTÃO
52
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
4. O limoneno é um composto orgânico natural existente
na casca do limão e da laranja. Sua molécula está
representada a seguir.
www.portalepisteme.com.br
b) heterogênea, alifática e insaturada.
c) heterogênea, aromática e saturada.
d) homogênea, aromática e insaturada.
e) homogênea, alifática e insaturada.
TEXTO PARA A PRÓXIMA QUESTÃO
(Uel) Você já sentiu o ardido de pimenta na boca? Pois
bem, a substância responsável pela sensação picante na
língua é a capsaicina, substância ativa das pimentas. Sua
fórmula estrutural está representada a seguir.
6.
Sobre essa molécula, é correto afirmar que ela
a) é aromática.
b) apresenta fórmula molecular C•€H….
c) possui cadeia carbônica insaturada, mista e
homogênea.
d) apresenta 2 carbonos quaternários.
e) possui somente 2 ligações duplas e 8 ligações simples.
TEXTO PARA A PRÓXIMA QUESTÃO
(Ufpel) Os recursos hídricos podem ser considerados
sob três aspectos distintos: como elemento físico da
natureza, como ambiente para a vida e como fator
indispensável à vida na Terra.
A água usada no abastecimento de comunidades
humanas requer padrões de qualidade. Assim, ela não
deve apresentar sabor, odor e aparência desagradáveis,
bem como não deve conter substâncias nocivas e
microrganismos patogênicos.
O tratamento convencional para obtenção de água
potável utiliza métodos tais como aeração, pré-cloração,
carvão ativado e outros, a fim de remover substâncias
que causam odor e sabor nos suprimentos públicos de
água, decorrentes da atividade industrial, esgotos
domésticos, gases dissolvidos, matéria mineral
dissolvida e algas. Assim, nas águas com ferro (+2) e
manganês (+2), formam-se óxidos amarronzados que
alteram a cor e sabor dessas águas, enquanto que o gás
sulfídrico (sulfeto de hidrogênio) lhes altera o sabor e o
odor. Substâncias orgânicas, como, por exemplo, os
compostos 2-trans-6-cis-nonadienal e 3-cis-hexenol
produzidos por algas, em níveis muito baixos
(nanograma/L), causam alterações no sabor e odor.
5. Sobre os compostos orgânicos citados no texto, é
correto afirmar que apresentam cadeia
a) homogênea, alifática e saturada.
Específico para Medicina!
–
Em relação à estrutura da capsaicina, considere as
afirmativas a seguir.
I. Apresenta cadeia carbônica insaturada.
II. Apresenta três átomos carbono terciário.
III. Apresenta possibilidade de formar ligações (ponte)
de hidrogênio.
IV. Apresenta um ciclo de 6 átomos de carbono sp£ com
elétrons ™ ressonantes.
Estão corretas apenas as afirmativas:
a) I e II.
b) I e IV.
c) II e III.
d) I, III e IV.
e) II, III e IV.
TEXTO PARA A PRÓXIMA QUESTÃO
(Ufpel) A proteína do leite apresenta uma composição
variada em aminoácidos essenciais, isto é, aminoácidos
que o organismo necessita na sua dieta, por não ter
capacidade de sintetizar a partir de outras estruturas
orgânicas. A tabela a seguir apresenta a composição em
aminoácidos essenciais no leite de vaca.
7.
53
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
9. (Mackenzie) Do trinito tolueno (T.N.T.), cuja fórmula
estrutural é mostrada na figura a seguir. É INCORRETO
dizer que:
Sobre os aminoácidos representados pelas fórmulas
estruturais é correto afirmar que leucina, isoleucina e
valina diferem, respectivamente, nos substituintes (- R)
a) Isobutil, sec-butil e isopropil
b) Isopropil, etil e metil
c) Sec-butil, propil e etil
d) Isobutil, metil e n-butil
e) Metil, etil e n-propil
a) em relação ao metil, o grupo nitro está em posição
orto e para.
b) a cadeia carbônica é aromática, mononuclear e
ramificada.
c) o número de hidrogênios, em uma molécula, é igual a
cinco.
d) todos os carbonos são híbridos sp¤.
e) é um poderoso explosivo.
8. (Cesgranrio) A PREDNISONA é um glicocorticóide
sintético de potente ação anti-reumática, antinflamatória
e antialérgica, cujo uso, como de qualquer outro derivado
da cortisona, requer uma série de precauções em função
dos efeitos colaterais que pode causar. Os pacientes
submetidos a esse tratamento devem ser periodicamente
monitorados, e a relação entre o benefício e reações
adversas deve ser um fator preponderante na sua
indicação.
10. (Mackenzie)
Sobre o limoneno, substância obtida do óleo de limão,
representada acima, é INCORRETO afirmar que:
a) apresenta uma cadeia cíclica e ramificada.
b) apresenta duas ligações covalentes pi.
c) apresenta um carbono quaternário.
d) sua fórmula molecular é C³H†.
e) apresenta três carbonos terciários.
Com base na fórmula estrutural apresentada
anteriormente, qual o número de átomos de carbono
terciários que ocorrem em cada molécula da prednisona?
a) 3
b) 4
c) 5
d) 6
e) 7
Específico para Medicina!
–
11. (Puc-rio) Um grupo de compostos, denominado
ácidos graxos, constitui a mais importante fonte de
energia na dieta do Homem. Um exemplo destes é o
ácido linoleico, presente no leite humano. A sua fórmula
estrutural simplificada é:
CHƒ(CH‚)„(CH)‚CH‚(CH)‚(CH‚)‡COOH
54
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
Sua cadeia carbônica é classificada como:
a) Aberta, normal, saturada e homogênea.
b) Aberta, normal, insaturada e heterogênea.
c) Aberta, ramificada, insaturada e heterogênea.
d) Aberta, ramificada, saturada e homogênea.
e) Aberta, normal, insaturada e homogênea.
12. (Pucmg) Os compostos isopentano, neopentano e
isobutano apresentam o seguinte número de carbonos,
respectivamente:
a) 5, 5, 4
b) 6, 6, 4
c) 5, 6, 4
d) 6, 4, 5
e) 6, 6, 5
13. (Pucpr) Em relação ao composto 2,4-dimetil-3hexanol, são feitas as seguintes afirmações:
I - É um álcool terciário.
II - Sua fórmula molecular é C•H•O
III - Apresenta 2 carbonos terciários.
IV - Apresenta um carbono assimétrico.
V - Apresenta 4 carbonos primários.
Estão corretas:
a) I, III, IV e V
b) I, II, III e V
c) II, III, IV e V
d) I, II, III e IV
e) I, II, III, IV e V
www.portalepisteme.com.br
15. (Pucpr) O cheiro de peixe podre é indicativo da
presença da substância X que apresenta as seguintes
características:
I. É uma amina terciária
II. Seus carbonos apresentam 9 ligações sigma s-sp¤
III. Possui uma cadeia heterogênea
IV. Sua massa molar é 59 g/mol.
(Massas atômicas: H = 1, C = 12, N = 14, O = 16.)
A única fórmula que corresponde à descrição da
substância X é a:
16. (Pucrs) A "fluxetina", presente na composição
química do Prozac, apresenta fórmula estrutural
14. (Pucpr) Dado o composto:
Com relação a este composto, é correto afirmar que
apresenta
a) cadeia carbônica cíclica e saturada.
b) cadeia carbônica aromática e homogênea.
c) cadeia carbônica mista e heterogênea.
d) somente átomos de carbonos primários e secundários.
e) fórmula molecular C‡H†ONF.
os radicais ligados aos carbonos 3, 5 e 6 da cadeia
principal são, respectivamente:
a) metil, etil e benzil
b) fenil, etil e metil
c) hexil, etil e metil
d) metil, etil e fenil
e) benzil, etil e metil
Específico para Medicina!
17. (Pucrs) A fórmula estrutural que representa
corretamente um álcool com cadeia carbônica alifática e
insaturada é
–
55
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
b) Arranjo de cadeias carbônicas acíclicas.
c) Cadeias alicíclicas de ligações saturadas.
d) Cadeias carbônicas heterocíclicas.
e) Arranjo de anéis de ciclohexano.
20. (Uerj) Na fabricação de tecidos de algodão, a adição
de compostos do tipo N-haloamina confere a eles
propriedades biocidas, matando até bactérias que
produzem mau cheiro.
O grande responsável por tal efeito é o cloro presente
nesses compostos.
18. (Uece) O radical benzeno chama-se fenil, enquanto
benzil é o radical derivado do tolueno. Estes dois radicais
apresentam as seguintes estruturas:
A cadeia carbônica da N-haloamina acima representada
pode ser classificada como:
a) homogênea, saturada, normal
b) heterogênea, insaturada, normal
c) heterogênea, saturada, ramificada
d) homogênea, insaturada, ramificada
19. (Uel) Dentre os componentes do cigarro, encontramse a nicotina que interfere no fluxo de informações entre
as células, a amônia que provoca irritação nos olhos e o
alcatrão, formado pela mistura de compostos como o
benzopireno, o crizeno e o antraceno, todos com
potencial cancerígeno. Sobre o benzopireno, cuja
estrutura química é apresentada a seguir, é correto
afirmar que a molécula é formada por:
Os números de carbono terciários e quaternários com
hibridização sp¤ e o número de elétrons ™ existentes na
molécula do lanosterol são, respectivamente,
a) 2, 4 e 2.
a) Cadeias aromáticas com núcleo benzênico.
Específico para Medicina!
21. (Ufes) O lanosterol é um intermediário na biossíntese
do colesterol, um importante precursor de hormônios
humanos e constituinte vital de membranas celulares.
–
56
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
b) 2, 4 e 4.
c) 3, 3 e 2.
d) 3, 4 e 2.
e) 3, 4 e 4.
22. (Ufes) O chá da planta 'Bidens pilosa', conhecida
vulgarmente pelo nome de picão, é usado para combater
icterícia de recém-nascidos. Das folhas dessa planta, é
extraída uma substância química, cujo nome oficial é 1fenilepta-1,3,5-triino e cuja estrutura é apresentada a
seguir. Essa substância possui propriedades
antimicrobianas e, quando irradiada com luz ultravioleta,
apresenta atividade contra larvas de mosquitos e
nematóides. Sobre a estrutura dessa substância, pode-se
afirmar que
a) possui 12 átomos de carbono com hibridização sp£.
b) possui 12 ligações œ carbono-carbono.
c) não possui carbonos com hibridização sp¤.
d) possui 3 átomos de carbono com hibridização sp.
e) possui 9 ligações ™ carbono-carbono.
23. (Uff) Analise a estrutura seguinte e considere as
regras de nomenclatura da IUPAC.
www.portalepisteme.com.br
Assinale a opção que indica as cadeias laterais ligadas,
respectivamente, aos carbonos de números 4 e 5 da
cadeia hidrocarbônica principal.
a) propil e isobutil
b) metil e isobutil
c) terc-pentil e terc-butil
d) propil e terc-pentil
e) metil e propil
24. (Ufg) Monoterpenos, substâncias de origem vegetal e
animal, podem ser divididos em acíclicos, monocíclicos
e bicíclicos. São exemplos de monoterpenos as estruturas
a seguir.
Entre os monoterpenos representados, são acíclico,
monocíclico e bicíclico, respectivamente:
a) 1, 2 e 3
b) 1, 3 e 5
c) 2, 3 e 5
d) 2, 4 e 6
e) 2, 4 e 5
25. (Ufmg) Observe a estrutura do adamantano.
Em relação a essa estrutura, todas as alternativas estão
corretas, EXCETO
a) Contém átomos de carbonos secundário.
Específico para Medicina!
–
57
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
b) Contém átomos de carbono terciário.
c) Contém átomos de hidrogênio primário.
d) É um hidrocarboneto saturado policíclico.
e) Tem fórmula molecular C³H†.
26. (Ufpel) O Mescal é uma planta da família das
Cactáceas, nativa do México, usada pela população de
certas partes do país como alucinógeno, em rituais
religiosos primitivos. O efeito alucinógeno dessa planta é
decorrente de um alcalóide conhecido como mescalina.
Observe sua estrutura:
Sobre a mescalina, é correto afirmar que
I - tem fórmula molecular CH‡OƒN.
II - tem na sua estrutura carbonos primários e
quaternários.
III - tem hibridação do tipo sp¤-sp¤ nos carbonos do anel
benzênico.
Está(ão) correta(s)
a) todas as afirmativas.
b) as afirmativas I e II.
c) as afirmativas II e III.
d) as afirmativas I e III.
e) somente a afirmativa I.
27. (Ufpr) As denúncias de falsificação de medicamentos
têm sido embasadas em diferenças na rotulagem e
aspectos físicos dos produtos, mas somente uma análise
química pode identificar e quantificar a presença dos
princípios ativos.
Na estrutura a seguir mostra-se o Sildenafil, princípio
ativo do Viagra. A análise preliminar de um comprimido
desse medicamento, comprado em uma farmácia
qualquer, revela:
"A amostra apresenta, dentre outras possíveis, as funções
orgânicas éter e amina e átomos de carbono, hidrogênio,
nitrogênio, enxofre e oxigênio."
Com base nas informações anterior, é correto afirmar:
(01) O resultado da análise preliminar indica a presença
de todos os elementos químicos que compõem a
molécula do princípio ativo do Viagra.
(02) A análise identifica duas funções orgânicas
presentes na molécula do princípio ativo do Viagra.
(04) O Sildenafil apresenta quatro anéis, sendo três
heterocíclicos e um aromático.
(08) Na estrutura ilustrada acima há onze carbonos com
hibridização sp£.
(16) O principio ativo do Viagra apresenta caráter ácido
devido aos pares de elétrons livres nos átomos de
nitrogênio.
(32) A estrutura do Sildenafil apresenta sete elétrons que
participam de ligações ™ no anel aromático.
Soma (
)
28. (Ufpr) Dioxinas são substâncias que estão presentes
na Terra há mais de 60 milhões de anos. Há mais de 200
tipos delas, constituindo o grupo mais venenoso
conhecido para o homem e para o meio ambiente.
Aparecem como subprodutos nos processos de
degradação e síntese de muitas substâncias em indústrias,
tais como a alimentícia e a de papel e celulose. Estudos
têm mostrado que as dioxinas causam câncer, reduzem
as defesas imunológicas e perturbam o equilíbrio
genético e hormonal, inclusive em embriões. Seu efeito é
tão devastador que os Estados Unidos da América
estabeleceram como concentração máxima permissível 1
fentograma de dioxina por litro de água (fento=1x10- ¢¦).
A molécula mais simples de dioxina, representada
adiante, é a estrutura de partida para as demais e dá o
nome a esta classe de compostos.
Específico para Medicina!
–
58
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
(04) O(s) composto(s) do conjunto XI apresenta(m)
ligações ™ deslocalizadas.
(08) O(s) composto(s) do conjunto VII apresenta(m)
cadeia(s) homogênea(s).
(16) O(s) composto(s) do conjunto V apresenta(m) três
carbonos primários.
Soma (
)
30. (Ufrrj) A estrutura do Geraniol, precursor de um
aromatizante com odor de rosas, está colocada a seguir.
Com base nas informações acima, é correto afirmar:
(01) A fórmula molecular da dioxina é C‚O‚H•.
(02) Na estrutura da dioxina aparecem apenas 6 átomos
de carbono com hibridização do tipo sp£.
(04) Os átomos de oxigênio apresentam-se com uma
densidade de carga eletrônica superior à dos átomos de
carbono adjacentes.
(08) A dioxina é uma substância muito pouco reativa,
não modificando a estrutura conformacional de proteínas
e DNA.
(16) Nos Estados Unidos da América, uma amostra de
água de volume igual a 1 m¤ seria considerada imprópria
para o consumo se nela estivesse dissolvido 1
fentograma de dioxina.
Soma (
)
29. (Ufpr) A questão refere-se ao esquema a seguir,
construído a partir da classificação dos compostos do
conjunto I, que é um subconjunto dos hidrocarbonetos.
Em relação à molécula, pode-se afirmar que
a) apresenta 30 ligações sigmas (œ) e 2 pi (™).
b) é um hidrocarboneto de cadeia insaturada.
c) os carbonos três e quatro da cadeia principal
apresentam hibridações sp¤ e sp£, respectivamente.
d) dos dez carbonos, quatro são trigonais e seis são
tetraédricos.
e) apresenta cadeia acíclica, ramificada, heterogênea e
insaturada.
31. (Ufrrj) Dos compostos a seguir, aquele que apresenta
uma cadeia carbônica acíclica, normal, saturada e
heterogênea é o
a) 2- propanol.
b) etilamina.
c) 1- cloro - propano.
d) etoxi - etano.
e) hidroxi - benzeno.
32. (Ufrs) A fumaça liberada na queima de carvão
contém muitas substâncias cancerígenas, dentre elas os
benzopirenos, como, por exemplo, a estrutura
Sobre a classificação dos compostos do conjunto I,
segundo o esquema acima, é correto afirmar:
(01) Os compostos do conjunto VI contêm apenas
ligações simples e duplas.
(02) Os compostos do conjunto II são hidrocarbonetos
saturados.
Específico para Medicina!
–
Sua cadeia carbônica corresponde a um
59
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
a) hidrocarboneto, insaturado, aromático, com núcleos
condensados.
b) hidrocarboneto, alicíclico, insaturado, com três
núcleos condensados.
c) heterocíclico, saturado, aromático.
d) ciclo homogêneo, saturado, aromático.
e) alqueno, insaturado, não aromático.
33. (Ufsc) A estrutura do hidrocarboneto aromático
benzeno (C†H†) é representada pelo híbrido de
ressonância a seguir, que possui:
www.portalepisteme.com.br
b) Na serotonia e na tirosina, existem ligações ™ entre
carbono sp£ e oxigênio.
c) Todas as moléculas contêm, pelo menos, uma ligação
entre carbono sp e oxigênio.
d) Todas as moléculas contêm ligações ™ em um sistema
com deslocalização de elétrons.
e) Somente na serotonia, existem ligações œ e ™ entre
átomos de carbono e nitrogênio.
35. (Ufu) O hidrocarboneto que apresenta cadeia
acíclica, ramificada, saturada e homogênea é
a) 4-etil-4,5-dimetil-2-heptanol.
b) 4-isopropil-2,4,5-trimetil-2-hepteno.
c) 2,4,5-trimetil-4-propileptano.
d) 2-etil-4-isopropil-1-metilcicloexano.
(01) três carbonos híbridos em sp¤ e três carbonos
híbridos em sp£.
(02) seis orbitais não-híbridos denominados "p puro".
(04) todos os átomos de hidrogênio ligados aos de
carbono através de ligações “ (s-sp£).
(08) três ligações do tipo ™.
(16) apenas seis ligações do tipo “.
(32) todos os carbonos híbridos em sp£.
(64) três carbonos saturados e três carbonos insaturados.
Soma ( )
34. (Ufsm) Considere, a seguir, o conjunto de
representações de moléculas de algumas substâncias
químicas com fundamental importância na fisiologia
humana.
36. (Unirio) O agente laranja ou 2,4-D é um tipo de arma
química utilizada na Guerra do Vietnã como desfolhante,
impedindo que soldados se escondessem sob as árvores
durante os bombardeios.
Na estrutura do agente laranja, anterior, estão presentes:
a) 4 ligações ™ e 1 cadeia aromática.
b) 3 ligações ™ e 1 cadeia aromática.
c) 1 cadeia mista e 9 ligações sigma.
d) 1 cadeia heterogênea e 5 carbonos secundários.
GABARITO
1. Ver figura.
Então, qual a afirmação correta a respeito das ligações
químicas existentes nas moléculas representadas?
a) Todas as moléculas contêm ligações ™ entre carbono
sp¤ e nitrogênio.
Específico para Medicina!
–
60
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
www.portalepisteme.com.br
2. [A]
20. [C]
3. [B]
21. [E]
4. [C]
22. [E]
5. [E]
23. [A]
6. [D]
24. [D]
7. [A]
25. [C]
8. [C]
26. [E]
9. [D]
27. 01 + 02 + 04 + 08 = 15
10. [C]
28. 01 + 04 = 05
11. [E]
29. 04 + 08 + 16 = 28
12. [A]
30. [D]
13. [C]
31. [D]
14. [B]
32. [A]
15. [C]
33. 02 + 04 + 08 + 32 = 46
16. [C]
34. [D]
17. [C]
35. [C]
18. [D]
36. [A]
19. [A]
Específico para Medicina!
–
61
e-mail: [email protected]
Curso de Química – Prof. Alexandre Oliveira
62
www.alexquimica.com.br –
e-mail: [email protected]