Crescimento e Absorção de Fósforo de Plantas de Sorgo Inoculadas com Fungos
Solubilizadores de Fosfato Associado à Aplicação de Fosfato Natural
Marcos V. M. Sarto(1), Fábio Steiner(2), Laércio A. Pivetta(2), Gustavo Castoldi(2) e Rafael L.
Lázaro(1)
(1)
Acadêmico do Curso de Agronomia da UNIOESTE - Universidade Estadual do Oeste do Paraná. Marechal
Cândido Rondon, PR. CEP 85960-000. Cx. Postal 91. (2)Faculdade de Ciências Agronômicas – FCA/UNESP, ,
Cx. Postal 237, Botucatu, SP. E-mail: [email protected]
Palavras-chave: Sorghum bicolor L., Fosfato natural, Aspergillus spp. e Penicillium spp.
A disponibilidade de nutrientes é um dos fatores determinantes para o
desenvolvimento vegetal. No caso dos solos brasileiros, o fósforo é um dos elementos mais
limitantes, e a utilização de formas solúveis para a adubação das culturas requer a aplicação
de doses superiores às necessárias ao crescimento da planta, tendo em vista que cerca de 90%
do P adicionado pode ser adsorvido pelos oxidróxidos de Fe e Al, presentes, de modo geral,
em maiores quantidades em solos tropicais mais intemperizados (Novais & Smyth, 1999;
Silva Filho et al., 2002), como exemplo, pode-se citar, os Latossolos presentes no Oeste do
Paraná. O íon fosfato pode também precipitar-se com íons Ca2+, Fe3+ e Al3+, formando
compostos de composição definida e pouco solúveis (Igual et al., 2001).
A solubilização dessas formas inorgânicas de P é favorecida pelo consumo dos
produtos solúveis, como os cátions e o íon fosfato, alterando a constante de equilíbrio (Bolan
et al., 1997). Essa alteração pode ser efetuada pelas plantas e por microrganismos do solo, que
são capazes de acidificar o meio, consumindo o fosfato e os cátions resultantes da
solubilização. Dessa forma, a solubilização de fosfatos inorgânicos geralmente é maior na
rizosfera do que em solo não-rizosférico (Bolan et al., 1997).
A inoculação de microrganismos benéficos em plantas tem sido empregada para
melhorar seu desenvolvimento (Caravaca et al., 2002). Vários grupos de microrganismos
edáficos apresentam capacidade de solubilizar fosfatos existentes no solo ou adicionados na
forma de fertilizantes (Whitelaw, 2000). Segundo Silva Filho et al. (2002) entre as populações
fúngicas com potencial para solubilização destacam-se os gêneros Aspergillus e Penicillium.
A importância dos microrganismos encontrados no solo rizosférico no suprimento de
P para as plantas já foi demonstrada em vários trabalhos (Freitas et al., 1997; Gyaneshwar et
al., 2002), e sua efetividade depende da interação destes com a planta hospedeira e a
microbiota associada. Esse fato é justificado pela variação que existe na composição dos
exsudatos radiculares em relação à espécie da planta (Grayston et al., 1996). Aumentos
significativos na produção de matéria seca e na absorção de nutrientes foram obtidos pela
inoculação com fungos solubilizadores de fosfato em diferentes espécies, como em canola
(Freitas et al., 1997), em milho (Nahas et al., 1994; Silva, 2009), em trigo (Singh & Kapoor,
1999; Costa et al., 2009; Steiner et al., 2009), assim como em espécies florestais, como Pinus
e Eucalyptus (Silva Filho et al., 2002). No entanto, até o momento pesquisas envolvendo a
cultura do sorgo granífero são inexistentes na literatura nacional.
Sabe-se que são vários os fatores que influenciam a capacidade de solubilização desses
microrganismos, como a fonte de carbono e nitrogênio disponíveis (Nautiyal et al., 2000), o
tipo de planta cultivada (Grayston et al., 1996), o tipo de fosfato a ser solubilizado (Nahas,
1996; Barroso & Nahas, 2005), entre outros, como a presença de herbicidas ou inseticidas
(Das & Murkherjee, 1998; Reis et al., 2008). Nahas et al. (1994) destacam que a população de
XXVIII Congresso Nacional de Milho e Sorgo, 2010, Goiânia: Associação Brasileira de Milho e Sorgo. CD-Rom
1462
microrganismos solubilizadores de fosfato e sua capacidade de solubilização estão
intimamente relacionadas ao tipo e ao manejo do solo.
Assim, devido à necessidade de se buscar alternativas que possibilitem altas
produtividades e com baixo custo. Este estudo foi conduzido com o objetivo de avaliar o
efeito da inoculação de fungos solubilizadores de fosfato associado à aplicação de fosfato
natural reativo de Gafsa sobre a absorção de P e o crescimento do sorgo granífero, cultivado
em Latossolo Vermelho eutroférrico.
Materiais e Métodos
O experimento foi conduzido em casa de vegetação pertencente ao Núcleo de Estação
Experimental – NEE da UNIOESTE, Campus de Marechal Cândido Rondon, PR, durante os
meses de novembro de 2009 e fevereiro de 2010. Foram utilizadas amostras, coletadas na
camada superficial de 0-20 cm de profundidade, de um Latossolo Vermelho eutroférrico
(LVef) de textura argilosa (580 g kg-1 argila). A análise química do solo apresentou os
seguintes resultados: matéria orgânica = 28,7 g dm-3; pH em CaCl2 = 5,1; P (Mehlich-1) = 4,8
mg dm-3; K = 3 mmolc dm-3; Ca = 29 mmolc dm-3 e Mg = 9 mmolc dm-3; CTC = 92 mmolc
dm-3 e V = 50%.
O delineamento experimental utilizado foi de blocos ao acaso com quatro tratamentos
e cinco repetições. Os tratamentos foram: 1) fosfato natural reativo de Gafsa (240 mg dm-3 de
P2O5); 2) fosfato natural de Gafsa (240 mg dm-3 de P2O5) + fungos solubilizadores de fosfato
– FSF (108 UFC mL-1); 3) FSF (108 UFC mL-1) e, 4) controle (sem inoculação e adubação
fosfatada). A unidade experimental foi constituída de vasos de polietileno com capacidade de
8,0 dm3. A dose de fosfato natural de Gafsa foi aplicada em todo o volume de solo. O potássio
foi aplicado na forma de cloreto de potássio em dose equivalente a 120 mg dm-3 de K2O.
Na semeadura utilizou-se a cultivar DKB 510 que após o desbaste deixou-se oito
plantas por vaso. A adubação nitrogenada foi realizada semanalmente, aplicando-se via
solução 10 mg dm-3 de N na forma de uréia. Os FSF foram inoculados três dias após a
emergência, via meio líquido GL (Sylvester-Bradley et al., 1982), pipetando-se 1 mL do
inoculante no colo de cada plântula (Costa et al., 2009). Para a preparação do inoculante, a
suspensão de cada isolado de FSF (Aspergillus sp. e Penicillium sp.) foi realizada
separadamente. Cada isolado foi repicado para placas de Petri contendo 20 mL de meio GL,
adicionado de CaHPO4 (10%), conforme Sylvester-Bradley et al. (1982). Após 4 dias de
incubação a 30 °C, procedeu-se a suspensão de esporos com solução salina (0,85%) e Tween
80%. Foram realizadas diluições sucessivas até 10-4. Esta última diluição foi utilizada para o
plaqueamento em triplicata. As placas foram incubadas por sete dias a 30 °C, no escuro, e
feita à contagem direta das UFC. As suspensões foram padronizadas para 108 UFC mL–1
conforme procedimentos utilizados por Costa et al. (2009).
Aos 45 dias após a emergência todas as plantas dos vasos foram cortadas rente ao solo
e submetidas às seguintes avaliações: i) altura de planta; ii) matéria seca da parte aérea e de
raiz, após secagem em estufa de circulação forçada de ar a 65 ± 2 ºC por 72 h, e os valores
expressos em gramas por vaso (g/vaso); iii) volume radicular, obtido pelo método da proveta
volumétrica. Uma amostra de 0,2 g de material seco da parte aérea foi submetida a digestão
ácida utilizando uma mistura de ácido nítrico e ácido perclórico na proporção 3:1 de acordo
com metodologia da Embrapa (1997) para determinação do teor de P e então calculou-se o
conteúdo de P absorvido (Braga & Defelipo, 1974).
XXVIII Congresso Nacional de Milho e Sorgo, 2010, Goiânia: Associação Brasileira de Milho e Sorgo. CD-Rom
1463
Os dados obtidos foram submetidos à análise de variância e as médias comparadas
pelo teste de Tukey ao nível de 5% de probabilidade. Utilizou-se o programa estatístico
SISVAR versão 5.0 para o processamento dos dados.
Resultados e Discussão
A aplicação de fosfato natural de Gafsa associado ou não à inoculação de fungos
solubilizadores de fosfato (FSF) proporcionaram os maiores incrementos na altura de plantas
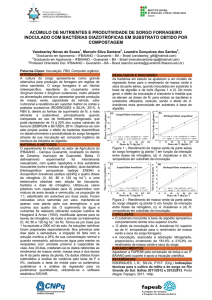
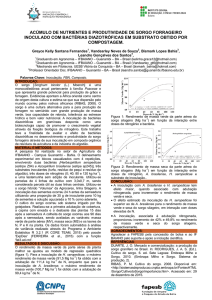
e na matéria seca de parte aérea. Apresentando altura média de 95,2 e 82,4 cm e matéria seca
da parte aérea de 49,5 e 39,6 g/vaso, respectivamente, na presença e na ausência de FSF
(Figura 1a e 1b). Deste modo, observa-se que a inoculação de fungos solubilizadores de
fosfato (FSF) proporcionou um acréscimo percentual de 15% e 25% na altura e matéria seca
da parte aérea, respectivamente.
Apesar do fosfato natural de Gafsa (29% P2O5) ser uma fonte pouco solúvel, mas por
ter sido a única fonte utilizada, naturalmente, o sorgo teve seu crescimento favorecido pela
adição deste fertilizante (Figura 1 e 2). Fato este que pode ser explicado, em parte, devido ao
nível médio de P (4,8 mg dm-3) existente no solo antes da implantação do experimento.
Trabalhando com fonte natural e solúvel de fosfato Harger et al. (2007), obtiveram
produção de matéria seca e teores de P da parte aérea de plantas de milho de modo similar,
com a utilização de superfosfato triplo e fosfato de Arad (33% P2O5).
Sabe-se que as características de reatividade das fontes de P são determinantes em
relação à sua eficiência. Os fosfatos de alta reatividade, sendo mais prontamente disponíveis,
favorecem a absorção e ao aproveitamento do P, principalmente pelas culturas de ciclo curto
(Bedin et al., 2003). Contrariamente, os fosfatos naturais apresentam solubilização mais lenta
e ocorre um aumento gradual da disponibilidade de P (Novais & Smyth, 1999).
Altura de planta (cm)
90
80
A
AB
B
70
60
50
40
30
20
60
(a)
C
Massa seca parte aérea (g/vaso)
100
(b)
A
50
40
30
B
C
D
20
10
Figura 1. Altura de plantas – (a) e massa seca da parte aérea – (b) do sorgo granífero cultivar
0
DKB0 510 em função da aplicação de fosfato natural
reativo de Gafsa (FNR) e fungos
FNR (Gafsa)
FNR (Gafsa) + FSF
FSF
Controle
FNR (Gafsa)
FNR (Gafsa) + FSF
FSF
Controle
solubilizadores de fosfato (FSF). Marechal Cândido Rondon, PR. 2009/2010. (Barra seguida
Tratamento
Tratamento
da mesma letra não difere entre si pelo teste Tukey a 5% de probabilidade).
10
A simples inoculação de FSF mostrou-se uma alternativa positiva, em que as plantas
inoculadas apresentaram valores superiores ao tratamento controle. Com valores de altura de
73,2 e 48,8 cm e de matéria seca da parte aérea de 29,4 e 21,0 g/vaso, respectivamente, com a
inoculação de FSF e para o tratamento controle (Figura 1). Resultados contrários foram
evidenciados por Steiner et al. (2009) para a cultura do trigo em estudo semelhante a este.
A aplicação de fosfato natural de Gafsa favoreceu o desenvolvimento do sistema
radicular das plantas de sorgo. De modo que se observa os maiores valores (14,5 g/vaso) de
XXVIII Congresso Nacional de Milho e Sorgo, 2010, Goiânia: Associação Brasileira de Milho e Sorgo. CD-Rom
1464
matéria seca de raiz, se diferenciando dos demais tratamentos (Figura 2a). Este maior
desenvolvimento do tratamento que recebeu apenas a aplicação de fosfato natural de Gafsa
pode ser explicado, devido que as raízes tiveram que se desenvolver mais para buscar o
fosfato no solo. Pois quando se promoveu a inoculação de FSF este fosfato esteve disponível
em maiores proporções e o sistema radicular não necessitou de procurar o íon fosfato para a
sua absorção. Resultado estes que podem ser comprovados pelos maiores teores e acúmulo de
P na parte aérea quando se aplicou fosfato natural de Gafsa associado à inoculação de FSF
(Figura 3a e 3b).
Entretanto, ao se analisar o volume radicular (Figura 2b) não se verificou diferença
significativa da aplicação com fosfato de Gafsa na presença e na ausência da inoculação de
FSF. A simples inoculação de FSF não se mostrou efetiva, em que as plantas inoculadas
apresentaram valores poucos superiores ao tratamento controle. Com valores de matéria seca
de raiz de 6,6 e 5,3 g/vaso e de volume radicular de 18,3 e 12,5 cm3/vaso, respectivamente,
com a inoculação de FSF e para o tratamento controle (Figura 2a,b).
15
50
(a)
A
Volum e radicular (cm3/vaso)
Massa seca de raiz (g/vaso)
18
B
12
9
C
C
6
3
0
(b)
A
40
A
30
B
20
B
10
0
FNR (Gafsa)
FNR (Gafsa) + FSF
FSF
Controle
FNR (Gafsa)
FNR (Gafsa) + FSF
Tratamento
FSF
Controle
Tratamento
Figura 2. Matéria seca de raiz – (a) e volume radicular – (b) de plantas de sorgo granífero
cultivar DKB 510 em função da aplicação de fosfato natural reativo de Gafsa (FNR) e fungos
solubilizadores de fosfato (FSF). Marechal Cândido Rondon, PR. 2009/2010. (Barra seguida
da mesma letra não difere entre si pelo teste Tukey a 5% de probabilidade).
A eficiente ação solubilizadora por fungos dos gêneros Aspergillus e Penicillium foi
relatada por Whitelaw (2000) e Vassilev & Vassileva (2003). Reyes et al. (1999) encontraram
correlação positiva entre a solubilização de fosfatos por P. rugulosum. Silva Filho & Vidor
(2001) relatam que as diferenças na capacidade e no potencial de solubilização ocasionam
alterações quantitativas ou qualitativas nos metabólitos produzidos e sugerem a ocorrência de
diferentes mecanismos de solubilização ou de processos com eficiência variável.
3,6
A
2,8
Teor de P (g kg -1)
(b)
A
160
2,4
B
2,0
B
1,6
1,2
Acúmulo de P (mg/vaso)
3,2
180
(a)
A
140
120
B
100
80
C
60
C
XXVIII
Congresso Nacional de Milho e Sorgo, 2010, Goiânia:
0,8
40 Associação Brasileira de Milho e Sorgo. CD-Rom
0,4
20
0,0
0
FNR (Gafsa)
FNR (Gafsa) + FSF
Tratamento
FSF
Controle
1465
FNR (Gafsa)
FNR (Gafsa) + FSF
Tratamento
FSF
Controle
Figura 3. Teor – (a) e acúmulo – (b) de fósforo na parte aérea do sorgo granífero cultivar
DKB 510 em função da aplicação de fosfato natural reativo de Gafsa (FNR) e fungos
solubilizadores de fosfato (FSF). Marechal Cândido Rondon, PR. 2009/2010. (Barra seguida
da mesma letra não difere entre si pelo teste Tukey a 5% de probabilidade).
No presente trabalho verifica-se, de modo geral, que a inoculação dos FSF resultou em
benefício apenas sobre o crescimento das plantas de sorgo. Em princípio, era esperado que
estes fungos disponibilizassem o P adsorvido aos colóides de argila para a solução do solo o
que, possivelmente, favoreceria a nutrição e o crescimento da cultura. Provavelmente, tais
fungos apresentaram baixa capacidade competitiva frente à biota nativa, o que comprometeu
seu estabelecimento no solo.
Segundo Richardson (1994) a aparente falta de especificidade entre os microrganismos
solubilizadores de fosfato e as plantas, constitui um dos principais fatores limitantes ao
sucesso da inoculação. Esse problema, de certa forma, pode ser minimizado pelo uso de
inoculantes com um número bastante elevado de células ativas e do uso de microrganismos
capazes de estabelecerem-se prontamente na rizosfera das plantas.
Conclusões
A aplicação de fosfato natural reativo de Gafsa de forma isolada ou associada à
inoculação de fungos solubilizadores de fosfato favorece a absorção de P e o crescimento de
plantas de sorgo granífero.
A inoculação dos fungos solubilizadores de fosfato sem aplicação de fosfato
influenciou positivamente o crescimento de plantas de sorgo granífero, porém, possui pouco
efeito sobre a absorção de P.
Literatura Citada
BARROSO, C.B.; NAHAS, E. The status of soil phosphate fractions and the ability of fungi
to dissolve hardly soluble phosphates. Applied Soil Ecology, v.29, n.1, p.73-83, 2005.
BEDIN, I.; FURTINI NETO, A.E.; RESENDE, A.V.; FAQUIN, V.; TOKURA, A.M.;
SANTOS, J.Z.L. Fertilizantes fosfatados e produção de soja em solos com diferentes
capacidades tampão de fosfato. Revista Brasileira de Ciência do Solo, v.27, p.639-646,
2003.
BOLAN, N.S. ELLIOT, J.; GRAGG, P.E.H. Enhanced dissolution of phosphate rocks in the
rhizosphere. Biology and Fertility of Soils, v.24, n.2, p.169-174, 1997.
BRAGA, J.M.; DEFELIPO, B.V. Determinação espectrofotométrica de fósforo em extratos
de solos e plantas. Revista Ceres, v.21, n.113, p.73-85, 1974.
XXVIII Congresso Nacional de Milho e Sorgo, 2010, Goiânia: Associação Brasileira de Milho e Sorgo. CD-Rom
1466
CARAVACA, F.; BAREA, J.M.; ROLDÁN, A. Assessing the effectiveness of mycorrhizal
inoculation and soil compost addition for enhancing reforestation with Olea europaea subs
sylvestris through changes in soil biological and physical parameters. Applied Soil Ecology,
v. 20, p. 107-118, 2002.
COSTA, L.M.; CABRAL, J.S.R.; SOUCHIE, E.L.; SILVA, F.G.; CAPRONI, A.L. Ácidos
orgânicos, fungos solubilizadores de fosfato e fosfato de arad na cultura do trigo em solo de
cerrado. Global Science and Technology, v.2, n.1, p.49-59, 2009.
DAS, A.C.; MUKHERJEE, D. Inseticidal effects on soil microorganisms and their
biochemical processes related to soil fertility. World Journal of Microbiology and
Biotechnology, v.14, n.6, p.903-909, 1998.
EMBRAPA. Centro Nacional de Pesquisa de Solos. Manual de métodos e análises de solos.
2.ed. Rio de Janeiro, 1997. 212p.
FREITAS, J.R.; BANERJEE, M.R.; GERMIDA, J.J. Phosphate solubilizing rhizobacteria
enhance the growth and yield but not uptake of canola (Brassica napus L.). Biology and
Fertility of Soils, v.24, n.4, p.358-364, 1997.
GRAYSTON, S.J.; VAUGHAN, D.; JONES, D. Rhizosphere carbon flow in trees, in
comparison with annual plants: The importance of root exudation and its impact on microbial
activity and nutrient availability. Applied Soil Ecology, v.5, n.1, p.29-56, 1996.
GYANESHWAR, P.; KUMAR, G.N.; PAREKH, L.J.; POOLE, P.S. Role of soil
microorganisms in improving P nutrition of plants. Plant and Soil, v.245, n.1, p.83-93, 2002.
HARGER, N.; BRITO, O.R.; RALISCH, R.; ORTIZ, F.R.; WATANABE, T.S. Avaliação de
fontes e doses de fósforo no crescimento inicial do milho. Semina - Ciências Agrárias, v.28,
p.39-44, 2007.
IGUAL, J.M.; VALVERDE, A.; CERVANTES, E.; VELAZQUEZ, E. Phosphatesolubilizing bacteria as inoculants for agriculture: Use of updated molecular techniques in
their study. Agronomie, v.21, p.561-568, 2001.
JONES, D.L. Organic acids in the rhizosphere – a critical review. Plant and Soil, v.205,
p.25-44, 1998.
NAHAS, E. Factors determining rock phosphate solubilization by microorganisms isolated
from soil. World Journal of Microbiology and Biotechnology, v.12, n.6, p.567-572, 1996.
NAHAS, E.; FORNASIERI, D.J.; ASSIS, L.C. Resposta à inoculação de fungo solubilizador
de fósforo em milho. Scientia Agricola, v.51, n.3, p.463-469, 1994.
NAHAS, E. Phosphate solubilizing microorganisms: Effect of carbon, nitrogen, and
phosphorus sources. p. 111-115. In: International Meeting on Microbial Phosphate
XXVIII Congresso Nacional de Milho e Sorgo, 2010, Goiânia: Associação Brasileira de Milho e Sorgo. CD-Rom
1467
Solubilization, 1, 2002, Salamanca, Anais… Salamanca: Kluwer Academic Publishers, 2002.
p.16-19.
NAUTIYAL, C.S.; BHADAURIA, S.; KUMAR, P.; LAL, H.; MONDAL, R.; VERMA, D.
Stress induced phosphate solubilization in bacteria isolated from alkaline soils. FEMS
Microbiol Lett, v.182, p.291-296, 2000.
NOVAIS, R.F.; SMYTH, T.J. (Eds.). Fósforo em solo e planta em condições tropicais.
Viçosa, MG: Universidade Federal de Viçosa, 1999. 399 p.
REIS, M.R.; SILVA, A.A.; GUIMARÃES, A.A.; COSTA, M.D.; MASSENSSINI, A.M.;
FERREIRA, E.A. Ação de herbicidas sobre microrganismos solubilizadores de fosfato
inorgânico de solo rizosférico de cana-de-açúcar. Planta Daninha, v.26, n.2, p.333-341,
2008.
REYES, I.; BERNIER, L.; SIMARD, R.R.; ANTOUN, H. Effect of nitrogen source on the
solubilization of different inorganic phosphates by an isolate of Penicillium rugulosum and
two UV-induced mutants. FEMS Microbiology Ecology, v. 28, p. 281- 290, 1999.
SILVA, E.A. Contribuições da micorrização e do Aspergillus niger, como solubilizador
de fosfato, no crescimento de milho, em diferentes solos. Ilha Solteira, 2009, 62 f.
Dissertação (Mestradto em Agronomia) - Universidade Estadual Paulista. Faculdade de
Engenharia de Ilha Solteira, 2009.
SILVA FILHO, G. N.; VIDOR, C. Atividade de microrganismos solubilizadores de fosfatos
na presença de nitrogênio, ferro, cálcio e potássio. Pesquisa Agropecuária Brasileira, v. 36,
p. 1495-1508, 2001.
SILVA FILHO, G.N.; NARLOCH, C.; SCHARF, R. Solubilização de fosfatos naturais por
microrganismos isolados de cultivos de Pinus e Eucalyptus de Santa Catarina. Pesquisa
Agropecuária Brasileira, v. 37, n. 6, p. 847-854, 2002.
SINGH, S.; KAPOOR, K.K. Inoculation with phosphate solubilizing microorganisms and a
vesicular-arbuscular mycorrhizal fungus improves dry matter yield and nutrient uptake by
wheat grown in a sandy soil. Biology and Fertility of Soils, v.28, n.2, p.139-144, 1999.
SYLVESTER-BRADLEY, R.; ASAKAWA, N.; LA TORRACA, S.; MAGALHÃES,
F.M.M.; OLIVEIRA, L.; PEREIRA, R.M. Levantamento quantitativo de microrganismos
solubilizadores de fosfatos na rizosfera de gramíneas e leguminosas forrageiras na Amazônia.
Acta Amazonica, v.12, p.15-22, 1982.
STEINER, F.; LANA, M.C.; FRANDOLOSO, J.F.; FEY, R.; ZOZ, T. Fosfato de Gafsa e
fungos solubilizadores de fosfato e seus efeitos na cultura do trigo. Cultivando o Saber, v.2,
n.1, p.156-164, 2009.
WHITELAW, M.A. Growth promotion of plants inoculated with phosphate-solubilizing
fungi. Advances in Agronomy, v.69, p.99-151, 2000.
XXVIII Congresso Nacional de Milho e Sorgo, 2010, Goiânia: Associação Brasileira de Milho e Sorgo. CD-Rom
1468
VASSILEV, N.; VASSILEVA, M. Biotechnological solubilization of rock phosphate on
media containing agroiindustrial wastes. Applied Microbiology and Biotechnology, v.61,
p.435-440, 2003.
XXVIII Congresso Nacional de Milho e Sorgo, 2010, Goiânia: Associação Brasileira de Milho e Sorgo. CD-Rom
1469