SEI Ensina - MILITAR
Química
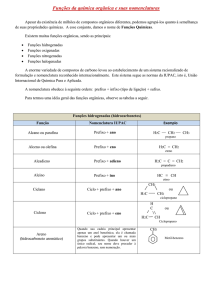
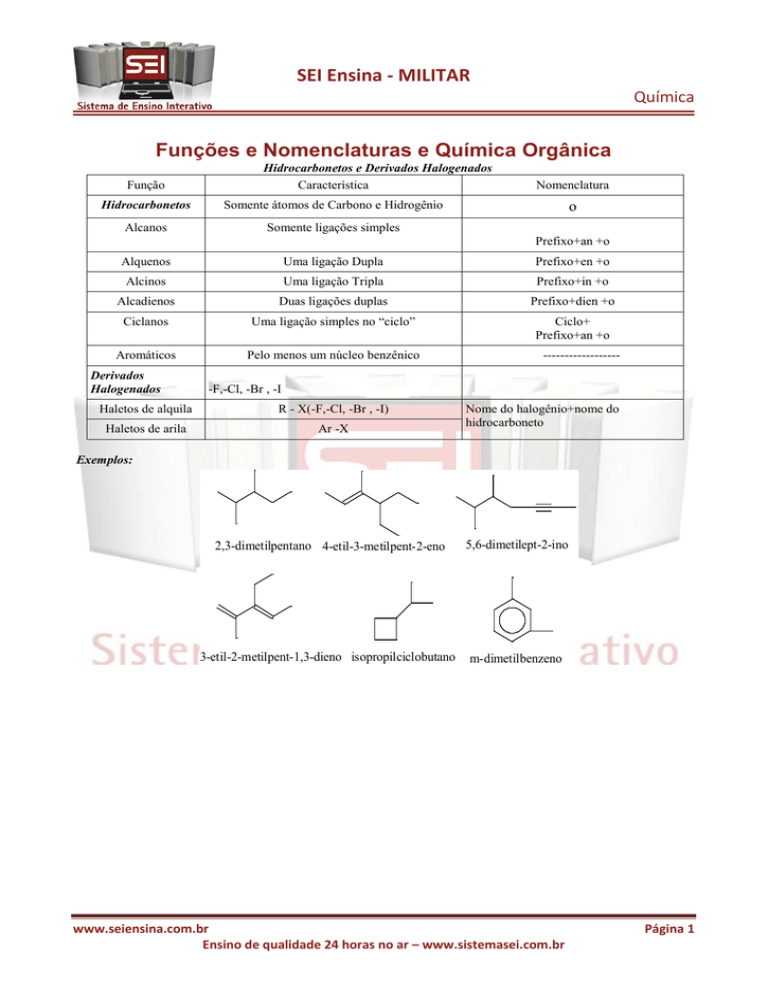
Funções e Nomenclaturas e Química Orgânica
Função
Hidrocarbonetos e Derivados Halogenados
Característica
Hidrocarbonetos
Somente átomos de Carbono e Hidrogênio
Alcanos
Somente ligações simples
Nomenclatura
o
Prefixo+an +o
Alquenos
Uma ligação Dupla
Prefixo+en +o
Alcinos
Uma ligação Tripla
Prefixo+in +o
Alcadienos
Duas ligações duplas
Prefixo+dien +o
Ciclanos
Uma ligação simples no “ciclo”
Ciclo+
Prefixo+an +o
Aromáticos
Pelo menos um núcleo benzênico
Derivados
Halogenados
------------------
-F,-Cl, -Br , -I
Haletos de alquila
R - X(-F,-Cl, -Br , -I)
Haletos de arila
Ar -X
Nome do halogênio+nome do
hidrocarboneto
Exemplos:
2,3-dimetilpentano 4-etil-3-metilpent-2-eno
5,6-dimetilept-2-ino
3-etil-2-metilpent-1,3-dieno isopropilciclobutano
m-dimetilbenzeno
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 1
Funções Oxigenadas
Característica
Função
R
Álcoois
OH
Nomenclatura
Prefixo+an,en,in+ol
(ligado a carbono saturado)
Fenóis
OH
(ligado a carbono aromático)
R
Éteres
O
hidroxi+nome do hidrocarboneto
aromático
R'
Menor radical(oxi)+maior
radical(ano,eno,ino)
Aldeídos
O
R
Prefixo+an,en,in+al
C
H
O
Cetonas
Prefixo+an,en,in+ona
C
O
Ácidos Carboxílicos
R
Prefixo+an,en,in+óico
C
OH
Ésteres
O
R
Prefixo+an,en,in+o+ato de prefixo+ila
C
O
Sais Orgânicos
R'
Prefixo+an,en,in+o+ato de (metal)
O
R
C
O
Haletos de Acila
Metal
-
x+
x
Nome do halogênio(ETO) de
Prefixo+ano+eno+ino+(ILA)
O
R
C
X
Anidridos Orgânicos
R
O
O
C
C
Anidrido Nome(s) do(s) Ácido(s)
Carboxílico(s) de Origem(ÓICO)
R'
O
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 2
Exemplos:
OH
OH
O
H
OH
O
2,3-butanal
etoxietano
3-etil-4-metilpentan-2-ol o-di-hidroxibenzeno
O
OH
O
O
O
4-metilpentan-2-ona
ácido 3-etil-4-metilpentanóico
propanoato de fenila
O
O
O
Cl
-
O
+
O Na
propanoato
de sódio
Função
O
anidrido etanóico
ou acético
cloreto
de benzoíla
Funções Nitrogenadas
Características
R
NH2
primária
R
Aminas
NH
R' R
secundária
Nomenclatura
N
R"
terciária
R'
nome(s) do(s) radical(is) +amina
O
Amidas
Nitrilas
R
R
C
C
NH2
Nome do hidrocarboneto + amida
N
Nome do hidrocarboneto + nitrila
O
Nitrocompostos
R
Nitro+Nome do hidrocarboneto
N
O
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 3
Exemplos:
NH2
O
NH2
metilpropanamida
fenilamina
CH3
N
H3C
C
Etanonitrila
ou Acetonitrila
NO2
p-nitrotolueno
Função
Funções Sulfuradas
Características
Tióis
R
Nome do Hidrocarboneto + TIOL
SH
R
Tioéteres
Nomenclatura
S
Nome do Hidrocarboneto+Tiona
R'
S
Tiocetonas
C
R
Radical Menor (ano)+ tio+Radical
Maior (ona)
R'
O
R
Ácidos Sulfônicos
S
Ácido Nome do Hidrocarboneto
Correspondente + Sulfônico
OH
O
S
SH
SO3H
S
Pentan-1-tiol
Etano-tiopropano
butanotiona
ácido benzenosulfônico
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 4
Funções Mistas
Ordem de Preferência das Principais Funções:
Halogênio <Nitro <Amina(Amino) <Hidroxila(hidroxi)<Éter <Cetona (ceto ou oxo) <Aldeído(oxo) <Ácido
Carboxílico
NO2
O
OH
OH
ácido 5-nitro-2-hidroxieptanóico
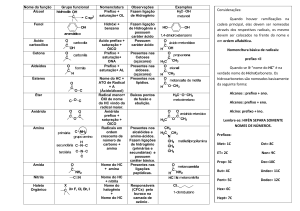
Derivados Halogenados e Compostos Organometálicos
Função
Características
R
Haletos Orgânicos
Compostos de
Grignard(Organomagnesianos)
R
Nomenclatura
Nome do halogênio + nome do
hidrocarboneto
X
MgX
Nome do halogênio(ETO) de
Radical(IL) Magnésio
Br
Cl
MgBr
3-cloro-2-metilpentano
4-bromoex-2-eno
brometo de fenilmagnésio
(H3C)2Hg
(H3CCH2)4Pb
tetraetilchumbo
dimetilmercúrio
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 5
Exercícios
01 – (ITA) – A estrutura molecular da morfina está representada abaixo:
CH3
N
H
H
O
O
O
H
Assinale a opção que apresenta dois grupos funcionais presentes nesta substância.
a) Álcool e éster
b) Amina e éter
c) Álcool e cetona
d) Ácido carboxílico e amina
e) Amida e éster
02 – Quando há picada de formigas em alguma pessoa , é colocada álcool etílico, porque:
a) As formigas não suportam o álcool
b) Não há ácido fómico nas formigas ,pois o que causa a dor é uma mistura de aminoácidos desconhecidos
c) O álcool dissolve o enxofre existente no ácido que a formiga libera
d) O álcool etílico contém sódio metálico que o torna anestésico
e) O ácido fórmico, existente nas formigas,reage com o álcool etílico originando o éster formiato de etila ,que evapora
mais rápido e não é tão agressivo quanto o ácido existente nas formigas.
03 – N a combustão completa do octeno ,a relação entre o número de mols de dióxido de carbono formado e o de
oxigênio consumido é:
a) 1/1
b) 2/3
c) 16/23
d) 16/25
e) 3/2
04 – Cloretos de Alquilas reage com magnésio segundo a reação abaixo:
RCl + Mg
RMgCl
O produto formado reage com CO2 e HCl ,dando um ácido carboxílico conforme a equação global abaixo:
RMgCl
+
CO 2 + HCl
RCO 2H + MgCl2
Partindo do cloreto de etila , executando as reações acima descritas, será obtido o ácido:
a) propanóico
b) etanóico
c) metanóico
d) monocloetanóico
e) dicloroetanóico
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 6
05 – Durante a Guerra do Vietnã , o chamado agente laranja ,que atuava côo desfolhante nas árvores da floresta , foi
destaque , pois essa substância é altamente cancerígena.
O
O
CH2
C
OH
Cl
Cl
Agente Laranja
As funções presentes na molécula deste composto são:
a) éster , ácido carboxílico e hidrocarboneto
b) éter , haleto orgânico e ácido carboxílico
c) tiocomposto , ácido carboxílico e amida
d) amina , ácido carboxílico e álcool
e) ácido carboxílico , éter e nitrocomposto
06 –Um inseticida natural é a piretrina,que é extraída de uma espécie de crisântemo denominado piretro.A obtenção da
piretrina se concentra no Rio Grande do Sul e sua estrutura pode ser representada por:
CH3
O
H3C
O
CH
C
CH3
C
CH3
CH3
H2C
CH
CH
CH
CH2
O
a) Escreva o nome das funções orgânicas presentes na piretrina.
b) Calcule o teor de carbono presente nessa substância.
07 – Três líquidos puros apresentam as propriedades da tabela:
Líquido
Ponto de Ebulição(OC)
A
36,2
B
34,6
C
117,7
a) Estabeleça uma associação de cada líquido, A , B e C , com as substâncias n-butanol, n-pentano e etoxietano.
b) Coloque as substâncias A ,B e C em ordem crescente de suas solubilidades em água.
08 – A oxidação do cumeno (isopropilbenzeno) é método industrial de produção de fenol e acetona.
H
H3C
C
HO
CH3
+
O2
+
H3C
C
CH3
O
Calcule a quantidade de cumeno (em mol) que deve ser oxidado para se obter 100 mL de acetona.
Massa molar da acetona = 58g/mol
Densidade da acetona = 0,80g/mL
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 7
Gabarito:
Questão
Gabarito
06 –
a) Cetona e Ester
b)
01
B
02
E
03
B
04
A
05
B
Fórmula Molecular =C21H28O3
Massa Molar = 21(12)+28(1)+3(16) = 252+28+48 = 328g/mol
%C =
252 x 100 =
76,83%
328
07 –
a) A = n-pentano
b) A<B<C
B = etoxotano
C = n-butanol
08 -
Fórmula Molecular =C3H6O
Massa Molar = 3(12)+6(1)+1(16) = 58g/mol
1 mol de cumeno----------58g de acetona
x mol de acetona----------(0,8g/mL)(100mL)
x = 1,38 mol
80g
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 8
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 9