O Átomo
1. O nome átomo tem origem na Grécia Antiga no sec. V a.c. Os pensadores antigos falavam
da existência de partículas invisíveis e indivisíveis que formariam toda matéria.
a + thomos = sem divisão
2. Em 1803 o britânico John Dalton apresentou o primeiro modelo atômico da história.
a. Átomos são partículas sólidas, com massa, indestrutíveis e indivisíveis que formam tudo
o que se conhece.
b. Cada elemento químico apresenta um
tipo
de
átomo,
com
propriedades
específicas
Dalton também afirmou que a combinação
química ocorre quando átomos de dois ou
mais elementos químicos formam uma
firme união.
Figura 1 – representação dos átomos segundo o modelo de Dalton.1
Os átomos seriam como “bolas de bilhar” microscópicas.
O Átomo
3. Em 1897 o físico britânico Joseph John Thomson afirmou que os átomos da matéria
possuíam partículas negativas que eram menores do que qualquer objeto conhecido
chamadas de elétrons.
a. O modelo de Thomson representa o átomo como uma esfera de carga positiva (em preto
na figura 2) uniformemente distribuída, onde estariam mergulhadas pequeninas esferas de
carga negativa.
Assim o átomo passou a não se mais um
corpúsculo indivisível.
Figura 2 – representação dos átomos segundo o modelo de
Thomson. Os átomos seriam como “pudim de passas”
microscópicos.
2
O Átomo
4. Em 1911 o físico e químico neozelandês Ernest Rutherford apresentou o “modelo
planetário”, descrevendo o átomo como:
a. um núcleo que apresenta carga positiva, no qual se encontra praticamente toda a massa
do átomo.
b. diversas pequenas estruturas que apresentam cargas negativas, os elétrons, que giram
núcleo
(+)
elétrons
(-)
ao redor do núcleo.
Figura 3 – representação dos átomos
segundo o modelo de Rutherford. Os
átomos seriam como “sistemas
planetários” microscópicos.
3
O Átomo
5. Em 1913 o físico dinamarquês Niels Bohr apresentou o modelo do átomo de “Rutherford-
Bohr”, descrevendo o átomo como:
a. um núcleo que apresenta carga positiva, no qual se encontra praticamente toda a massa
do átomo.
b. diversas pequenas estruturas que apresentam cargas negativas, os elétrons, que giram
Núcleo (+)
ao redor do núcleo
em trajetos (órbitas)
específicos, que impedem o
elétrons
(-)
colapso das cargas opostas.
diferença de
energia
Figura 4 – representação dos átomos
segundo o modelo de Rutherford-Bohr.
Nos átomos, os elétrons descrevem
órbitas específicas com níveis de energia
definidos.
4
O Átomo
6. Em 1932 o físico britânico James Chadwick confirmou a existência de uma partícula
neutra no núcleo. Sua descoberta completou a descrição da estrutura básica do átomo em
três partes. De acordo com o modele de Rutherford-Bohr-Chadwick:
a. no núcleo, há estruturas com cargas positivas (prótons) e sem carga (nêutrons). Eles
são os responsáveis por praticamente toda a massa do átomo
b. Partículas com carga
nêutrons (0)
negativa, chamadas de
elétrons giram ao redor do
prótons (+)
núcleo em órbitas específicas
diferença de
energia
elétrons (-)
Figura 5 – representação dos átomos segundo o modelo de Rutherford-Bohr-Chadwick. No
núcleo há prótons e nêutrons e os elétrons descrevem órbitas específicas com níveis de
energia definidos.
5
Elemento químico
. Elementos químicos são compostos fundamentais da matéria.
. Existe um número finito de tipos de átomos e cada um representa um elemento químico.
. Átomo é a menor partícula que representa um elemento químico.
. As substâncias químicas são formadas por átomos de um determinado elemento químico.
Há substâncias que são formadas apenas por um de elemento químico (substâncias simples)
enquanto outras são formadas por mais de um elemento (substâncias compostas).
Barras de latão. Zn + Cu
Pedaço de cobre metálico. Cu
Pedaço de zinco metálico. Zn
6
Como identificar um átomo
(A) Número de massa = n. prótons + n. nêutrons
número de
massa
A=Z+n
número
atômico
número de
nêutrons
(Z) Número atômico = n. prótons
Representação de um elemento
A
Z
X
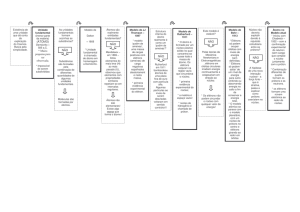
Distribuição eletrônica de Linus Pauling
Camada
Nível
Subnível
s2
p6
elétrons
d10
f14
K
1
1s
2
L
2
2s
2p
M
3
3s
3p
3d
N
4
4s
4p
4d
4f
32
O
5
5s
5p
q5d
5f
32
P
6
6s
6p
6d
Q
7
7s
7p
8
18
18
8
8
O Átomo
. Dentro de um nível de energia na eletrosfera há subníveis.
. O número de cada nível indica o número de subníveis que ele possui.
Ex: o nível 1 apresenta 1 subível; o nível 2 apresta 1 subníveis...
- o subníveis são representados pelas letras s, p, d, f, g, h...
- existe uma ordem crescente de energia nos subníveis
s, p, d, f, g, h...
Energia
- os elétrons de um mesmo subnível tem a mesma energia
- os elétrons de distribuem pela eletrosfera ocupando em ordem crescente os
subníveis, ou seja, começando pelo de menor energia.
número de e-
1s2
nível
subnível
(camada K)
( orbital S)
( nesse no máx 2)
9
Distribuição eletrônica de Linus Pauling
Elemento químico
Número atômico
Distribuição eletrônica
He Hélio
2
1s2
K=2
Cl Cloro
17
1s2 2s2 2p6 3s2 3p5
K = 2, L = 8, M = 7
Zr Zircônio
40
1s2 2s2 2p6 3s2 3p64s2 3d10 4p6 5s2
4d2
K = 2, L = 8, M = 18, n = 10, O =2
Pt Platina
78
1s2 2s2 2p6 3s2 3p64s2 3d10 4p6 5s2
4d105p6 6s1 4f145d9
K = 2, L = 8, M = 18, N = 32, O =
17, P = 1
10
11
12
Organização da tabela periódica
Grupo
18
1
2
13 14 15 16 17
3 4
5 6
7 8
9 10 11 12
5
6
7
Zern Liew/ Shutterstock
Período
1
2
3
4
Elementos representativos:
•Grupo
•Grupo
•Grupo
•Grupo
•Grupo
•Grupo
•Grupo
•Grupo
1 ou dos metais alcalinos
2 ou dos metais alcalino-terrosos
13 ou do boro
14 ou do carbono
15 ou do nitrogênio
16 ou dos calcogênios
17 ou dos halogênios
18 ou dos gases nobres
Elementos não representativos:
•Transição: grupos 3 a 12
•Transição interna: actinídeos e lantanídeos
Paula Radi
Tabela periódica
Metais:
•Grupo 1 (metais alcalinos): Li, Na, K, Rb, Cs e Fr
•Grupo 2 (metais alcalino-terrosos): Be, Mg, Ca, Sr, Ba e Ra
•Grupo 13 (do boro): Al, Ga, In e Tl (B é um não metal)
Gases nobres: He, Ne, Ar, Kr, Xe e Rn
Hidrogênio: H (não é metal)
Ametais ou não metais:
Grupo 14 (do carbono): C, Si e Ge (Sn e Pb são metais)
Grupo 15 (do nitrogênio): N, P, As e Sb (Bi é metal)
Grupo 16 (calcogênios): O, S, Se e Te (Po é metaloide)
Grupo 17 (halogênios): F, Cl, Br, I e At
Semimetais ou metaloides: Bi, Si, Ge, As, Sb, Te e Po
18