EMBRIOLOGIA ODONTOLÓGICA APLICADA
Prfº FREDERICO BARBOSA DE SOUSA
u f p b /
C C S
DEPARTAMENTO DE MORFOLOGIA
DISCIPLINA DE HISTOLOGIA HUMANA
JOÃO PESSOA
SETEMBRO DE 1999
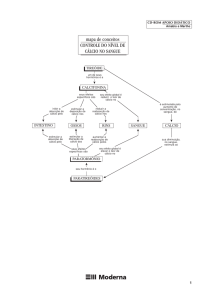
SUMÁRIO
1 INTRODUÇÃO ..........................................................................02
2 ODONTOGÊNESE .....................................................................03
3 CARIOLOGIA ............................................................................07
3.1 PATOLOGIA DA DOENÇA CÁRIE .............................07
3.1.1 ESTÁGIO FINAIS DO EPITÉLIO REDUZIDO
DO ESMALTE .................................................08
4 ENDODONTIA ...........................................................................09
4.1 REABSORÇÃO RADICULAR INTERNA ....................07
5 PERIODONTIA ...........................................................................11
5.1 DOENÇA PERIODONTAL ............................................11
6 ORTODONTIA ............................................................................13
9 REFERÊNCIAS BIBLIOGRÁFICAS ..........................................15
1 INTRODUÇÃO
O ensino das disciplinas básicas Histologia e Embriologia nos cursos
de Odontologia tem sido, classicamente, muito voltado apenas para a transmissão de
conhecimentos relativos aos aspectos morfológicos em si, e sendo pouco enfático na
aplicação destes conhecimentos na atividade profissional, quer seja atividade clínica ou de
âmbito de saúde coletiva. Tal comportamento gera profissionais desinteressados e pouco
embasados nessas áreas, o que, por sua vez, acarreta na formação de novos profissionais de
ensino que não conseguem estabelecer uma relação mais íntima entre as áreas básicas e a
prática clínica. Uma característica marcante do método clássico de ensino das disciplinas
básicas é a de limitar os objetivos educacionais apenas ao nível de conhecimento,
transmitindo e exigindo dos alunos algo que só exige esforço de memória. Como decorar
informações é dependente da freqüência de contato com a qual o indivíduo tem com
determinado assunto e considerando a falta de uma relação estimulante entre as disciplinas
básicas e a prática profissional, é natural que a grande maioria dos profissionais recém
formados tenham pouco interesse nas disciplinas básicas.
Por outro lado, é interessante notar que os recentes grandes avanços
nas diversas especialidades odontológicas estão intimamente relacionados com a Histologia
e a Embriologia Odontológicas. Os novos procedimentos clínicos - almejados pela classe
profissional, principalmente pelos jovens profissionais - estão cada vez mais tendo seu
sucesso clínico dependente do conhecimento do profissional nas áreas básicas. Neste
contexto, decidimos elaborar uma abordagem mais voltada para a prática profissional, e
este documento - que une informações coletadas de livros e de várias outras fontes - tem
como objetivo servir de fonte bibliográfica dos assuntos abordados em aula.
2 ODONTOGÊNESE
Os eventos celulares das fases de desenvolvimento do germe dentário
(botão, capuz, e campânula) são determinados por informações genéticas, e esta é
expressada através das interações das células do germe dentário. As alterações
morfológicas deste último e a formação dos tecidos dentários são guiadas por moléculas
mensageiras.
A disposição dos tipos celulares no germe dentário e, posteriormente,
nos estágios mais avançados da formação do dente, tem razões biológicas. O fato de o
órgão do esmalte ser formado por células epiteliais e ser rodeado por células do
ectomesênquima, que posteriormente irão formar coroa, raiz e periodonto, não é aleatório.
Como se sabe, células da crista neural migram para a área subjacente
ao epitélio da lâmina dentária, onde haverá interação entre estes (Ten Cate, 1982). As
células da crista neural só formam germes dentais após sofrerem uma indução do epitélio
oral. Além disso, as células da crista neural podem ser dividias em sub-populações, cada
contendo um código genético que, quando ativado pelo epitélio oral, desencadeia a
formação de dente específico, isto é, há a sub-população de células ectomesenquimais prédestinada a formar especificamente primeiro molar permanente, outra população prédentinada a formar incisivo decíduo e assim por diante. Assim, quando se tem um grupo de
células da crista neural destinadas a formar um germe dental num momento futuro (quando
entrarem em contato com o epitélio oral), já se tem também, nessas células, a informação
genética indicando que tipo de dente elas irão formar. Ainda não se sabe a época exata em
que as células ectomesenquimais são pré-determinadas a formar um tipo específico de
dente, mas pode ser antes ou durante a migração celular para formar os arcos branquiais ou
no momento em que as células alcançam seu destino final (Tucker, Sharpe, 1999).
Na discussão que segue, se usará os termos ectomesênquima,
expressão genética e fator. O ectomesênquima é representado por células da crista neural
que fazem parte do tecido conjuntivo componente do germe dental. O termo expressão
genética indica que um dado gene está sendo expresso através da produção da molécula
(geralmente uma proteína) para a qual detém o código genético; e o termo fator indica uma
molécula (que é formada em resultado da expressão de um gene) envolvida na indução de
alterações morfo-funcionais na célula que o produz e/ou em outras células. Deve-se atentar
que, em muitos casos, os genes podem estar presentes, porém não estão expressos. As
interações moleculares descritas a seguir são baseadas no artigo de Tucker, Shaper, 1999.
A determinação dos locais de futura atividade odontogênica no
primeiro arco branquial está sendo feita através da investigação da expressão genética de
certos genes do grupo homoeobox (envolvidos na morfogênese tecidual e geral durante a
embriogênese). Os genes homeobox Lhx 6 e Lhx 7 só são expressos nas células
ectomesenquimais da crista neural do 1 arco branquial, o que é resultado de uma indução
de um fator produzido no epitélio oral. O fator atualmente conhecido como indutor do
início do potencial odontogênico (que induz a expressão genética de genes “adormecidos”)
é o Fgf-8, produzido pelo epitélio oral. Se o epitélio oral for posto em contato com células
da crista neural do 2“arco branquial, estas também passarão a desenvolver um germe
dental, o que indica que o sinal para o início da odontogênse está no epitélio oral. A Fig. 1
mostra o resultado da interação de duas populações de células da crista neural com dois
tipos de epitélio e os tipos de tecido formado subseqüentemente.
Uma vez que o ectomesênquima com potencial odontogênico inativo
entre em contato com o epitélio oral e seja ativado pelo Fgf-8, seguirá uma casta de eventos
que irá resultar na formação final de um dente específico. A cascata de ventos inicia com a
liberação, pelo ectomesênquima, do fator proteína morfogenética óssea 4 (Bmp-4), que
induz a proliferação das células epiteliais, inicialmente visível ao microscópico óptico
como um espessamento do epitélio (fig. 2). A proliferação do epitélio prossegue com a
formação do botão epitelial, que, juntamente com o ectomesênquima condensado
subjacente, formam o primeiro estágio do germe dental (estágio de botão - fig. 3). O início
da odontogênese, no homem, se dá por volta da 6ª semana de vida intra-uterina (SVIU). A
tabela 1 mostra a cronologia do início da formação dos germes diversos dentes.
Tabela 1. Cronologia do início da formação dos germes dentais
Período
6ª-8ª SVIU
8ª-9ª SVIU
10ª-11ª SVIU
3º- 4º MVIU
nascimento – 10º mês de vida
9º- 12º mês de vida
* No caso de dentes homólogos, os
antes daqueles do maxilar superior.
dentes
incisivos e caninos decíduos
1º molar decíduo
2º molar decíduo
incisivos, caninos e 1º molar permanentes
1º e 2º premolares
2º molar permanente
germes dos dentes mandibulares iniciam sua formação
No final do estágio de botão, pode-se detectar, no espessamento
epitelial, o nó do esmalte primário, que é um população transitória de células no centro do
epitélio proliferante e em contato ínitmo com o ectomesênquima. Nesse estágio, o nó do
esmalte só é identificado através da expressão genética do gene Shh (não é uma
identificação histológica), mas, no início do estágio de capuz, ele pode identificado, ao
microscópio óptico, como uma densa população de células (fig. 4). O nó do esmalte
primário, após a indução do Bmp-4, passa a ser um centro controlador da proliferação
celular no órgão do esmalte, através da liberação do fator Fgf-4. Este fator irá atuar nas
outras áreas do órgão do esmalte, exceto nele mesmo, induzindo uma aumentada
proliferação celular. Como resultado da maior proliferação celular na periferia e da menor
proliferação no local do nó do esmalte, o órgão do esmalte passa a ter um crescimento
heterogêneo resultando na formação do aspecto de capuz. O local do nó do esmalte
primário indica, nos germes dos dentes anteriores, a posição da borda incisal. No final do
estágio de capuz, o nó do esmalte primário desaparece devido a um aumento da morte
celular por apoptose. Daí por diante, a proliferação celular continua com um ritmo
homogêneo no órgão do esmalte, porém mantendo a forma conferida pela ação do nó do
esmalte.
Nos dentes posteriores (multicuspídeos), nós do esmalte
secundários aparecem no estágio de sino, determinando os locais das pontas das cúspides
(fig. 4). Estes nós também são locais de menor proliferação celular, de onde é liberado o
Fgf-4, que estimula a proliferação celular nas outras áreas do órgão do esmalte.
Na seqüência da cascata de eventos, ainda sob a influência de fatores
do órgão do esmalte (entre eles, o FATOR DE CRESCIMENTO EPITELIAL - EGF), o
ectomesênquima sofrerá, nas suas células mais superficiais, alterações que levarão à
formação de odontoblastos. As funções do EGF estão ligadas àquelas do grupo molecular
ao qual pertence - fatores de crescimento - , que serve para induzir a migração celular
quimiotática, a proliferação celular, inibir a divisão celular e induzir a expressão genética.
O EGF exerce sua função durante a odontogênese pela indução das
células da papila dental a diferenciarem em odontoblastos, após a destruição da lâmina
basal. A presença de EGF em altas concentrações nas células só ocorre no período de
diferenciação celular. Quando as células estão diferenciadas, a lâmina basal não se rompe
e/ou o EGF não migra com a mesma facilidade (Whitcomb et al. 1993). Células totalmente
diferenciadas (ameloblastos, odontoblastos, e osteoblastos) contêm poucas quantidades de
EGF (Whitcomb et al. 1993).
O EGF atua diferentemente em cada tipo celular, no sentido de
induzir características bioquímicas diferentes. Por exemplo, os ameloblastos e os
odontoblastos não possuem, na sua membrana celular, receptores para os mediadores
químicos da reabsorção óssea, por isso, em situações normais, não ocorre reabsorção nem
anquilose na coroa dental durante a erupção (Consolaro, 1993). Os cementoblastos também
não possuem receptores de membrana para os mediadores da reabsorção óssea, e exercem
função de proteção na raiz.
No caso da formação do cemento, as células epiteliais da bainha de
Hertwig têm que se soltar da dentina radicular para que haja a colonização dessa área pelos
pré-cementoblastos, e o papel das células epiteliais, pelo nosso conhecimento, ainda não
está bem definido, o que também é válido para as outras partes do dente.
Em síntese, inicialmente o ectomesênquima odontogênico inativo é
ativado pelo Fgf-8 liberado pelo epitélio oral. O ectomesênquima ativado irá liberar Bmf-4
para o epitélio oral, estimulando a proliferação celular com padrões peculiares. A
formação do nó do esmalte torna o padrão de proliferação celular heterogêneo, dando
origem às bordas incisais (dentes anteriores) e pontas de cúspide (dentes posteriores). O
epitélio do órgão do esmalte passa a liberar Egf para o ectomesênquima, induzindo a
diferenciação dos odontoblastos. Uma vez produzida a primeira camada de dentina, há
uma indução dos ameloblastos, que passam a produzir a matriz do esmalte. As tabelas
2 e 3 mostram a cronologia do início da mineralização dos germes dentais decíduos e
permanentes, respectivamente. O margeamento do esmalte e da dentina pelos ameloblastos
e odontoblastos é importante para a manutenção desses tecidos em proximidade ao tecido
conjuntivo, protegendo-os contra reabsorção, formação de cemento e osso. No caso da raiz,
a bainha epitelial de Hertwig prolifera, recobrindo a superfície dentinária, depois
desprende-se desta, quando ocorre a colonização dos pré-cementoblastos e diferenciação
dos cementoblastos. Estes também exercem função de proteção na superfície radicular
externa por não possuírem receptores de membrana para os mediadores da reabsorção
óssea.
Tabela 2. Cronologia do início da mineralização dos dentes decíduos*
Dentes
IC
SVIU (escala)
IL
15ª-19ª
16ª-21ª
C
19ª-22ª
1ºM
2 ºM
16ª-19ª
20ª-22ª
* Extraído de Sunderland, Smith, Sunderland, 1987.
Tabela 3. Cronologia do início da mineralização dos dentes permanentes inferiores*
IC
Idade
4-6m
IL
C
Dentes
1ºPM
2ºPM
4,6m
6m
2,5 anos
1ºM
2 ºM
3,5 anos nasc. 4 anos
3ºM
8,5 anos
* Extraído de Nicodemo, Moraes, Médici Filho, 1979.
O antigo conceito de que o cemento não reabsorve porque não
contém vasos sangüíneos está abandonado. Hoje sabe-se que o que determina a reabsorção
de um tecido duro é a presença de osteoblastos margeando este tecido, pois estas células
são as únicas - dentre as células produtoras de tecido mineral - que possuem receptores de
membrana para as moléculas que controlam o remodelamento ósseo (Sandy, 1993).
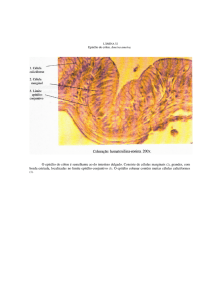
O epitélio reduzido do esmalte também exerce função de proteção
contra a reabsorção do esmalte dental antes da erupção. Como as células epiteliais não
possuem receptores para os mediadores do inflamação, o esmalte dental, que está todo
envolto pelo epitélio reduzido, não é reabsorvido. Caso algum trauma venha a causar
degeneração das células do epitélio reduzido, o esmalte dental estará susceptível a sofrer
reabsorção pelas células clásticas e/ou poderá ficar ligado às trabéculas ósseas. Neste
último caso, a reabsorção do esmalte ocorrerá com a mesma velocidade da remodelação
óssea.
Com relação aos restos epiteliais de Malassez, tem sido sugerido que
eles exercem sua função mantendo o espaço do ligamento periodontal (Melcher, 1970),
porém estudos experimentais mostraram que sua presença não é essencial para a
manutenção do espaço do LPD. Porém, foi mostrado que as células epiteliais liberam
substâncias que inibem a formação de matriz de tecido ósseo (Kollar et al., 1993). Kollar et
al. (1993) mostraram que as células epiteliais do LPD e da mucosa oral continuam a ter
interações com o mesênquima mesmo na vida adulta, e que as interações são graduadas
pelas interações vividas durante a odontogênese. Por exemplo, células dos restos epiteliais
de Malassez são menos inibidoras da proliferação dos fibroblastos do LPD do que células
do epitélio gengival, devido os primeiros manterem contato com o mesênquima durante a
odontogênese (Kollar et al., 1993).
O efeito das células epiteliais inibindo a formação de matriz de
colágeno, precursora dos tecidos mineralizados, pode ser evidenciado pela presença de
áreas cervicais dentais sem a presença de cemento. Lado (1987) relatou uma prevalência de
20% de áreas cervicais sem cemento em contato com esmalte, nos dentes anteriores. É
interessante notar que uma situação semelhante ocorre nas áreas mais cervicais das feridas
periodontais reparadas com cemento, onde tem-se uma área sem cemento abaixo do
epitélio juncional.
Nestas últimas situações, a ação das células epiteliais pode ser
também através da secreção de EGF, que agiria diretamente sobre as células-alvo, ou pela
secreção de outros fatores semelhantes ao EGF, que também se uniriam aos receptores para
o EGF , uma vez que estes últimos podem servir de receptores para outros fatores além do
EGF (Whitcomb et al., 1993).
3 CARIOLOGIA
3.1 PATOLOGIA DA DOENÇA CÁRIE
Sendo o esmalte o tecido primário passível de ataques de
desmineralização, suas características físicas superficiais influenciam o padrão de
desenvolvimento da lesão cariosa. Os estágios finais da formação do esmalte são de grande
importância para entender as características superficiais do esmalte do dente recém
erupcionado, as podem servir de base uma reavaliação de alguns conceitos pertinentes à
cariologia.
3.1.1 ESTÁGIO FINAIS DO EPITÉLIO REDUZIDO DO ESMALTE
Com relação às fases finais da amelogênese, é sabido que, após a fase
secretora, os ameloblastos dão origem ao epitélio dentário reduzido, cuja função é a de
proteger o esmalte da reabsorção e da formação de cemento (Guedes-Pinto, 1993). Nas
faces oclusais, remanescentes do epitélio reduzido do esmalte permanecem por algum
tempo após a irrupção do dente na cavidade bucal, como foi demonstrado por Ekstrand et
al. (1991). Os autores analisaram o conteúdo de fissuras estreitas e profundas da face
oclusal de primeiros molares permanentes humanos, não erupcionados, apresentando mais
de 2/3 de formação radicular, cobertos ou por mucosa, ou por mucosa e osso alveolar. Os
resultados mostram que quanto mais avançada a formação radicular e o estágio de erupção,
os ameloblastos passavam de um formato colunar para um estágio degenerativo,
permanecendo neste estágio mesmo após a irrupção do dente, preenchendo as partes mais
internas da fissura. Assim, estando o interior das fissuras preenchido por material orgânico,
só é possível que o biofilme microbiano se forme na entrada daquelas, que são as áreas que
podem sofrer a ação mecânica das cerdas das escovas dentais.
Os resultados deste estudo vêm reforçar a teoria, muito polemizada,
de que a escova dental pode atuar na remoção de placa nas regiões de fissura.
Classicamente, o selante oclusal tem sido o principal método de prevenção da doença cárie
nas superfícies oclusais, com base na idéia de que as cerdas da escova não atingem o fundo
da fissura (onde as bactérias se alojariam e inevitavelmente causariam lesão cariosa), e
também servindo ao paradigma cirúrgico-restaurador, que valoriza alta tecnologia e
procedimentos cirúrgicos/manuais. Os achados de Ekstrand et al. (1991) são reforçados
pelos estudo de König (1963), que mostrou que a lesão cariosa nas fissuras se inicia pelas
paredes laterais de suas entradas, e de Frank (1973), que relatou, num estudo com
microscopia eletrônica de transmissão sobre a formação de placa oclusal, que a película
adquirida só foi vista nas entradas da fissura.
A presença de restos epiteliais no interior das fissuras das faces
oclusais não dura, entretanto, por muito tempo após a irrupção dental, de forma que outro
evento é necessário para explicar a não formação de acúmulo microbiano no interior das
fissuras estreitas e profundas. Thylstrup et al. (1989) , num estudo com molares
permanentes hígidos com marcante atrição oclusal, mostraram que as porções mais internas
das fissuras estreitas e profundas são preenchidas por depósitos bacterianos calcificados e
bactérias mortas, demonstrando, assim, que o interior das fissuras não é favorável à
permanência de bactérias vivas. Estes achados foram recentemente reforçados por Ekstrand
et al. (1998), que demonstraram que as porções central e interna das fissuras estreitas e
profundas são preenchidas por restos “fantasmas” de células bacterianas e focos de
calcificação (cálculo).
Assim, o interior das fissuras profundas e estreitas da face oclusal
dos dentes posteriores estão preenchidos ou por restos do epitélio reduzido do esmalte, ou
por bactérias mortas e/ou calcificadas e a formação de acúmulos microbianos e o início da
lesão cariosa só ocorrem na entrada das fissuras, onde as cerdas da escova dental têm
acesso.
Ademais, em estudos a longo prazo sobre o efeito de programas de
saúde bucal, foi provada a eficácia de um tratamento não operatório (sem selantes) da
doença cárie, que se mostrou mais eficiente e mais barato que um programa baseado na
aplicação de selantes (Carvalho et al., 1991, 1992).
4 ENDODONTIA
A importância das interações teciduais na endodontia está
particularmente na abordagem das reabsorções radiculares. Para tratar sobre reabsorções
radiculares (RR), é necessário que salientemos sua classificação.
Classificação das RR (Tronstad, 1988; Brezniak, 1993; Consolaro, 1993)
A) Quanto à superfície
A.1 Interna - ocorre nas paredes que limitam a câmara pulpar e os
canais radiculares, expandindo o contorno dessas estruturas, em forma de balão. O canal
dentário acompanha o contorno da área de reabsorção.
A.2 Externa - ocorre nas superfícies externas da raiz, sendo irregular.
O canal radicular fica superposto, com contorno normal. Isso ocorre porque quando a
reabsorção atinge a pré-dentina, ela é inibida. Essa regra não é válida para o ápice, que
possui as paredes internas e externas cobertas por cemento.
B) Quanto à fase
B.1 Ativa ou progressiva: está em avanço no tecido;
B.2 Inativa: o processo está paralisado;
B.3 Reparada: houve reparação, parcial ou total, das áreas
reabsorvidas.
Estas classificações respondem a processos dinâmicos, de forma que
uma lacuna de reabsorção pode passar pelos três estágios, alternadamente ou não.
C) Quanto à região do dente
C.1 Coronária;
C.2 Cervical;
C.3 Radicular.
D) Quanto à etiologia
D.1 Fisiológica: D.1.1 induzida (folículo dental);
D.1.2 espontânea (gene da morte celular)
D.2 Patológica:
D.2.1 Inflamatória: I progressiva (quando há estímulo
contínuo dos osteoclastos);
D.2.2 Substituição (substitui dente por osso);
D.2.3 Superficial (autolimitante).
O conhecimento das interações teciduais através de moléculas
mensageiras é de fundamental importância para entender como os procedimentos
endodônticos podem atuar causando e tratando a RR. Passaremos a abordar sobre a RR
interna, e posteriormente abordaremos a RR externa quando tratarmos sobre clareamento
dental.
4.1 REABSORÇÃO RADICULAR INTERNA
Como já foi salientado anteriormente, a disposição das camadas
externas da polpa dentária segue uma razão biológica. A presença de odontoblastos
intimamente aderidos entre si, margeando toda a superfície dentinária interna, além de
manter a elasticidade da dentina e protegê-la de agentes externos, também exerce
importante papel na proteção do tecido dentinário contra os agentes internos do conjuntivo
pulpar (Brezniak, 1993b; Yaacob, 1980).
Os tecidos mineralizados presentes no sistema estomatognático
(osso, dentina, cemento, e esmalte) passam por diferentes processos metabólicos dinâmicos
normais durante sua existência. O osso passa por um processo contínuo de remodelação
tecidual, de forma que o esqueleto é totalmente renovado a cada 6 meses (Consolaro,
1993). Tal processo não ocorre com o esmalte, a dentina, e o cemento, que possuem,
durante toda a vida do dente, a maior parte de seu mineral primariamente secretado, só
ocorrendo algumas trocas ou incorporações teciduais, decorrentes de processos patológicos
e/ou condutas terapêuticas. O organismo não pode, nem deve, realizar renovação constante
dos tecidos dentais mineralizados assim como o faz para o tecido ósseo, e, para que o
equilíbrio seja mantido, é necessário que haja meios do organismo saber o que deve ou não
ser renovado. Essas regras foram brilhantemente esclarecidas pela biologia molecular nos
anos recentes.
A reabsorção mineral é determinada por um sistema
mensageiro/receptor, do qual, dentre as células formadoras de matrizes que mineralizam, só
o osteoblasto faz parte, por ser a única célula desse grupo a conter receptores celulares para
as moléculas mensageiras da reabsorção mineral (Sandy, 1993, Consolaro, 1993).
A reabsorção óssea, quando não moldada por fatores hormonais, tem
a origem de seus mensageiros moleculares no trauma (Consolaro, 1993). O trauma é
qualquer evento que provoque a formação de proteína livre nos tecidos, o que é percebido
pelo organismo como um sinal de que algo está errado e, então, ativa-se um sistema de
defesa (reação inflamatória), para haver o processo que vai reparar os danos causados pelo
trauma. A proteína livre formada pelo trauma vai estimular a formação de várias
moléculas que participam da inflamação e que, dependendo do grau, da duração, e da
freqüência do trauma, irão ou não se ligar a receptores compatíveis, presentes na membrana
dos osteoblastos e estes, por sua vez, destruirão o osteóide (pela produção de colagenase),
se afastarão da matriz óssea e comandarão a ação dos osteoclastos (Sandy, 1993,
Consolaro, 1993). Posteriormente, iremos abordar com mais detalhes esse processo.
Então, como já foi salientado, os odontoblastos protegem toda a parte
interna da dentina contra a reabsorção, por não terem receptores para os mediadores da
reabsorção óssea e por margearem toda a dentina, impedindo que células
do tecido conjuntivo pulpar entrem em contato com a mesma. Porém, a integridade da
camada odontoblástica pode ser alterada por vários fatores/eventos, tais como: inflamação
pulpar severa, medicamentos, necrose pulpar e trauma oclusal (Wedenberg, Zetterqvist,
1987). Wedenberg, Zetterqvist (1987) relataram a ausência de odontoblastos e a
descontinuidade da pré-dentina nas lacunas de reabsorção interna em dentes decíduos e
permanentes que foram extraídos devido a reabsorção interna progressiva.
É interessante notar que, como previamente mencionado na
classificação das reabsorções dentais, a reabsorção externa normalmente não atinge a
polpa, o que é explicado pela presença da pré-dentina, que inibe a ação dos odontoclastos.
Esta proteção é dada, em qualquer tecido mineralizado, pelas matrizes orgânicas não
calcificadas que os reveste (Brezniak, 1993a, Yacoob, 1980, Consolaro, 1993). A proteção
da integridade das trabéculas ósseas é dada também por uma matriz orgânica, o osteóide
(no cemento, pelo pré-cemento). Para que o osso seja reabsorvido, é necessária a destruição
do osteóide pela colagenase, expondo o tecido mineralizado, tornando possível a ação dos
osteoclastos, que não atuam sobre a matriz orgânica do osteóide (Consolaro, 1993).
O tratamento da RRI visa eliminar fatores locais favoráveis à
reabsorção (ex.: prostaglandinas, pH, citocinas, fatores de crescimento, infecção), e dentre
os seus objetivos, se destina a combater a infecção e aumentar o pH - por ter ação inibidora
da atividade osteoclástica.
5 CEMENTOGÊNESE
A formação de cemento reparador está envolvida em processos importantes
relativos à erupção dental, ao processo de esfoliação dos dentes decíduos, a traumatismo
dentais que causam lesão no cemento, ao movimento ortodôntico - que pode causar lesão
no cemento - e ao processo de formação de novo cemento em áreas onde houve lesão
periodontal (destruição do ligamento periodontal e do cemento, pela placa dental
bacteriana, com exposição da raiz dental). Este cemento reparador é predominantemente
celular, e tem como principal benefício recobrir as superfície dentais inseridas no osso
alveolar, protegendo-as da reabsorção por células clásticas. Neste texto, será destacada a
cementogênese secundária, ou reparativa, em relação ao processo de anquilose dental e ao
reparo de feridas periodontais.
5.1 Mecanismo básico da cementogênese reparativa
Blomlöf et al. (1988) e Lindskog et al (1987) relataram que a
cicatrização periodontal (promovida pela cementogênese reparativa) em áreas de dentina
radicular exposta, em decorrência da remoção do cemento, se inicia pelo povoamento
dessas áreas por células semelhantes a fibroblastos (do ligamento periodontal), vindas da
periferia (provenientes de células mesenquimais indiferenciadas), que passam a secretar
colágeno, formar matriz, se transformam em cementoblastos, que promovem a
mineralização. As células com maior proximidade aos cementoblastos periféricos são as
responsáveis pela formação de novo cemento, e as células mesenquimais no corpo principal
do LPD são de pouca importância (Lindskog et al., 1987). No caso de uma ferida
periodontal (remoção localizada de cemento) com comunicação com a cavidade bucal, o
reparo geralmente envolve a migração apical do epitélio juncional, e o novo cemento só é
formado na parte mais apical da ferida (Blomlöf et al., 1988), havendo uma área sem
cementoblastos entre o novo cemento e a parte mais apical do epitélio juncional, o que se
deve à atividade inibidora do fator de crescimento epitelial - secretado pelas células
epiteliais - sobre a secreção de colágeno pelas células do LPD (Kollar, Yagger, 1993). É
válido salientar que, no caso de uma pequena ferida periodontal sem comunicação
marginal, o reparo geralmente irá ocorrer por formação de novo cemento (Lindskog et al.,
1987; Blomlöf et al., 1988). Um dado muito importante é que este repovoamento da
superfície radicular por cementoblastos, com formação de cemento reparativo, não ocorre
em áreas extensas.
5.2 Reparo periodontal e cementogênese reparativa
A situação decorrente de uma periodontite (doença periodontal) é a
perda de inserção periodontal, seguida por uma migração apical do epitélio juncional. As
condutas terapêuticas aplicadas a tal situação sofreram grandes mudanças nos últimos anos.
Há alguns anos, se pensava que, após realizada a limpeza da raiz exposta e remoção da
placa dental e do tecido inflamado da gengiva, através de acesso cirúrgico, a cicatrização
do periodonto iria resultar na formação de nova inserção periodontal, desde que a área de
gengiva restante fosse suturada ao dente e mantida com controle de placa dental. Porém, foi
verificado que, nestas condições, o que ocorre é a formação de uma epitélio juncional
longo sobre a superfície radicular outrora desnuda, e não uma nova inserção com cemento e
fibras, pois a velocidade de proliferação do epitélio é bem maior que a do conjuntivo
periodontal, e, assim, o epitélio juncional atinge a área apical pré-cirúrgica antes que o
conjuntivo possa se reestruturar (Lindhe, 1992). Como foi anteriormente comentado, o
epitélio libera substâncias que inibem a síntese de colágeno pelos fibroblastos e estimulam
a atividade da colagenase liberada pelas células do LPD (Oshima et al., 1993, Kollar,
Yeaggen, 1993), de modo que não haverá formação de matriz necessária para que o tecido
mineralizado, no caso o cemento, venha a se formar.
Foi verificado que, quando retirava-se o cemento e o LPD de um
dente, e o colocava dentro da esponjosa óssea, de forma que o dente ficasse envolto por
tecido conjuntivo, não havia formação de cemento e LPD, mas sim de fibras que corriam
paralelamente à superfície radicular (Lindhe, 1992). Nesta situação, a raiz dental
apresentava-se sem proteção de células cementoblásticas e epiteliais, e as células do tecido
ósseo passam a reconhecer o dente como parte do osso, o que irá levar a uma reabsorção
por substituição decorrente do processo de remodelamento ósseo dinâmico (Lindskog,
Hammarström, 1980). Porém, quando áreas radiculares com feridas periodontais, em
dentes que foram mantidos em seus alvéolos, cicatrizaram com uma película sintética
(membrana periodontal) entre o epitélio gengival e o dente, o tecido conjuntivo periodontal
proliferou, e houve formação de novo cemento e novas fibras periodontais de inserção
(Lindhe, 1992). Este achado culminou com a introdução de uma nova técnica para o reparo
periodontal, utilizando-se de membranas (barreiras) colocadas entre o epitélio e a área
radicular que sofreu tratamento periodontal, a fim de impedir a migração apical do epitélio,
permitindo que o conjuntivo periodontal prolifere e forme novo cemento e novas fibras na
área da ferida periodontal (Lindhe, 1992). Esta técnica é chamada de REGENERAÇÃO
TECIDUAL GUIADA (RTG), e vários são os materiais usados para a confecção das
membranas.
Entretanto, os resultados histológicos iniciais obtidos com esta
técnica eram resultado de uma espera de várias semanas para que ocorresse a formação de
cemento reparativo, e na verdade não se sabia realmente de que células (do ligamento
periodontal ou do osso alveolar) vinha este cemento reparativo. Em estudos publicados
recentemente por um grupo de pesquisadores suecos (Lindskog et al., 1995), a formação
deste cemento reparativo foi acompanhada em intervalos pequenos, de modo que pudesse
saber de que células provinha o cemento reparativo. Através de análises morfológicas e
histoquímicas, os pesquisadores verificaram que este cemento provinha de células do osso
alveolar, e não de fibroblastos do ligamento periodontal. Desta forma, o novo “cemento”
representa na verdade osso, e assim, irá sofrer o processo normal de remodelação óssea
com o tempo.
Este dado não tinha sido descoberto antes porque o cemento é muito
parecido com o osso compacto, e o fato de não apresentar vasos sangüíneos não permitia
que se pudesse distinguir se era realmente cemento ou se era uma trabécula de osso
compacto.
5.3 Anquilose dental e cementogênese reparativa
O recurso mais utilizado para combater uma anquilose dental tem
sido a aplicação de um trauma mecânica sobre o elemento dental acometido, objetivando
promover uma reabsorção da ponte que liga o osso e o dente, e permitira formação de
cemento reparativo. Este recurso tem obtido êxito em vários casos relatados na literatura,
mas não é de eficácia total.
Sabendo-se que a formação de novo cemento/LPD depende da
proliferação e diferenciação de células associadas aos cementoblastos que margeiam a área
afetada, uma reavaliação dos procedimentos utilizados para tratar a anquilose merece ser
feita. Pode-se reconhecer que, dada uma grande área de anquilose (mais que 20% da
superfície radicular vista na radiografia), a probabilidade de ocorrer a migração de células
semelhantes a fibroblastos (fibroblast-like - FL), a partir da periferia da área anquilosada,
será pouco provável, senão impossível. Assim, nos casos em que o diagnóstico
clínico/radiográfico indicar a presença de anquilose ampla, nenhum procedimento de
trauma mecânico poderá, teoricamente, restabelecer o LPD e a erupção normal do dente.
Este raciocínio também é válido para questionar a formação de nova inserção periodontal
em feridas periodontais amplas, sendo uma das razões da polêmica em torno da RTG.
6 ORTODONTIA
O conceito de movimento ortodôntico que explica o processo pela
reabsorção no lado da pressão e neoformação óssea no lado da tensão, não havendo a
reabsorção do dente porque o cemento não é vascularizado, já não é mais aceito. O
mecanismo do movimento ortodôntico atualmente é explicado por eventos moleculares.
O fato de não ocorrer reabsorção no cemento se deve à ausência de
receptores na membrana dos cementoblastos para os mediadores da reabsorção óssea
(Sandy, 1993). O movimento ortodôntico é iniciado pelo processo da inflamação. A força
ortodôntica é o agente que provoca o trauma, que é caracterizado pela formação de proteína
livre no organismo. Biologicamente, um trauma é caracterizado por proteína livre. No
organismo, fisiologicamente, todas as proteínas estão unidas umas às outras, e quando uma
proteína se torna livre, fica instável, e logo é degradada por alguma enzima. A proteína
livre vai desencadear uma série de eventos, os quais serão brevemente esquematizados a
seguir.
O trauma gera, juntamente com proteína livre, fosfolipídeos
(moléculas presentes em todas as membranas celulares) livres, que sofrem a ação de uma
enzima chamada fosfolipase, que converte os fosfolipídeos em ácido araquidônico. Este irá
passar por duas vias enzimáticas: uma é a da enzima cicloxigenase, resultando na formação
de prostaglandinas e tromboxanas; e a outra é a da enzima lipoxigenase, resultando na
formação de hidroxi-etoxi-tetra-enóico (HETE) e leucotrienes.
Todos os produtos do ácido araquidônico são chamados de
eicosanóides. Dentre estes, as prostaglandinas (PG), principalmente a PGE, exercem
importante papel no movimento ortodôntico. Quando produzida, a PGE causa:
vasodilatação, aumento da permeabilidade celular, regulação do metabolismo de
fibroblastos e osteoblastos, e altera a função imune celular. O efeito da PGE sobre os
fibroblastos e osteoblastos se dá pela alteração de seu metabolismo, e estas células passam
a secretar colagenase e PGE, alterando também sua morfologia.
A PGE produzida por essas células irá atrair os osteoclastos para a
área. A colagenase irá destruir a matriz colágena não mineralizada do osso (pré-osso),
tendo acesso através de canaletas formadas entre os osteoblastos, pela contração destes
(Consolaro, 1993, Ngan et al., 1990). A destruição do periósteo levará à exposição da
hidroxiapatita, que é quimiotática para os osteoclastos. O próximo evento será a
movimentação dos osteoblastos para a periferia do osso, e dos osteoclastos para a área de
hidroxiapatita (HAP) desnuda (Consolaro, 1993).
Ao mesmo tempo, a PGE ativa a dilatação dos vasos, causando a
migração de macrófagos, entre outras células. Os macrófagos liberam umas moléculas
chamadas de interleucinas -tipo de citocina- (Saito et al., 1990a), que são potentes
modificadores biológicos, tendo importante papel na inflamação, incluindo a estimulação
da produção de PGE pelos fibroblastos e osteoblastos (Saito et al., 1990b). Outras funções
das interleucinas (IL) sobre os fibroblastos e osteoblastos incluem estímulo da produção de
colagenase, indução da proliferação celular, e inibição da formação óssea in vitro (Saito et
al., 1990b).
O conjunto formado por osteoblastos, osteoclastos, e macrófagos é
chamado de UNIDADE DE REABSORÇÃO DE TECIDO DURO (Consolaro, 1993).
Nesse conjunto, os osteoblastos e os macrófagos controlam a migração e o metabolismo
dos osteoclastos. Os odontoblastos e os cementoblastos não estão envolvidos porque
não possuem receptores celulares para PGE.
Aceleração e inibição do movimento ortodôntico já foram tentados
com a administração de PGE e indometacina, respectivamente, mas a aceleração foi
conseguida. O uso de indometacina só inibiu parcialmente o movimento ortodôntico, o que
sugere o envolvimento de outros mediadores químicos além da PGE (Saito, 1990, Sandy,
1993). Outros fatores envolvidos na remodelação óssea, além da PGE, foram relatados
serem secretados por osteoblastos e fibroblastos (Meghji, 1988, Dinarello, 1984).
Estes conceitos requerem uma reavaliação clínica minuciosa por
parte do Cirurgião-Dentista no sentido de determinar fatores de risco presentes no paciente.
Por exemplo, pacientes com doença periodontal ativa, com lesão infra-óssea, são
susceptíveis a apresentar RR por uma força ortodôntica, devendo-se fazer uma diagnóstico
periodontal prévio, e as medidas terapêuticas inerentes serem aplicadas (Wennström et al.,
1993). Outro exemplo de fator que deve ser averiguado é se há história de traumatismo
dental. Como se sabe, o trauma pode destruir a camada de cementoblastos, e uma vez
iniciado o processo de remodelamento ósseo pelo trauma do movimento ortodôntico, as
células ósseas podem passar a colonizar a superfície radicular e reconhecer o dente como
parte do osso, que vai sendo reabsorvido (Brezniak, 1993b, Tronstad, 1988).
Outros fatores importantes na avaliação de risco à RR foram
revisados por Brezniak (1993b), os quais listaremos para que se possa ter uma orientação
mais completa.
8 REFERÊNCIAS BIBLIOGRÁFICAS
1 BLOMLÖF, L. et al. Storage of experimentally avulsed teeth in milk prior to
replantation. J. Dent. Res., Houston, v.62, n.8, p.912-916, Aug. 1983.
2
BLOMLÖF, L., LINDSKOG, S., HAMMARSTRÖM, L. Influence of pulpal
treatments on cell and tissue reactions in the marginal periodontium. J.
Periodontol., v.59, n.9, p.577-583, Sep. 1988a.
3
BLOMLÖF, L., LINDSKOG, S., HAMMARSTRÖM, L. A time related study of
healing inthe marginal periodontal/root surface. Swed. Dent. J., Jönköping,
v.12, p.101-112, 1988b.
4
BREZNIAK, N. Root resorption after orthodontic treatmente: part 1. Literature
review. Am. J. Orthod. Dentofac. Orthop., v.103, n.1, p.62-66, Jan. 1993.
5 _________ Root resorption after orthodontic treatment: part 2. Literature review.
Am. J. Orthod. Dentofac. Orthop., v.103, n.2, p.138-146, Feb. 1993.
6 CARVALHO, J.C., EKSTRAND, K.R., THYLSTRUP, A. Results after 1 year of
non-operative occlusal caries treatment of erupting permanent first molars.
Community Dent Oral Epid., v.19, p.23-28, 1991.
7 CARVALHO, J.C., THYLSTRUP, A., EKSTRAND, K.R. Results after 3 years of
non-operative occlusal caries treatment of erupting permanent first molars.
Community Dent. Oral Epid., v.20, p.187-192, 1992.
8 CONSOLARO, A. Curso sobre reabsorção radicular no tratamento
ortodôntico. Araçatuba, Nov. 1993.
9 CRUZ, R., ÖGAARD, B., RÖLLA, G. Acquisition of alkali-soluble fluoride by
enamel through treatment with NAF-containing toothpastes in vitro. Scand. J.
Dent. Res., Copenhagen, v.101, n.1, p.9-15, 1993.
10 CHEN, S.H., INOVE, T., SHIMONO, M. An experimental study of osteogenesis in
explants of rat dental pulp, periodontal ligament, bone marrow and muscle cells
in vitro.
Bull. Tokyo Dent. Coll., Tikyo, v.30, n.3, p.155-164, Aug. 1989.
11 DINARELLO, C. A. Interleukin-1. Rev. infec. Dis., v.6, p.51-95, 1984. APUD:
SAITO, S. et al. Effects of parathyroid hormone and cytokines on prostaglandin
E sunthesis and bone resorption by human periodontal ligament fibroblasts.
Archs. Oral Biol., London, v.35, n.10, p.845-855, 1990.
12 EKSTRAND, K.R., WESTERGAARD, J., THYLSTRUP, A. Organic content in
occlusal groove-fossa-system in unerupted 3rd mandibular molars: a light and
electron microscopic study. Scand. J. Dent. Res., Copenhagen, v.99, p.270280, 1991.
13 FEJERSKOV, O., JOSEPHSEN, K., NYVAD, B. Surfece structure of unerupted
mature human enamel. Caries Res., Basel, v.18, p.302-314, 1984.
14 FEJERSKOV, O. Curso de epidemiologia da cárie dental.
6º Congresso
Nacional da ABOPREV, Gramado, maio, 1993.
15 FRANK, R.M. Microscopie életronique de la carie des sillons chez phommè.
Archs. Oral Biol., London, v.18, p.9-25, 1973.
16 INGRAM, G.S., FEJERSKOV, O. Scanning electron microscope study of artificial
caries lesions formation. Caries Res., Basel, v.20, p.32-39, 1986.
17 KEHOE, J.C. pH reversal following in vitro bleaching of pulpless teeth. J Endo.,
v.13, p.6-9, 1987.
18 KING, G.J., COURTS, F.J. Changes in titer of tooth root antibodies
accompanying traumatic root resorption. In: DAVIDOVITCH, Z. The
biological mecanisms of tooth eruption and root resorption. Birmingham:
EBSCO Medic, 1988. p.365-370. APUD: NG, K.T., KING, G.J., COURTS,
F.J. Humoral immune response to active root resortion with a murine model.
Am J. Orthod. Dentofac. Orthop., v.98, n.5, p.465-462, Nov. 1990.
19 KOLLAR, H.L.T., YAEGER, J.A. Epithelial cell-fibroblast interactions:
modulation of extracellular matrix proteins in cultured oral cells. J. Periodont.
Res., Copenhagen, v.28, p.102-14, Mar. 1993
20 KÖNIG, K.G. Dental morfology inrelation to caries resistence with special
reference to fissure as susceptible areas. J. Dent. Res., Houston, v.42, p.461476, 1963.
21 LADO, E.A. Bleaching of endodontically treated teeth: an update on cervical
resorption. Gen.Dent., v.36, p.500-501, 1988.
22 LINDHE, J. Tratado de Periodontologia Clínica. 2.ed. Rio de Janeiro: Guanabara
Koogan, 1992. 493p.
23 LINDSKOG, S., BLOMLÖF, L., HAMMARSTRÖM, L. Cellular colonization of
denuded root surfaces in vivo: cell morphology in dentin resorption and
cementum repair. J. Clin. Periodontol., Copenhagen, v.14, p.390-395, 1987
24 LINDSKOG, S., HAMMARSTRÖM, L. Evidence in favour of an anti-invasion
factor in cementum or periodontal membrane og human teeth. Scand. J. Dent
Res., Copenhagem, v.88, p.161-163, 1980.
25 LINDSKOG, S., LENGHEDEN, A., BLOMLÖF, L. Successive removal of
periodontal tissues: marginal healing without plaque control. J. Clin.
Periodontol., Copenhagen, v. 20, p.14-19, Jan. 1993.
26 MEGHJI,
et al.
Heterogenicity of bone resorbing factors produced by
unestimulated murine osteoblasts in vitro and in response to stimulation by
patathyroid hormone and molecular cell factors. Archs. Oral Biol., London,
v.33, p.773-778, 1988.
27 MEIKLE, M.C., HEATH, J.K., REYNOLDS, J.J. Advances in understanding cell
interactions in tissue resorption. Relevance to the pathogenesis of periodontal
diseases and a new hypothesis. J. Oral Pathol., v.15, p.239-250, 1986. APUD:
OHSHIMA, M. et al. Gingival epithelial cells secrete a substance which
increase the collagenolytic enzyme activity of periodontal ligament cells. J.
NIhon Univ. Sch. Dent., Tokyo, v.35, p.57-64, 1993.
26 MELCHER, A.H. Repair of wounds in the periodontium of the rat. Influence of
periodontal ligament on osteogenesis. Achs. Oral Biol., London, v.15, p.1183-204,
1970.
27 NG, K.T., KING, G.J., COURTS, F.J. Humoral immune response to active root
resorption with a murine model. Am. J. Orthod.Dentofac. Orthop., v.98, p.456462, Nov. 1990.
28 NGAN, P. et al. The interactive effects of mechanical stress and interleukin-1 on
prostaglandin E and cyclic AMP production in human periodontal ligament
fibroblasts in vitro: comparison with cloned osteoblastic cells of mouse. Archs.
Oral Biol., London, v.35, n.9, p.717-725, 1990.
29 NYVAD, B., FEJERSKOV, O., JOSEPHSEN, K. Organic structures of developmental
origin in human surface enamel. Scand. J. Dent. Res., Copenhagen, v.96, p.288292, 1988.
30 OHSHIMA, M. et al. Gingival epithelial cells secrete a substance which increases the
collagenolytic enzyme activity opf periodontal ligament cells. J. Nihin, Uni. Sch.
Dent., Tokyo, v.35, p.57-64, 1993.
31
PIERCE, A., LINDSKOG, S. The effect of an antibiotic/corticisteroid paste on
inflammatory root resorption in vivo. Oral Surg., v.64, p.216, 1987.
32 PITT FORD, T.R. The effects on the periapical tissues of bacterial contamination of the
filled root canal. Int. Endod. J., v.15, p.16-22, 1982. APUD: SOLOMON, G.S.,
NOTARO, P.J., KELLERT, M. External root resorption - fact or fancy. J. Endod.,
v.15, n.5, p. , May, 1989.
33 POWELL, L.V., BALES, D.J. Tooth bleaching: its effect on oral tissues. JADA,
v.122, p.50-54, Nov. 1991.
34 ROTSTEIN, I. et al. Histological characterization of bleaching-induced external root
resorption in dogs. J. Endod., v.17, n.9, p.436-441, 1991.
35 SAITO, S. ET AL. Effects of cytokine on prostaglandin E and cAMP levels in human
periodontal ligament fibroblasts in vitro. Archs. Oral Biol., London, v.35, n.5,
p.387-395, 1990.
36 SAITO, , S. et al. Effects of parathyroid hormone and cytokines on prostaglandin E
synthesis and bone resorption by human periodontal ligament fibroblasts. Archs.
Oral Biol., London, v.35, n.10, p.845-855, 1990b.
37
SANDY, J.R., FARNDALE, R.W., MEIKLE, M.C.
Recents advances in
undrestanding mechanically induced bone remodeling and their relevance to
orthodontic theory and pratice. Am. J. Orthod. Dentofac. Orthop., v.103, n.3,
p.212-222, Mar. 1993.
38 SLAVIN, H.C., BRINGAS, J.R. Epithelial-mesenchyme interactions during
odontogenesis. IV. Morphological evidence for direct heterotypic cell-cell contacts.
Develop. Biol., v.50, p.428-442, 1976.
39 SOLOMON, C.S., NOTARO, P.J., KELLERT, M. External root resorption - fact or
fancy. J. Endod., v.15, n.5, p. , May, 1990.
40 SOUSA, F.B. Periodontite pré-pubertal versus peridontite juvenil: uma questão de
época de diagnóstico. CCS, João Pessoa, v.11, n.1, nov. 1993
41 TATEVOSSIAN, A. Plaque fluoride. Proc. Finn. Dent. Soc., Helsink, v.87, n.4,
p.501-513, 1991.
42 TEN CATE, J.R. Histilogia Oral. 2.ed. Rio de Janeiro: Guanabara Koogan, 1986.
365p.
43 THYLSTRUP. A,, FEJERSKOV, O. Surface features of early carious enamel at
various stages of activity. In: RÖLLA, SÖNJU, EMBERY Proceedings of a
workshop on tooth surface interactions and preventive dentistry. London: IRL
Press, 1981. p.193-205. APUD: FEJERSKOV, O., JOSEPHSEN, K., NYVAD, B.
Surface ultrastructure of unerupted mature human enamel. Caries Res., Basel, v.18,
p.302-314, 1984.
44 TRONSTAD, L. Root resorption - etiology, terminology and clinical manifestations.
Endod. Dent. Traumatol., v.4, p.241-252, 1988.
45 WANG, S.L. etal. Identification of epidermal growth factor receptor in human buccal
mucosa. Archs. Oral Biol., London, v.35, n.10, p.823-828, 1990.
46
WEDENBERG, C., ZETTERQVIST, L. Internal resorption in human teeth - a
histological scanning electron microscopic, and enzyme histochemical study. J.
Endod., v.13, n.6, p.255-259, Jun. 1987.
47 WENNSTRÖM, J.L. et al. Periodontal tissue response to orthodontic movement of
teeth infrabony pockets. Am. J. Orthod. Dentofac. Orthop., v.103, n.4, p.313-319,
Apr. 1993.
48 WHEELER, T.T., STROUP, S.E. Traumatic root resorption in dentine-immunized
mice. Am. J. Orthd. Dentofac. Orthop., v.103, n.4, p.352-357, Apr. 1993.
49
WHITCOMB, S.S., EVERSOLE, L.R., LINDEMAN, R.A. Immunohistochemical
mapping of epidermal growth-factor receptors in normal human oral soft tissue.
Archs. Oral Biol., London, v.38, n.9, p.823-826, 1993.
50
WIKESJO, U.M., NILVEUS, R. Periodontal repair in dogs: effect of wound
stabilization on healing. J. Period., v.61, p.719-24, 1990.
51 YAACOB, H.B. The resistant dentine shell of teeth suffering from idiopathic external
resorption. Aust. Dent J,, v.25, p.73-75, 1980.