CURSO DE LICENCIATURA EM QUÍMICA
ENCONTRO DE VIVÊNCIA 2015 – LICENCIATURA QUÍMICA
REVISÃO QUÍMICA ORGÂNICA - ARÉA 2
Profa. Lenalda Dias e Profa. Márcia Araújo
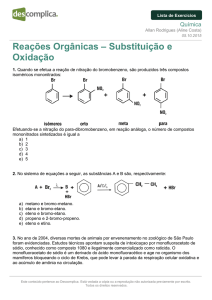
QUESTÃO 01 A produção mundial de alimentos poderia se reduzir a 40% da atual sem a aplicação de controle
sobre as pragas agrícolas. Por outro lado, o uso frequente dos agrotóxicos pode causar contaminação em solos,
águas superficiais e subterrâneas, atmosfera e alimentos. Os biopesticidas, tais como a piretrina e a coronopilina,
têm sido uma alternativa na diminuição dos prejuízos econômicos, sociais e ambientais gerados pelos agrotóxicos
Identifique as funções orgânicas presentes simultaneamente nas estruturas dos dois biopesticidas apresentados:
a) Éter e éster.
b) Cetona e éster.
c) Álcool e cetona.
d) Aldeído e cetona.
e) Éter e ácido carboxílico.
QUESTÃO 02 Os pesticidas modernos são divididos em várias classes, entre as quais se destacam os
organofosforados, materiais que apresentam efeito tóxico agudo para os seres humanos. Esses pesticidas contêm
um átomo central de fósforo ao qual estão ligados outros átomos ou grupo de átomos como oxigênio, enxofre,
grupos metoxi ou etoxi, ou um radical orgânico de cadeia longa. Os organofosforados são divididos em três
subclasses: Tipo A, na qual o enxofre não se incorpora na molécula; Tipo B, na qual o oxigênio, que faz dupla
ligação com fósforo, é substituído pelo enxofre; e Tipo C, no qual dois oxigênios são substituídos por enxofre. Um
exemplo de pesticida organofosforado Tipo B, que apresenta grupo etoxi em sua fórmula
estrutural, está representado em:
CURSO DE LICENCIATURA EM QUÍMICA - ENADE 2014
QUESTÃO 03 No ano de 2004, diversas mortes de animais por envenenamento no zoológico de São Paulo foram
evidenciadas. Estudos técnicos apontam suspeita de intoxicação por monofluoracetato de sódio, conhecido como
composto 1080 e ilegalmente comercializado como raticida. O monofluorcetato de sódio é um derivado do ácido
monofluoracético e age no organismo dos mamíferos bloqueando o ciclo de Krebs, que pode levar à parada da
respiração celular oxidativa e ao acúmulo de amônia na circulação.
O monofluoracetato de sódio pode ser obtido pela
a) Desidratação do ácido monofluoracético com liberação de água.
b) Hidrólise do ácido monofluoracético sem formação de água.
c) perda de íons hidroxila do ácido monofluoracético, com liberação de hidróxido de sódio.
d) Neutralização do ácido monofluoracético usando hidróxido de sódio, com liberação de água.
e) substituição dos íons hidrogênio por sódio na estrutura do ácido monofluoracético, sem formação de água.
QUESTÃO 04 . O poli(álcool vinílico) utilizado como espessante em loções e xampus é preparado através da
polimerização do acetaldeído.
PORQUE
O álcool vinílico ocorre em equilíbrio tautomérico com o acetaldeído, sendo que este último é a espécie
encontrada em maior proporção.
CURSO DE LICENCIATURA EM QUÍMICA - ENADE 2014
Em relação às afirmações acima, conclui-se que
(A) as duas afirmações são verdadeiras e a segunda justifica a primeira.
(B) as duas afirmações são verdadeiras e a segunda não justifica a primeira.
(C) a primeira afirmação é verdadeira e a segunda é falsa.
(D) a primeira afirmação é falsa e a segunda é verdadeira.
(E) as duas afirmações são falsas.
QUESTÃO 05 O benzeno é um hidrocarboneto aromático presente no petróleo, no carvão e em condensados de
gás natural. Seus metabólitos são altamente tóxicos e se depositam na medula óssea e nos tecidos gordurosos. O
limite de exposição pode causar anemia, câncer (leucemia) e distúrbios do comportamento. Em termos de
reatividade química, quando um eletrófilo se liga ao benzeno, ocorre a formação de um intermediário, o
carbocátion. Por fim, ocorre a adição ou substituição eletrofílica.
Com base no texto e no gráfico do progresso da reação apresentada, as estruturas químicas encontradas em I, II e
III são, respectivamente:
CURSO DE LICENCIATURA EM QUÍMICA - ENADE 2014
QUESTÃO 06 . Para se evitar a indução ao erro, o transporte, o armazenamento, o manuseio e o descarte de
produtos químicos devem ser executados sob regras rigorosas de segurança. Com relação ao soro fisiológico e à
vaselina líquida, substâncias visualmente semelhantes, analise as afirmações abaixo.
I. A vaselina líquida e o soro fisiológico glicosado devem ficar em áreas separadas, pois são produtos químicos
incompatíveis, que podem reagir violentamente entre si, resultando em uma explosão ou na produção de gases
altamente tóxicos ou inflamáveis.
II. A vaselina líquida e o soro fisiológico glicosado podem ser guardados no mesmo armário, desde que fiquem em
compartimentos separados de acordo com suas funções químicas e estejam, cada um, em frascos e etiquetas
bem diferenciados.
III. Tanto a vaselina líquida quanto o soro fisiológico não podem ser descartados em esgotos, bueiros ou qualquer
outro corpo d’água, a fim de se prevenir a contaminação dos cursos pluviais.
IV. A leitura atenta de rótulos de reagentes antes de usá-los é um princípio de segurança fundamental que deve
ser adotado pelos profissionais que manipulam esses produtos.
É correto apenas o que se afirma em
A I.
B II.
C I e III.
D II e IV.
E III e IV.
QUESTÃO 07 A Resolução n.º 150, de 28 de maio de 1999, da Agência Nacional de Vigilância Sanitária (ANVISA),
autoriza a utilização do ácido dicloroisocianúrico e seus sais de sódio e potássio como princípio para desinfecção
de água para consumo humano.
A equação a seguir representa a dissociação em água do dicloroisocianurato de sódio.
Considerando as estruturas propostas na equação acima, analise as afirmações seguintes.
I. Os derivados clorados de origem orgânica, por sua estrutura química, são vinculados à presença de ácido
cianúrico, ressaltando-se a formação desse ácido no processo de dissociação do dicloroisocianurato de sódio em
água.
II. O aumento do uso de derivados clorados orgânicos é devido à sua capacidade de reduzir a formação de THMs
(trialometanos, subprodutos do processo de desinfecção), quando comparados com a adição de Cl2 ou de
derivados clorados inorgânicos.
CURSO DE LICENCIATURA EM QUÍMICA - ENADE 2014
III. As estruturas (1) e (2) são possíveis porque o ácido de origem apresenta duas formas tautoméricas. A estrutura
(1) representa a forma ceto, enquanto a estrutura (2) representa a forma enólica.
IV. Compostos clorados de origem orgânica, tais como as cloraminas orgânicas, são produtos de reações do ácido
hipocloroso com aminas, iminas, amidas e imidas.
É correto apenas o que se afirma em
A I.
B II.
C I e III.
D II e IV.
E III e IV.
QUESTÃO 08 Derivados halogenados são bons substratos para a preparação de éteres, em laboratório, através de
reação com reagentes nucleofílicos fortes como o metóxido de sódio. A velocidade dessas reações pode ser
drasticamente aumentada pela escolha apropriada do solvente.
Considere os substratos 3-bromo-3-metil-hexano e brometo de metila. Qual o tipo de mecanismo e o solvente
adequado para a reação desses substratos halogenados com o metóxido de sódio?
QUESTÃO 09 . Recentemente, a imprensa internacional divulgou informação relacionada à contaminação de leite
em pó com melamina, cuja estrutura está representada abaixo.
A adulteração do leite tinha como objetivo simular níveis de proteínas mais altos do que os que realmente
existiam no leite. As proteínas mais abundantes do leite são as caseínas (fosfoproteínas de massa molecular da
ordem de 18 a 25 kDa).
Comparando a estrutura da melamina com a da caseína, conclui-se que ambas
(A) possuem ligações peptídicas.
(B) geram aminoácidos por hidrólise.
(C) formam polímeros de condensação com o formaldeído.
(D) apresentam o mesmo teor de nitrogênio.
(E) podem ser analisadas por cromatografia gasosa.
CURSO DE LICENCIATURA EM QUÍMICA - ENADE 2014
QUESTÃO 10 Polímeros sintéticos são macromoléculas que podem apresentar diferentes tipos de organização,
apresentando propriedades que permitem seu uso em vários objetos do cotidiano. As embalagens utilizadas no
processo de armazenamento e transporte de produtos é um exemplo.
As garrafas do tipo PET são feitas de polímeros sintéticos e possuem inúmeras vantagens, como leveza e
resistência, o que permite a produção de embalagens com alta capacidade volumétrica, fáceis de transportar e
empilhar, além de baixo custo, caracterizando essa embalagem como uma das mais práticas que existe.
Em relação ao Poli(tereftalato de etileno) – PET, analise as afirmações a seguir.
I. Similarmente aos vidros, o PET é um material cristalino, caracterizado por arranjos moleculares ordenados,
formando uma estrutura tridimensional denominada rede cristalina.
II. Macromoléculas são sempre flexíveis a baixas temperaturas, porque a energia cinética dos átomos é menor; no
entanto, são rígidas a altas temperaturas, porque se dilatam, permitindo movimentos além das vibrações.
III. O polímero PET é obtido pela reação entre unidades condensadas de dois monômeros: A (ácido tereftálico –
diácido orgânico) e B (etilenoglicol - diálcool), formando uma macromolécula C, um poliéster.
IV. O PET é classificado como um termoplástico, ou seja, não sofre alteração em sua estrutura química durante o
aquecimento até a sua fusão. Após resfriamento, pode novamente ser fundido e, portanto, ser remoldado.
É correto apenas o que se afirma em
A I.
B II.
C I e III.
D II e IV.
E III e IV.
QUESTÃO 11 O rótulo de um desodorante aerossol informa ao consumidor que o produto possui em sua
composição os gases isobutano, butano e propano, dentre outras substâncias. Além dessa informação, o rótulo
traz, ainda, a inscrição “Não contém CFC”. As reações a seguir, que ocorrem na estratosfera, justificam a não
utilização de CFC (clorofluorcarbono ou Freon) nesse desodorante:
A preocupação com as possíveis ameaças à camada de ozônio (O3) baseia-se na sua principal função: proteger a
matéria viva na Terra dos efeitos prejudiciais dos raios solares ultravioleta. A absorção da radiação ultravioleta
pelo ozônio estratosférico é intensa o suficiente para eliminar boa parte da fração de ultravioleta que é
prejudicial à vida.
A finalidade da utilização dos gases isobutano, butano e propano neste aerossol é
a) substituir o CFC, pois não reagem com o ozônio, servindo como gases propelentes em aerossóis.
b) servir como propelentes, pois, como são muito reativos, capturam o Freon existente livre na atmosfera,
impedindo a destruição do ozônio.
c) reagir com o ar, pois se decompõem espontaneamente em dióxido de carbono (CO2) e água (H2O), que não
atacam o ozônio.
d) impedir a destruição do ozônio pelo CFC, pois os hidrocarbonetos gasosos reagem com a radiação UV,
liberando hidrogênio (H2), que reage com o oxigênio do ar (O2), formando água (H2O).
e) destruir o CFC, pois reagem com a radiação UV, liberando carbono (C), que reage com o oxigênio do ar (O2),
formando dióxido de carbono (CO2), que é inofensivo para a camada de ozônio.
GABARITO:
01
B
02
E
03
D
04
D
05
A
06
D
07
D
08
A
CURSO DE LICENCIATURA EM QUÍMICA - ENADE 2014
09
C
10
E
11
A