Química – Reações Orgânicas
Vestibular - FUVEST
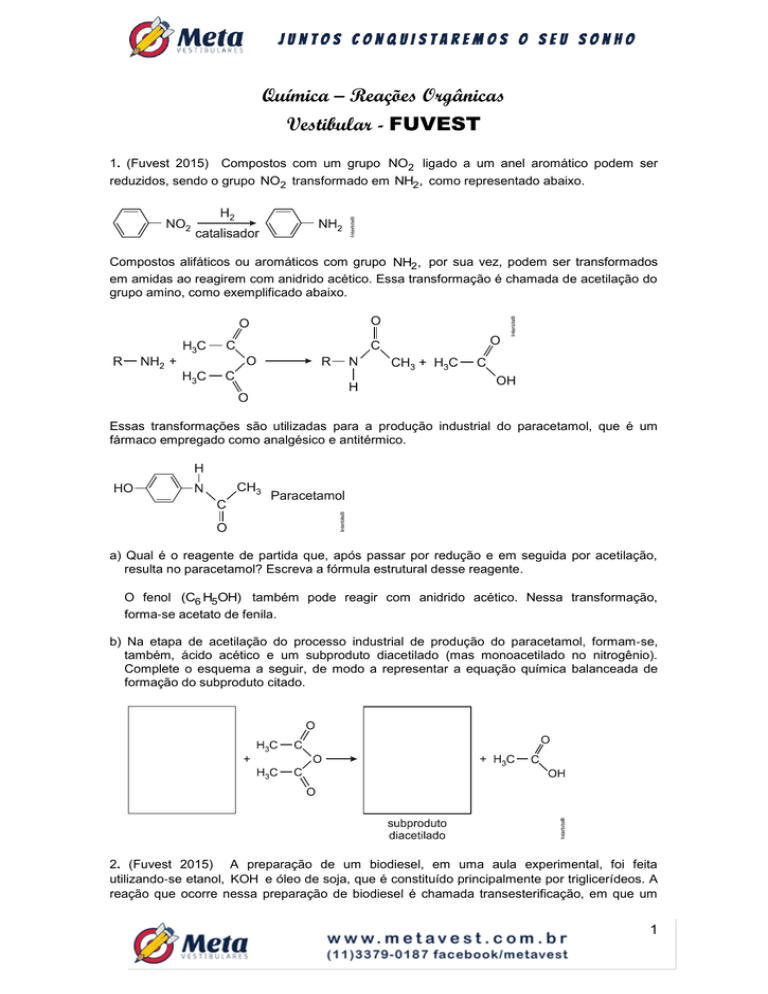
1. (Fuvest 2015) Compostos com um grupo NO2 ligado a um anel aromático podem ser
reduzidos, sendo o grupo NO2 transformado em NH2, como representado abaixo.
Compostos alifáticos ou aromáticos com grupo NH2, por sua vez, podem ser transformados
em amidas ao reagirem com anidrido acético. Essa transformação é chamada de acetilação do
grupo amino, como exemplificado abaixo.
Essas transformações são utilizadas para a produção industrial do paracetamol, que é um
fármaco empregado como analgésico e antitérmico.
a) Qual é o reagente de partida que, após passar por redução e em seguida por acetilação,
resulta no paracetamol? Escreva a fórmula estrutural desse reagente.
O fenol (C6 H5OH) também pode reagir com anidrido acético. Nessa transformação,
forma‐se acetato de fenila.
b) Na etapa de acetilação do processo industrial de produção do paracetamol, formam‐se,
também, ácido acético e um subproduto diacetilado (mas monoacetilado no nitrogênio).
Complete o esquema a seguir, de modo a representar a equação química balanceada de
formação do subproduto citado.
2. (Fuvest 2015) A preparação de um biodiesel, em uma aula experimental, foi feita
utilizando‐se etanol, KOH e óleo de soja, que é constituído principalmente por triglicerídeos. A
reação que ocorre nessa preparação de biodiesel é chamada transesterificação, em que um
1
éster reage com um álcool, obtendo‐se um outro éster. Na reação feita nessa aula, o KOH foi
utilizado como catalisador.
O procedimento foi o seguinte:
1ª etapa: Adicionou‐se 1,5 g de KOH a 35 mL de etanol, agitando‐se continuamente a
mistura.
2ª etapa: Em um erlenmeyer, foram colocados 100 mL de óleo de soja, aquecendo‐se em
banho‐maria, a uma temperatura de 45C. Adicionou‐se a esse óleo de soja a solução de
catalisador, agitando‐se por mais 20 minutos.
3ª etapa: Transferiu‐se a mistura formada para um funil de separação, e esperou‐se a
separação das fases, conforme representado na figura abaixo.
a) Toda a quantidade de KOH, empregada no procedimento descrito, se dissolveu no volume
de etanol empregado na primeira etapa? Explique, mostrando os cálculos.
b) Considere que a fórmula estrutural do triglicerídeo contido no óleo de soja é a mostrada a
seguir.
Escreva a fórmula estrutural do biodiesel formado.
c) Se, na primeira etapa desse procedimento, a solução de KOH em etanol fosse substituída
por um excesso de solução de KOH em água, que produtos se formariam? Responda,
completando o esquema a seguir com as fórmulas estruturais dos dois compostos que se
formariam e balanceando a equação química.
2
Dado: solubilidade do KOH em etanol a 25C 40 g em 100 mL
3. (Fuvest 2015) O glicerol pode ser polimerizado em uma reação de condensação catalisada
por ácido sulfúrico, com eliminação de moléculas de água, conforme se representa a seguir:
a) Considerando a estrutura do monômero, pode‐se prever que o polímero deverá ser formado
por cadeias ramificadas. Desenhe a fórmula estrutural de um segmento do polímero,
mostrando quatro moléculas do monômero ligadas e formando uma cadeia ramificada.
Para investigar a influência da concentração do catalisador sobre o grau de polimerização do
glicerol (isto é, a porcentagem de moléculas de glicerol que reagiram), foram efetuados dois
ensaios:
Ensaio 1:
Ensaio 2 :
25 g de glicerol
0,5% (em mol) de H2SO 4
25 g de glicerol
3% (em mol) de H2SO 4
agitação e aquecimento
durante 4h
polímero 1
agitação e aquecimento
durante 4h
polímero 2
Ao final desses ensaios, os polímeros 1 e 2 foram analisados separadamente. Amostras de
cada um deles foram misturadas com diferentes solventes, observando‐se em que extensão
ocorria a dissolução parcial de cada amostra. A tabela a seguir mostra os resultados dessas
análises:
Amostra
polímero 1
polímero 2
Solubilidade (% em massa)
Hexano
Etanol
(solvente apolar) (solvente polar)
3
13
2
3
b) Qual dos polímeros formados deve apresentar menor grau de polimerização? Explique sua
resposta, fazendo referência à solubilidade das amostras em etanol.
4. (Fuvest 2014) Ésteres podem reagir com álcoois ou com aminas, como exemplificado a
seguir:
3
a) Escreva as fórmulas estruturais dos produtos da reação entre acetato de etila
(CH3CO2CH2CH3) e metilamina (CH3NH2).
Considere o seguinte esquema de reação:
O composto intermediário
se transforma no produto final
, por meio de uma reação
intramolecular que resulta na formação de um novo ciclo na estrutura molecular do produto
b) Escreva, nos espaços indicados, as fórmulas estruturais dos compostos
e
.
.
5. (Fuvest 2013) Os chamados “compostos de Grignard” foram preparados, pela primeira vez,
por Victor Grignard no final do século XIX. Esses compostos podem ser obtidos pela reação de
um haleto de alquila ou haleto de arila com magnésio metálico, utilizando um éter como
solvente, conforme representado pelas seguintes equações químicas:
Os compostos de Grignard são muito úteis, por exemplo, para preparar alcoóis a partir de
cetonas ou aldeídos, conforme representado abaixo:
4
Os compostos de Grignard também reagem com aminas, alcoóis e ácidos carboxílicos,
conforme representado pelas seguintes equações químicas:
RNH2 R 'MgBr R 'H RNHMgBr
ROH R 'MgBr R 'H ROMgBr
RCO2H R 'MgBr R 'H RCOOMgBr
Assim sendo, para preparar um composto de Grignard, é preciso escolher corretamente o
haleto orgânico, que não deve conter grupos funcionais que reajam com o composto de
Grignard que se pretende preparar.
a) Dentre os cinco compostos representados abaixo, apenas dois são adequados para reagir
com magnésio e preparar compostos de Grignard. Indique esses dois compostos,
justificando sua escolha.
b) Escreva a fórmula estrutural do produto orgânico da reação representada abaixo.
6. (Fuvest 2010) Na dupla hélice do DNA, as duas cadeias de nucleotídeos são mantidas
unidas por ligações de hidrogênio entre as bases nitrogenadas de cada cadeia. Duas dessas
bases são a citosina (C) e a guanina (G).
5
a) Mostre a formula estrutural do par C-G, indicando claramente as ligações de hidrogênio que
nele existem.
No nosso organismo, a síntese das proteínas e comandada pelo RNA mensageiro, em cuja
estrutura estão presentes as bases uracila (U), citosina (C), adenina (A) e guanina (G). A
ordem em que aminoácidos se ligam para formar uma proteína e definida por tríades de bases,
presentes no RNA mensageiro, cada uma correspondendo a um determinado aminoácido.
Algumas dessas tríades, com os aminoácidos correspondentes, estão representadas na tabela
da folha de respostas. Assim, por exemplo, a tríade GUU corresponde ao aminoácido valina.
Letra da esquerda Letra do meio Letra da direita
G
U
U
b) Com base na tabela da folha de respostas e na estrutura dos aminoácidos aqui
apresentados, mostre a fórmula estrutural do tripeptídeo, cuja sequência de aminoácidos foi
definida pela ordem das tríades no RNA mensageiro, que era GCA, GGA, GGU. O primeiro
aminoácido desse tripeptídeo mantém livre seu grupo amino.
Letra da
esquerda
G
G
G
G
Letra do meio
U
C
A
Val Ala Asp
Val Ala Asp
Val Ala Glu
val
Ala Glu
G
Gly
Gly
Gly
Gly
Letra da
direita
U
C
A
G
7. (Fuvest 2010) Pesquisadores da Universidade de São Paulo mostraram que as bromélias,
que vivem no alto de árvores e acumulam água entre suas folhas, obtêm nitrogênio da ureia
presente nessa água e que é proveniente da urina dos anfíbios que aí habitam. Nessas
plantas, a ureia sofre uma reação catalisada pela enzima uréase, que origina amônia e gás
carbônico. Em outra reação, catalisada pela enzima sintetase de glutamina, a amônia formada
é utilizada na produção do aminoácido glutamina.
6
Revista Pesquisa FAPESP, 157, março de 2009. Adaptado.
a) Escreva a equação química balanceada que representa a reação, citada no texto, em que
são produzidos amônia e gás carbônico.
b) Em que processos, associados ao crescimento das plantas, as bromélias podem utilizar o
gás carbônico e a glutamina?
8. (Fuvest 2010) A hidroxicetona (I) pode ser oxidada à dicetona (II), pela ação de ácido nítrico
concentrado, com formação do gás N2O4.
Utilizando formulas moleculares,
a) escreva a equação química balanceada que representa a semirreação de oxidação da
hidroxicetona (I).
b) escreva a equação química balanceada que representa a semirreação de redução do íon
nitrato.
c) com base nas semirreações dos itens a) e b), escreva a equação química global balanceada
que representa a transformação de (I) em (II) e do íon nitrato em N2O4.
9. (Fuvest 2010) O endosperma do grão de milho armazena amido, um polímero natural. A
hidrólise enzimática do amido produz glicose.
a) Em que fase do desenvolvimento da planta, o amido do grão de milho é transformado em
glicose?
b) Cite o processo celular em que a glicose é utilizada. O amido de milho é utilizado na
produção industrial do polímero biodegradável PLA, conforme esquematizado:
O PLA é um poliéster, no qual moléculas de ácido láctico se uniram por sucessivas reações de
esterificação.
c) Escreva a equação química balanceada que representa a reação de esterificação entre duas
moléculas de ácido láctico.
7
10. (Fuvest 2011) A espectrometria de massas é uma técnica muito utilizada para a
identificação de compostos. Nesse tipo de análise, um feixe de elétrons de alta energia provoca
a quebra de ligações químicas, gerando fragmentos das moléculas da amostra, os quais são
registrados como linhas verticais em um gráfico, chamado espectro de massas. Nesse gráfico,
em abscissas, são representadas as massas molares dos fragmentos formados e, em
ordenadas, as abundâncias desses fragmentos.
Quando alcoóis secundários são analisados por espectrometria de massas, resultam várias
quebras de ligações, sendo a principal a que ocorre entre o átomo de carbono ligado ao grupo
OH e o átomo de carbono vizinho. Para o 3-octanol, por exemplo, há duas possibilidades para
essa quebra, como mostrado abaixo. Forma-se, em maior abundância, o fragmento no qual o
grupo OH está ligado à cadeia carbônica mais curta.
A reação de hidratação do cis-2-penteno produz dois alcoóis secundários que podem ser
identificados por seus espectros de massas (A e B), os quais estão apresentados no espaço
destinado à resposta desta questão.
a) Escreva a equação química que representa a reação de hidratação do cis-2-penteno,
mostrando os dois alcoóis secundários que se formam.
b) Atribua, a cada espectro de massas, a fórmula estrutural do álcool correspondente. Indique,
em cada caso, a ligação que foi rompida para gerar o fragmento mais abundante.
H
massa molar
g mol-1
1
C
12
O
16
11. (Fuvest 2011) A borracha natural apresenta propriedades que limitam o seu uso. Por
exemplo, ao ser aquecida, torna-se mole e pegajosa. O processo de vulcanização da borracha,
desenvolvido a partir de 1839 e exemplificado na figura abaixo, permitiu a produção de pneus,
mangueiras e outros utensílios incorporados à vida cotidiana. A utilidade industrial da borracha
estimulou sua exploração comercial a partir das seringueiras da Amazônia. A produção
brasileira desse produto dominou o mercado mundial até 1913, quando foi superada pela
produção proveniente do cultivo de seringueiras na Ásia.
a) Por que a adição de enxofre, no processo de vulcanização, altera as características
mecânicas da borracha natural?
b) Supondo que 16 g de enxofre foram adicionados a 1000 g de borracha natural pelo processo
de vulcanização, exemplificado no esquema acima, responda: Que porcentagem de
8
unidades de isopreno foi modificada por ligações cruzadas? (Massas molares: H = 1 g/mol,
C = 12 g/mol e S = 32 g/mol)
c) Cite e explique uma consequência social provocada pela exploração da borracha na
Amazônia até 1913.
12. (Fuvest 2011) Aldeídos aromáticos reagem com anidrido acético, produzindo ácidos com
uma ligação dupla entre os dois átomos de carbono adjacentes ao grupo carboxila, como
exemplificado:
Fenóis também podem reagir com anidrido acético, como exemplificado:
Um novo polímero, PAHF, foi preparado a partir da vanilina, por uma sequência de etapas. Na
primeira delas, ocorrem duas transformações análogas às já apresentadas. Seguem as
representações da vanilina e do PAHF.
a) Escreva a equação química balanceada que representa a reação da vanilina com anidrido
acético. O composto aromático obtido na reação descrita no item a pode ser transformado
no polímero PAHF pela seguinte sequência de reações: hidrogenação, hidrólise e
polimerização.
b) Considerando a ligação entre duas unidades monoméricas no polímero, como se pode
classificar o PAHF? Seria: poliamida, poliálcool, poliácido, poliéster ou polialdeído? Explique.
13. (Fuvest 2011) Os componentes principais dos óleos vegetais são os triglicerídeos, que
possuem a seguinte fórmula genérica:
9
Nessa fórmula, os grupos R, R' e R" representam longas cadeias de carbono, com ou sem
ligações duplas.
A partir dos óleos vegetais, pode-se preparar sabão ou biodiesel, por hidrólise alcalina ou
transesterificação, respectivamente. Para preparar sabão, tratam-se os triglicerídeos com
hidróxido de sódio aquoso e, para preparar biodiesel, com metanol ou etanol.
a) Escreva a equação química que representa a transformação de triglicerídeos em sabão.
b) Escreva uma equação química que representa a transformação de triglicerídeos em
biodiesel.
14. (Fuvest 2012)
Peptídeos são formados por sequências de aminoácidos, como
exemplificado para o peptídeo a seguir:
Para identificar os dois primeiros aminoácidos desse peptídeo e também a sequência de tais
aminoácidos, foram efetuadas duas reações químicas. Na primeira reação, formaram-se uma
hidantoína e um novo peptídeo com um aminoácido a menos. Esse novo peptídeo foi
submetido a uma segunda reação, análoga à anterior, gerando outra hidantoína e outro
peptídeo:
O mesmo tipo de reação foi utilizado para determinar a sequência de aminoácidos em um outro
peptídeo de fórmula desconhecida, que é formado por apenas três aminoácidos. Para tanto,
três reações foram realizadas, formando-se três hidantoínas, na ordem indicada na página de
resposta.
Preencha a tabela da página de resposta, escrevendo
a) as fórmulas dos três aminoácidos que correspondem às três respectivas hidantoínas
formadas;
10
b) a fórmula estrutural do peptídeo desconhecido formado pelos três aminoácidos do item a).
15. (Fuvest 2012) Dois tipos de reação, bastante utilizados na síntese e transformação de
moléculas orgânicas, são:
- Ozonólise: reação química em que cada carbono da ligação dupla de um composto orgânico
forma uma ligação dupla com oxigênio, como exemplificado:
- Condensação aldólica: reação química em que dois compostos carbonílicos se unem e
perdem
água, formando um novo composto carbonílico com uma ligação dupla adjacente ao grupo
carbonila, como exemplificado:
Em 1978, esses dois tipos de reação foram utilizados na síntese do hormônio progesterona, de
acordo com a sequência ao lado, em que A’ e A identificam, respectivamente, partes das
fórmulas estruturais dos produtos I e II, cujas representações, abaixo, não estão completas.
Na página de resposta, complete as fórmulas estruturais
a) do composto I;
b) do composto II, em que A é um anel constituído por 6 átomos de carbono, e em que o anel B
não possui grupo carbonila.
16. (Fuvest 2013) Uma vela foi colocada dentro de um recipiente cilíndrico e com raio igual a
10 cm, sem tampa, ao qual também foi adicionado hidrogenocarbonato de sódio sólido,
NaHCO3. A vela foi acesa e adicionou-se ao recipiente, lentamente, solução aquosa de ácido
acético, C2H4O2, de tal forma que o nível da solução atingiu somente a parte inferior da vela,
ficando distante da chama. Após 3 segundos, observou-se que a chama apagou.
11
a) Apresente a fórmula estrutural do ácido acético.
b) Escreva a equação química balanceada da reação entre o sólido e a solução aquosa de
ácido acético.
c) O experimento foi repetido com outra vela de mesma altura e com as mesmas quantidades
de reagentes utilizadas anteriormente. Mudou-se apenas o recipiente, que foi substituído por
outro, de mesma altura que o anterior, mas com raio igual a 20 cm. Dessa vez, após os
mesmos 3 segundos, observou-se que a chama não apagou. Proponha uma explicação para
esse fato, considerando a densidade das substâncias gasosas presentes.
Dados: Massa molar (g/mol): C=12; N=14; O=16.
12
Gabarito:
Resposta da questão 1:
a) De acordo com as equações fornecidas no texto, tem-se redução e em seguida acetilação:
b) Formação do subproduto:
Resposta da questão 2:
a) Dados:
Solubilidade do KOH em etanol a 25C 40 g em 100 mL .
Adicionou-se 1,5 g de KOH a 35 mL de etanol, agitando-se continuamente a mistura.
100 mL (e tanol)
40 g (KOH)
35 mL (e tanol)
mKOH
mKOH 14 g (valor máximo que pode ser dissolvido)
Foi colocado 1,5 g.
1,5 g 14 g
Conclusão: toda a quantidade de KOH empregada no procedimento descrito, se dissolveu.
b) Tem-se a seguinte reação de transesterificação:
13
c) Utilizando-se excesso de solução de KOH em água, vem:
Resposta da questão 3:
a) A formação do polímero ocorre a partir do glicerol, conforme indicado no texto.
14
Possível polímero de cadeia ramificada:
b) Quanto maior for o grau de polimerização menor o número de hidroxilas restantes, já que
estas são utilizadas na polimerização e menor será a solubilidade deste polímero em etanol.
15
Quanto menor for o grau de polimerização maior o número de hidroxilas restantes, já que
estas são utilizadas na polimerização e maior será a solubilidade deste polímero em etanol
(polar dissolve polar - pontes de hidrogênio entre as hidroxilas).
Analisando a tabela,
Amostra
polímero 1
polímero 2
Solubilidade (% em massa)
Hexano
Etanol
(solvente apolar)
(solvente polar)
3
13 (mais solúvel)
2
3
13 > 3, conclui-se que o polímero 1 é o mais solúvel, ou seja, possui maior quantidade de
hidroxilas não utilizadas no processo de polimerização, consequentemente é o polímero de
menor grau de polimerização.
Resposta da questão 4:
a) Reação entre acetato de etila (CH3CO2CH2CH3) e metilamina (CH3NH2) e seus produtos:
b) Fórmula de A e C:
16
Resposta da questão 5:
a) De acordo com o enunciado, para formar composto de Grignard, o reagente tem que
apresentar o bromo ligado diretamente a carbono saturado e não pode apresentar grupos
funcionais que reajam com o composto formado, ou seja, carboxila, carbinol e amino. Neste
caso os compostos I e IV se encaixam.
b) Teremos:
Observação teórica:
17
Resposta da questão 6:
a) Teremos as seguintes ligações de hidrogênio (pontes de hidrogênio):
b) Teremos:
Letra da
esquerda
G
G
G
Letra do
meio
C
G
G
Letra da
direita
A
A
U
Aminoácido
Alanina
Glicina
Glicina
Resposta da questão 7:
a) A equação química balanceada que representa a reação, citada no texto, em que são
produzidos amônia e gás carbônico é dada por:
18
b) As bromélias podem utilizar o gás carbônico e a glutamina nos seguintes processos:
- Fotossíntese (gás carbônico).
- Síntese de proteínas nos ribossomos (glutamina).
Resposta da questão 8:
a) Podemos verificar que o número de oxidação do carbono varia de zero para +2 na
hidroxicetona. Consequentemente temos uma oxidação.
b) Equação química balanceada que representa a semirreação de redução do íon nitrato:
2NO3 4H 2e N2O 4 2H2O
5
4 (Re dução)
c) Equação química global balanceada da transformação citada:
C14H12O2 C14H10 O2 2H 2e
3
2NO 2e 4H N2 O4 2H2O
(Oxidação)
(Re dução)
Global
C14H12O2 2NO3 2H
C14H10 O2 N2O4 2H2O
Resposta
da
questão
a) O amido é transformado em glicose durante a germinação da semente.
9:
b) A glicose é utilizada no processo de respiração celular.
c) Na reação de esterificação entre duas moléculas de ácido láctico, o grupo álcool de uma
molécula interage com a carboxila de outra:
Resposta da questão 10:
a) A equação química, que representa a reação de hidratação do cis-2-penteno, pode ser
representada por:
19
b) Para o 3- pentanol:
Verificamos que o fragmento de massa molar 59 é mais abundante:
A ligação rompida foi entre o carbono 2 e 3.
Para o 2-pentanol
Verificamos que o fragmento de massa molar 45 é mais abundante:
A ligação rompida foi entre o carbono 2 e 3.
20
Resposta
da
questão
11:
a) A adição do enxofre forma ligações tridimensionais cruzadas. Os átomos de enxofre
funcionam como “pontes” de ligação entre uma cadeia carbônica e sua vizinha. Estas
ligações aumentam a resistência mecânica, a elasticidade, e diminuem a sensibilidade ao
calor e aos agentes naturais.
b) De acordo com a figura fornecida no enunciado, podemos observar a adição de enxofre a
quatro átomos de carbono:
Para 2 monômeros temos 4 átomos de enxofre.
2 68 g 128 g
m 16 g
m = 17 g
Para 16 g de enxofre adicionados a 1000 g de borracha natural, teremos:
1000 g 100 %
17 g p
p = 1,7 %
c) Dentre as diversas consequências do “Ciclo da Borracha” iniciado no século XIX e, como
afirma o próprio enunciado da questão, enfraquecido em 1913, podemos citar um grande fluxo
migratório do sertão nordestino para a região amazônica quando um grande número de
retirantes da seca foi em busca de melhores condições de vida extraindo o ouro branco da
floresta. Porém, boa parte dessas pessoas foi dizimada pelas insalubres condições da floresta,
como pela malária por exemplo. Além das condições naturais os seringueiros foram
submetidos a um regime de trabalho conhecido como “aviamento”, quando ele tinha sua
viagem paga por atravessadores e suas primeiras despesas pelo dono do seringal. Tais
encargos constituíam-se em dívidas impagáveis e acabavam por prender o trabalhador ao
seringal, pois com seu trabalho deveria saldá-las, mas como isso não era possível nunca
poderia parar de trabalhar.
Resposta da questão 12:
a) A equação química balanceada que representa a reação da vanilina com anidrido acético
pode ser representada por:
21
b) O PAHF seria um poliéster:
Reação de hidrogenação do composto formado:
Reação de hidrólise:
Reação de polimerização:
Resposta da questão 13:
a) Escreva a equação química que representa a transformação de triglicerídeos em sabão
pode ser dada por:
22
b) Uma equação química que representa a transformação de triglicerídeos em biodiesel pode
ser dada por:
Resposta da questão 14:
a) As moléculas das hidantoínas produzidas nas reações podem ser utilizadas na
descoberta dos aminoácidos que as compõe. Por exemplo:
A partir da tabela da página de resposta obtemos os aminoácidos.
23
b) A condensação dos três aminoácidos obtidos na tabela anterior, na ordem dada, gerando o
peptídeo desconhecido pode ser representada
Resposta da questão 15:
a) De acordo com a reação de ozonólise descrita no texto, teremos:
b) De acordo com a reação de condensação aldólica descrita no texto, teremos:
24
Resposta da questão 16:
a) Fórmula estrutural do ácido acético:
b) Teremos:
c) Massa molares dos gases envolvidos:
CO2 44 g / mol (produzido)
O2 32 g / mol
(presentes no ar)
N2 28 g / mol
Nas mesmas condições de pressão e temperatura, a densidade de um gás pode ser dada
por:
d
M(molar )
V(molar )
Como o volume molar é o mesmo, quanto maior a massa molar, mais denso será o gás e
vice-versa.
O gás carbônico formado é mais denso do que os outros gases presentes no sistema e se
acumula na parte de baixo do recipiente.
Quando o gás carbônico alcança o pavio da vela impede o contato do gás oxigênio com o
pavio e a combustão cessa.
Com o aumento do raio do recipiente, e supondo o mesmo volume de gás carbônico (em 3
segundos), o gás se acomodará na parte de baixo do recipiente e não atingirá o pavio e a vela
continuará acessa.
25