UNIVERSIDADE FEDERAL DE SANTA CATARINA
CENTRO DE CIÊNCIAS BIOLÓGICAS
DEPARTAMENTO DE BIOQUÍMICA
Campus Universitário, Florianópolis, SC - Brasil, 88040-900
Curso de Farmácia – Disciplina de Bioquímica Básica para Farmácia
BQA 5109 T 0353B Semestre: 2011-1 - Prof. Rodrigo B. Leal - Data: 29/03/2011
Professor: Dr. Rodrigo Bainy Leal
Pós-graduandos: Débora Kurrle Rieger, Mark William Lopes
Grupo de Estudo - ENZIMAS
1. O que é energia de ativação de uma reação? De que maneira as enzimas aumentam a
velocidade da reação?
2. Por que a estrutura (primária, secundária, terciária e quaternária) das enzimas é essencial
para o desempenho de sua atividade catalítica?
3. Conceitue Km e Vmáx. Como os vários tipos de inibição influenciam os valores de Km e
Vmáx?
4. Explique como o pH e a temperatura podem influenciar a atividade enzimática. Exemplifique.
5. Defina uma enzima alostérica e o mecanismo na interação de um inibidor ou ativador.
Exemplifique.
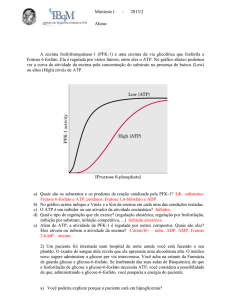
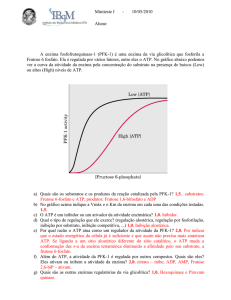
6. O gráfico abaixo mostra a atividade de uma enzima da via glicolítica (Fosfofrutocinase-1)
extraída do músculo. Sua atividade (PFK-1 activity) foi medida frente a concentrações
crescentes do seu substrato, Frutose-6-fosfato (Frutose 6-phosphate). Uma das medidas de
atividade foi realizada na presença de baixas concentrações de ATP (Low ATP), enquanto
outra medida foi realizada na presença de elevadas concentrações de ATP (high ATP).
Compare as duas curvas e explique qual a principal diferença na cinética da enzima. Postule
qual seria o papel do ATP na regulação da via glicolítica no músculo?
7. A enzima hepática da glicólise Piruvato cinase é uma enzima regulatória. Identifique o passo
metabólico catalisado por essa enzima. Adicionalmente, explique o mecanismo pelo qual o
hormônio glucagon induz inibição dessa enzima.
8. A glicemia de um paciente em jejum de 12h era de 4 mM. Após uma refeição rica em
carboidratos sua glicemia aumentou para 20mM. A glicose é substrato para a enzima
glicocinase no fígado e para a hexocinase no músculo. Baseado nas propriedades cinéticas
dessas enzimas explique:
a. Como a concentração sanguínea de glicose pode interferir na atividade da hexocinase
no músculo? Qual o tipo de regulação observada?
b. Como estaria a atividade da glicocinase hepática no jejum e após a refeição rica em
carboidratos?
9. A glicocinase pancreática de um paciente com MODY tem uma mutação substituindo uma
leucina por uma prolina. O resultado foi que o Km para glicose da enzima mutada passou de
para um valor de 2,2 mM (o valor de Km da glicocinase nativa é 6 mM). Além disso, a Vmáx
mudou de 93 unidades/mg de proteína para 0,2 unidades/mg de proteína (para a enzima
mutada). Baseado nesses dados qual sua conclusão em termos da atividade da enzima com a
mutação comparada a enzima nativa. Explique.
10. O metanol é extremamente tóxico ao organismo, pois quando ingerido, é convertido a
formaldeído pela álcool desidrogenase. A intoxicação por metanol pode ser tratada por
ingestão de doses elevadas de etanol. Como se justifica esta terapia?
11. As estatinas (exemplo a sinvastatina) representam uma das classes de medicamentos mais
utilizados no tratamento da hipercolesterolemia (aumento dos níveis sanguíneos de colesterol).
Estes medicamentos são análogos estruturais do HMG-CoA, o substrato da reação catalisada
pela enzima HMG-Coa redutase.
A) Identifique a reação catalisada pela HMG-CoA redutase.
B) Identifique a estrutura das estatinas e do HMG-CoA
C) Determine a ação das estatinas sobre a enzima em questão.
12. Explique o que são isoenzimas sob o ponto de vista estrutural e cinético e qual a
importância das isoenzimas no diagnóstico de doenças.
13. Explique o significado das diferentes isoenzimas da enzima Lactato desidrogenase e da
enzima Creatina cinase.
14. O gráfico abaixo mostra a atividade de uma enzima da via glicolítica (Fosfofrutocinase-1)
que foi extraída do fígado. Sua atividade (PFK-1 activity) foi medida frente a concentrações
crescentes do seu substrato Frutose-6-fosfato (Frutose 6-phosphate). Uma das medidas de
atividade foi realizada na presença de baixas concentrações de um efetor alostérico frutose
2,6-bisfosfato (- F2,6BP), enquanto uma outra medida foi realizada na presença de elevadas
concentrações de frutose 2,6-bisfosfato (+ F2,6BP). Compare as duas curvas e explique qual a
principal diferença na cinética da enzima. Postule qual seria o papel da frutose 2,6 bisfosfato na
regulação da via glicolítica hepática?