PROPRIEDADES FÍSICAS
1- (UNIFOR) Analise as substâncias abaixo.
I. etanol (C2H5OH)
II. éter dimetílico (H3COCH3)
III. 1 - propanol (C3H7OH)
Considerando existência ou não de pontes de hidrogênio ligando moléculas iguais e suas
correspondentes massas moleculares é de se prever que, sob mesma pressão, os pontos de
ebulição dessas substâncias sejam crescentes na seguinte ordem:
A) I, II e III
B) I, III e II
C) II, I e III
D) II, III e I
E) III, II e I
____________________________________________________________________________
2- (UFC) A capsaicina é responsável pelo gosto picante da pimenta vermelha. O ardor
causado por essa molécula pode ser aliviado através da ingestão de líquidos capazes de
solubilizá-la.
O
H 3C
O
HO
N
C
H
Assinale o líquido mais adequado para reduzir a sensação de ardor causado pela pimenta.
A) Aguardente de cana
B) Água mineral
C) Água-de-coco
D) Refrigerante
E) Chá-mate
____________________________________________________________________________
3- Considere a seguinte tabela:
COMPOSTO
TEMPERATURA DE EBULIÇÃO (ºC), a 1 atm
n-pentano
36
n-hexano
69
2,2-dimetil-propano
9,5
2,2-dimetil-butano
50
etanol
78
éter dimetílico
−24
A análise das informações da tabela permite concluir que a temperatura de ebulição de um
composto está relacionada com
I. o número de átomos de carbono e hidrogênio de suas moléculas.
II. o formato de suas moléculas.
III. a existência ou não de pontes de hidrogênio entre moléculas do composto.
É correto afirmar
A) somente I B) somente II C) somente III D) somente I e II
E) I, II e III
____________________________________________________________________________
(UNIFOR) Instruções: Para responder às questões de números 4 e 5 considere as seguintes
informações:
-Propriedades físicas dos compostos, tais como, ponto de ebulição (sob mesma pressão) e
solubilidade em água são bastante dependentes da formação de pontes de hidrogênio, bem
como, da polaridade da molécula.
-As forças entre as moléculas que possuem dipolos não são tão fortes como as de pontes de
hidrogênio, mas levam a maiores pontos de ebulição e solubilidades quando comparadas com
moléculas apolares de, aproximadamente, mesma massa molar.
-Água líquida é formada por aglomerados de moléculas unidas por pontes de hidrogênio.
4- Quando se comparam, sob mesma pressão, butano, propanona e 1–propanol deve-se ter o
ponto de ebulição crescendo na seguinte ordem:
A) butano - 1–propanol - propanona
B) butano - propanona - 1–propanol
C) propanona - butano - 1–propanol
D) propanona - 1–propanol - butano
E) 1–propanol - propanona - butano
1
5- Quando se comparam, à mesma temperatura, butano, propanona e 1–propanol a
solubilidade em água deve aumentar na seguinte ordem:
A) butano - propanona - 1–propanol
B) butano - 1–propanol - propanona
C) 1–propanol - propanona - butano
D) propanona - 1–propanol - butano
E) propanona - butano - 1–propanol
____________________________________________________________________________
(UNIFOR) Instruções: Para responder às questões de números 6 e 7, considere as seguintes
informações:
-Comparando-se moléculas de alcanos não ramificadas (n-alcanos), as forças de atração
aumentam com o aumento da cadeia carbônica.
- Comparando-se alcanos de mesmo número de átomos de carbono por molécula, as forças
intermoleculares tornam-se mais fracas à medida que aumentam as ramificações na cadeia
carbônica.
6- As informações dadas no texto são suficientes para comparar as intensidades de forças de
atração entre moléculas de
A) benzeno e hexeno.
B) butano e heptano.
C) propano e propeno.
D) propano e dimetilpropano.
E) etano e etino.
7- Sendo t1, t2 e t3, respectivamente, as temperaturas de ebulição a 1 atm de
- 2-metilexano
- 2,2,3-trimetilbutano
- n-heptano
pode-se afirmar que
A) t1 = t2 = t3
B) t1 = t2 > ! t3
C) t3 > t1 > t2
D) t3 < t2 < t1
E) t1 < t2 = t3
____________________________________________________________________________
8- Butano e 2–metilpropano, cujos modelos de bolas são mostrados ao lado, são apolares e
têm a mesma fórmula molecular, mas, enquanto o
butano tem ponto de ebulição de –0,5oC, o 2–
metilpropano tem ponto de ebulição de –11,7oC.
Assinale a explicação CORRETA para isso.
A) O 2–metilpropano tem momento de dipolo.
B) O 2–metilpropano apresenta ramificação, o que não é
o caso do butano.
(a) Butano
C) Apenas o 2–metilpropano pode formar ligação de
hidrogênio.
D) O butano é mais pesado que 2–metil-propano.
(b) 2– metilpropano
____________________________________________________________________________
9- (FURG) Têm-se cinco compostos orgânicos para os quais os pontos de ebulição
determinados
experimentalmente foram 36,1ºC, 68,7ºC, 98ºC, -0,5ºC e 125ºC. Sabendo-se que estes
compostos são alcanos, podemos afirmar que os pontos de ebulição correspondem
respectivamente ao:
A) pentano, hexano, heptano, butano e octano.
B) butano, pentano, hexano, heptano e octano.
C) heptano, butano, octano, hexano e pentano.
D) butano, hexano, pentano, heptano e octano.
E) hexano, octano, heptano, butano e pentano.
____________________________________________________________________________
2
10- (UNIFOR) Considere as seguintes estruturas moleculares:
NH2
N
NH
N
NH
NH
O
N
NH2
guanina
citosina
Citosina e guanina são _x_ constituintes do DNA. Citosina de uma fita de DNA e guanina de
outra fita de DNA, unem-se através de ligações _y_ na formação da "dupla-hélice". Dessas
ligações participam os grupos _z_ e _w_ da citosina e da guanina.
Completa-se corretamente o texto, substituindo-se x, y, z e w, respectivamente, por
A) bases - de hidrogênio - carboxila - carbonila
B) ácidos - covalentes - carbonila - carboxila
C) bases - de hidrogênio - amino - carbonila
D) ácidos - iônicas - carbonila - amino
E) bases - de hidrogênio - carboxila - amino
____________________________________________________________________________
11- (ITA) Considere as temperaturas de ebulição (T) das seguintes substâncias na pressão
ambiente:
I. cloridreto, T(I)
II. ácido sulfúrico, T(II)
III. água,T(III)
IV. propanona, T(IV)
V. chumbo, T(V)
Assinale a opção que contém a ORDEM CRESCENTE CORRETA das temperaturas de
ebulição das substâncias citadas anteriormente.
A) T(I) < T(IV) < T(III) < T(II) < T(V)
B) T(IV) < T(III) < T(V) < T(I) < T(II)
C) T(I) < T(II) < T(IV) < T(V) < T(III)
D) T(III) < T(I) < T(II) < T(V) < T(IV)
E) T(II) < T(V) < T(IV) < T(I) < T(III)
____________________________________________________________________________
12- (ITA) Assinale a opção CORRETA em relação à comparação das temperaturas de ebulição
dos seguintes pares de substâncias:
A) Éter dimetílico > etanol
Propanona > ácido etanóico
Naftaleno < benzeno
B) Éter dimetílico < etanol
Propanona < ácido etanóico
Naftaleno > benzeno
C) Éter dimetílico > etanol
Propanona < ácido etanóico
Naftaleno > benzeno
D) Éter dimetílico > etanol
Propanona > ácido etanóico
Naftaleno > benzeno
E) Éter dimetílico < etanol
Propanona < ácido etanóico
Naftaleno < benzeno
____________________________________________________________________________
13- (ITA) Assinale a alternativa ERRADA relativa à comparação do ponto de ebulição de
algumas substâncias orgânicas.
A) a etilamina tem ponto de ebulição maior que o do éter metílico.
B) O n-butanol tem ponto de ebulição maior que o do npentano.
C) O éter metílico tem ponto de ebulição maior que o do etanol.
D) O etanol tem ponto de ebulição maior que o do etanal
E) O butanol tem ponto de ebulição maior que o do éter etílico
____________________________________________________________________________
14- (PUCRS) Considere a vitamina C, de fórmula que, no organismo humano, atua como
antioxidante.
Essa vitamina apresenta
A) fórmula molecular C7H7O5.
B) cadeia carbônica saturada.
C) grupo funcional carboxila.
D) grupos hidrófilos.
E) pouca solubilidade em água.
3
15- (PUCRS) O índice de octano tem o objetivo de avaliar a qualidade da gasolina e
fundamenta-se na comparação da mesma com uma mistura padrão das substâncias cujas
fórmulas estão relacionadas a seguir:
Pela análise dessas fórmulas, é correto afirmar que as substâncias
A) são insaturadas.
B) são solúveis em água.
C) pertencem a diferentes funções químicas.
D) apresentam o mesmo tipo de cadeia carbônica.
E) apresentam o mesmo tipo de ligações intermoleculares.
____________________________________________________________________________
16- (PUCRS)
Pela análise do quadro, conclui-se que a ordem crescente dos pontos de ebulição dos
compostos indicados é:
A) I < II < III < IV < V
B) II < I < V < III < IV
C) II < V < I < III < IV
D) III < IV < I < II < V
E) IV < III < V < I < II
____________________________________________________________________________
4
17- (PUCRS) Quando uma célula produz uma proteína, a cadeia de polipeptídio dobra-se
espontaneamente para assumir certa forma. Um dos dobramentos dessa cadeia polipeptídica
envolve várias forças de interação entre várias cadeias laterais de aminoácidos, conforme
exemplificado no esquema a seguir.
Os tipos de forças de interação que ocorrem em (I) e (II) são, respectivamente,
A) dipolo-dipolo e ligação de hidrogênio.
B) ligação de hidrogênio e dipolo-dipolo.
C) dipolo induzido-dipolo induzido e ligação de hidrogênio.
D) dipolo induzido-dipolo induzido e dipolo-dipolo.
E) dipolo induzido-dipolo e dipolo-dipolo.
____________________________________________________________________________
18- (PUCRS) Comparando-se moléculas de tamanhos aproximadamente iguais de um
hidrocarboneto, um aldeído e um álcool, é correto afirmar que
A) o hidrocarboneto apresenta temperatura de ebulição maior, pois contém forças
intermoleculares mais intensas.
B) o aldeído apresenta forças intermoleculares do tipo dipolo induzido-dipolo induzido.
C) o álcool apresenta maior temperatura de ebulição, pois contém forças intermoleculares
menos intensas.
D) o álcool apresenta o mesmo tipo de forças intermoleculares que o aldeído.
E) as forças intermoleculares são menos intensas entre as moléculas do aldeído do que entre
as moléculas do álcool.
____________________________________________________________________________
19- Durante as mudanças de estado ocorrem somente afastamentos e aproximações entre as
moléculas, ou seja, as forças intermoleculares são rompidas ou formadas, influenciando no
estado físico da substância.
Relacione as substâncias da Coluna A aos respectivos pontos de ebulição, em °C, da Coluna
B, numerando os parênteses.
Coluna A
Coluna B
1. metanol
( ) –88,4
2. etanol
( ) 20,0
3. etanal
( ) 64,0
4. etano
( ) 78,5
5. propan–1–ol
( ) 97,0
A numeração correta dos parênteses, de cima para baixo, é:
A) 4 – 3 – 1 – 2 – 5
B) 5 – 1 – 4 – 3 – 2
C) 3 – 5 – 1 – 2 – 4
D) 4 – 3 – 2 – 1 – 5
E) 5 – 4 – 3 – 2 – 1
____________________________________________________________________________
5
20- (UEL) Um professor de Química usou duas substâncias coloridas, I2 (sólido castanho) e
Ni(NO3)2 (sólido azul), e duas substâncias líquidas incolores, água e CH2Cl2, para realizar um
experimento que demonstrasse a seguinte regra: “semelhante dissolve semelhante”.
Em três tubos de ensaio ele adicionou as substâncias conforme a tabela.
0
3
Dados: Densidades a 20 C (g/cm ) H2O = 1,00; CH2Cl2 = 1,32
Assinale a alternativa correta.
A) No tubo de ensaio 1 observou-se a formação de duas fases. A fase aquosa formando uma
camada inferior e a fase orgânica formando uma camada superior.
B) No tubo de ensaio 2 observou-se a formação de duas fases. Uma fase orgânica homogênea de
coloração castanha na camada superior e uma fase aquosa incolor na camada inferior.
C) O tubo número 2 formou uma única camada de coloração castanha.
D) No tubo de ensaio 3 observou-se a formação de duas fases. Uma fase aquosa homogênea de
coloração azul na camada superior e uma fase orgânica incolor na camada inferior.
E) A água não dissolve substâncias orgânicas.
____________________________________________________________________________
21- (UEM) Ao fazer a limpeza de um armário em um laboratório de química, um aluno deparouse com três frascos sem rótulo, contendo compostos líquidos e incolores. A listagem de
compostos na porta do armário mostrava que o mesmo armazenava propan-1-ol, butan-1-ol e
n-pentano.
Para descobrir qual composto continha em cada frasco, o aluno mediu o ponto de ebulição
(P.E.) e a solubilidade em água de cada composto, possibilitando a elaboração da tabela
abaixo.
Composto
P.E. (°C) a 1 atm
solubilidade em água
(g/100g água) a 25 °C
I
97
infinita
II
36
insolúvel
III
117
7,9
Com base nos dados da tabela e considerando que a massa molar do propan-1-ol é 60 g.
mol−1, do butan- 1-ol é 74 g.mol mol−1 e do n-pentano é 72 g.mol mol−1, o aluno pode chegar à
conclusão de que os líquidos I, II e III eram, respectivamente,
A) butan-1-ol, n-pentano e propan-1-ol.
B) butan-1-ol, propan-1-ol e n-pentano.
C) propan-1-ol, butan-1-ol e n-pentano.
D) propan-1-ol, n-pentano e butan-1-ol.
E) n-pentano, butan-1-ol e propan-1-ol
____________________________________________________________________________
22- (UFC) Estudos recentes têm indicado que o uso inapropriado de lubrificantes ordinários,
normalmente encontrados em farmácias e drogarias, tais como loções oleosas e cremes, que
contêm vaselina, óleo mineral ou outros derivados de petróleo, acarretam danificações nos
preservativos masculinos (camisinhas), os quais são feitos, geralmente, de um material
denominado látex ( poli-1,4-isopreno), cujo momento dipolar é aproximadamente igual a zero (μ
≠ 0), e cuja estrutura da unidade monomérica é dada a seguir:
H3C
H
C
H2C
C
CH2
Tais danificações, geralmente, constituem-se de micro-rupturas das camisinhas, imperceptíveis
a olho nu, que permitem o fluxo de esperma através das mesmas, acarretando gravidez
6
indesejável, ou na transmissão de doenças sexualmente transmissíveis, particularmente a
AIDS.
Assinale a alternativa correta.
A) Substâncias apolares seriam mais adequadas como lubrificantes dos preservativos.
B) Óleos lubrificantes bastante solúveis em tetracloreto de carbono ( CCl4 ), geralmente, não
interagem com o látex.
C) Os óleos que provocam danificações nos preservativos são, geralmente, de natureza
bastante polar.
D) Substâncias, cujas forças intermoleculares se assemelham às presentes no látex, seriam
mais adequadas como lubrificantes dos preservativos.
E) Substâncias com elevados valores de momento de dipolo seriam mais adequadas como
lubrificantes dos preservativos.
____________________________________________________________________________
23- (FCMMG) O tioetanol, C2H5−SH, tem a estrutura semelhante à do etanol, C2H5−OH.
Considerando-se as características dos átomos de enxofre e de oxigênio, é INCORRETO
afirmar que:
A) A combustão completa do tioetanol produz CO2 , SO2 e H2O.
B) O tioetanol é mais solúvel em água do que o etanol.
C) O tioetanol é ácido mais forte do que o etanol.
D) O tioetanol é mais volátil do que o etanol.
____________________________________________________________________________
24- Dadas as substâncias abaixo
OH
SH
I
II
assinale a opção correta:
A) O ponto de ebulição de I é maior do que o de II devido à presença de pontes de hidrogênio
entre as moléculas de I.
B) O ponto de ebulição de II é maior do que o de I porque o enxofre tem maior massa atômica
do que o oxigênio.
C) O ponto de ebulição de II é maior do que o de I porque a força atrativa entre as moléculas
de II é mais intensa.
D) Não podemos comparar os pontos de ebulição de I e II porque o enxofre e o oxigênio
pertencem à mesma família.
E) Nenhuma das alternativas.
____________________________________________________________________________
25- A tensão superficial dos líquidos depende diretamente de processos de interação entre
moléculas, como por exemplo, ligação de hidrogênio. Qual das substâncias abaixo tem maior
tensão superficial?
A) benzeno
B) octano
C) tetracloreto de carbono
D) éter dietílico
E) etanol
____________________________________________________________________________
26- O ponto de ebulição do benzeno é superior ao do metano. Isso se deve, principalmente, ao
fato de o benzeno possuir:
A) estrutura cíclica.
B) duplas ligações conjugadas.
C) moléculas mais pesadas.
D) maior volume molar.
E) forças intermoleculares mais intensas.
____________________________________________________________________________
7
27- Água e metano têm massas moleculares quase iguais e pontos de ebulição bem diferentes.
Qual das propriedades abaixo explica melhor o fato de a água apresentar um ponto de ebulição
bastante superior ao do metano?
A) estabilidade térmica.
B) ação solvente.
C) atomicidade.
D) densidade.
E) polaridade.
___________________________________________________________________________
28- Analise as substâncias abaixo.
I - etanol
II - metóxi-metano
III - propanol-1
Considerando existência ou não de pontes de hidrogênio ligando moléculas iguais e suas
correspondentes massas moleculares é de se prever que, sob mesma pressão, os pontos de
ebulição dessas substâncias sejam crescentes na seguinte ordem:
A) I, II e III
B) I, III e II
C) II, I e III
D) II, III e I
E) III, II e I
____________________________________________________________________________
29- Os compostos contidos em dois frascos sem rótulo, no laboratório, foram analisados e os
resultados mostrados abaixo:
Frasco A
Frasco B
Fórmula molecular: C4H10O
Fórmula molecular: C4H10O
Massa molar: 74 g/mol
Massa molar: 74 g/mol
Ponto de fusão: - 90ºC
Ponto de fusão: - 116ºC
Ponto de ebulição: 118ºC
Ponto de ebulição: 35ºC
Densidade (20ºC): 0,81 g/cm3
Densidade (20ºC): 0,71 g/cm3
Considerando-se apenas as possibilidades apresentadas, pode-se afirmar que os compostos
contidos nos frascos A e B são, respectivamente:
A) butanol-1 e etóxi-etano
B) butano e pentano
C) pentano e butano
D) etóxi-etano e butanol-1
E) butanol-1 e butanol-2
____________________________________________________________________________
30- (UPF) As propriedades físicas dos compostos orgânicos dependem da sua estrutura.
Compostos que formam ligações de hidrogênio entre suas moléculas apresentam ponto de
ebulição elevado. O composto que forma ligações de hidrogênio é:
A) CH3 – CH2 – O – CH3
B) CH3 – CH2 – CH2 – OH
C) CH3 – CH2 – CHO
D) CH3 – CH2 – CH = CH2
E) CH3 – COO – CH3
____________________________________________________________________________
31- (PUCRS) O exame das fórmulas apresentadas a seguir
I
CH4
II
permite afirmar que NÃO é verdadeira a afirmativa da alternativa
A) São substâncias químicas apolares.
B) Apresentam somente ligações covalentes entre seus átomos.
C) Apresentam interações moleculares por forças de Van der Waals.
D) Pertencem à função química hidrocarboneto.
E) São mais densos do que a água.
____________________________________________________________________________
32- A interação entre as bases citosina e guanina como parte formadora da cadeia em dupla
hélice da molécula de DNA é representada abaixo:
8
H
O
N
H
N
Guanina
N
N
H
N
N
N
N
H
O
Citosina
H
Assinale a opção correspondente ao tipo de interação que ocorre entre as moléculas das bases
(linhas pontilhadas).
A) ligação iônica
B) força de Van der Waals
C) ligação covalente polar
D) ligação covalente apolar
E) ligação de hidrogênio
____________________________________________________________________________
33- A tabela a seguir apresenta as propriedades de três substâncias puras.
Substância Ponto de ebulição
Solubilidade em água
(ºC)
(g/100 g de H2O)
36
0,04
A
34
7,5
B
117
7,9
C
Os compostos A, B e C podem ser, respectivamente:
A) 1-butanol, pentano, etóxi-etano
B) pentano, 1-butanol, etóxi-etano
C) etóxi-etano, pentano, 1-butanol
D) pentano, etóxi-etano, 1-butanol
E) 1-butanol, etóxi-etano, pentano
____________________________________________________________________________
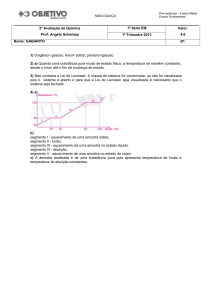
34- (UFMG) Este gráfico representa a variação de temperatura de ebulição, a 1 atm, de séries
homólogas de álcoois e alcanos de cadeia linear, em função da massa molar:
Considerando-se esse gráfico e os compostos nele representados, é INCORRETO afirmar que
A) As curvas I e II correspondem, respectivamente, aos álcoois e aos alcanos.
B) O aumento da cadeia carbônica aumenta a intensidade das interações intermoleculares.
C) A interação por ligação de hidrogênio é a única presente nos álcoois.
D) A interação entre dipolos induzidos é a única presente nos alcanos.
____________________________________________________________________________
35- (UERGS) Um dos mais graves acidentes ecológicos dos últimos tempos ocorreu há alguns
meses na costa atlântica da Europa. Um petroleiro carregado afundou, espalhando milhares de
litros de petróleo na água. Parte desse petróleo atingiu praias da Espanha, de Portugal e da
França.
Sobre o petróleo, considere as afirmações abaixo.
I - Trata-se de uma mistura formada principalmente por hidrocarbonetos.
II - As ligações intermoleculares predominantes nas substâncias constituintes do petróleo são
do tipo dipolo instantâneo-dipolo induzido.
III- A densidade do petróleo é maior que a densidade da água.
IV - O petróleo forma com a água uma solução.
9
Quais estão corretas?
A) Apenas I e II
B) Apenas II e III
C) Apenas III e IV
D) Apenas I, II e III
E) I, II, III e IV
____________________________________________________________________________
36- (UFC) A atividade bactericida de determinados compostos fenólicos deve-se, em parte, à
atuação destes compostos como detergentes, que solubilizam e destroem a membrana celular
fosfolipídica das bactérias. Quanto menor for a solubilidade dos compostos fenólicos em água,
maior será a ação anti-séptica.
Com relação às solubilidades dos compostos fenólicos I, II e III, em água, assinale a opção
correta.
OH
OH
OH
CH3
CH
CH3
CH3
.
CH3
A) I é mais solúvel que II e II mais solúvel que III.
B) I é menos solúvel que II e II menos solúvel que III.
C) II é menos solúvel que I e I menos solúvel que III.
D) II é mais solúvel que I e I mais solúvel que III.
E) I, II e III têm, individualmente, a mesma solubilidade.
____________________________________________________________________________
37- (UFC) Em geral, os corantes e pigmentos naturais, responsáveis pelas belas colorações
observadas nos animais e nas plantas, são obtidos por extração em solução. Assim, uma
extração eficiente requer que o corante apresente elevada solubilidade no solvente utilizado.
Analise a estrutura do corante amarelo luteolina, representada abaixo, e assinale a alternativa
que relaciona o solvente mais adequado para a obtenção da luteolina por extração, a partir de
plantas.
OH
OH
O
HO
OH
O
A) n-hexano (C6H14)
B) tetracloro-etileno (C2Cl4)
C) tetracloreto de carbono (CCl4)
D) benzeno (C6H6)
E) álcool etílico (C2H6O)
____________________________________________________________________________
1-C
2-A
3-E
4-B
5-A
6-B
7-C
8-B
9-A
10-C 11-A 12-B
13-C 14-D 15-E 16-B 17-C 18-E 19-A 20-D 21-D 22-E 23-B 24-A
25-E 26-C 27-E 28-C 29-A 30-B 31-E 32-E 33-D 34-C 35-A 36-A
37-E
____________________________________________________________________________
10