Material Extra 2012
QUÍMICA A
a) Poucas partículas atravessam a placa de ouro,
demonstrando que o átomo é maciço.
b) No centro do átomo existe um núcleo muito pequeno
e denso onde está concentrada sua massa.
c) O núcleo do átomo tem carga negativa.
d) A massa do átomo está concentrada na eletrosfera,
onde estão localizados os elétrons.
e) Estava definitivamente desvendado o interior de um
átomo e, até hoje, seu modelo para átomo não foi
questionado.
LISTA
QUESTÕES 04 E 05
Nivel 1
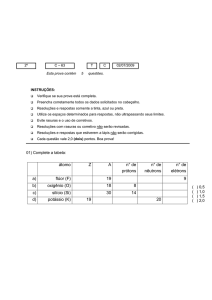
01. Faça a distribuição eletrônica e em camadas dos átomos
a seguir:
06. (ACAFE) Em relação às partículas atômicas, a
alternativa falsa é:
a) 6C.
b) 17Cl.
c) 31Ga.
d) 47Ag.
e) 59Pr.
f) 26Fe+3.
g) 16S-2.
02. Indique o número de prótons, elétrons e nêutrons dos
átomos a seguir:
a) 20Ca40.
b) 8O17.
c) 21Sc45.
d) 30Zn65.
e) S-2 A= 34 Z=16.
f) Fr+1 A= 223 Z = 87.
a) A massa do próton é igual a massa do elétron.
b) A massa do elétron é menor que a massa do próton.
c) As cargas do próton e do elétron são iguais, porém
os sinais são contrários.
d) A massa do neutron e do próton são aproximadamente
iguais.
e) Os prótons e os neutrons estão localizados no núcleo
do átomo.
07. (ITA - 2010) Historicamente, a teoria atômica recebeu
várias contribuições de cientistas. Assinale a opção que
apresenta, na ordem cronológica correta, os nomes de
cientistas que são apontados como autores de modelos
atômicos.
a)
b)
c)
d)
e)
03. Considere as afirmativas:
I. O átomo é maciço e indivisível.
II. O átomo é um grande vazio com um núcleo muito
pequeno, denso e positivo no centro.
I e II pertencem aos modelos atômicos propostos,
respectivamente,por:
a)
b)
c)
d)
e)
Dalton e Thomson.
Bohr e Thomson.
Rutherford e Bohr.
Thomson e Rutherford.
Dalton e Rutherford.
04. Determine o conjunto de números quânticos do elétron
mais energético dos átomos abaixo:
a) 20Ca.
b) 25Mn.
c) 57La.
d) 9F.
e) 80Hg.
Nível 2
05. (ACAFE) Ernest Rutherford, em 1911, realizou
experiências, bombardeando uma finíssima lâmina
de ouro com partículas de carga positiva, emitidas
pelo polônio radioativo. A alternativa verdadeira,
considerando as conclusões de Rutherford, é:
Dalton, Thomson, Rutherford e Bohr.
Thomson, Millikan, Dalton e Rutherford.
Avogadro, Thomson, Bohr e Rutherford.
Lavoisier, Proust, Gay-Lussac e Thomson.
Rutherford, Dalton, Bohr e Avogadro.
08. (UFSC) A palavra átomo é originária do grego e significa
indivisível, ou seja, segundo os filósofos gregos, o átomo
seria a menor partícula da matéria que não poderia ser
mais dividida. Atualmente essa idéia não é mais aceita.
A respeito dos átomos, é verdadeiro afirmar que:
01. Não podem ser desintegrados.
02. São formados por, pelo menos, três partículas fundamentais.
04. Possuem partículas positivas denominadas elétrons.
08. Apresentam duas regiões distintas, o núcleo e a
eletrosfera.
16. Apresentam elétrons, cuja carga elétrica é negativa.
32. Contêm partículas sem carga elétrica, os nêutrons.
09. (ITA) Considerando a experiência de Rutherford,
assinale a alternativa falsa:
a) A experiência consistiu em bombardear películas
metálicas delgadas com partículas alfa.
b) Algumas partículas alfa foram desviadas do seu
trajeto devido à repulsão exercida pelo núcleo
positivo do metal.
c) Observando o espalhamento das partículas alfa,
Rutherford concluiu que o átomo tem densidade
uniforme.
d) Essa experiência permitiu descobrir o núcleo atômico
e seu tamanho relativo.
e) Rutherford sabia antecipadamente que as partículas
alfa eram carregadas positivamente.
Líder absoluto em exames de seleção de Ensino Médio e UFPR Ensino Superior
1
Material Extra 2012
10. (Acafe - SC) Os pares de átomos 19K39 e 19K40; 20Ca40 e
Ar40 ; 19K39 e 20Ca40 representam, respectivamente, a
18
ocorrência de:
a)
b)
c)
d)
e)
14. Sendo o subnível 4s1 (com um elétron) o mais energético
de um átomo, podemos afirmar que:
I. O número total de elétrons deste átomo é igual a 19.
II. Este átomo apresenta 4 camadas eletrônicas.
III. Sua configuração eletrônica é: 1s2 2s2 2p6 3s2 3p6
3d10 4s1.
Isotonia, isotopia, isobaria.
Isotopia, isobaria, isotonia.
Isobaria, isotopia, isotonia.
Isotopia, isotonia, isobaria.
Isobaria, isotonia, isotopia.
a)
b)
c)
d)
e)
11. (UFPR) Segundo o modelo atômico de Niels Bohr,
proposto em 1913, é correto afirmar:
a) No átomo, somente é permitido ao elétron estar em
certos estados estacionários, e cada um desses
estados possui uma energia fixa e definida.
b) Quando um elétron passa de um estado estacionário
de baixa energia para um de alta energia, há a
emissão de radiação (energia).
c) O elétron pode assumir qualquer estado estacionário
permitido sem absorver ou emitir radiação.
d) No átomo, a separação energética entre dois estados
estacionários consecutivos é sempre a mesma.
e) No átomo, o elétron pode assumir qualquer valor
de energia.
12. (UEPG - 2010) Quando um átomo está eletricamente
neutro ele possui prótons e elétrons em igual número.
Contudo, quando um átomo neutro perde ou ganha
elétrons, ele se transforma em um íon. Baseado nisso,
assinale o que for correto:
01) Um íon negativo é chamado de ânion e um íon
positivo é chamado de cátion.
02) Quando o átomo neutro de sódio origina seu cátion
monovalente, observa-se a diminuição de uma unidade
em sua massa atômica.
04) O cátion Ca (dado: Ca, Z = 20) é constituído por
20 prótons e 18 elétrons.
08) Dado que para o Cl, Z = 17, a distribuição eletrônica
do ânion Cl – é 1s2 2s2 2p6 3s2 3p6.
2+
13. (UFPR - 2010) Considere as seguintes afirmativas sobre
o modelo atômico de Rutherford:
1. O modelo atômico de Rutherford é também
conhecido como modelo planetário do átomo.
2. No modelo atômico, considera-se que elétrons de
cargas negativas circundam em órbitas ao redor de
um núcleo de carga positiva.
3. Segundo Rutherford, a eletrosfera, local onde se
encontram os elétrons, possui um diâmetro menor
que o núcleo atômico.
4. Na proposição do seu modelo atômico, Rutherford
se baseou num experimento em que uma lamínula
de ouro foi bombardeada por partículas alfa.
Assinale a alternativa correta:
a)
b)
c)
d)
e)
Somente a afirmativa 1 é verdadeira.
Somente as afirmativas 3 e 4 são verdadeiras.
Somente as afirmativas 1, 2 e 3 são verdadeiras.
Somente as afirmativas 1, 2 e 4 são verdadeiras.
As afirmativas 1, 2, 3 e 4 são verdadeiras.
2
Apenas a afirmação I é correta.
Apenas a afirmação II é correta.
Apenas a afirmação III é correta.
As afirmações I e II são corretas.
As afirmações I e III são corretas.
15. (Unimep - SP) Os valores dos números quânticos
principal, secundário, magnético e spin para o elétron
de diferenciação do gálio, de número atômico 31, são,
respectivamente:
a)
b)
c)
d)
e)
3, 0, 1, + ½.
4, 1, - 1, + ½.
3, - 1, 0, + ½.
4, 0, 0, - ½.
4, 2, 0, + ½.
16. Os átomos dos elementos genéricos X, Y e Z
apresentam as seguintes características:
I. X +2 é isoeletrônico de Y.
II. Y possui número atômico igual a 28.
III. Y é isótopo de Z e isóbaro de X.
IV.Z é isótono de X.
V. X tem 30 nêutrons.
Sobre os elementos acima caracterizados, assinale a
alternativa correta:
a) O número de massa de Z é 60.
b) O subnível mais energético de X é 4s2.
c) A distribuição eletrônica do íon Y+2 é: 1s2 2s2 2p6 3s2
3p6 4s2 3d6.
d) O número de nêutrons de Y é igual a 30.
e) O átomo X apresenta igual número de prótons e
nêutrons.
17. (UFPR - 2011) A constituição elementar da matéria
sempre foi uma busca do homem. Até o início do
século XIX, não se tinha uma ideia concreta de como
a matéria era constituída. Nas duas últimas décadas
daquele século e início do século XX, observou-se um
grande avanço das ciências e com ele a evolução dos
modelos atômicos. Acerca desse assunto, numere a
coluna da direita de acordo com sua correspondência
com a coluna da esquerda:
1.
2.
3.
4.
5.
Próton.
Elétron.
Átomo de Dalton.
Átomo de Rutherford.
Átomo de Bohr.
(( ) Partícula de massa igual a 9,109 x 10-31 kg e carga
elétrica de -1,602 x 10-19 C.
(( ) Partícula constituída por um núcleo contendo
prótons e nêutrons, rodeado por elétrons que
circundam em órbitas estacionárias.
(( ) Partícula indivisível e indestrutível durante as
transformações químicas.
Líder absoluto em exames de seleção de Ensino Médio e UFPR Ensino Superior
Material Extra 2012
(( ) Partícula de massa igual a 1,673 x 10−27 kg, que
corresponde à massa de uma unidade atômica.
(( ) Partícula que possui um núcleo central dotado de
cargas elétricas positivas, sendo envolvido por uma
nuvem de cargas elétricas negativas.
21. (FUVEST) Dalton, na sua teoria atômica, propôs, entre
outras hipóteses, que:
Assinale a alternativa que apresenta a numeração correta da coluna da direita, de cima para baixo.
a)
b)
c)
d)
e)
2 – 5 – 3 – 1 – 4.
1 – 3 – 4 – 2 – 5.
2 – 4 – 3 – 1 – 5.
2 – 5 – 4 – 1 – 3.
1 – 5 – 3 – 2 – 4.
18. (UFRN) A luz amarela das lâmpadas de vapor de sódio
usadas na iluminação pública é emitida pelo decaimento
da energia de elétrons excitados no átomo de sódio. No
estado fundamental, um certo elétron deste elemento
se encontra no segundo nível de energia, num orbital p.
Os valores dos números quânticos que podem caracterizar esse elétron são:
a)
b)
c)
d)
n = 2; 1 = 1; m = 2; s = –½.
n = 2; 1 = 2; m = –2; s = –½.
n = 2; 1 = 1; m = –1; s = +½.
n = 2; 1 = 0; m = 0; s = +½.
19. (UEPG) Sobre as representações abaixo, assinale o
que for correto:
I. 5426Fe.
II. 5626Fe+2.
III. 5626Fe+3.
IV. 5726Fe+2.
V. 5726Fe+3.
VI. 5626Fe.
01. I e VI são isótopos, apresentam a mesma configuração eletrônica, mas não tem a mesma quantidade de
nêutrons.
02. I e II têm o mesmo número de prótons e de elétrons.
04. Embora sejam isótopos isoeletrônicos, II e IV não
tem a mesma massa atômica.
08. III e V, que não tem o mesmo número de neutrôns,
apresentam menor quantidade de elétrons que o átomo
IV.
16. II e IV não têm o mesmo número de neutrôns nem
a mesma massa atômica.
Nível 3
20. (UFPB) Um átomo X de número de massa igual a 63 e
número de nêutrons igual a 36, é isótono de um átomo
Y, de número de massa 64 e isóbaro de um átomo Z
que possui 34 nêutrons. Em relação a esses átomos,
é correto afirmar que as configurações de X+2, Y+2 e Z+2
são, respectivamente:
a)
b)
c)
d)
e)
•
[Ar] 4s1 3d8; [Ar] 4s2 3d5 e [Ar] 4s2 3d6.
[Ar] 4s2 3d5; [Ar] 4s2 3d6 e [Ar] 4s2 3d7.
[Ar] 3d5 4s2; [Ar] 3d6 4s2 e [Ar] 3d9 4s0.
[Ar] 3d7; [Ar] 3d8 e [Ar] 3d9.
[Ar] 4s2 3d5; [Ar] 4s2 3d6 e [Ar] 4s1 3d8.
Ar - cerne de gás nobre [Ar] = 1s2 2s2 2p6 3s2 3p6.
18
I. “Os átomos são indivisíveis”.
II. “Os átomos de um determinado elemento são
idênticos em massa”.
A luz dos conhecimentos atuais, quais são as críticas
que podem ser formuladas a cada uma dessa hipóteses?
___________________________________________
___________________________________________
____________________________________________
22. (CESGRANRIO - RJ) Um átomo Q tem 36 nêutrons
e é isóbaro do átomo R. Considerando que R+2 é
isoeletrônico do átomo Q, qual o número de nêutrons
do átomo R?
___________________________________________
___________________________________________
____________________________________________
Desafio
23. (PUC - SP) Considere as seguintes informações sobre
átomos A, B e C.:
a)
b)
c)
d)
e)
A e B são isótopos.
A e C são isótonos.
B e C são isóbaros.
O número de massa de A é igual a 55.
A soma dos números de prótons de A , B e C é
igual a 79.
f) A soma dos números de nêutrons de A, B e C é
igual a 88.
Determine os números atômicos e de massa de A , B
e C:
____________________________________________
___________________________________________
Gabarito
A)1s2 2s2 2p4
K=2 L=6
B)1s2 2s2 2p6 3s2 3p5
K=2 L=8 M=7
C)1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p1
K=2 L=8 M=18 N=3
D)1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10
K=2 L=8 M=18 N=18 O=1
E)1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f3
K=2 L=8 M=18 N=21 O=8 P=2
F)1s2 2s2 2p6 3s2 3p6 3d5
K=2 L=8 M=13
G)1s2 2s2 2p6 3s2 3p6
K=2 L=8 M=8
Líder absoluto em exames de seleção de Ensino Médio e UFPR Ensino Superior
3
Material Extra 2012
01. A.
a)
b)
c)
d)
e)
f)
20;20;40.
8;8;9.
21;21;24.
30;30;35.
16;18;18.
87;86;136.
02. E.
03.
a)
b)
c)
d)
e)
4,0,0,-1/2.
3,2,+2,+1/2.
4,3,-3,+1/2.
2,1,0,-1/2.
5,2,+2,-1/2.
04.
05.
06.
07.
08.
09.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
B.
A.
A.
02-08-16-32.
C.
B.
A.
01-04-08.
D.
D.
B.
E.
A.
D.
01-04-08-16.
B.
a) Falso. Os átomos são divisíveis, pois podem se
dividir em prótons, elétrons e nêutrons.
b) Falso. Os isótopos provam que átomos de um
mesmo elemento podem possuir massa diferente.
C12 6C13.
6
21. 34.
DESAFIO: 26A55 26B56 27Y56.
4
Líder absoluto em exames de seleção de Ensino Médio e UFPR Ensino Superior