INSTITUTO NACIONAL DE PESQUISAS DA AMAZÔNIA
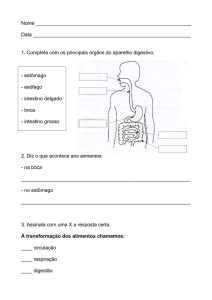
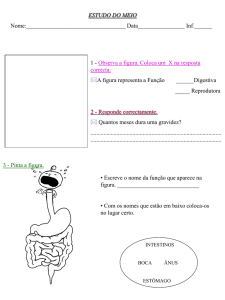
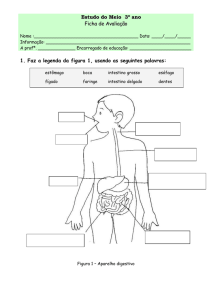
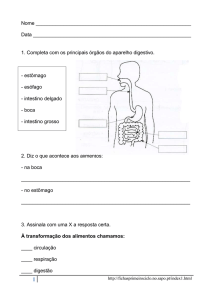
PROGRAMA DE PÓS-GRADUAÇÃO EM
BIOLOGIA DE ÁGUA DOCE E PESCA INTERIOR
Morfologia do tubo digestório aplicada à compreensão da dieta em
quelônios da família Podocnemididae
MARCELA DOS SANTOS MAGALHAES
Manaus, Amazonas
Março/2010
1
MARCELA DOS SANTOS MAGALHAES
Morfologia do tubo digestório aplicada à compreensão da dieta em
quelônios da família Podocnemididae
Orientador: Dr. Richard C. Vogt
Co-orientador: Dr. Carlos Eduardo B. de Moura – UFRN
Co-oreintador: Dr. Jose Fernando M. Barcellos – UFAM
Dissertação apresentada ao Programa de
Pós-Graduação do Instituto Nacional de
Pesquisas da Amazônia como parte dos
requisitos para obtenção do título de
Mestre em Ciências Biológicas, área de
concentração em Biologia de Água Doce e
Pesca Interior.
Manaus, Amazonas
Março/2010
2
FICHA CATALOGRÁFICA
M188
Magalhães, Marcela dos Santos
Morfologia do tubo digestório aplicada à compreensão da dieta em
quelônios da família Podocnemididae / Marcela dos Santos Magalhães.--Manaus : [s.n.], 2010.
xii, 78 f. : il. color.
Dissertação (mestrado)-- INPA, Manaus, 2010
Orientador : Richard Carl Vogt
Co-orientadores : Carlos Eduardo Bezerra de Moura ; José Fernando
Marques Barcellos
Área de concentração : Biologia de Água Doce e Pesca Interior
1. Quelônios. 2. Sistema digestório. 3. Anatomia. 4. Histologia.
I. Título.
CDD 19. ed. 597.920443
Sinopse:
Foi descrita a morfologia do tubo digestório das espécies Podocnemis
expansa, Podocnemis unifilis, Podocnemis erythrocephala, Podocnemis
sextuberculata e Peltocephalus dumerilianus. Relacionando a anatomia e a
histologia com a categoria alimentar de cada uma destas espécies.
Palavras-chave: Quelônios, Sistema digestório, Anatomia, Histologia.
3
AGRADECIMENTOS
Ao CNPq pelo financiamento da bolsa de estudo.
Ao INPA pelo programa de Pós-Graduação e suporte para realização do meu trabalho.
Ao meu orientador Dr. Richard Vogt (Dick), por ter aceitado me orientar e ter
acreditado no meu trabalho
Ao meu co-orientador Carlos Eduardo (Cadu), pela sua grande contribuição e por mais
uma vez ter participado do meu crescimento profissional.
Ao meu co-orientador Fernando Marques (Ferdinando), pela sua orientação, e
principalmente pela amizade e paciência.
A minha mãe, que esteve presente em todos os momentos da minha vida, acreditando,
incentivando e apoiando nas minhas decisões e conquistas. E ao meu irmão pela torcida.
Ao CNPq, MCT, MMA, MPA e CT-INFRA, Processo 408760/2006-0 para RDS pelo
financiamento e apoio ao projeto “BAJAQUEL”.
Ao Dr. Ronis Da-Silveira, por ter me dado espaço no projeto “BAJAQUEL” e
disponibilizado exemplares de quelônios para análises.
Ao Dr. Celso Morato, pela contribuição na parte estatística do projeto e pelo seu
incentivo.
A Dra. Eliana Feldberg, por ter disponibilizado o microscópio com câmera acoplada
para realização das imagens histológicas.
As técnicas Rose Campos e Maíza da Conceição, pela importante ajuda na preparação
das lâminas histológicas no laboratório de histologia da UFAM.
Ao laboratório de histologia da UFRN, onde realizei parte da coloração (PAS) das
laminas histológicas com ajuda da Lourdes (Lourdinha).
Aos meus amigos e companheiros da Coleção de anfíbios e répteis do INPA: Virgínia,
Camila, Rosa, Letícia (Tica), Ladislau, Rafael, Rayath, Melina, Elis, Larissa, Lucéia, Vinícios
e Altamir, pela ajuda em vários momentos da realização desse trabalho e pelas experiências
compartilhadas.
A Márcia e ao Daniel Praia (“Meus Pibic`s”), pela imensa ajuda na parte da
morfometria.
Aos vários companheiros de republica, Daniel, Alex, Daniela, Anelena, Raquel,
Francimario e em especial Ricardo, que fizeram minha estadia em Manaus mais alegre e
colorida.
Aos amigos do BADPI turma 2008, especialmente Luciana (lut), Ariana (lurinha),
João Henrique (Minhoca), Túlio, Fernanda (Nanda), Mariel, Marla, Roberta (Robertinha),
4
William (China) e Daiane, por todos os momentos de ciência nos estudos do metabolismo do
álcool.
Aos grandes amigos conquistados em Manaus, João Vitor (JB), Alice, Fabi (in
memorian), Marcelino, Priscila, entre outros vários que fizeram deste um lugar mais feliz.
Aos amigos BAJAQUEL, Adriana, Shamila, Michele, Boris, Washington, Robin...,
que mesmo sem perceberem me fizeram enxergar Manaus de forma diferente.
Aos professores do BADPI, que me mostraram como eu deveria ser profissionalmente
e também como eu não deveria ser.
A Elany e Carminha, que sempre estiveram dispostas a me ajudar.
A todos os funcionários do CPBA, em especial Sida e Dona Rosa.
Ao Flavio Augusto (Guto) pela enorme e indispensável ajuda nas análises dos meus
dados morfométricos.
A todos que direta e indiretamente me ajudaram a realizar esse trabalho.
5
RESUMO
Neste estudo foram utilizados 75 animais sendo 15 exemplares de cada espécie, Podocnemis
expansa, Podocnemis unifilis, Podocnemis sextuberculata, Podocnemis erythrocephala e
Peltocephalus dumerilianus, com objetivo de caracterizar a morfologia do tubo digestório
dessas espécies. Foram realizadas as descrições anatômicas e histológicas e análise dos órgãos
do tubo digestório. As cinco espécies apresentaram a mucosa esofágica caracterizada por duas
regiões distintas, a primeira com papilas esofágicas e a segunda com pregas longitudinais;
sendo um órgão aglandular, com células mucosas, caliciformes e secretoras. O estômago em
P. expansa, P. unifilis e P. erytrhocephala é formado por duas porções gástricas separadas por
uma constrição, a primeira mais volumosa composta pelas regiões cárdica e fúndica
aglandulares e caracterizadas pela presença de células caliciformes. A segunda porção se
curva para direita logo abaixo da primeira e é formada pela região pilórica desenvolvida, com
grande quantidade de glândulas em sua lâmina própria. Em P. sextuberculata o estômago
apresentou forma de “J” e em P. dumerilianus forma de ferradura encurvada. Nessas duas
espécies esse órgão apresentou grande quantidade de glândulas em todas as regiões. O
intestino delgado (ID) em todas as espécies é um tubo longo e enovelado. Apresenta pregas
reticulares na região cranial, longitudinais baixas e em zigue-zague na região média e,
longitudinais altas em zigue-zague bem evidentes na região caudal. Caracteriza-se pela
presença de vilosidades que se apresentam diferentes em cada região do ID. O intestino
grosso (IG) em P. expansa, P. unifilis, P. erythrocephala inicia-se com uma dilatação, o ceco,
seguindo por região reta e tubular, o cólon/reto. Em P. sextuberculata e P. dumerilianus, o IG
é formado apenas de uma região tubular. O IG apresenta maior quantidade de células
caliciformes quando comparado ao ID. Em todas as espécies ocorreu diferença entre o
comprimento do ID e IG, sendo ID proporcionalmente maior que o IG (p < 0,0001). Este
trabalho define que para a manutenção destas espécies de quelônios em cativeiro uma dieta ou
ração deva ser elaborada em separado para as de adaptações herbívora, onívora e carnívora.
6
ABSTRACT
In the present study were used 15 specimens of each species, Podocnemis expansa,
Podocnemis
unifilis,
Podocnemis
sextuberculata,
Podocnemis
erythrocephala
and
Peltocephalus dumerilianus, aiming to define and characterize the morphology of their
digestive tract. The biometric parameters were held in each specimen. The anatomical and
histological procedure were carried out for further analysis of the organs of the digestive tract.
The five species showed the esophageal mucosa divided and characterized by two distinct
regions, the first with esophageal papillae and the second with longitudinal folds. The
esophagus appeared as an aglandular organ with marked presence of mucous cells, goblet
cells and secretory cells. The stomach in P. expansa, P. unifilis and P. erytrhocephala
consists of two parts separated by a gastric evident constriction, the first portion is composed
of massive cardic and fundic regions. Both were glandular regions, but characterized by the
presence of goblet cells. In the anatomical position, the second part bends to the right just
below the first one and is composed by a pyloric region well developed, and a large number
of glands in the lamina propria. In P. sextuberculata the stomach showed a "J" shape and in
Peltocephalus dumerilianus has a "C" shape. The small intestine (SI) in all species is a long,
thin meandering tube with reticular folds in the proximal region, low longitudinal folds in a
zigzag design in the medial region and a very evident high longitudinal fold with zigzag in the
distal region. The organ is characterized by the presence of villi which appear different in
each region of the SI. The large intestine (LI) in P. expansa, P. unifilis and P. erythrocephala
begin with an enlarged and clear tube, the cecum, followed by a straight and tubular region,
the colon/rectum. In P. sextuberculata and P. dumerilianus the large intestine is composed
only by a tubular region, with a diameter larger than the SI. The GI has a large number of
goblet cells. In all species difference was found between the length of the SI and LI. The SI is
proportionally higher than the LI (p <0.0001). This work defines that the maintenance of these
species of turtles in captivity need a diet that should be prepared separately for the adaptations
of herbivores and another one for omnivory and carnivory.
7
SUMÁRIO
LISTA DE FIGURAS.............................................................................................................IX
1 INTRODUÇÃO ..................................................................................................................... 1
2. REVISÃO DE LITERATURA............................................................................................ 4
2.1 Caracterização geral das espécies de Podocnemididae da Amazônia ........................... 4
2.1.1 Podocnemis expansa............................................................................................... 4
2.1.2 Podocnemis unifilis ................................................................................................ 5
2.1.3 Podocnemis erythrocephala .................................................................................... 5
2.1.4 Podocnemis sextuberculata .................................................................................... 6
2.1.5 Peltocephalus dumerilianus .................................................................................... 7
2.2 Aspectos Gerais ............................................................................................................. 8
2.2.1 Morfologia do tubo digestório em quelônios ....................................................... 10
3 OBJETIVOS ........................................................................................................................ 12
3.1 Objetivo geral .............................................................................................................. 12
3.2 Objetivos específicos .................................................................................................. 12
4 MATERIAL E MÉTODOS ................................................................................................ 13
4.1 Obtenção dos animais ................................................................................................. 13
4.2 Biometria dos animais ................................................................................................. 14
4.3 Processamento e análise da anatomia do tubo digestório ........................................... 14
4.4 Preparação dos cortes histológicos para microscopia de luz ...................................... 16
4.5 Análise estatística ........................................................................................................ 18
5 RESULTADOS .................................................................................................................... 19
5.1 Esôfago ........................................................................................................................ 19
5.2 Estômago ..................................................................................................................... 28
5.3 Intestino Delgado ........................................................................................................ 38
5.4 Intestino Grosso .......................................................................................................... 44
6 DISCUSSÃO ........................................................................................................................ 49
7 CONCLUSÃO...................................................................................................................... 60
ANEXOS ................................................................................................................................. 73
8
LISTA DE FIGURAS
Figura 1 – Espécies de Podocnemididae analisadas. A: P. expansa; B: P. unifilis; C: P.
erythrocephala; D: P. sextuberculata; E: P. dumerilianus ........................................................ 8
Figura 2 – Representação da biometria do comprimento e da largura retilínea da carapaça.
(adaptado de Luz et al., 2003) .................................................................................................. 14
Figura 3 – Figura esquemática demonstrando o local dos fragmentos retirados ao longo do
tubo digestório para análise histológica. ▌corte transversal; ▬ corte longitudinal. ................ 17
Figura 4 – Disposição do esôfago encontada em P. expansa, P.unifilis e P. erythrocephala. e:
esôfago; s: estômago; (→) transição esôfago-estômago. ......................................................... 19
Figura 5 – Disposição do esôfago encontrada em P. dumerilianus. e: esôfago; s: estômago;
(→) transição esôfago-estômago. ............................................................................................. 20
Figura 6 - Mucosa esofágica em Podocnemididae. Primeira porção caracterizada pela
presença de papilas esofágicas (→); Segunda porção caracterizada pela presença de pregas
longitudinais ( ). A: P. expansa. B: P. unifilis. C: P. erythrocephala. D: P. sextuberculata.
E: P. dumerilianus. ................................................................................................................... 23
Figura 7 – Fotomicrografia da primeira porção do esôfago caracterizada pela presença de
papilas esofágicas em Podocnemididae. A: Epitélio estratificado cilíndrico em P. expansa.
(→): células superficiais mucosas; a: célula caliciforme; b: célula secretora; c: submucosa PAS. B: Epitélio estratificado pavimentoso em P. expansa. d: epitélio estratificado
pavimentoso; e: submucosa - HE. C: Epitélio estratificado cilíndrico em P. unifilis. (→):
células superficiais mucosas; f: célula secretora; g: submucosa - PAS. D: Em P. unifilis. h:
epitélio estratificado pavimentoso; i: epitélio estratificado cilíndrico; j: célula caliciforme HE. E: Epitélio estratificado cúbico alto em P. erythrocephala. (→): células superficiais
mucosas; k: célula caliciforme - PAS. F: Epitélio estratificado cilíndrico em P.
sextuberculata. (→): células superficiais cilíndricas mucosas; l: Célula caliciforme ; m:
epitélio estratificado cilíndrico - HE. Aumento todas as fotos: 400X ...................................... 24
Continuação Figura 7 - Fotomicrografia da primeira porção do esôfago caracterizada pela
presença de papilas esofágicas em Podocnemididae. G: Epitélio estratificado cilíndrico em P.
dumerilianus. n: células superficiais cilíndricas mucosas; o: submucosa - PAS. Aumento:
400X. H: Epitélio estratificado pavimentoso em P. dumerilianus (→) - PAS. Aumento: 400X.
I: Camada muscular (→) em P. expansa; p: submucosa- HE. Aumento: 50X. J. Camada
muscular (→) em P. erythrocephala; q: epitélio; r: submucosa; s: feixes de tecido conjuntivo
entre as fibras musculares - HE. Aumento: 100X. L: Camada muscular (→); t: feixes de
tecido conjuntivo entre as fibras musculares – TM. Aumento: 100X . M: Plexo mioentérico
(→) em P. sextuberculata. - HE. Aumento: 100X. ................................................................... 25
Figura 8 – Fotomicrografia da segunda porção do esôfago caracterizada pela presença de
pregas longitudinais em Podocnemididae. A: Mucosa esofágica pregueada em P.
erythrocephala - TM. Aumento: 50X. Nas imagens de B a D: observa-se o epitélio
estratificado cilíndrico com células superficiais mucosas alongadas, característico desta região
ix
nas espécies P. expansa, P. unifilis, P. erythrocephala, respectivamente (→). a: pregas
esofágicas; b: epitélio; c: submucosa; d: camada muscular. B; D – PAS. C – HE. Aumento B a
D: 400X .................................................................................................................................... 26
Continuação Figura 8 – Fotomicrografia da segunda porção do esôfago caracterizada pela
presença de pregas longitudinais em Podocnemididae. Nas imagens de E e F: observa-se o
epitélio estratificado cilíndrico com células superficiais mucosas alongadas, característico
desta região nas espécies P. sextuberculata e P. dumerilianus, respectivamente (→). c:
submucosa; d: camada muscular. E – PAS. F – HE. Aumento E e F: 400X. G: Camada
muscular em P. expansa - HE. Aumento: 100X. H: camada muscular em P. dumerilianus. c:
submucosa; d: camada muscular circular interna; e: camada muscular longitudinal externa; f:
tecido conjuntivo - TM. Aumento: 50X. .................................................................................. 27
Figura 9 - Padrões anatômicos encontrados para o estômago em Podocnemididae. c: região
cárdica; f: região fúndica; p: região pilórica. A; B; C: estômago dividido em duas porções por
uma constrição (→) em P. expansa, P. unifilis e P. erythrocephala, respectivamente; D:
estômago em forma de “J” em P. sextuberculata; E: estômago em forma de ferradura
encurvada em P. dumerilianus. ................................................................................................ 29
Figura 10 - Mucosa do estômago. A: Mucosa da primeira porção do estômago da P. expansa
com pregas transversais; A’: Mucosa da segunda porção do estômago da P. expansa com
pregas longitudinais; B: Mucosa da primeira porção do estômago da P. unifilis com pregas
transversais; B’: Mucosa da segunda porção do estômago da P. unifilis com pregas
longitudinais; C: Mucosa da primeira porção do estômago da P. erythrocephala com pregas
transversais; C’: Mucosa da segunda porção do estômago da P. erythrocephala com pregas
longitudinais. (►) transição entre a primeira e a segunda porção do estômago. D: Mucosa do
estômago da P. sextuberculata com pregas longitudinais; E: Mucosa do estômago do P.
dumerilianus com pregas longitudinais. (→): transição esôfago-estômago. ........................... 30
Figura 11- Fotomicrografia da região cárdica do estômago em Podocnemididae. A: Pequenas
pregas secundárias sem formação de fossetas em P. expansa. a: pregas; b: muscular da
mucosa; c: submucosa - HE. Aumento: 50X. B: Células caliciformes presentes no epitélio em
P. expansa (→). d: epitélio - PAS. Aumento: 400X. C: Pequenas pregas secundárias sem
formação de fossetas em P. erythrocephala. e: pregas; f: submucosa - HE. Aumentov 100X.
D: Células caliciformes presentes no epitélio em P. erythrocephala (→) – PAS. Aumento:
400X. ........................................................................................................................................ 32
Continuação Figura 11- Fotomicrografia da região cárdica do estômago em
Podocnemididae. E: Pequenas pregas secundárias sem formação de fossetas em P. unifilis. g:
pregas - PAS. Aumento: 100X. F: Região das fossetas e glândulas gástricas em P.
sextuberculata. (→): fosseta gástrica; (*): epitélio cilíndrico simples com células superficiais
mucosas; h: região das glândulas gástricas - PAS. Aumento: 100X. G: Em P. dumerilianus. i:
região das glândulas gástricas; j: muscular da mucosa - HE. Aumento 50X. H: Região das
fossetas e glândulas gástricas em P. dumerilianus. (→): fosseta gástrica; l: região das
glândulas gástricas - PAS. Aumento: 100X. ............................................................................ 33
Figura 12 – Fotomicrografia da região fúndica do estômago em Podocnemididae. A:
Pequenas pregas secundárias sem formação de fossetas em P. expansa. a: pregas; b: muscular
da mucosa; c: submucosa - PAS. Aumento: 100X. B: Células caliciformes presentes no
epitélio em P. expansa (→) - PAS. Aumento: 400X. C: Pequenas pregas secundárias sem
x
formação de fossetas em P. erythrocephala. d: pregas; e: epitélio cilíndrico simples; f:
muscular da mucosa – HE. Aumento: 100X. D: Células caliciformes presentes no epitélio em
P. erythrocephala (→) - PAS. Aumento: 400X. E: Pequenas pregas secundárias sem
formação de fossetas em P. unifilis. g: pregas; (→): célula caliciforme - HE. Aumento: 400X.
F: Região das fossetas e glândulas gástricas em P. dumerilianus. (→): fosseta gástrica; h:
região das glândulas gástricas; i: muscular da mucosa; j: submucosa - PAS. Aumento: 100X.
.................................................................................................................................................. 34
Figura 13 – Fotomicrografia da região pilórica do estômago em Podocnemididae. A: Fossetas
e glândulas pilóricas em P. expansa. (→): fosseta; a: glândulas; b: muscular da mucosa; c:
submucosa - PAS. B: Região das glândulas pilóricas em P. unifilis - HE. C: Fossetas gástricas
em P. unifilis (→) - PAS. D: Fossetas gástricas em P. erythrocephala (→). (*): células
superficiais mucosas. Aumento A e B: 100X. Aumento C e D: 400X. ................................... 35
Continuação Figura 13 - Fotomicrografia da região pilórica do estômago em
Podocnemididae. E e F: Fossetas e glândulas pilóricas em P. sextuberculata. (→): fosseta; d:
glândulas; e: muscular da mucosa; f: submucosa. E – HE. F – PAS. G: Fossetas gástricas e
glândulas pilóricas em P. dumerilianus. (→): fossetas; g: glândulas - PAS. H: Região das
glândulas pilóricas em P. dumerilianus - PAS. Aumento E a G: 100X. Aumento H: 400X. .. 36
Figura 14 - Esfincter pilórico (→). s: estômago; d: duodeno. A: P. expansa. B: P. unifilis. C:
P. erythrocephala. D: P. dumerilianus. .................................................................................... 37
Figura 15 - Intestino delgado. A: P. erythrocephala. B: P. sextuberculata. s: estômago; d:
duodeno, primeira região do intestino delgado caracterizado como uma porção curta; j/i:
jejuno/íleo, região do intestino delgado caracterizada como longa e enovelada; ig: intestino
grosso. ....................................................................................................................................... 38
Figura 16 - Mucosa do intestino delgado. Em A: Região cranial com pregas reticulares na P.
expansa; e A’ na P. unifilis. B: Região medial com pregas longitudinais em zigue-zague
baixas em P. expansa. C: Região caudal com pregas longitudinais em zigue-zague altas e bem
evidentes na P. expansa e em C’: na P. unifilis........................................................................ 39
Figura 17 – Fotomicrografia das vilosidades do duodeno em Podocnemididae. A: Em P.
expansa. a: simples; b: ramificada - PAS. B: Vilosidades filiformes em P. erythrocephala HE. C: Vilosidades filiformes em P. dumerilianus - PAS. D: Células caliciformes presentes
nas vilosidades (↔) em P. dumerilianus - PAS. Aumento A a C: 100X. Aumento D: 400X. 41
Figura 18 – Fotomicrografia das vilosidades do jejuno em Podocnemididae. Observar
alternância de vilosidades foliáceas, ramificadas e digitiformes. A: Em P. expansa – HE. B:
Em P. unifilis – HE. C: Em P. sextuberculata. a: vilosidade digitiforme; b: vilosidade
ramificada; c: vilosidade foliácea - PAS. Aumento de todas as fotos: 50X. ............................ 42
Figura 19 – Fotomicrografia das vilosidades do íleo em Podocnemididae. A: Vilosidades
fungiformes baixas em P. sextuberculata - HE. Aumento: 50X. B: Vilosidades ramificadas
em P. sextuberculata - TM. Aumento: 100 X. C: Vilosidades convolutas em P. dumerilianus PAS. Aumento 50X. D: Células caliciformes presentes no íleo em P. dumerilianus (→) PAS. Aumento: 400X. .............................................................................................................. 43
Figura 20 - Intestino grosso. A: Padrão encontrado em P. expansa, P. unifilis e P.
erythrocephala. Intestino grosso iniciando com uma dilatação, cc: ceco, e seguindo com uma
xi
região reta e tubular, c/r: cólon/reto. B: Mucosa do ceco com pregas transversais (→); mucosa
do cólon/reto com pregas longitudinais onduladas ( ). C e D Padrão encontrado em P.
sextuberculata e P. dumerilianus, respectivamente. Intestino grosso formado por uma região
tubular. E: Mucosa do intestino grosso em P. dumerilianus com pregas transversais. id:
intestino delgado; ig: intestino grosso. Região circulada refere-se ao esfíncter ileocecal. ...... 45
Figura 21 – Fotomicrografia da região proximal do intestino grosso. A: Região referente ao
ceco em P. expansa. a: mucosa pregueada; b: camada muscular - HE. Aumento: 50X. B:
Região proximal do intestino grosso em P. sextuberculata. (→): prega primária; c: pregas
secundárias; d: submucosa - PAS. Aumento: 50X. C: Presença de células caliciformes na
região proximal do intestino grosso em P. dumerilianus (→). e: epitélio cilíndrico simples PAS. Aumento: 400X. .............................................................................................................. 46
Figura 22 – Fotomicrografia da região do reto. A: Mucosa pregueada e submucosa formada
por tecido conjuntivo frouxo em P. unifilis. a: mucosa pregueada com células caliciformes; b:
submucosa; c: camada muscular circular interna; d: camada muscular longitudinal externa
formando tênias - PAS. Aumeto: 100X. B: Camada muscular do reto em P. expansa - HE.
Aumento: 50X. ......................................................................................................................... 47
xii
1 INTRODUÇÃO
Os quelônios amazônicos foram e continuam sendo um importante recurso alimentar e
econômico para as populações indígenas em toda Amazônia. Eles têm sido caçados, pescados
e seus ovos colhidos há muitas gerações (Smith, 1979; Fachín-Terán et al., 1996; Vogt,
2001). Em sentido estrito, existe uma boa documentação do uso da carne e dos ovos da
tartaruga-da-amazônia no Amazonas (Smith, 1979). Bates (1863) estimou que, durante o
século 19 aproximadamente 48 milhões de ovos de Podocnemis expansa foram removidos
anualmente na região do médio rio Solimões. E o óleo extraído a partir dos ovos foi um
produto importante para cozinha e iluminação (Redford e Robinson, 1991). No Rio Negro e
na Amazônia como um todo, o consumo de quelônios é uma maneira de se obter carne ou
proteína (Alho, 1984), no entanto, este hábito associado a um intenso comércio ilegal, levou à
drástica diminuição de suas populações naturais (Mittermeier, 1975; Vogt, 2001). Todas estas
características, juntamente com o seu comportamento de nidificar em grandes colônias e a
presença de ovos em altas densidades nas praias facilitaram ao homem reduzir as populações
de quelônios (Hernandez et al., 1998).
Podocnemis expansa, Podocnemis unifilis, Podocnemis sextuberculata, Podocnemis
erythrocephala e Peltocephalus dumerilianus são as espécies de quelônios mais consumidos
na Amazônia (Smith, 1979; Rebelo e Pezzuti, 2000; Vogt, 2001). Entretanto, uma grande
variação é observada dependendo da preferência e de qual espécie é mais abundante em
determinada localidade (Smith, 1979; Rebelo e Pezzuti, 2000). Em locais onde já houve uma
grande exploração das espécies maiores, as menores passam a ocupar um lugar de destaque na
caça (Smith, 1979).
Por exemplo, na Reserva de Desenvolvimento Sustentável Mamirauá – AM, a
população de P. sextuberculata vem sendo permanentemente explorada pelo homem (FachínTerán et al., 2003). No Parque Nacional do Jaú - médio rio Negro – AM as espécies de
quelônios consumidas em maior escala são o P. unifilis, P. erythrocephala e P. dumerilianus,
sendo a última uma das mais consumidas (Pezzuti et al., 2004; Rebelo, 2002; Silva, 2004). No
município de Barcelos - médio rio Negro - AM, as duas maiores espécies, P. expansa e P.
unifilis são geralmente compradas por comerciantes para revenda em Manaus, e as três
menores, P. sextuberculata, P. erythrocephala e P. dumerilianus, são vendidas para consumo
local (Vogt, 2001).
1
Entre as principais atividades adotadas para conservação desses animais, estava o
incentivo à criação com finalidade comercial em criadouros legalizados, desestimulando a
caça predatória e o comércio ilegal por meio da oferta legal de tartarugas e de seus
subprodutos (Brasil, 2001). A criação comercial de quelônios amazônicos foi normalizada
pelas Portarias 142-N, de 30 de dezembro de 1992, que dispõe sobre a criação em cativeiro de
P. expansa e P. unifilis, e 070, de 23 de agosto de 1996, que dispõe sobre a comercialização
de produtos e subprodutos de P. expansa e P. unifilis (Brasil, 1992; Brasil, 1996). Portanto, o
desenvolvimento de sistemas de criação pode contribuir, não somente para diminuir a pressão
sobre os animais de vida livre, como também para oferecer alternativas econômicas de
utilização sustentada e racional dos recursos da fauna (CENAQUA, 2000).
Embora a abertura para criação em cativeiro proporcionada pela legislação seja
extremamente importante, as pesquisas conduzidas até o momento não ofereceram subsídios
científicos suficientes para estabelecer tecnologia adequada e eficiente para o manejo (Luz,
2000). Conforme Lima (1998), a escassez de informações científicas sobre quelônios cria
dificuldades para a sua criação em escala comercial para abastecer a demanda de sua carne,
que é muito apreciada nos centros urbanos do Amazonas. Um dos fatores que condicionam o
bom desenvolvimento de espécies nativas em cativeiro está relacionado à questão nutricional
destes animais, incluindo estudos do sistema digestório (Rodrigues et al., 2004).
O
efetivo
enquadramento
de
quelônios,
como
fonte
protéica
disponível
comercialmente só será possível à medida que houver maior conhecimento científico,
relacionado à sua biologia e fisiologia. Pouco se conhece sobre a taxa de crescimento, as
exigências nutricionais, as densidades populacionais, o rendimento de carcaça, além dos
aspectos relacionados à morfologia do tubo digestório destes animais (Luz, 2000).
Análise dos parâmetros morfométricos do tubo digestório são necessários para o
conhecimento dos processos digestivos dos alimentos no organismo animal além de indicar a
preferência alimentar de uma espécie (Luz et al., 2003). Além disso, estudos anatômicos e
morfométricos fornecem informações necessárias na clínica de animais silvestres (Pinto,
2006). Esses estudos juntamente com exames complementares como endoscopia,
colonoscopia e radiografia podem ser conduzidos em quelônios, com finalidade de elucidar
fenômenos fisiológicos e patológicos do tubo gastrintestinal (Holt, 1978; Meyer, 1998). Do
ponto de vista morfológico, é importante que se conheça a descrição da localização dos
órgãos digestórios na cavidade celomática.
2
As pesquisas científicas de caráter biológico e ecológico, desenvolvidas com os
quelônios, vieram crescendo significativamente na Amazônia, principalmente quando
relacionados a aspectos reprodutivos, alimentares e populacionais dos Podocnemididae
(Hildebrand et al., 1988; Vogt, 1994; Vogt et al., 1991; Fachin-Terán, 1992; Fachin-Terán et
al., 1995; Cantarelli, 1997; Soini, 1997; Vogt, 2001; Fachin-Terán e Vogt, 2004). Entretanto
não se dispõe de informações detalhadas da anatomia e histologia do tubo digestório de
quelônios da Amazônia.
Em quelônios, estudos morfológicos do tubo digestório e da composição alimentar se
tornam importantes para fornecer informações essenciais à formulação de produtos que
possam suprir suas necessidades alimentares em cativeiro (Rodrigues et al., 2004). Estes
animais são alimentados com ração para aves e peixes, ou na experimentação de fórmulas
caseiras, como peixe in natura e vísceras bovinas (Duarte, 1998). Os trabalhos de Best
(1984) e Lima (1998) avaliaram o efeito da dieta em animais em cativeiro e concluíram que
uma dieta adequada é importante para manutenção de tartarugas em cativeiro, tanto para fins
de conservação como para fins de comercialização da espécie.
Portanto existe a necessidade de maiores informações que auxiliem na correta
localização e delimitação das estruturas do tubo digestório bem como elucidar questões
referentes a adaptações morfológicas frente a variações nutricionais na dieta, tanto na natureza
como em criadouros.
3
2. REVISÃO DE LITERATURA
2.1 Caracterização geral das espécies de Podocnemididae da Amazônia
Na Amazônia são encontradas cinco espécies da família Podocnemididae: Podocnemis
expansa, Podocnemis unifilis, Podocnemis erythrocephala, Podocnemis sextuberculata e
Peltocephalus dumerilianus (Vogt, 2008).
2.1.1 Podocnemis expansa
Podocnemis expansa, conhecida como tartaruga-da-amazônia, caracteriza-se como o
maior quelônio de água doce da América do Sul podendo atingir até 80 cm de carapaça
(Pritchard e Trebbau, 1984) (Figura 1A). É uma espécie largamente distribuída, ocorrendo em
rios da Colômbia, Venezuela, Guiana, Equador, Peru, Bolívia e no Brasil, nas bacias
Amazônica e do Araguaia/Tocantins (Roze, 1964; Pritchard e Trebbau, 1984), vivendo tanto
em sistema de água branca ou preta (Ernst e Barbour, 1989; Rueda-Almonacid et al., 2007).
Na natureza, a tartaruga-da-amazônia é herbívora, sua dieta constituiu-se de frutas,
raízes, sementes, gramíneas e folhas de plantas silvestres de várzeas (Pritchard, 1979;
Almeida et al., 1986; Fachín-Terán, 1992; Fachín-Terán et al., 1995; Rueda-Almonacid et al.,
2007; Vogt, 2008). Em um estudo realizado de conteúdo estomacal por Rodrigues et al.
(2004) em Trombetas-PA, o material de origem vegetal teve quantidade elevada, sendo que as
folhas destacaram-se como um alimento representativo, vindo em seguida as sementes e, em
menor representatividade, os talos e palmito. Corroborando que a alimentação dessa espécie
em condições de vida livre está predominantemente baseada em alimentos de origem vegetal.
Segundo Duarte (1998), essa espécie em alguns casos se comporta como onívora porque
também ingere, em quantidades menores, alimento de origem animal, mas sem especificar se
este é um hábito oportunista, em função da disponibilidade de alimentos existentes no meio
ambiente. Em cativeiro P. expansa apresenta fácil adaptação a alimentos de origem animal e
vegetal (Acosta et al., 1995; Malvasio et al., 2003).
4
2.1.2 Podocnemis unifilis
Podocnemis unifilis, popularmente conhecida como tracajá, quando filhote, juvenil e
machos adultos exibem manchas amarelas na cabeça, enquanto as fêmeas adultas perdem essa
coloração, passando a ser marrom. (Pritchard, 1979; Pritchard e Trebbau, 1984; Ernst e
Barbour, 1989) (Figura 1B). Ocorre nas bacias venezuelanas dos rios Orinoco e Amazonas,
leste da Colômbia, leste do Equador, nordeste do Peru, Guiana Francesa, Guiana, Suriname e
bacia do rio Amazonas no Brasil e Bolívia (Ernst e Barbour, 1989). Seu habitat abrange rios
de água preta, clara e branca (Rueda-Almonacid et al., 2007; Vogt, 2008).
A dieta dessa espécie em ambiente natural indica que é herbívora, alimentando-se de
plantas aquáticas, algas, sementes, folhas, frutos, flores, raízes e talos (Fachín-Terán et al.,
1995; Portal et al., 2002; Balensiefer, 2003; Balensiefer e Vogt, 2006), mas ocasionalmente
ingerem pequenos animais como moluscos, crustáceos, insetos e peixes, sendo que o baixo
volume de artrópodes e peixes no conteúdo estomacal indicou que esses itens não são
importantes na dieta dessa espécie (Fachin-Terán et al., 1995; Balensiefer, 2003; Balensiefer e
Vogt, 2006). Balensiefer e Vogt (2006) encontraram que, do volume total analisado de
alimento para P. unifilis 79,6% era matéria vegetal, sendo que folhas (81,5%), sementes
(61,5%) e frutos (50,8%) ocorreram com maior freqüência. Fachín-Teráan et al. (1995)
encontraram que essa espécie consome com mais freqüência sementes e frutos, sendo que
caule e folhas são consumidas durante todo o ano. Em cativeiro essa espécie apresentou fácil
adaptação a alimentos de origem animal e vegetal em todas as fases de desenvolvimento
(Malvasio et al., 2003).
2.1.3 Podocnemis erythrocephala
Podocnemis erythrocephala, conhecida como irapuca, tem como característica da
espécie o padrão de coloração vermelha ou alaranjada na cabeça nos filhotes, juvenis e nos
machos adultos este padrão persiste enquanto que nas fêmeas adultas torna-se marrom escuro
(Pritchard, 1979) (Figura 1C). Essa espécie ocorre na Colômbia, Venezuela e no Brasil nos
rios Negro, Tapajós e Trombetas (Rueda-Almonacid et al., 2007). Apresenta distribuição
restrita, vivendo preferencialmente em água preta (Pritchard e Trebbau, 1984; RuedaAlmonacid et al., 2007), havendo registros de pequenas populações também em água clara
5
(Hoogmoed e Avila-Pires, 1990; Pritchard, 1990; Rebêlo, 1991; Vogt et al., 1991; Iverson,
1992).
Na natureza, a irapuca é primariamente herbívora alimentando-se de plantas aquáticas,
frutos e uma variedade de sementes (Vogt, 2001; Rueda-Almonacid et al., 2007). No entanto,
peixes também foram registrados como fazendo parte da sua dieta (Mittermeier e Wilson,
1974). Vogt (2001); Sousa e Vogt (2008) observaram que essa espécie alimenta-se
principalmente de matéria vegetal, representado por algas filamentosas e sementes,
consumindo peixes, crustáceos e insetos em menor escala. Segundo Santos-Junior (2009), na
época da seca P. erythrocephala é uma espécie herbívora que consome frutos e sementes, mas
também material animal em menor proporção, o que parece ser um padrão dentro da família
Podocnemididae.
2.1.4 Podocnemis sextuberculata
Podocnemis sextuberculata, conhecida como iaçá, apresenta nos indivíduos jovens o
plastrão com seis pontas salientes denominadas tubérculos, que desaparecem à medida que o
indivíduo cresce (Rueda-Almonacid et al., 2007) (Figura 1D). Sua distribuição geográfica
compreende a drenagem do rio Amazonas no Brasil, Peru e Colômbia (Ernst e Barbour, 1989;
Iverson, 1992). No Brasil, esta espécie é encontrada em rios de água branca como o Solimões,
Amazonas, Japurá e Branco, além de rios de água clara como o Trombetas e Tapajós (Smith,
1979; Pezzuti e Vogt 1999; Pezzuti et al., 2000; Bernhard, 2001; Fachin-Teran et al.; 2003).
Com relação à dieta, Ernst e Barbour (1989) afirmam que a iaçá alimenta-se de plantas
aquáticas e peixes. Fachín-Terán (1999) verificou que essa espécie é herbívora, desde filhote
até adulto, com 95,17% do volume total contendo material vegetal, entre eles sementes, talo,
folha e rizoma. Alimentando-se principalmente de sementes em todas as épocas do ano, sendo
rizoma o segundo ítem vegetal mais consumido. Material animal, principalmente peixe e
caranguejos foi encontrado em pequenas quantidades, no entanto foi detectado que material
animal foi mais freqüente na vazante, e que os insetos apresentaram freqüência de ocorrência
alta, supondo que esses são ingeridos como parte da sua dieta. O mesmo autor encontrou
mudanças na alimentação em função do tamanho, talo, folha e rizoma só foram consumidos
por exemplares cujo tamanho foi igual ou mais que 15 cm de comprimento.
6
Vogt (2008) relata que em Trombetas-PA foram encontrados principalmente pequenos
caramujos no conteúdo estomacal desta espécie. Rueda-Almonacid et al. (2007) consideram
essa espécie onívora que se alimenta de peixes, rãs, moluscos, insetos pequenos, assim como
frutos e sementes. Em cativeiro, P. sextuberculata demonstra ser uma espécie
predominantemente carnívora nas faixas etárias recém eclodidas e jovens (Malvasio et al.,
2003).
2.1.5 Peltocephalus dumerilianus
Peltocephalus dumerilianus, conhecido como cabeçudo, ao contrário da maioria das
espécies da mesma família, os machos são maiores do que as fêmeas (Pritchard e Trebbau,
1984; De La Ossa, 2007). Os machos adultos podem atingir 52 cm de comprimento da
carapaça, enquanto às fêmeas adultas 47 cm (Medem, 1983; Iverson e Vogt, 2002) (Figura
1E). É uma espécie amplamente distribuída, encontrada na Bacia Amazônica, que
compreende desde o rio Orinoco na Venezuela, leste da Colômbia, leste do Equador, nordeste
do Peru, Guiana Francesa e Brasil (Iverson e Vogt, 2002). Essa espécie habita
preferencialmente rios, igapós e lagoas de água preta, sendo abundantes no rio Negro.
Entretanto, ocasionalmente, também pode ser encontrado, em menor número, em rios de água
branca e clara. (Pritchard e Trebbau, 1984; Rueda-Almonacid et al., 2007).
É considerada uma espécie onívora oportunista e generalista, com consumo de frutas,
sementes, peixes, plantas aquáticas, invertebrados e algas (Perez-Eman e Paolillo, 1977; Vogt,
2001; De La Ossa, 2007). Segundo De La Ossa (2007) é uma espécie com um consumo de
matéria vegetal diversa. Os conteúdos estomacais analisados por Perez-Eman e Paolillo
(1977) apresentaram 36% em volume de frutos e sementes e 51,6% de peixes, sendo o
Podocnemididae que registra maior ingestão de matéria animal.
7
Figura 1 – Espécies de Podocnemididae analisadas. A: P. expansa; B: P. unifilis; C: P.
erythrocephala; D: P. sextuberculata; E: P. dumerilianus
2.2 Aspectos Gerais
A morfologia do tubo digestório está relacionada à função digestiva, sendo que os
hábitos alimentares aproximados e a dieta de um vertebrado geralmente podem ser
determinados a partir do sistema digestório, e ocasionalmente, sua estrutura é utilizada na
sistemática (Hildebrand e Goslow, 2006). É possível diagnosticar o regime alimentar de uma
espécie a partir de diferenças anátomo-fisiológicas do tubo digestório, o que fica evidenciado
quando se observa os formatos variados dos estômagos ou os diferentes comprimentos do
intestino (Godinho, 1970). Estudos comparativos indicam que existem diferenças distintas na
estrutura e função do tubo digestório entre herbívoros e carnívoros (Grady et al., 2005). Esses
autores sugerem que as diferenças na morfologia do intestino são governadas por diferenças
na estratégia na dieta.
Segundo a descrição feita por D`arce e Flechtmann (1985) em mamíferos, o tubo
digestório é um tubo musculomembranoso que se estende da boca ao ânus e glândulas anexas.
O estômago é uma dilatação do tubo digestório, situado na parte dorsal da cavidade
abdominal e à esquerda do plano mediano. Visto externamente é subdividido em cárdia, corpo
e piloro. A cárdia e o piloro se encontram bem próximos um do outro. Esta disposição
8
determina o aparecimento de um bordo bastante curto e côncavo entre a cárdia e o piloro, que
é conhecido com pequena curvatura, e o bordo oposto bem mais longo e convexo, conhecido
como grande curvatura.
A abertura esofágica, ou cárdica, mostra-se obliterada por numerosas dobras da
mucosa. A comunicação com o intestino delgado, o piloro, é provida de um espessamento da
musculatura circular, constituindo o esfíncter pilórico. O intestino delgado é um tubo longo,
todo dobrado em voltas ou circunvoluções, que se inicia no orifício pilórico. A sua porção
inicial, curta, fixa e bem delimitada, denomina-se duodeno. O restante é conhecido em
anatomia animal por jejuno-íleo. Este termina no intestino grosso onde se abre por meio de
um orifício circundado por uma saliência esta que constitui a válvula íleo-cecal. O intestino
grosso consiste em ceco, cólon e reto, mostrando grande variação quando se comparam as
diversas espécies (D`arce e Flechtmann, 1985).
Diversos trabalhos demonstram que existe correlação entre as estruturas do tubo
digestório e o hábito alimentar dos peixes (Fugi e Hahn, 1991). Segundo Fryer e Iles (1972),
o comprimento do intestino é claramente relacionado à categoria trófica em peixe, e o
comprimento é ordenado da seguinte maneira: carnívoro < onívoro < herbívoro < detritívoro.
O conhecimento de características morfofisiológicas do tubo digestório é essencial
para se compreender as modificações devido às adaptações a dietas e também para se obter
sucesso na criação (Curry, 1939; Al-Hussaini, 1949; Langille e Youson, 1984).
A análise do tubo digestório é importante na determinação da dieta em marsupiais e
em geral, o formato e o tamanho dos órgãos são funcionalmente adaptados (Crowe e Hume,
1997). O tamanho do intestino grosso é um bom indicador da dieta para pequenos mamíferos:
uma maior dimensão indica que a espécie tende a ser mais herbívora na dieta, e em contraste,
uma menor dimensão, indica ser mais carnívora. Por outro lado, o comprimento do intestino
delgado não ajuda a elucidar a atual dieta do animal (Schieck e Millar, 1985; Stevens e Hume,
1998). Segundo Junger et al. (1989), o comprimento intestinal menor indica uma tendência da
espécie a carnivoria. Além disso, herbívoros podem possuir especializações ausentes em
carnívoros como o ceco e válvulas intestinais.
A importância do intestino grosso varia segundo a espécie animal. Nos carnívoros, o
intestino grosso é de tamanho relativamente pequeno, apresentando pouca importância
digestiva, sendo o local onde simplesmente ocorre a recuperação da água que foi perdida com
9
as secreções digestivas. Para os herbívoros monogástricos, no entanto, o intestino grosso e,
em especial, o ceco, são de enorme importância digestiva. Aí ocorre a digestão bacteriana da
celulosa e outros carboidratos das forragens que, de outra maneira, não poderiam ser
aproveitados (D`arce e Flechtman, 1985).
Os répteis mostram alto grau de adaptação morfofisiológica aos seus hábitats, sendo o
tubo digestório característico para espécies herbívoras, onívoras e carnívoras, diferindo na
forma do estômago e em comprimento e volume do intestino delgado e intestino grosso
(Zentek e Dennert, 1997). De acordo com Hildebrand (1995); (Hildebrand e Goslow, 2006),
os répteis carnívoros têm um estômago simples, mas distensível, e o intestino tende a ser
curto. Enquanto a maioria dos répteis herbívoros tem um estômago grande e complexo, que
funciona como reservatório ou câmara fermentativa, com intestino relativamente longo.
2.2.1 Morfologia do tubo digestório em quelônios
De acordo com Parsons e Cameron (1977); Legler (1993) para quelônios em geral, o
esôfago é um tubo distensível e a mucosa consiste tipicamente de pregas longitudinais. Já
segundo Hildebrand (1995), o esôfago tende a ser ciliado se o alimento ingerido é mole e é
queratinizado em algumas tartarugas. Em tartarugas marinhas, o esôfago é revestido
internamente com papilas pontiagudas e queratinizadas (Rainey, 1981; Work, 2000;
Wyneken, 2001; Pressler et al., 2003; Magalhães, 2007; Magalhães et al., 2008).
O estômago em tartarugas marinhas está situado no lado esquerdo da cavidade
celomática (Work, 2000; Magalhães, 2007), é semelhante a uma bolsa e distintamente mais
largo do que partes adjacentes do intestino, com amplas rugosidades e pregas longitudinais na
sua mucosa (Parsons e Cameron, 1977; Legler, 1993). P. unifilis apresenta estômago dividido
em dois compartimentos por uma constrição, um proximal e outro distal (Pinto, 2006). Em P.
expansa, o estômago apresenta forma achatada, com a região pilórica bem desenvolvida e
encurvada (Oliveira et al., 1996; Santos et al., 1998).
Segundo Work (2000); Wyneken (2001), a mucosa do intestino delgado em muitas
tartarugas marinhas possui aparência de “favos de mel”. Entretanto, Magalhães (2007)
descreveu que, nas espécies Chelonia mydas, Lepdochelys olivacea, Caretta caretta e
Eretmochelys imbricata existem diferenças na mucosa do duodeno, jejuno e do íleo, sendo a
10
mucosa do duodeno marcada com pregas reticulares e do jejuno e íleo por pregas
longitudinais. Já na Dermochelys coriacea, todo o intestino delgado apresentou mucosa com
pregas reticulares. De acordo com Wyneken (2001) a transição entre as regiões do intestino
(duodeno, jejuno e íleo) é muitas vezes de difícil identificação e delimitação, onde para
confirmação o ideal é utilizar métodos histológicos. Em P. expansa (Oliveira et al., 1996;
Santos et al., 1998) e P. unifilis (Pinto, 2006) o intestino delgado é longo e enovelado.
O intestino grosso em tartarugas marinhas é marcado pela alternância de regiões
abauladas (haustros ou saculações) com ausência de pregas, e estreitamentos com pregas
retilíneas. A região referente ao reto apresentou pregas retilíneas evidentes (Magalhães,
2007). De acordo com Parsons e Cameron (1977) o padrão do cólon é muito difícil de
descrever porque raramente é distinto, e por ser distensível, o padrão das pregas pode
desaparecer completamente quando o cólno está cheio. Em P. expansa (Oliveira et al., 1996;
Santos et al., 1998) e P. unifilis (Pinto, 2006) inicia-se com uma dilatação, conhecida como
ceco.
Trabalhos publicados com histologia do tubo digestório em quelônios ainda são de
pouco conhecimento, tendo trabalhos apresentados em congressos com tartaruga marinha C.
mydas (Magalhães et al., 2008), com P. expansa (Oliveira et al., 1996), um relatório (Santos
et al., 1998), uma monografia com tartarugas marinhas (Magalhães, 2007), um artigo no prelo
com C. mydas (Magalhães et al. no prelo) e um artigo apenas com a descrição histológica do
esôfago (Vogt et al., 1998).
O esôfago foi descrito como apresentando epitélio estratificado pavimentoso para os
Podocnemididae (Vogt et al., 1998), estratificado pavimentoso queratinizado em C. mydas
(Magalhães, 2007; Magalhães et al. no prelo), epitélio colunar ciliado em P. expansa
(Oliveira et al., 1996) e estratificado colunar também em P. expansa (Santos et al., 1998).
Esse órgão apresentou-se aglandular em C. mydas (Magalhães, 2007; Magalhães et al., 2008)
em espécies da família Podocnemididae (Vogt et al., 1998) e em P. expansa (Santos et al.,
1998).
O estômago em P. expansa (Oliveira et al., 1996) e C. mydas (Magalhães, 2007)
apresenta glândulas gástricas com células secretoras e o intestino delgado mucosa com
inúmeras vilosidades e células caliciformes. O intestino grosso em P. expansa (Oliveira et al.,
1996) apresenta mucosa com muitas vilosidades revestida por um epitélio pseudoestratificado cilíndrico com células caliciformes em grande quantidade .
11
3 OBJETIVOS
3.1 Objetivo geral
Caracterizar a morfologia do tubo digestório nos segmentos esôfago, estômago,
intestinos delgado e grosso de cinco espécies da família Podocnemididae: Podocnemis
expansa, Podocnemis unifilis, Podocnemis erythrocephala, Podocnemis sextuberculata e
Peltocephalus dumerilianus, relacionando esses achados morfológicos com sua categoria
alimentar.
3.2 Objetivos específicos
1) Descrever a anatomia do tubo digestório;
2) Descrever a histologia dos órgãos do tubo digestório;
3) Comparar a morfometria dos intestinos delgado e grosso;
4) Comparar a anatomia e a histologia entre as espécies;
5) Relacionar a morfologia do tubo digestório das espécies analisadas à sua categoria
alimentar.
12
4 MATERIAL E MÉTODOS
4.1 Obtenção dos animais
O tubo digestório das espécies P. expansa e P. unifilis analisados foram de quelônios
provenientes de vida livre no âmbito do Projeto “Bases Técnico-Científicas e Protocólons de
Beneficiamento para a Implantação da Cadeia Produtiva de Jacarés e de Quelônios nas
Florestas Alagáveis de Várzea da Amazônia Central (Bajaquel) - CNPq/408760/2006-0”, em
nome de Ronis Da Silveira (Licenças IBAMA 11919-1, 11919-2, 14498-1, 14498-2). As
coletas foram desenvolvidas na várzea localizada na margem esquerda (em relação à
nascente) do Rio Purus, no limite norte da Reserva de Desenvolvimento Sustentável PiagaçuPurus e na área de várzea adjacente. Os tubos digestórios foram obtidos nos meses de abril,
agosto e setembro de 2008 e posteriormente tombados na Coleção de Anfíbios e Répteis do
Instituto Nacional de Pesquisas da Amazônia – INPA (Anexo 1).
Os exemplares de P. erytrhocephala, P. sextuberculata e P. dumerilianus foram
quelônios coletados para a Coleção de Anfíbios e Répteis do INPA (Licença 13347-1). P.
erytrhocephala são provenientes do rio Itu, Barcelos/AM (00º30'390"S; 063º12'876"W) e
próximos da Comunidade da Floresta I, Barcelos (01º22’171’’S; 061’39’769’’W), P.
sextuberculata das proximidades da Comunidade da Floresta I, Barcelos/AM (01º22’171’’S;
061’39’769’’W) e P. dumerilianus do rio Itu, Barcelos/AM (00º30’390’’S; 063’12’876’’ W).
Essas espécies foram obtidas nos meses de maio e setembro de 2008 e março de 2009. Todos
os exemplares estão tombados na Coleção de Anfíbios e Répteis do Instituto Nacional de
Pesquisas da Amazônia – INPA (Anexo 1).
As coletas foram realizadas com redes malhadeiras. Essas redes são formadas por três
malhas, duas laterais (firmes) e uma interna (solta) que formam uma espécie de saco quando
os quelônios são coletados. Cada malhadeira possui 100 m de comprimento, 2,5 m de altura e
distâncias entre nós de 10 ou 20 cm. As malhadeiras foram revisadas a cada três horas para
evitar afogamento dos animais (Vogt, 1980).
13
4.2 Biometria dos animais
Realizou-se a biometria de todos os espécimes analisados, sendo registrados os dados
individuais referentes ao comprimento retilíneo da carapaça (CRC) (Figura 2). A mensuração
foi realizada com auxílio de um paquímetro digital (precisão de 1mm). Essa medida foi
realizada para indicar as classes de tamanho de cada exemplar analisado. Ver tabela 1 as
médias do CRC de cada espécie.
Figura 2 – Representação da biometria do comprimento e da largura retilínea da carapaça. (adaptado
de Luz et al., 2003)
4.3 Processamento e análise da anatomia do tubo digestório
Parte do procedimento e análise anatômica foi realizada ainda em campo e parte no
Laboratório de Ecologia e Sistemática de Quelônios do Instituto Nacional de Pesquisas da
Amazônia – INPA.
Para o estudo anatômico foram utilizados 75 animais de comprimentos variados
agrupados em 15 exemplares de cada espécie, P. expansa, P. unifilis, P. erythrocephala, P.
sextuberculata e P. dumerilianus.
Os quelônios do projeto BAJAQUEL foram insensibilizados por resfriamento (gelo
em água, de 0 a 20º Celsius, por 15 minutos), segundo características fisiológicas e
14
comportamentais de reptilianos, e posteriormente abatidos através da secção da cabeça. Todos
esses processos seguiram normas mínimas de ética humanitária de produção animal, sendo
todas as etapas supervisionadas por dois Médicos Veterinários e por um biólogo do IBAMAAM, membros da Equipe Técnica do Projeto. (Licenças IBAMA 11919-1, 11919-2, 14498-1,
14498-2). Após dissecação o tubo digestório foi doado para análise.
O abate dos animais destinados a coleção foi realizado conforme os procedimentos
sugeridos por Silva Neto (1998). Para insensibilização dos animais, estes foram colocados em
um recipiente, contendo água e gelo a uma temperatura em torno de 5ºC, durante 20 minutos.
Para o abate foi realizada a secção da cabeça. (Licença 13347-1).
Os animais foram dissecados de acordo com a metodologia utilizada por Work (2000),
possibilitando análise de características morfológicas externas e internas do tubo digestório.
Para análise da disposição e morfologia dos órgãos digestórios, foram retirados além do
plastrão, os músculos peitorais, clavículas e cintura pélvica; ficando exposto todo o tubo
digestório, sendo assim realizada a descrição sobre a topografia de cada órgão na cavidade
celomática e também sua morfologia.
Para estudo da morfologia interna dos órgãos, o tubo digestório foi retirado
manualmente, em seguida, aberto com auxílio de uma tesoura e imerso em água, sendo as
partículas alimentares removidas para facilitar a visualização. Em seguida, foi realizada a
descrição morfológica interna de cada órgão, sendo descrito a presença de papilas, tipo e a
disposição das pregas da mucosa, e presença de esfíncteres. Para auxiliar na descrição
morfológica foram realizadas imagens fotográficas.
A medida do comprimento de cada órgão (esôfago, estômago, intestino delgado e
intestino grosso) foi realizada com o tubo digestório aberto, levando em consideração a
presença de esfíncteres, formato do órgão e mudança do padrão das pregas da mucosa, com o
auxílio de uma linha e de fita métrica flexível. A linha foi colocada percorrendo todo o tubo
digestório e na transição do órgão a linha era cortada e colocada sobre a fita métrica para
obtenção do comprimento em centímetros. Ver na tabela 1 a média do comprimento (cm) de
cada órgão (esôfago, estômago, intestino delgado e intestino grosso).
Ao fim de cada análise o material foi devidamente acondicionado, etiquetado e fixado
em solução aquosa de formol tamponado a 10%.
15
4.4 Preparação dos cortes histológicos para microscopia de luz
O processamento e a análise histológica, foram realizados no Laboratório de
Histologia do Departamento de Morfologia da Universidade Federal do Amazonas (UFAM) e
a coloração pelo método de PAS no Laboratório de Histologia do Departamento de
Morfologia da Universidade Federal do Rio Grande do Norte (UFRN).
Para esta análise foram utilizados três exemplares de cada espécie alvo. De cada
exemplar, foram retirados fragmentos de diferentes segmentos ao longo do tubo digestório,
conforme descritos a seguir:
- Regiões cranial e caudal do esôfago, referente à porção das papilas esofágicas e
pregas longitudinais, respectivamente (corte transversal);
- Transição do esôfago com o estômago (corte longitudinal);
- Regiões cranial, média e caudal do estômago equivalem às regiões: cárdica, fúndica
e pilórica (corte transversal);
- Região do esfíncter pilórico (corte longitudinal);
- Região referente ao duodeno, jejuno e íleo no intestino delgado (corte transversal);
- Transição do intestino delgado com o intestino grosso (corte longitudinal);
- Região referente ao ceco e ao cólon e reto no intestino grosso (corte transversal).
Ver figura 3.
16
Figura 3 – Figura esquemática demonstrando o local dos fragmentos retirados ao longo do tubo digestório para
análise histológica. ▌corte transversal; ▬ corte longitudinal.
O material foi acondicionado individualmente em frascos contendo solução aquosa de
formaldeído a 10% tamponado com fosfato de sódio 0,1M, pH 7,4 a 4oC. Após fixação, o
material foi lavado em água corrente para retirada do excesso do fixador e então submetido às
técnicas histológicas padrão (desidratação, diafanização e inclusão em parafina) (Maia, 1979)
(Anexo 2). Obtidos os blocos, foram preparados cortes de 5µm em micrótomo (slee Cut
4255), que eram levados à esfufa a 55°C. As lâminas posteriormente foram submetidas às
técnicas de coloração por Hematoxilina-Eosina - HE (Maia, 1979), Tricômio de Mallory
(Mallory, 1938) e Ácido Periódico de Schiff - PAS (Hooghwinkel e Smith, 1948) (Anexo 3).
Finalizada a coloração, procedeu-se a montagem definitiva das lâminas utilizando-se bálsamo
do canadá interface entre lâmina e lamínula. Em seguida, as lâminas confeccionadas foram
observadas ao microscópio de luz (Olympicos BX41), e imagens obtidas em microscópio
trinocular com iluminação transmitida (Axiostar Plus Zeiss) com câmera fotográfica digital
Canon PowerShot acoplada para posterior análise.
17
4.5 Análise estatística
As medidas do comprimento dos intestinos delgado e grosso foram utilizadas para
comparação estatística. As demais variáveis amostradas foram descritas através de média
aritmética e desvio-padrão.
Os comprimentos relativos do intestino delgado e do intestino grosso foram obtidos
pela divisão de cada uma dessas medidas pelo comprimento total do seu respectivo tubo
digestório. O coeficiente de variação dos intestinos delgado e grosso foi calculado baseado na
media aritmética e desvio padrão de cada espécie (CV = desvio padrão / média x 100). Para
evitar a heterocedasticidade das variáveis relacionada com percentagens e proporções (Zar,
1996) os dados foram submetidos à transformação arcosseno da raiz quadrada (Crowe e
Hume, 1997).
Os comprimentos dos intestinos delgado e grosso foram comparados em cada uma das
espécies estudadas através do Teste t de Student para amostras pareadas (Zar, 1996), com
nível de significância de 5%.
Foram analisados os valores relativos dos comprimentos dos intestinos delgados e
grossos entre as cinco espécies estudadas. Essas variáveis foram submetidas ao teste de
homogeneidade de variância de Levene. Os valores referentes ao intestino delgado não se
mostraram heterocedásticos, sendo comparados pelo testes não paramétricos de KruskalWallis para a variância e de Dwass-Steel-Critchlow-Fligner para comparação das médias
(Critchlow e Fligner, 1991). Os valores relativos do intestino grosso mostraram-se
homocedásticos, sendo comparados por análise de variância unifatorial e em seguida
submetidos ao teste de Tukey para amostras de tamanhos diferentes (Zar, 1996).
18
5 RESULTADOS
Nesse estudo foi descrita a morfologia dos segmentos do tubo digestório, esôfago,
estômago, intestino delgado e intestino grosso de cinco espécies de Podocnemididae.
5.1 Esôfago
O esôfago nas cinco espécies analisadas apresentou-se com um órgão tubular
músculo-membranáceo. Os comprimentos do esôfago de cada espécie estudada estão
descritos na tabela 1. Em P. expansa, P. unifilis e P. erythrocephala o esse órgão encontrouse localizado medianamente na região cervical e sofre um desvio lateral à direita na região
celomática, unindo-se ao cárdia (Figura 4). Em P. sextuberculata e P. dumerilianus o esôfago
também se encontrou localizado medianamente na região cervical, e na região celomática
sofre um desvio à esquerda, quando se une ao cárdia (Figura 5). A mucosa esofágica mostrouse dividida e caracterizada por duas regiões distintas.
Figura 4 – Disposição do esôfago encontada em P. expansa, P.unifilis e P. erythrocephala. e: esôfago; s:
estômago; (→) transição esôfago-estômago.
19
Figura 5 – Disposição do esôfago encontrada em P. dumerilianus. e: esôfago; s: estômago; (→) transição
esôfago-estômago.
A primeira região esofágica, mais curta, localizada na região cervical foi caracterizada
por pequenas papilas cônicas, as papilas esofágicas, orientadas no sentido do estômago
(Figura 6).
Histologicamente, as papilas esofágicas eram formadas pela projeção da mucosa e da
submucosa do esôfago. Nas cinco espécies analisadas, a mucosa foi revestida por dois tipos
distintos de epitélio, epitélio estratificado pavimentoso (Figura 7B; 7H) e epitélio estratificado
cilíndrico (Figura 7A; 7C; 7D; 7F; 7G), porém em P. erythrocephala ao invés de cilíndrico
foi observado epitélio cúbico alto (Figura 7E). O epitélio estratificado pavimentoso
localizava-se nas regiões apicais das papilas, enquanto o epitélio estratificado cilíndrico
distribuía-se nas demais áreas como pode ser observado na porção superior da Figura 7D. O
elemento com predominância no epitélio estratificado cilíndrico foram células superficiais
mucosas, que são células cilíndricas alongadas com reação positiva ao PAS (Figura 7A; 7C;
7E), dispostas de forma homogênea na região apical do epitélio. Estavam presentes
20
numerosas células secretoras, caracterizadas
como células ovaladas que reagem
irregularmente ao PAS (Figura 7A; 7C) e células caliciformes, caracterizadas com células
globosas, mas às vezes ovaladas, que reagem positivamente ao PAS (Figura 7E), ambas
disposta de forma não homogênea no epitélio.
Não foi evidenciada a muscular da mucosa. A submucosa era aglandular, constituída
de tecido conjuntivo frouxo (Figura 7).
A coloração pelo método de Tricômio de Mallory indicou ausência de camada
muscular contínua, e sim camada disposta em feixes de músculo intercalados com feixes de
conjuntivo frouxo. Em alguns cortes foi possível diferenciar as duas subcamadas, a camada
circular interna e a camada longitudinal externa, ambas de músculo liso. (Figura 7I; 7J; 7L).
Presença de plexo mioentérico entre as camadas circular e longitudinal da camada muscular
(Figura 7M).
A segunda região, localizada na região celomática, constituiu quase todo o órgão, foi
caracterizada por apresentar em sua superfície interna pregas longitudinais elevadas,
ligeiramente onduladas e um pouco espaçadas entre si (Figura 6). Observou-se, também, que
quanto maior o animal, mais desenvolvidas as papilas esofágicas e mais evidentes as pregas
longitudinais.
Histologicamente essa região apresentou mucosa pregueada constituída por epitélio
estratificado cilíndrico, com predominância de células superficiais mucosas cilíndricas
alongadas (Figura 8C; 8E; 8F). As células superficiais mucosas apresentaram-se mais
alongadas que na primeira região, dando a impressão que a camada de muco estava mais
espessa, demonstrado pela atividade através do PAS (Figura 8B; 8D; 8E). Foi identificada a
presença de tecido linfóide associado à lâmina própria (GALT). Nesta região também não foi
observado à muscular da mucosa.
A Submucosa também era aglandular, formada por tecido conjuntivo frouxo e bem
vascularizada (Figura 8). A camada muscular própria seguiu o mesmo padrão da primeira
região do esôfago (figura 8G; 8H). Ainda, externamente, o esôfago era contínuo pela túnica
adventícia exceto próximo a região cárdica onde recebe um revestimento mesotelial seroso.
Não foi averiguado um esfíncter no limite de transição entre esôfago e estômago,
contudo macroscopicamente existe uma simples constrição e mudança da coloração mais
clara do esôfago, para avermelhada do estômago, quando no animal in vivo. Internamente
21
ocorre mudança da mucosa, de pregas longitudinais no esôfago para transversais no estômago
em P. expansa, P. unifilis e P. erytrhocephala, e para pregas longitudinais espaçadas em P.
sextuberculata e P. dumerilianus (Figura 7). Histologicamente é perceptível a transição pela
mudança da mucosa esofágica pregueada para a mucosa com fossetas gástricas e da
substituição do epitélio estratificado cilíndrico pelo epitélio cilíndrico simples.
22
Figura 6 - Mucosa esofágica em Podocnemididae. Primeira porção caracterizada pela presença de papilas
esofágicas (→); Segunda porção caracterizada pela presença de pregas longitudinais (
). A: P. expansa. B: P.
unifilis. C: P. erythrocephala. D: P. sextuberculata. E: P. dumerilianus.
23
Figura 7 – Fotomicrografia da primeira porção do esôfago caracterizada pela presença de papilas esofágicas em
Podocnemididae. A: Epitélio estratificado cilíndrico em P. expansa. (→): células superficiais mucosas; a: célula
caliciforme; b: célula secretora; c: submucosa - PAS. B: Epitélio estratificado pavimentoso em P. expansa. d:
epitélio estratificado pavimentoso; e: submucosa - HE. C: Epitélio estratificado cilíndrico em P. unifilis. (→):
células superficiais mucosas; f: célula secretora; g: submucosa - PAS. D: Em P. unifilis. h: epitélio estratificado
pavimentoso; i: epitélio estratificado cilíndrico; j: célula caliciforme - HE. E: Epitélio estratificado cúbico alto
em P. erythrocephala. (→): células superficiais mucosas; k: célula caliciforme - PAS. F: Epitélio estratificado
cilíndrico em P. sextuberculata. (→): células superficiais cilíndricas mucosas; l: Célula caliciforme ; m: epitélio
estratificado cilíndrico - HE. Aumento todas as fotos: 400X
24
Continuação Figura 7 - Fotomicrografia da primeira porção do esôfago caracterizada pela presença de papilas
esofágicas em Podocnemididae. G: Epitélio estratificado cilíndrico em P. dumerilianus. n: células superficiais
cilíndricas mucosas; o: submucosa - PAS. Aumento: 400X. H: Epitélio estratificado pavimentoso em P.
dumerilianus (→) - PAS. Aumento: 400X. I: Camada muscular (→) em P. expansa; p: submucosa- HE.
Aumento: 50X. J. Camada muscular (→) em P. erythrocephala; q: epitélio; r: submucosa; s: feixes de tecido
conjuntivo entre as fibras musculares - HE. Aumento: 100X. L: Camada muscular (→); t: feixes de tecido
conjuntivo entre as fibras musculares – TM. Aumento: 100X . M: Plexo mioentérico (→) em P. sextuberculata. HE. Aumento: 100X.
25
Figura 8 – Fotomicrografia da segunda porção do esôfago caracterizada pela presença de pregas longitudinais
em Podocnemididae. A: Mucosa esofágica pregueada em P. erythrocephala - TM. Aumento: 50X. Nas imagens
de B a D: observa-se o epitélio estratificado cilíndrico com células superficiais mucosas alongadas, característico
desta região nas espécies P. expansa, P. unifilis, P. erythrocephala, respectivamente (→). a: pregas esofágicas;
b: epitélio; c: submucosa; d: camada muscular. B; D – PAS. C – HE. Aumento B a D: 400X
26
Continuação Figura 4 – Fotomicrografia da segunda porção do esôfago caracterizada pela presença de pregas
longitudinais em Podocnemididae. Nas imagens de E e F: observa-se o epitélio estratificado cilíndrico com
células superficiais mucosas alongadas, característico desta região nas espécies P. sextuberculata e P.
dumerilianus, respectivamente (→). c: submucosa; d: camada muscular. E – PAS. F – HE. Aumento E e F:
400X. G: Camada muscular em P. expansa - HE. Aumento: 100X. H: camada muscular em P. dumerilianus. c:
submucosa; d: camada muscular circular interna; e: camada muscular longitudinal externa; f: tecido conjuntivo TM. Aumento: 50X.
27
5.2 Estômago
Para as cinco espécies analisadas foram evidenciados três padrões anatômicos
diferentes para o estômago.
O primeiro padrão observado em P. expansa, P. unifilis e P. erytrhocephala, o
estômago apresentou-se formado por duas porções bem evidentes, separadas por uma
constrição com pregas longitudinais em sua mucosa. A primeira porção é a mais volumosa,
localizada medianamente e ligeiramente deslocada para esquerda na cavidade celomática.
Compreende praticamente todo o órgão, e é composta pelas regiões cárdica e fúndica (Figura
9A; 9B; 9C). A região cárdica foi caracterizada como sendo a primeira porção, logo após o
esôfago, e a região fúndica ou corpo, a seguir, compreende todo o restante do órgão (Figura
9A; 9B; 9C). Internamente, as duas regiões são caracterizadas pela presença de pregas
transversais em toda sua mucosa (Figura 10A; 10B; 10C).
A segunda porção estomacal se curva para direita logo abaixo da primeira, sendo
formada pela região pilórica bem desenvolvida (Figura 9A; 9B; 9C). Internamente, sua
mucosa é marcada por pregas longitudinais elevadas (Figura 10A’; 10B’; 10C’).
O segundo padrão encontrado, observado em P. sextuberculata, o estômago estava
localizado no antímero esquerdo do animal e apresentou forma de “J” de aspecto saculiforme
com fundo cego. Do esôfago, inicialmente o estômago se curva discretamente para a direita,
sendo a porção inicial formada pela região cárdica, seguida por uma grande bolsa, a região
fúndica ou corpo, com a curvatura maior localizada do lado esquerdo; dando continuidade à
região pilórica, ascendente e curvada para a direita (Figura 9D). Internamente, sua mucosa é
constituída, em toda extensão, por diversas dobras elevadas no sentido longitudinal,
conferindo um aspecto pregueado (Figura 10D).
No terceiro padrão, observado em P. dumerilianus o estômago, localizado à esquerda
da cavidade celomática do animal, apresentou forma de ferradura curvada de aspecto
saculiforme de fundo cego. A partir da porção caudal do esôfago, curva-se para a esquerda
inicialmente formando a região cárdica, em seguida forma uma grande bolsa, a região fúndica
ou corpo, e por fim a região pilórica constitui uma pequena área curvada para a direita (Figura
9E). Internamente a mucosa foi marcada pela presença de dobras longitudinais elevadas
(Figura 10E).
28
Figura 9 - Padrões anatômicos encontrados para o estômago em Podocnemididae. c: região cárdica; f: região
fúndica; p: região pilórica. A; B; C: estômago dividido em duas porções por uma constrição (→) em P. expansa,
P. unifilis e P. erythrocephala, respectivamente; D: estômago em forma de “J” em P. sextuberculata; E:
estômago em forma de ferradura encurvada em P. dumerilianus.
29
Figura 10 - Mucosa do estômago. A: Mucosa da primeira porção do estômago da P. expansa com pregas
transversais; A’: Mucosa da segunda porção do estômago da P. expansa com pregas longitudinais; B: Mucosa da
primeira porção do estômago da P. unifilis com pregas transversais; B’: Mucosa da segunda porção do estômago
da P. unifilis com pregas longitudinais; C: Mucosa da primeira porção do estômago da P. erythrocephala com
pregas transversais; C’: Mucosa da segunda porção do estômago da P. erythrocephala com pregas longitudinais.
(►) transição entre a primeira e a segunda porção do estômago. D: Mucosa do estômago da P. sextuberculata
com pregas longitudinais; E: Mucosa do estômago do P. dumerilianus com pregas longitudinais. (→): transição
esôfago-estômago.
30
Os comprimentos do estômago de cada espécie estudada estão descritos na tabela 1.
Histologicamente em todas as espécies o estômago apresentou mucosa pregueada
revestida por epitélio cilíndrico simples, constituído por células superficiais mucosas
cilíndricas que são PAS positivas (Figuras 11, 12 e 13). Essas células podem variar de
tamanho sendo maiores nos ápices das fossetas, e menores ao constituir as criptas. Em P.
expansa, P. unifilis e P. erythrocephala, não ocorreu formação de fossetas nas regiões cárdica
e fúndica do estômago e sim pequenas pregas secundárias, onde as células superficiais
mucosas encontram-se distribuídas homogeneamente por todo o epitélio.
Em P. sextuberculata e P. dumerilianus, que apresentam criptas ou fossetas gástricas,
as mesmas estiveram dispostas regularmente por toda a mucosa, diferenciando-se em tamanho
e profundidade dependendo da região. Estas fossetas são invaginações do epitélio que
estabelecem comunicação com a porção secretora das glândulas tubulares gástricas. As
glândulas gástricas quando presentes localizaram-se apenas na lâmina própria. A muscular da
mucosa apresentou-se bem evidente em todas as regiões do estômago e a submucosa foi
constituída por tecido conjuntivo frouxo rico em vasos sanguíneos (Figuras 11, 12 e 13).
Na região cárdica de P. expansa, P. unifilis e P. erythrocephala o epitélio de
revestimento recobre pequenas pregas secundárias, e não origina criptas ou fossetas (Figura
11A, 11C, 11E). Não foram encontradas glândulas gástricas nesta região. Células caliciformes
foram evidenciadas nessas três espécies - PAS positivas (Figura 11B; 11D). A região fúndica
seguiu o mesmo padrão da cárdica para estas espécies, sendo também encontradas células
caliciformes PAS positiva (Figura 12A; 12B; 12C; 12D; 12E). A região pilórica apresentou
fossetas relativamente profundas, com uma grande quantidade de glândulas tubulares longas e
simples (Figura 13A; 13B; 13C; 13D).
As espécies P. sextuberculata e P. dumerilianus apresentavam a região cárdica com
mucosa bem desenvolvida, com numerosas fossetas gástricas de pequena profundidade e com
glândulas tubulares longas e simples, ocupando toda a lâmina própria (Figura 11F; 11G;
11H). A região fúndica apresentou o mesmo padrão que a cárdica, porém aparentemente com
fossetas mais profundas e glândulas longas e simples (Figura 12F). Ambas as regiões
apresentaram uma grande quantidade de glândulas. A região pilórica, diferentemente das
outras regiões, possui fossetas mais profundas com glândulas tubulares simples e curtas,
podendo apresentar também glândula tubular enovelada (Figura 13E; 13F; 13G; 13H).
31
A camada muscular no estômago variou nas três regiões. Em algumas espécies foi
verificada a presença de duas camadas musculares, uma circular interna e uma longitudinal
externa. Enquanto, que em outras foi verificado uma terceira camada, uma camada muscular
oblíqua entre a circular e a longitudinal. Sendo evidente que na região pilórica a camada
muscular se apresenta mais espessa do que nas outras regiões.
Externamente, o estômago é recoberto por uma membrana serosa.
Figura 11- Fotomicrografia da região cárdica do estômago em Podocnemididae. A: Pequenas pregas secundárias
sem formação de fossetas em P. expansa. a: pregas; b: muscular da mucosa; c: submucosa - HE. Aumento: 50X.
B: Células caliciformes presentes no epitélio em P. expansa (→). d: epitélio - PAS. Aumento: 400X. C:
Pequenas pregas secundárias sem formação de fossetas em P. erythrocephala. e: pregas; f: submucosa - HE.
Aumentov 100X. D: Células caliciformes presentes no epitélio em P. erythrocephala (→) – PAS. Aumento:
400X.
32
Continuação Figura 11- Fotomicrografia da região cárdica do estômago em Podocnemididae. E: Pequenas
pregas secundárias sem formação de fossetas em P. unifilis. g: pregas - PAS. Aumento: 100X. F: Região das
fossetas e glândulas gástricas em P. sextuberculata. (→): fosseta gástrica; (*): epitélio cilíndrico simples com
células superficiais mucosas; h: região das glândulas gástricas - PAS. Aumento: 100X. G: Em P. dumerilianus. i:
região das glândulas gástricas; j: muscular da mucosa - HE. Aumento 50X. H: Região das fossetas e glândulas
gástricas em P. dumerilianus. (→): fosseta gástrica; l: região das glândulas gástricas - PAS. Aumento: 100X.
33
Figura 12 – Fotomicrografia da região fúndica do estômago em Podocnemididae. A: Pequenas pregas
secundárias sem formação de fossetas em P. expansa. a: pregas; b: muscular da mucosa; c: submucosa - PAS.
Aumento: 100X. B: Células caliciformes presentes no epitélio em P. expansa (→) - PAS. Aumento: 400X. C:
Pequenas pregas secundárias sem formação de fossetas em P. erythrocephala. d: pregas; e: epitélio cilíndrico
simples; f: muscular da mucosa – HE. Aumento: 100X. D: Células caliciformes presentes no epitélio em P.
erythrocephala (→) - PAS. Aumento: 400X. E: Pequenas pregas secundárias sem formação de fossetas em P.
unifilis. g: pregas; (→): célula caliciforme - HE. Aumento: 400X. F: Região das fossetas e glândulas gástricas
em P. dumerilianus. (→): fosseta gástrica; h: região das glândulas gástricas; i: muscular da mucosa; j:
submucosa - PAS. Aumento: 100X.
34
Figura 13 – Fotomicrografia da região pilórica do estômago em Podocnemididae. A: Fossetas e glândulas
pilóricas em P. expansa. (→): fosseta; a: glândulas; b: muscular da mucosa; c: submucosa - PAS. B: Região das
glândulas pilóricas em P. unifilis - HE. C: Fossetas gástricas em P. unifilis (→) - PAS. D: Fossetas gástricas em
P. erythrocephala (→). (*): células superficiais mucosas. Aumento A e B: 100X. Aumento C e D: 400X.
35
Continuação Figura 13 - Fotomicrografia da região pilórica do estômago em Podocnemididae. E e F: Fossetas e
glândulas pilóricas em P. sextuberculata. (→): fosseta; d: glândulas; e: muscular da mucosa; f: submucosa. E –
HE. F – PAS. G: Fossetas gástricas e glândulas pilóricas em P. dumerilianus. (→): fossetas; g: glândulas - PAS.
H: Região das glândulas pilóricas em P. dumerilianus - PAS. Aumento E a G: 100X. Aumento H: 400X.
36
A transição do estômago para o intestino delgado nas cinco espécies estudadas se deu
pela presença de um espessamento muscular circular, caracterizando o esfíncter pilórico. Esse
esfíncter é bem evidente em P. expansa, P. unifilis e P. erythrocephala, porém em P.
dumerilianus e P. sextuberculata esse esfíncter é menos expressivo (Figura 14).
Histologicamente na região do esfíncter ocorre um espessamento da submucosa e da camada
muscular própria, e ocorre mudança da mucosa com fossetas estomacais para as vilosidades
intestinais.
Figura 14 - Esfincter pilórico (→). s: estômago; d: duodeno. A: P. expansa. B: P. unifilis. C: P. erythrocephala.
D: P. dumerilianus.
37
5.3 Intestino Delgado
Em todas as espécies analisadas, o intestino delgado (ID) consistiu de um tubo longo,
fino e enovelado. A primeira alça intestinal originou-se a partir do esfíncter pilórico, como
uma região retilínea e curta da esquerda para a direita. Em seguida descende se tornando um
órgão
enovelado,
localizado
à
direita
na
cavidade
celomática
(Figura
15).
Macroscopicamente, não foi possível a delimitação exata de cada região do ID (duodeno,
jejuno e íleo) por não possuírem limites de demarcação definidos. Desta forma, neste estudo
foram consideradas regiões cranial, média e caudal para as análises do duodeno, jejuno e íleo,
respectivamente. A primeira região, retilínea, foi considerada como duodeno e a parte mais
longa e enovelada, jejuno/íleo (Figura 15). Os comprimentos (cm) do ID de cada espécie
estudada estão descritos na tabela 1. Ver tabela 2 para comparação do tamanho proporcional
(%) do ID entre as espécies.
A região cranial apresentou pregas reticulares (Figura 16A; 16A’), e a região média
apresentou pregas longitudinais baixas em zigue-zague (Figura 16B). No entanto, não foi
claramente observado o local exato de transição das pregas reticulares para aquelas em ziguezague. Na região caudal as pregas longitudinais em zigue-zague eram altas e bem evidentes
(Figura 16C; 16C’).
Figura 15 - Intestino delgado. A: P. erythrocephala. B: P. sextuberculata. s: estômago; d: duodeno, primeira
região do intestino delgado caracterizado como uma porção curta; j/i: jejuno/íleo, região do intestino delgado
caracterizada como longa e enovelada; ig: intestino grosso.
38
Figura 16 - Mucosa do intestino delgado. Em A: Região cranial com pregas reticulares na P. expansa; e A’ na
P. unifilis. B: Região medial com pregas longitudinais em zigue-zague baixas em P. expansa. C: Região caudal
com pregas longitudinais em zigue-zague altas e bem evidentes na P. expansa e em C’: na P. unifilis.
39
Histologicamente o intestino delgado de todas as espécies apresentou mucosa
constituída por vilosidades revestida por epitélio cilíndrico simples, com células caliciformes
dispersas nas vilosidades, as quais reagem fortemente ao PAS. A lâmina própria e a
submucosa aglandular, foram formadas por tecido conjuntivo frouxo. A muscular da mucosa
foi constituída de uma fina camada de músculo liso.
Cada região (cranial, média e caudal) foi diferenciada pelo padrão de suas vilosidades
e pela quantidade de células caliciformes. Ocorreu padrão semelhante para todas as espécies,
havendo diferenças de altura. O duodeno apresentou vilosidades filiformes e alongadas, sendo
encontradas vilosidades simples e ramificadas. Em algumas espécies mostravam-se mais
alongadas que em outras (Figura 17). O jejuno apresentou vilosidades menores que as
duodenais, porém não seguiu um padrão contínuo, ocorrendo alternância de vilosidades
foliáceas, ramificadas e digitiformes (Figura 18). O íleo apresentou vilosidades baixas e com
base larga, com aspecto fungiforme, no entanto algumas vilosidades mostraram-se
ramificadas, e também convolutas (Figura 19). A quantidade de células caliciformes
aumentou em direção ao íleo.
A camada muscular é composta pela camada circular interna e pela longitudinal
externa, sendo a primeira mais espessa que a segunda, ambas de fibras musculares lisas.
Limitando o órgão externamente encontrou-se a serosa.
A delimitação do intestino delgado para o intestino grosso se deu pela presença de um
espessamento muscular, caracterizando um esfíncter ileocecal (Figura 20).
40
Figura 17 – Fotomicrografia das vilosidades do duodeno em Podocnemididae. A: Em P. expansa. a: simples; b:
ramificada - PAS. B: Vilosidades filiformes em P. erythrocephala - HE. C: Vilosidades filiformes em P.
dumerilianus - PAS. D: Células caliciformes presentes nas vilosidades (↔) em P. dumerilianus - PAS. Aumento
A a C: 100X. Aumento D: 400X.
41
Figura 18 – Fotomicrografia das vilosidades do jejuno em Podocnemididae. Observar alternância de vilosidades
foliáceas, ramificadas e digitiformes. A: Em P. expansa – HE. B: Em P. unifilis – HE. C: Em P. sextuberculata.
a: vilosidade digitiforme; b: vilosidade ramificada; c: vilosidade foliácea - PAS. Aumento de todas as fotos: 50X.
42
Figura 19 – Fotomicrografia das vilosidades do íleo em Podocnemididae. A: Vilosidades fungiformes baixas em
P. sextuberculata - HE. Aumento: 50X. B: Vilosidades ramificadas em P. sextuberculata - TM. Aumento: 100
X. C: Vilosidades convolutas em P. dumerilianus - PAS. Aumento 50X. D: Células caliciformes presentes no
íleo em P. dumerilianus (→) - PAS. Aumento: 400X.
43
5.4 Intestino Grosso
Em P. expansa, P. unifilis e P. erythrocephala o intestino grosso iniciou-se com uma
dilatação bem evidente, o ceco, com presença de pregas transversais em sua mucosa. Segue
em uma região reta e tubular, constituindo o cólon/reto, com pregas longitudinais onduladas
em sua mucosa, demonstrando às vezes um padrão irregular das pregas (Figura 20A; 20B).
Diferente, em P. sextuberculata e P. dumerilianus, o intestino grosso não apresenta
um ceco evidente (dilatação), seguindo de uma região tubular. Nestas espécies o intestino
grosso, a partir do esfíncter ileocecal, aumenta de diâmetro em relação ao intestino delgado,
mantendo constate o diâmetro até a cloaca. Internamente apresenta pregas transversais em sua
mucosa (Figura 20C; 20D; 20E).
Os comprimentos (cm) do IG de cada espécie estudada estão descritos na tabela 1. Ver
tabela 2 para comparação do tamanho proporcional (%) do IG entre as espécies.
44
Figura 20 - Intestino grosso. A: Padrão encontrado em P. expansa, P. unifilis e P. erythrocephala. Intestino
grosso iniciando com uma dilatação, cc: ceco, e seguindo com uma região reta e tubular, c/r: cólon/reto. B:
Mucosa do ceco com pregas transversais (→); mucosa do cólon/reto com pregas longitudinais onduladas (
).
C e D Padrão encontrado em P. sextuberculata e P. dumerilianus, respectivamente. Intestino grosso formado por
uma região tubular. E: Mucosa do intestino grosso em P. dumerilianus com pregas transversais. id: intestino
delgado; ig: intestino grosso. Região circulada refere-se ao esfíncter ileocecal.
45
A histologia de todas as espécies seguiu padrão semelhante. O ceco e o cólon/reto
apresentaram mucosa pregueada com pregas primárias e secundárias. A mucosa foi revestida
por epitélio cilíndrico simples, com numerosas células caliciformes e uma camada de muco
evidente, reagindo fortemente ao PAS (Figura 21 e 22).
A lâmina própria e a submucosa mostraram-se aglandulares, compostas de tecido
conjuntivo frouxo, bastante vascularizado e com linfócitos associados formando agregados
linfóides na lâmina própria.
A camada muscular própria foi composta por uma camada circular interna e
longitudinal externa, ambas de fibras musculares lisas. A camada circular apresentou-se mais
espessa que a longitudinal. No reto os feixes de músculo da camada muscular longitudinal
externa se congregaram em faixas formando as tênias (Figura 22)
Figura 21 – Fotomicrografia da região proximal do intestino grosso. A: Região referente ao ceco em P. expansa.
a: mucosa pregueada; b: camada muscular - HE. Aumento: 50X. B: Região proximal do intestino grosso em P.
sextuberculata. (→): prega primária; c: pregas secundárias; d: submucosa - PAS. Aumento: 50X. C: Presença de
células caliciformes na região proximal do intestino grosso em P. dumerilianus (→). e: epitélio cilíndrico
simples - PAS. Aumento: 400X.
46
Figura 22 – Fotomicrografia da região do reto. A: Mucosa pregueada e submucosa formada por tecido
conjuntivo frouxo em P. unifilis. a: mucosa pregueada com células caliciformes; b: submucosa; c: camada
muscular circular interna; d: camada muscular longitudinal externa formando tênias - PAS. Aumeto: 100X. B:
Camada muscular do reto em P. expansa - HE. Aumento: 50X.
Foram observadas diferenças significativas (p<0,05) no comprimento dos intestinos
delgado e grosso em relação ao tubo intestinal para as cinco espécies de Podocnemididae
(Tabela 2). P. dumerilianus apresentou o intestino grosso relativamente maior entre as
espécies de Podocnemididae avaliadas. O maior e o menor comprimento relativo do intestino
delgado foram observados na P. sextuberculata e P. dumerilianus, respectivamente. As
espécies P. expansa, P. unifilis e P. erythrocephala não apresentaram diferenças (p>0,05)
entre si na proporção em relação ao tubo intestinal possuindo valores medianos entre as duas
espécies anteriores.
Para todas as cinco espécies o intestino delgado foi proporcionalmente maior que o
grosso (p < 0,0001). O intestino delgado apresentou uma menor variação no tamanho em
relação ao intestino grosso (p<0,0001) das Podocnemididae estudadas.
Ver tabela 2 para os resultados das análises estatísticas.
47
Tabela 1 - Médias do Comprimento (cm) da Carapaça (CC) e dos órgãos do tubo digestório – esôfago,
estômago, intestino delgado (ID) e intestino grosso (IG) nas espécies de Podocnemididae.
Espécie
CC
Esôfago
Estômago
ID
IG
P. expansa
29,98±2,85
9,32±3,13
22,84±4,32
47,90±13,58
12,25±3,35
P. unifilis
37,29±4,90
10,99±2,80
37,88±11,99
81,39±16,34
22,84±7,81
P. erythrocephala
24,62±2,67
7,87±0,95
20,25±5,81
44,37±14,23
10,50±3,83
P. sextuberculata
22,53±1,38
10,00±1,46
8,07±1,11
44,91±7,47
10,38±2,61
P. dumerilianus
29,39±2,65
12,31±1,20
12,81±2,42
37,82±4,50
21,61±2,77
Média ± Desvio Padrão
Tabela 2: Tamanho proporcional* (%) dos intestinos delgado e grosso para cinco espécies da família de
Podocnemididae.
INTESTINO DELGADO
%
INTESTINO GROSSO
%
TESTE t
P. expansa
51,41±8,96 a
13,39±3,55 A
p < 0,0001
P. unifilis
52,57±5,35 a
14,47±3,34 A
p < 0,0001
P. erythrocephala
52,91±4,20 a
12,60±2,46 A
p < 0,0001
P. sextuberculata
61,34±2,47 b
14,13±2,47 A
p < 0,0001
P. dumerilianus
44,68±4,16 c
25,62±3,42 B
p < 0,0001
CV T
14,46
35,72
p < 0,0001
CV D
12,70
22,03
p < 0,0001
ESPÉCIE
*Média ± desvio padrão
Letras minúsculas diferentes na coluna indicam, diferença (p<0,05) pelo teste de Dwass-Steel-Chritchlow-Fligner
Letras maiúsculas diferentes na coluna indicam, diferença (p<0,05) pelo teste de Tukey para amostras de tamanho desigual.
CV: coeficiente de variação; T: todas as espécies ; D: todas as espécies excluindo P. dumerilianus
48
6 DISCUSSÃO
Para todas as espécies estudadas a mucosa esofágica mostrou-se caracterizada por
duas regiões bem distintas. A primeira região com papilas esofágicas orientadas no sentido do
estômago e a segunda com pregas longitudinais. Essas papilas também foram descritas por
Vogt et al. (1998) para as cinco espécies de Podocnemididade, porém foram ausentes para
espécies de Chelidae. A presença dessa região com papilas, esta possivelmente associada com
o peculiar comportamento alimentar de neustofagia empregada por P. unifilis (Belkin e Gans,
1968) e outras espécies de Podocnemis (Rhodin et al., 1981). As papilas esofágicas também
estão presentes em todas as tartarugas marinhas (Parsons e Cameron, 1977; Bjorndal, 1985;
Work, 2000, Wyneken, 2001, Magalhães, 2007, Magalhães et al. no prelo). Entretanto, ao
contrário do que ocorre em Podocnemididae essas papilas se estendem até a transição com o
estômago. A orientação das mesmas sugere que elas podem facilitar na ingestão do alimento e
evitar sua regurgitação do estômago devido à mudança de pressão durante o mergulho
(Bleakney, 1965; Porter, 1972; Work, 2000; Wyneken, 2001; Pressler, 2003).
A presença de pregas longitudinais na mucosa esofágica já havia sido descrita por
diversos
autores
(Porter,
1972;
Legler,
1993;
Zug
et
al.,
2001),
aumentando
significativamente o diâmetro do esôfago para garantir a capacidade de dilatação do órgão
adequando-o para a condução do alimento ao estômago. Menin (1988) propôs que o padrão da
mucosa, se mais ou menos pregueada, levaria a maior ou menor capacidade de deglutição. No
Caiman crocodilus (jacaré-tinga) e no Chelus fimbriatus (matamatá), que engolem presas
grandes e inteiras, foi verificada uma mucosa esofágica bem pregueada (obs. pessoal). Então,
o padrão pregueado longitudinalmente das espécies de Podocnemididae estudadas pode ser
relacionado ao fato de que nas análises anatômicas foram encontradas muitas sementes
grandes e inteiras.
Vogt et al. (1998) descreveu o epitélio esofágico dos Podocnemididae como sendo
estratificado pavimentoso. Entretanto, Oliveira et al. (1996) descreveu para P. expansa como
sendo colunar ciliado, enquanto que para a mesma espécie Santos et al. (1998) descreveu que
era estratificado colunar. Porém no presente estudo foi verificado na primeira região esofágica
a presença de dois tipos distintos de epitélio, na porção mais apical das papilas um epitélio
estratificado pavimentoso como descrito por Vogt (1998), e no restante da papila e na maior
parte da mucosa, epitélio estratificado cilíndrico mucoso como encontrado por Santos et al.
49
(1998), e em P. sextuberculata estratificado cúbico alto. Enquanto que na segunda região toda
a mucosa foi revestida por epitélio estratificado cilíndrico mucoso.
Segundo Humbert et al. (1984), o epitélio do tipo estratificado pavimentoso funciona
como uma importante camada protetora contra agressões mecânicas e invasão bacteriana.
Como uma das funções das papilas esofágicas, presentes nas espécies estudadas, é evitar a
regurgitação do alimento do estômago, esse tipo de epitélio presente no ápice das papilas
protege a mucosa contra atritos decorrentes da passagem e retorno do alimento. E o epitélio
estratificado cilíndrico, devido à presença de células secretoras de muco, produz muco para
facilitar a deglutição e transporte do alimento em direção aboral (Al-Hussaini,1949; Godinho
et al., 1970).
Para as espécies de Podocnemididade analisadas foram evidenciadas três tipos
distintos de células produtoras de muco: células superficiais mucosas, células secretoras e
células caliciformes. Parsons e Cameron (1977) descrevem no esôfago de quelônios, as
células ciliadas e as células mucosas, essas últimas foram caracterizadas como células
globosas que reagem positivamente ao PAS e apresentam baixa atividade enzimática. Vogt et
al. (1998) em Podocnemididae apenas descreveu que o epitélio apresentava bordas apicais
com pouca reação positiva ao PAS e Alcian blue, porém não detalhando que tipos de células
se tratava. George e Castro (1998) descrevem a presença de células caliciformes no esôfago
de répteis e por sua vez, Oliveira et al. (1996) relatam sua presença em P. expansa sendo
importantes na liberação de muco ao longo de todo tubo digestório auxiliando na lubrificação
do alimento.
Para anfíbios, George e Castro (1998) descrevem a presença de células caliciformes na
mucosa esofágica. Em Bombina sp foram evidenciadas células caliciformes entre as células
colunares (Duellman e Trueb, apud Santana e Menin, 1997). Células classificadas como
mucosas foram encontradas no anuro Leptodactylus labyrinthicus, onde o muco produzido,
além de auxiliar na progressão do alimento em direção ao estômago, também protege o
segmento esofágico contra danos mecânicos provocados pelos alimentos, uma vez que os
Anura deglutem itens alimentares inteiros, ou seja, sem preparação digestiva (Santana e
Menin, 1997). Enquanto que, a ocorrência de células mucossecretoras é uma característica
comum nos epitélios do tubo digestório de teleósteos (Reid et al., 1988). Essas células, que
equivalem às células secretoras descritas no presente estudo, ainda não tinham sido
50
demonstradas para quelônios, portanto pela primeira vez estão sendo descritas para espécies
de Podocnemididae
A camada muscular seguiu o mesmo padrão descrito por Parsons e Cameron (1977),
duas camadas de fibras de músculo liso, uma circular interna e uma longitudinal externa.
Porém foi encontrada nas espécies desse estudo a presença de fibras conjuntivas entre blocos
de fibras musculares lisas. George e Castro (1998) descrevem que em peixes e anfíbios a
camada muscular presente no esôfago tem importância no trajeto do alimento para o
estômago, pois é responsável pelas contrações peristálticas.
A transição do esôfago para estômago na espécie de peixe P. maculatus é claramente
percebida através da abrupta mudança do epitélio estratificado pavimentoso para o epitélio
simples cilíndrico (Santos et al. 2007). Para as espécies de Podocnemididae analisadas além
da mudança do epitélio estratificado cilíndrico para o epitélio simples cilíndrico, a transição
também foi notada pela mudança da mucosa esofágica pregueada para a mucosa com fossetas
do estômago.
Em P. expansa, P. unifilis e P. erythrocephala analisadas nesse trabalho foi verificado
que o estômago é um órgão dividido em dois compartimentos por uma constrição e apresentar
região pilórica desenvolvida o que corrobora a descrição feita por Pinto (2006) para P.
unifilis, caracterizado como tendo uma região proximal em forma de sifão e outra distal
alongada disposta transversalmente na cavidade celomática. Trabalhos realizados por Oliveira
et al. (1996); Santos et al. (1998), em P. expansa, demonstraram que o estômago apresenta
uma forma achatada, com a região pilórica bem desenvolvida e encurvada.
Além das funções digestivas, o estômago também funciona como um reservatório de
alimentos (D`arce e Flechtmann, 1985). Segundo Hildebrand e Goslow (2004) uma
estocagem temporária é promovida por bolsas faciais em alguns roedores, primatas e
morcegos. Em aves, essa função de armazenamento temporário de alimentos é realizada em
uma porção do esôfago em forma de saco, chamada papo ou inglúvio. Em C. mydas existe na
região distal do esôfago uma porção dilatada em forma de saco, que possui a mesma função
do inglúvio das aves (Magalhães et al. no prelo). Não apresentando bolsas ou um papo, a
maioria dos répteis e mamíferos herbívoros possui um grande estômago mesmo quando este
não funcione como câmara de fermentação. Com essa adaptação o animal pode manter a
refeição por mais tempo e digeri-la com mais eficiência. Portanto, a separação do estômago
em dois compartimentos bem definidos demonstra uma especialização e uma divisão das
51
funções entre cada porção. O estômago nesse formato reflete bem o tipo de alimento ingerido
pelas espécies que o possuem, já que P. expansa, P. unifilis e P. erythrocephala apresentam
uma dieta basicamente de matéria vegetal, sendo assim consideradas herbívoras. Enquanto a
primeira porção do estômago funciona como uma câmara fermentativa, a região pilórica
desenvolvida é que realiza a função de digestão desse órgão.
Entre as cinco espécies analisadas P. dumerilianus foi o que apresentou o estômago
mais simples. Sendo essa espécie considerada onívora e a que consome a maior quantidade de
matéria animal entre os Podocnemididae (Perez-Eman e Paolillo, 1977). Legler (1993)
comenta que a maioria das espécies de Testudines é onívora oportunista e apresenta
comportamento típico de onívoros aquáticos, rondando perto do leito do rio, investigando a
vegetação e as frutas caídas das árvores, além dos botes oportunistas em pequenos
invertebrados. No entanto, infere-se que cada espécie tem uma tendência a uma determinada
categoria trófica, como acontece com algumas espécies em questão.
Em tartarugas marinhas ocorre diferença na forma do estômago entre as espécies, no
qual a espécie herbívora (C. mydas), e as onívoras (Eretmochelys imbricata e Lepidochelys
olivacea) apresentaram estômago com aspecto saculiforme em J, e a Caretta caretta e a
Dermochelys coriacea (carnívoras) de aspecto tubular (Magalhães, 2007). De acordo com
Hildebrand (1995); (Hildebrand e Goslow, 2006), os répteis carnívoros têm um estômago
simples, mas distensível, e o intestino tende a ser curto. Em contrapartida, a maioria dos
répteis herbívoros tem um estômago grande e complexo, que funciona como reservatório ou
câmara fermentativa e um intestino relativamente longo. P. sextuberculata apresentou
estômago com o formato similar as espécies herbívoras e onívoras citadas acima.
Parsons e Cameron (1977) descreveram que algumas espécies de quelônios
apresentavam pregas longitudinais na mucosa gástrica. Em D. coriacea, o mesmo autor
encontrou a presença de pregas transversais na mucosa gástrica divergindo do padrão
encontrado para esta espécie por Magalhães (2007) que encontrou pregas longitudinais na
região cárdica, pregas transversais na fúndica e ausência de pregas na pilórica. Para P.
expansa, P. unifilis e P. erythrocephala analisadas nesse trabalho a primeira região do
estômago apresentou pregas transversais e a segunda, pregas longitudinais. P. sextuberculata
e P. dumerialianus apresentaram pregas longitudinais em toda mucosa gástrica. Segundo
Parsons e Cameron (1977) as pregas longitudinais, provavelmente, permitem a livre passagem
de alimentos através do lúmen ao passo que pode ser impedida por pregas transversais ou
52
oblíquas. Portanto, supõe-se que a presença das pregas transversais nas espécies analisadas
sirva pra retardar a livre passagem do alimento ajudando a mantê-lo por mais tempo no
estômago.
Em animais em que o estômago estava repleto de alimento, no momento da análise, a
mucosa da primeira região se mostrou desprovida de pregas, demonstrando que essas dobras
são importantes para distensão do órgão e aumento da área de contato.
Histologicamente nas espécies analisadas o estômago apresentou mucosa revestida por
epitélio cilíndrico simples. Como descritos para peixes, anfíbios e répteis (George e Castro,
1998) e para peixes das espécies Steindachnerina notonota (Silva, 2004) e Pimelodus
maculatus (Santos et al. 2007). Esse epitélio é constituído por células superficiais mucosas
PAS positivas homogeneamente distribuídas pelo epitélio. A presença desse epitélio
mucossecretor também foi descrito para répteis, anfíbios e peixes (George e Castro, 1998),
como exemplo S. notonota e Hoplias malabaricus (Silva, 2004), Pseudoplatystoma coruscans
(Cal, 2006). Estes autores relatam que a função dessa secreção mucosa é provavelmente a de
proteger as células epiteliais contra o ácido clorídrico produzido pelas glândulas gástricas,
além de ser encarregada de proporcionar o deslocamento do alimento ao intestino e auxiliar
na hidratação do alimento.
Fossetas gástricas são invaginações do epitélio de revestimento para dentro da lâmina
própria que estabelecem ligação com a porção secretora das glândulas tubulares gástricas, são
estruturas que se encontram dispostas por toda a mucosa. Porém em P. expansa, P. unifilis e
P. erythrocephala nas regiões cárdica e fúndica não ocorreu formação de fossetas, o epitélio
de revestimento recobriu pequenas pregas secundárias, com presença de células superficiais
mucosas e células caliciformes. Além disso, essas regiões se mostraram desprovida de
glândulas. Portanto, devido à ausência de glândulas nas regiões cárdica e fúndica nas espécies
de estudo, a atividade secretora é restrita ao epitélio, pelas células superficiais mucosas e
caliciformes. A ausência de fossetas também foi descrito por Silva (2004) para a região
pilórica de S. notonota e para o estômago de H. maculatus. Células caliciformes também
foram descritas para o estômago anterior de anfíbios (George e Castro, 1998).
As fossetas estiveram presentes apenas na região pilórica de P. expansa, P. unifilis e
P. erythrocephala. Como sendo descrito para répteis no geral por George e Castro (1998). De
acordo com Oliveira et al. (1996) e Santos et al. (1998) em P. expansa, o estômago apresenta
53
glândulas gástricas com células secretoras, além de células acidófilas nas glândulas pilóricas.
Mas como descrito anteriormente essa espécie apresentou glândulas apenas na região pilórica.
Portanto constata-se que as regiões estomacais cárdica e fúndica em P. expansa, P.
unifilis e P. erythrocephala possivelmente estão envolvidas com o armazenamento e
fermentação dos itens alimentares ingeridos, tendo a região pilórica funções de digestão e
deslocamento do alimento ao intestino.
P. sextuberculata e P. dumerilianus apresentaram semelhante padrão histológico
descrito para a maioria dos grupos de vertebrados (George e Castro, 1998). Apresentando
fossetas e glândulas nas três regiões estomacais, cárdica, fúndica e pilórica. Com variação
entre as regiões na profundidade das fossetas e na quantidade de glândulas. Esse padrão foi o
mesmo para espécie C. mydas (Magalhães et al. no prelo). As células mucosas, encontradas
nas espécies acima citadas, são comuns nas glândulas tubulares como descrito para quelônios
(Parsons e Cameron, 1977). Devido a essas características esse órgão não apresenta função
fermentativa, e sim função de armazenamento e, digestão além de deslocamento do alimento
ao intestino, auxiliado pelas células superficiais mucosas.
Em todas as espécies estudadas nesse trabalho a muscular da mucosa no estômago foi
bem espessa e evidente. Segundo Chaves e Vazzoler (1984), a presença da muscular da
mucosa nas paredes do estômago de Semaprochilodus insignis está relaciona com o
movimento de pressão sobre as glândulas para a eliminação de seus produtos.
A camada muscular própria das espécies de Podocnemididae variou entre regiões e
espécies, sendo verificada a presença ora de duas camadas, uma circular interna e uma
longitudinal externa e ora, com três camadas, sendo uma intermediária e oblíqua. Foi evidente
que na região pilórica a camada muscular se apresentou mais espessa que nas outras regiões.
De acordo com Silva (2004) a camada muscular é responsável pela motilidade gástrica, e,
portanto, pelo transporte e mistura do alimento com as secreções estomacais. Além disso, o
esvaziamento gástrico é causado em virtude das contrações desenvolvidas na espessa camada
muscular que compõe as paredes da região pilórica, e do padrão longitudinal das pregas de
sua mucosa (Menin, 1988; Santos et al., 2007).
Entre as espécies estudadas, independente do hábito alimentar existe a presença do
esfíncter pilórico que marca o início do intestino. Esse esfíncter controla o movimento dos
alimentos do estômago para o intestino delgado (Zug et al., 2001).
54
Em P. unifilis Pinto (2006) verificou que a transição para o duodeno é suave e esta
porção do intestino delgado revela-se curta como um segmento retilíneo da direita para a
esquerda, onde se inicia o jejuno-íleo. Este por sua vez é enovelado e compreende a maior
porção do intestino delgado. Oliveira et al. (1996); Santos et al. (1998) descreveram para P.
expansa o intestino delgado longo e bem enovelado. As espécies analisadas nesse trabalho
apresentaram arranjo semelhante ao descrito acima, no entanto ao contrário do relatado por
Pinto (2006) o duodeno não se curva da direita para a esquerda, pois no animal na sua posição
anatômica, o duodeno se curva da esquerda para a direita.
Pregas longitudinais formam um padrão em zigue-zague, o qual provavelmente
desaparece quando o tubo é distendido (Parsons e Cameron, 1977). De acordo com Legler
(1993), o padrão de vilosidades é mais complexo no duodeno e se torna mais simples e menor
para o cólon, com mudança de pregas em zigue-zague para pregas longitudinais simples perto
da região distal do íleo. Em tartarugas marinhas a mucosa de todo o intestino delgado
apresenta aparência de “favos de mel” (Work, 2000; Wyneken, 2001). No entanto, nas
espécies de Podocnemididae analisadas o duodeno apresentou pregas reticulares, o jejuno,
pregas longitudinais baixas em zigue-zague e o íleo pregas longitudinais altas em zigue-zague
e evidentes. Nas espécies de tartarugas marinhas C. mydas, L. olivacea, C. caretta e E.
imbricata o duodeno apresentou pregas reticulares, e o jejuno/íleo pregas retilíneas. Já em D.
coriacea todo o intestino delgado apresentou mucosa com pregas reticulares (Magalhães,
2007).
Histologicamente em répteis o epitélio cilíndrico que reveste as pregas intestinais é
simples, e a camada muscular consiste de uma camada circular interna e uma longitudinal
externa (Parsons e Cameron, 1977). Oliveira et al. (1996); Santos et al. (1998), descreveram
que a mucosa do intestino delgado em P. expansa possui inúmeras vilosidades e seu epitélio é
simples e cilíndrico com borda estriada e células caliciformes. A mucosa constituída por
vilosidades também foi descrita para C. mydas, sendo longa e filiforme no duodeno, curta e
digitiforme no jejuno e foliado no íleo (Magalhães et al., no prelo). A mesma autora
descreveu a presença de glândulas na lâmina própria apenas no duodeno.
As espécies de Podocnemididae analisadas também apresentaram mucosa constituída
por vilosidades e revestida por epitélio cilíndrico simples, com células caliciformes dispersas
nas vilosidades. No entanto, ao contrário do que foi descrito para C. mydas (Magalhães et al.,
no prelo), apresentaram lâmina própria e a submucosa aglandular. As vilosidades nos
55
Podocnemididae também variaram em relação à região do intestino delgado, sendo filiformes
e alongadas no duodeno, com alternância de vilosidades foliáceas, ramificadas e digitiformes
no jejuno e o íleo apresentou vilosidades fungiformes. A presença destas pregas e vilos
aumentam sobremodo a superfície da parede intestinal (Porter, 1972; Romer e Parsons, 1985;
Legler, 1993; Young e Heath, 2000; Wyneken, 2001).
A delimitação do intestino delgado para o intestino grosso se deu pela presença de um
espessamento muscular, caracterizando um esfíncter ileocecal em todas as espécies desse
trabalho. Esse esfíncter tem como função regular a passagem de material do intestino delgado
para o grosso. Semelhantes achados foram descritos por Rainey (1981); Wyneken (2001) e
Magalhães (2007) para tartarugas marinhas.
O intestino grosso em P. expansa, P. unifilis e P. erythrocephala analisadas nesse
trabalho constitui inicialmente por uma dilatação, o ceco, e segue em direção a cloaca,
assumindo posição mediana até alcançar a pelve e apresenta dimensões reduzidas. Oliveira et
al. (1996); Santos et al. (1998) em P. expansa e Pinto (2006) em P. unifilis, descreveram
mesmo padrão para esse órgão. Porém para P. sextuberculata e P. dumerilianus o intestino
grosso não apresentou um ceco (dilatação), caracterizando-se como um órgão tubular.
Para as espécies analisadas foram encontradas pregas transversais no ceco e pregas
longitudinais onduladas, demonstrando às vezes um padrão irregular, no cólon/reto. No
entanto, como descrito por Parsons e Cameron (1977), o cólon e o ceco são distensíveis, e
para alguns espécimes não foi verificado a presença de pregas na mucosa. Em peixes as
relações entre o arranjo das pregas mucosas e a velocidade de transporte do alimento no
intestino sugere que o padrão longitudinal com numerosas anastomoses, retardam o avanço do
alimento em sentido aboral, o que possibilita maior período digestivo e, conseqüentemente,
maior aproveitamento dos nutrientes, em virtude da exposição do material alimentar à mucosa
intestinal por maior período, além de contribuir para a preparação do bolo fecal (Seixas-Filho
et al., 2003). A organização das pregas do ceco e cólon/reto evidenciadas neste trabalho para
as cinco espécies analisadas demonstram a retenção do alimento por um maior período de
tempo, devido à presença de pregas transversais.
A importância digestiva do intestino grosso varia segundo a espécie animal. Para os
carnívoros, é o local onde simplesmente ocorre a recuperação hidroeletrolítica que foi perdida
com as secreções digestivas, além disso, o ceco é pequeno ou mesmo ausente. Para os
herbívoros, em especial o ceco, são de enorme importância. Sendo o local onde ocorre a
56
digestão bacteriana da celulose e outros carboidratos do material vegetal que, de outra
maneira, não poderiam ser aproveitados (D’arce e Flechtmann, 1985; Hildebrand e Goslow,
2006). P. expansa, P. unifilis e P. erythrocephala, espécies herbívoras, apresentaram o ceco
desenvolvido, o que mostra a importância desse órgão. No entanto, apesar de P.
sextuberculata ser considerada herbívora, apresentou o mesmo padrão que P. dumerilianus,
que consome maior quantidade de material animal, onde não foi evidenciado um ceco
desenvolvido, todo o intestino grosso apresentou o mesmo diâmetro do inicio ao fim. Esse
padrão já descrito por Porter (1972), onde o intestino grosso tem o diâmetro maior que o
intestino delgado, e é geralmente reto.
Histologicamente o intestino grosso nas espécies estudadas apresentou mucosa
pregueada revestida por epitélio cilíndrico simples. Em comparação ao intestino delgado,
observa-se maior quantidade de células caliciformes. O tipo de epitélio encontrado e a
presença de células caliciformes foram o mesmo descrito por George e Castro (1998) para
peixes, anfíbios, répteis, aves e mamíferos. No entanto, Oliveira et al. (1996); Santos et al.
(1998) descreveram que em P. expansa a mucosa apresentava muitas vilosidades e revestida
por um epitélio pseudo-estratificado cilíndrico, divergindo do encontrado no presente estudo.
Porém também evidenciaram células caliciformes em quantidade. O muco secretado pelas
células caliciformes promove a lubrificação do tubo, o que facilita o deslizamento das fezes,
já que chegam nesta região bastante desidratadas (George e Castro, 1998; Young e Heath,
2000; Cal, 2006).
Em C. mydas, o intestino grosso apresentou mucosa pregueada contendo glândulas e
acúmulo de linfócitos na lâmina própria (Magalhães, 2007). Mesmo padrão foi descrito em
répteis (George e Castro, 1998). Porém nas espécies analisadas a submucosa foi aglandular,
mas ocorreu a presença de acúmulo linfocitário expressivo. A presença de células do sistema
imunitário está relacionada com a flora bacteriana no intestino grosso (Young e Heath, 2000).
Apesar de P. sextuberculata ser considerada herbívora, apresentou características mais
próximas do P. dumerilianus, espécie onívora, possuindo o estômago bem mais simples
quando comparada com as outras espécies herbívoras analisadas. Morfologicamente essa
espécie não possui especializações para uma dieta herbívora, desse modo sugere-se que esteja
em processo transicional da sua dieta, ou está se adaptando a disponibilidade de alimento no
meio, por isso a maioria dos autores considera essa espécie herbívora a partir de estudos
57
recentes da sua dieta. No entanto Vogt (2008) encontrou principalmente pequenos caramujos
no conteúdo estomacal dessa espécie.
Luz et al. (2003) verificou que o estômago seguido pelo intestino delgado, foram os
que apresentaram maior capacidade em alocação, desempenhando importantes funções na
digestão de alimentos em P. expansa jovens. No entanto, em trabalho com trânsito
gastrintestinal na mesma espécie demonstrou que os dois segmentos do tubo digestório que
parecem exercer função importante no tempo de retenção da digestão são o estômago e o
ceco, que retiveram o contraste por até 24 e 29 dias, respectivamente (Lopes, 2006). Em um
trabalho parecido, Pinto (2006) observou que P. unifilis reteve o contraste no intestino grosso
em um tempo médio de permanência alto, quando comparado aos outros órgãos.
Apesar de não terem sido enfatizados os aspectos funcionais da digestão, a morfologia
demonstrou que em P. expansa, P. unifilis e P. erythrocephala o estômago e o ceco
desempenham importante função no retardo do alimento, ratificando as informações dos
autores acima.
Luz et al. (2003) e Pereira et al. (2003) encontraram que os comprimentos médios de
intestino delgado e intestino grosso em P expansa, são 46,68 cm e 96,36 cm, 14 cm e 13,09
cm, respectivamente. No presente estudo P. expansa apresentou comprimentos médios de
intestino delgado e intestino grosso de 47,90 cm e 12,25 cm, respectivamente. O que
demonstra aproximação com os resultados encontrados pelos autores citados acima. Além
disso, os resultados de Luz et al., (2003) demonstraram que o estômago apresentou maior
percentual do tubo digestório, com 44,20%, seguido pelo intestino delgado, que correspondeu
a 28,68% e pelo intestino grosso, a 20,93%. Em todas as espécies analisadas o intestino
delgado também correspondeu a um maior percentual quando comparado ao intestino grosso,
como observado na tabela 2.
O intestino delgado tende a ser mais longo nos carnívoros e o mais curto nos
herbívoros, enquanto o intestino grosso é mais longo nos herbívoros e mais curto nos
carnívoros (Stevens e Hume, 1998). Essa diferença no comprimento do intestino delgado e do
grosso ocorre porque os alimentos de origem animal são mais facilmente digeridos do que os
de origem vegetal (Ricklefs, 2003).
No entanto, nossos resultados não seguiram por completo essa relação. P.
dumerilianus, espécie onívora, esteve de acordo com a afirmação acima, onde o intestino
58
delgado apresentou maior média percentual quando comparado com o intestino grosso. Além
disso, essa espécie apresentou o intestino grosso relativamente maior que as espécies de
Podocnemididae herbívoras. Porém, P. expansa, P. unifilis e P. erythrocephala, consideradas
herbívoras, apresentaram média percentual do intestino delgado maior que o intestino grosso.
Mas apesar de o intestino grosso ser proporcionalmente menor que o intestino delgado, é
capaz de reter a digestão por um tempo suficientemente longo para permitir uma ampla
atividade microbiana (Luz, 2000), como observado por Lopes (2006) em P. expansa e Pinto
(2006) em P. unifilis em trabalhos com trânsito gastrintestinal.
59
7 CONCLUSÃO
O esôfago nas espécies de Podocnemididae está morfologicamente preparado para se
proteger contra ação abrasiva do alimento e para auxiliar seu transporte até a próxima câmara.
Existem 3 tipos de células secretoras de muco no esôfago nas espécies estudadas:
células superficiais mucosas, células secretoras e células caliciformes.
Foi verificada para as cinco espécies a presença de três padrões anatômicos diferentes
para o estômago. O estômago dividido em dois compartimentos, em forma de “J”e em forma
de ferradura encurvada.
As espécies herbívoras, Podocnemis expansa, Podocnemis unifilis e Podocnemis
erythrocephala, apresentaram semelhança em sua morfologia macroscópica e microscópica
para todos os órgãos, principalmente em relação ao estômago e intestino grosso.
Em P. expansa, P. unifilis e P. erythrocephala há uma separação do estômago em
duas porções definidas demonstrando uma especialização e uma divisão das funções entre
cada região. A primeira porção do estômago funciona como câmara fermentativa e a segunda
região realiza a digestão. Com ausência de fossetas e glândulas gástricas na porção
fermentativa
Podocnemis sextuberculata, considerada herbívora, não apresentou especializações
para uma dieta herbívora. Possuindo características anatômicas e histológicas mais próximas
do Peltocephalus dumerilianus, espécie onívora.
A relação ID/IG diverge da esperada para os indivíduos herbívoros, pois é
compensada pela região do ceco que auxilia nestes animais como uma câmara fermentativa.
60
REFERÊNCIAS
Acosta, A.; Fachín-Terán, A.; Vilchez, I.; Taleixo, G. 1995. Alimentacion de crias de taricaya
Podocnemis unifilis (Reptilia, Testudines) em cautiverio, Iquitos, Peru. In: Fang, T.G.;
Bodmer, R.E.; Aquino, R.; Valqui, M.H. (Eds). Manejo de Fauna Silvestre em la
Amazônia. Instituto de Ecólongia, La Paz. 334pp.
Alho, C.J.R. 1984. A ciência do manejo da fauna silvestre. Ver. Bras. Tecnol., 15(6): 24-33.
Al-Hussaini, A.H. 1949. On the functional morphology of the alimentary tract of some fish in
relation to differences in their feedings habits. II – Citology and Physiology. Quat. J.
Micr. Sec. London, 90: 323-354.
Almeida, S.S.; Sá, P.G.; Garcia, A. 1986. Vegetais utilizados como alimento por Podocnemis
(Chelonia) na região do baixo rio Xíngú (Brasil/Pará). Boletim do Museu Paraense
Emílio Goeldi-Botânica, 2( 2): 199-211.
Balesienfer, D.C. 2003. Dieta de Podocnemis unifilis (Testudines, Pelomedusidae) em um
período de seca em uma várzea do médio Solimões, Amazonas. Dissertação de
Mestrado, Instituto Nacional de Pesquisas da Amazônia/ Fundação Universidade do
Amazonas, Manaus, Amazonas. 34 pp.
Balesienfer, D.C. e Vogt, R.C. 2006. Diet of Podocnemis unifilis (Testudines,
Podocnemididae) during the dry season in the Mamirauá Sustainable Development
Reserve, Amazonas, Brasil. Chelonian Conservation and Biology, 5 (2): 312-317.
Bates, H. W. 1863. The Naturalist on the River Amazon. John Murray, London. 407 pp.
Belkin, D.A.; Gans, C. 1968. An unusual chelonian feeding niche. Ecólongy, 49: 768-769.
Bernhard, R. 2001. Biologia reprodutiva de Podocnemis sextuberculata Testudines,
Pelomedusidae) na Reserva de Desenvolvimento Sustentável Mamirauá, Amazonas,
Brasil. Dissertação de Mestrado, Instituto Nacional de Pesquisas da Amazônia/
Fundação Universidade do Amazonas, Manaus, Amazonas.. 52pp.
Best, R. C. 1984. The aquatic mammals and reptiles of the amazon. Dorbrecht Netherlands,
[S.l], p. 371-412.
61
Bjorndal, K.A. 1985. Nutritional ecólongy of sea turtles. Copeia, 1985: 736-751.
Bjorndal, K. A. 1989. Flexibility of digestive responses in two generalist herbivores, the
tortoises Geochelone carbonaria and Geochelone denticulata. Oecólongia, 78: 317-321.
Bleakney, J.S. 1965. Reports os marine turtles from New New England and eastern Canada.
Can. Field-Natur., 79: 120-128.
Brasil. Portaria 142, de 30 de dezembro de 1992. 1992. Normatiza a criação em cativeiro das
espécies de quelônios Podocnemis expansa e Podocnemis unifilis, em criadouros com
finalidade comercial, partindo de filhotes, nas áreas de distribuição geográfica. Diário
Oficial da União. Brasília, n. 14, p. 922-923, 21.01.1992
Brasil. Portaria 70, de 23 de agosto de 1996. 1996. Normalização a comercialização de
produtos e subprodutos das espécies de quelônios Podocnemis expansa e Podocnemis
unifilis, provenientes de criadouros comerciais regulamentados pelo IBAMA. Diário
Oficial da União. Brasília, n. 165, p. 16390-16391, 26.08.1996.
Brasil. Portaria 58, de 24 de abril de 2001. 2001. Institui o Centro de Conservação e Manejo
de Répteis e Anfíbios - Répteis e Anfíbios Nacionais (RAN). Diário Oficial da União.
Brasília, 24.04.2001.
Cal, J.A. 2006. Histologia do tubo digestório do surubim-pintado (Pseudoplatystoma
coruscans – Agassiz, 1829). Dissertação de Mestrado, Universidade de são Paulo,
Faculdade de Medicina Veterinária, São Paulo. 87pp.
Cantarelli, V.H. 1997. The Amazon Turtles: Conservation and Management in Brasil. In: Van
Abbena, J. (Ed). Proc. Conservation, Restoration of tortoises and turtles. An
international Conferences. Turtle and tortoise Society, State Universty of New York,
New York. p. 407- 410.
CENAQUA. 2000. Noções básicas sobre criação da tartaruga-da-amazônia e do tracajá em
cativeiro. Goiânia. Centro Nacional dos Quelônios da Amazônia. IBAMA. 20pp.
[Apostila].
Chaves, P.T.C. e Vazzoler, C. 1984. Aspectos biológicos de peixes anatômicos. III. Anatomia
microscópica do esôfago, estômago e cecos pilóricos de Semaprochilodus insignis
(Characiformes: Prochilodontidae). Acta Amazônica, 14(3-4): 343-353.
62
Crowe, O e Hume, I. D. 1997. Morphology and function of the gastrointestinal tract of
Australian folivorous possums. Aust. J. Zool., 45: 357–368
Critchlow, D.E. e Fligner, M.A. 1991. On distribution-free multiple comparisons in the oneway analysis of variance. Communications in Statistics - Theory and Methods, 20: 127139.
Curry, E. 1939. The histology of the alimentary tract canal of the carp (Cyprinus carpio
communis). J. Morphol., 65: 53-78.
Cuvier, G. 1835. Lecons d’ Anatomie Camparee. Recueillies ET Publiees par G. L. duvernoy.
Corrigee ET Augmentee, 2nd Ed. Crochard ET Cie, Paris.
D`arce, R.D. e Flechtmann, C.H.W. 1985. Introdução à anatomia e Fisiologia Animal. Nobel,
São Paulo. 187pp.
De La Ossa, J.L.V. 2007. Ecólongia e conservação de Peltocephalus dumerilianus em
Barcelos, Amazonas, Brasil. Tese de Doutorado, Instituto Nacional de Pesquisas da
Amazônia/Fundação Universidade do Amazonas, Manaus, Amazonas. 178 pp.
Duarte, F.S. 1998. Diagnóstico da criação de quelônios e incubação artificial de ovos de
tartaruga Podocnemis expansa no Amazonas. Monografia (Graduação em Engenharia
Agronômica), Faculdade de Ciências Agrárias da Fundação Universidade do Amazonas,
Manaus, Amazonas. 76pp.
Ernst, C.H. e Barbour, R.W. 1989. Turtles of the World. Smithsonian Institution Press.
Washington, D. C., and London. 313 pp.
Fachín-Terán, A. 1992. Alimentação de cinco espécies de quelônios em Costa Marques,
Rondônia-Brasil. Dissertação de Mestrado, Instituto Nacional de Pesquisas da
Amazônia/Fundação Universidade do Amazonas, Manaus, Amazonas. 65pp.
Fachín-Terán, A. 1999. Ecólongia de Podocnemis sextuberculata na Reserva de
Desenvolvimento Sustentável Mamirauá, Amazonas, Brasil. Tese de Doutorado,
Instituto Nacional de Pesquisas da Amazônia/Fundação Universidade do Amazonas,
Manaus, Amazonas. 188p.
63
Fachín-Terán, A.; Vogt, R.C.; Gomez, M.F.S. 1995. Food habitats of an assemblage of five
species of turtles in the Rio Guapore, Rondônia, Brazil. Jounal. of Herpetology, 29(4):
536-547.
Fachín-Terán, A.; Chumbe- Ayllon, M.; Taleixo-Torres, G. 1996. Consumo de tortugas de la
Reserva Nacional Pacaya-Samiria, Loreto, Peru. Vida Silvestre Neotropical., 5:147-150.
Fachín-Terán, A.; Vogt, R. C.; Thorbjarnarson, J. B. 2003. Estrutura populacional, razão
sexual e abundância de Podocnemis sextuberculata (Testudines, Podocnemididae) na
Reserva de Desenvolvimento Sustentável Mamirauá, Amazonas, Brasil. Phyllomedusa,
2(1): 43-63.
Fachín-Terán, A e Vogt, R.C. 2004. Estrutura populacional, tamanho e razão sexual de
Podocnemis unifilis (Testudines, podocnemididae) n o rio Guaporé (RO), norte do
Brasil. Phyllomedusa, 3(1): 29-42.
Fryer G, Iles TD (1972) The Cichlid Fishes of the Great Lakes of Africa. Oliver and Boyd,
London.
Fugi, R. e Hahn, N. S. 1991. Espectro alimentar e relações morfológicas com o aparelho
digestivo de três espécies comedores de fundo do rio Paraná, Brasil. Rev. Bras. Biol.,
51(4): 873-879
Fugi R.; Agostinho, A.A; Hahn, N.S. 2001. Trophic Morphology of Five Benthic-Feeding
Fish Species of a Tropical Floodplain. Rev. Brasil. Biol., 61(1): 27-33.
George, L.L. e Castro, R.R.L. 1998. Histologia Comparada. 2 ed. Roca, São Paulo. p.141-173
Godinho, M.H. 1970. Considerações gerais sobre anatomia dos peixes. In: Comissão
Interestadual da Bacia Paraná-Uruguais. Poluição e Psicultura. São Paulo: Edanee. p.
113-116.
Godinho, H.; Tokumaru, M.; Ferri, A.G. 1970. Histologia do tubo digestivo de Pimelodus
maculatus Lacepede (Pisces, Siluroidei). Rev. Brasil. Biol., 30(4): 583-593.
Grady, S.P.O.; Morando, M.; Ávila, L.; Dearing, M.D. 2005. Correlating diet and digestive
tract specialization: Examples from the lizard family Liolaemidae. Zoology, 108(3):
201-210.
64
Hernandez, O.; Narvaiza I.; Espín, R. 1998. Zoocriadero de Tortuga del Orinoco (Podocnemis
expansa) con fines de reforzamiento de poblaciones silvestres. In: J. López, I. Saavedra
y M. Dubois (Eds). “El río orinoco aprovechamiento sustentable” Memorias de las
primeras jornadas de investigación sobre el Río Orinoco. Universidad Central de
Venezuela Instituto de Mecánica de Fluidos. p. 69-75.
Hildebrand, P.; Saenz, C.; Pehyela, M.C.; Caro, C. 1988. Biología reproductiva y manejo de
La tortuga charapa (Podocnemis expansa) en el bajo río Caquetá. Cólonmbia
Amazonica, 3: 89-102.
Hildebrand, M. 1995. Análise da Estrutura dos Vertebrados. Atheneu, São Paulo. 700pp.
Hildebrand, M. e Goslow, G. E. 2006. Análise da estrutura dos vertebrados. São Paulo:
Atheneu,. p. 358-366.
Holt, P.E. 1978. Radiological studies of the alimentary tract in two Greek tortoises (Testudo
graeca). Vet. Rec., 103(10): 198-200.
Hooghwinkel, G.J. e Smith, G. 1948. The specificity of periodoc acid-Schiff technique
studied by a quantitative test tube method. J. Histochemistry, 16: 131-41.
Hoogmoed, M.S. e Avila-Pires, C.S. 1990. New distribution data for Podocnemis
erythrocephala (Spix) with remarks on some other turtle taxa (Reptilia: chelonia:
Pelomedusidae). Zoologische Mededelingen, 64: 21-24.
Humbert, W.; Kirsch, R.; Meister, M.F. 1984. Scanning electron microscopic study of the
oesophageal mucous layer in the eel, Anguilla anguilla. Journal of Fish Biology, 25(1):
117-122.
Iverson, J.B. 1992. A revised checklist with distribution maps of the turtles of the world.
Earlham College, Richmond, Indiana. 363 pp.
Iverson, J.B. e Vogt, R.C. 2002. Peltocephalus Dumérilianus and Bibron – Bigheaded
Amazon River Turtles. Catalogue of American Amphibians and Reptiles, 744.1-744.4.
Junger, H.; Kotrschor, K.; Goldchmid, A. 1989. Comparative morphology and
ecomorphologyof the gut in European cyprinids. J.Fish.Biol., 34: 315-326.
65
Kemenes, A. e Pezzuti, J. C. B. 2007. Estimate of Trade Traffic of Podocnemis (Testudines,
Pedocnemididae) from the Middle Purus River, Amazonas, Brazil. Chelonian
Conservation and Biology, 6(2): 259–262.
Langille, R.M. e Youson, J.H. 1984. Morphology of the intestine of prefeeding and feeding
adult lampreys (Petromyzon marinus L.) The mucosa of the diverticulum, anterior
intestine and transition zone. J. Morphol., 182: 39-61.
Legler, J.M. 1993. Morphology and Physiology of the Chelonia. In: Glasby, C.J.; Ross,
G.J.B.; Beesley, P. L. (Eds). Fauna of Australia. Caberra, vol. 2. p.108-119.
Lima, M. G. H. S. 1998. A importância das proteínas de origem animal e vegetal no primeiro
ano de vida da tartaruga-da-Amazônia - Podocnemis expansa (Schweigger, 1812).
Dissertação de Mestrado, Instituto Nacional de Pesquisas da Amazônia/Fundação
Universidade do Amazonas, Manaus, Amazonas. 93p.
Lopes, L.A.R. 2006. Determinaçao do Tempo de Trânsito Gastrintestinal em Tracajá
Podocnemis expansa, Schweigger, 1812 (Tartaruga-da-amazônia) (Testudines,
Podocnemididae). Dissertação de Mestrado, Universidade Federal de Uberlândia,
Uberlândia, Minas Gerais. 34p.
Luz, V.L.F. 2000. Avaliação do Crescimento e Morfometria do Tubo Digestivo de
Podocnemis expansa (Tartaruga-da-amazônia) criada em Sistema de Cativeiro em
Goiás. Dissertação de Mestrado, Universidade Federal de Goiás, Goiânia, Goiás. 83p.
Luz, V.L.F., Stringhini, J.H., Bataus, Y.S.L., Paula, W.A., Novais, M.N.; Reis I.J. 2003.
Morfometria do tubo digestório da tartaruga-da-amazônia (Podocnemis expansa) criada
em sistema comercial. Revta Bras. Zootec., 32(1): 10-18.
Malvasio, A.; Souza, A.M.; Molina, F.B.; Sampaio, F.A. 2003. Comportamento e preferência
alimentar em Podocnemis expansa (Schweigger), P. unifilis (Troschel) e P.
sextuberculata (Cornalia) em cativeiro (Testudines, Pelomedusidae). Revista Brasileira
de Zoologia, 20(1): 161-168.
Mackie, R.I. 2002. Mutualistic Fermentative Digestion in the Gastrointestinal Tract: Diversity
and Evolution. Integrative and Comparative Biology, 42(2): 319-326.
66
Magalhães, M.S. 2007. Análise Comparativa do Tubo Digestório de Tartarugas Marinhas.
Monografia, Universidade Federal do Rio Grande do Norte, Natal, Rio Grande do
Norte. 52p.
Magalhães, M.S.; Santos, A.J.B.; Freitas, M.L.; Silva, N.B.; Moura, C.E.B. 2008. Macro and
Microscopic Anatomy of the Esophagus of the Green Turtle. In: 28th Annual
Symposium on Sea Turtle Biology and Conservation, Loreto.
Maia V. 1979. Técnica Histológica. 2a ed. Atheneu, São Paulo. 246pp.
Mallory, F.B. 1938. Pathological technique, Philadelphia, WB Saunders.
Medem, F. 1983. La Reproduccion De La Tortuga “Cabezon” Peltocephalus tracaxa (spix).
1924.(Testudines.
Pelomedusidae).
en
Cólonmbia.
Lozania.
Acta
Zoológica
Cólonmbiana, 41: 1-12.
Menin, E. 1988. Anátomo-Histologia Funcional Comparativa de aparelho digestivo de seis
Teleóstei (pisces) de Água Doce. Tese de Doutorado, Universidade de São Paulo, São
Paulo. 359pp.
Meyer J. 1998. Gastrgrafin as a gastrointestinal contrast agent in the Greek tortoise (Testudo
hermani). J. Zoo Wildlife Med., 29(2): 183-189.
Mittermeier, R.A. 1975. A turtle in every pot: A valuable South American resource going to
waste. Animal Kingdom, 78: 9-14.
Mittermeier, R.A. e Wilson, R.A. 1974. Redescription of Podocnemis erythrocephala (Spix,
1824) an Amazonian Pelomedusid Turtle. Pap. Avulsos Zool., 28: 147-162.
Oliveira, G.M.; Santos, E.E.D., Luz, V.L.F. 1996. Estudo morfológico do tubo digestivo de
Podocnemis expansa (tartaruga-da-amazônia). In: Congresso Brasileiro de Zoologia,
Santa Maria/RS.
Parsons T.S. e Cameron J.E. 1977. The internal relief of the digestive tract. In: Gans G. e
Parsons T.S. (Eds.). Biology of the Reptilia. Academic Press, New York. p.159-223.
Perez-Éman, J.L. e Paollilo, O.A. 1997. Diet of the Pelomedusid turtle Peltocephalus
dumerilianus in the Venezuelan Amazon. Journal of herpetology, 31(2): 173-179.
67
Pezzuti, J.C.B. e Vogt, R.C. 1999. Nesting ecólongy of Podocnemis sextuberculata
(Testudines: Pelomedusidae) in the Japurá River, Amazonas, Brazil. Chelonian
Conservation and Biology, 3(3): 419-424.
Pezzuti, J.C.B.; Vogt, R.C.; Kemenes, A.; Felix, D.; Salvestrini, F.; Jackson, P. 2000. Nesting
ecólongy of pelomedusid turtles in the Purus River, Amazonas, Brasil. In: Program
Book and Abstracts of 80th Anual Meeting American Society of SSAR. Unversidad
Autónoma de Baja California Sur, La Paz, B.C.S, México. p. 294.
Pezzuti, J. C. B.; G. H. Rebelo.; D. F. SILVA.; J. P. Lima.; M. C. Ribeiro. 2004. A caça e a
pesca no Parque Nacional do Jaú, 213-230. In: S. H. Borges, S. Iwanaga, C. C. Durigan,
and M. R. Pinheiro (Eds.). Janelas para a biodiversidade no Parque Nacional do Jaú:
Uma estratégia para o estudo da biodiversidade na Amazônia. Fundação Vitória
Amazônica, Manaus.
Pinto, J.G.S. 2006. Aspectos Anátomo-Radiográficos e Tempo de Trânsito Gastrintestinal em
Tracajá Podocnemis unifilis Troschel, 1848 (Testudines, Podocnemididae). Dissertação
de Mestrado, Universidade Federal de Uberlândia, Uberlândia, Minas Gerais. 34pp.
Portal, R.R.; Lima, M.A.S.; Luz, V.L.F.; Bataus, Y.S.L.; Reis, I.J. 2002. Espécies Vegetais
Utilizadas na Alimentação de Podocnemis Unifilis, Troschel 1948 (Reptilia, Testudinae,
Pelomedusidae) na Região do Pracuúba -Amapá-Brasil. Ciência Animal Brasileira,
3(1): 11-19.
Porter, K.R. 1972. Herpetology. Canada, W.b. Saunders company. 524pp.
Pressler, B.M.; Goodman, R.A.; Harms, C.A.; Hawkins, E.C; Lewbart,
G.A. 2003.
Endoscopic evaluation of the esophagus and stomach in three loggerhead sea turtles
(Caretta caretta) and a malaysian giant turtle (Orlitia borneensis). J. Zoo Wildlife Med,
34(1): 88-92.
Pritchard, P.C.H. 1979. Encyclopedia of turtles. 1 ed. USA: T. F.H. Publications Inc. Ltd.
895pp.
Pritchard, P.C.H. 1990. Course on amazonian freshwater turtles, editorial. Tortoises e Turtles.
Vol. 5. IUCN Tortoise and Freshwater Turtles Specialist Group.
68
Pritchard, P.C.H. e Trebbau, P. 1984. The turtles of Venezuela. Society for the Study of
Amphibians and Reptiles. Ithaca, NY. 415pp.
Rainey, W.E. 1981. Guide to Sea Turtle Visceral Anatomy. NOAA Technical Memorandum
NMFS-SEFC, University of California, Berkeley. 61pp.
Rebêlo, G.H. 1991. Um novo hábitat e localidade para Podocnemis erythrocephala (Spix,
1824) (Testudines: Pelomedusidae). Bol. Mus. Par. Emílio Goeldi, sér. Zool., 7: 10-15.
Rebêlo, G.H. 2002. Quelônios, jacarés e ribeirinhos no Parque Nacional do Jaú (AM). Tese
de doutorado, Instituto de Biologia, Universidade Estadual de Campinas, São Paulo. 156 pp.
Rebêlo, G e Pezzuti, J. 2000. Percepções sobre o consumo de quelônios na Amazônia.
Sustentabilidade e alternativas ao manejo atual. Ambiente & Sociedade. 6/7: 85-105.
Redford, K.H. e Robinson, J.G. 1991. Subsistence and commercial uses of wildlife, 7-23. In:
Robinson, J.G. & Redford, K.H. (Eds.). Neotropical wildlife use and conservation.
Chicago, University of Chicago Press. pp.
Reid, P.E.; Volz, D.; Cho, K.Y.; Owen, D.A. 1988. A new method for the histochemical
demonstration of O-acyl suggars in human cólonnic epithelial glycoproteins. The
Histochemical Journal, 20: 510-518.
Rhodin, A.G.J.; Meden, F.; Mittermeier, R.A. 1981. The ocuurrence of neustophahia among
podocnemididae turtles. Brit. J. Herpetol., 6: 175-176.
Ricklefs, R.E. 2003. A economia da natureza. Guanabara Koogan, Rio de Janeiro. 503pp.
Rodrigues, M.J.J.; Cardoso, E.C.; Cintra, I.H.A.; Souza, R.F.C. 2004. Composição Química
do
Conteúdo
Estomacal
da
Tartaruga-da-Amazônia,
Podocnemis
expansa
(Schweigger,1812), em Ambiente Natural. Bol. Téc. Cient. CEPNOR, 4(1): 57-65.
Romer A.S. e Parsons T.S. 1985. Anatomia Comparada dos Vertebrados. Atheneu, São
Paulo. 481pp.
Roze, J.A. 1964. Piligrim of the river. Natural History, 73: 34-41.
Rueda-Almonacid, J.V.; Carr, J,L.; Mittermeier, R,A.; Rodriguez- Mahecha, J,V.; Mast, R,
B.; Vogt, R, C.; Rhodin, A,G, J.; De la Ossa-Velásquez, J.; Rueda, J. N.; Mittermeier,
69
C,G. 2007. Las tortugas y los crocodilianos de los paises andinos del trópico. Serie de
guias tropicales de campo. n° 6. Conservacion Internacional. Bogotá, D. C. Colômbia.
274pp.
Santana, M.A. e Menin, E. 1997. Histologia do esôfago de Leptodactylus labyrinthicus Spix,
1824 (Amphibya, Anura, Leptodactylidae. Revista Ceres, 44(251): 111-123.
Santos, A.L.Q.; Beletti, M.E.; Queiroz R.P. 1998. Estudo morfológico do tubo digestivo da
Tartaruga-da-amazônia Podocnemis expansa. Relatório. Universidade Federal de
Uberlândia, Uberlândia, Minas Gerais. 15p.
Santos, C.M.; Duarte, S.; Souza, T.G.L.; Ribeiro, T.P.; Sales, A.; Araújo, F.G. 2007.
Histologia e caracterização histoquímica do tubo gastrintestinal de Pimelodus maculatus
(Pimelodidae, Siluriformes) no reservatório de Funil, Rio de Janeiro, Brasil Iheringia,
Sér. Zool. Porto Alegre, 97(4):411-417.
Santos-Júnior, L.B. 2009. Dieta de Podocnemis unifilis (Testudines: Podocnemididae) no
Parque Nacional do Jaú, Amazonas, Brasil. Dissertação de Mestrado, Instituto
Nacional de Pesquisas da Amazônia/Fundação Universidade do Amazonas, Manaus,
Amazonas. 28pp.
Schieck, J.O. e Millar, J.S. 1985. Alimentary tract measurements as indicators of diets of
small mammals. Mammalia, 49: 93–104.
Seixas-Filho, J.T.; Brás, J.M.; Gomide, A.T.M.; Oliveira, M.G.; Donzele, J.L.; Menin. E.
2003. Anatomia funcional e morfometria dointestino de Teleostei (Pisces) de água doce
surubim (Pseudoplatystoma coruscans, Agassiz, 1829). Rev. Bras. Zootec., 30(6): 0113.
Silva, D.F. 2004.
Ecólongia Reprodutiva do cabeçudo (Peltocephalus dumerilianus)
Testudines: Pelomedusidae no Parque Nacional do Jaú, Amazonas- Brasil. Dissertação
de Mestrado, Universidade do Estado do Rio de Janeiro, Rio de Janeiro. 120p.
Silva N.B. 2004. Estudo morfohistológico do tubo digestório de Steindachnerina notonota
Ribeiro 1937 (Characiforme, Curimatidae) e Hoplias malabaricus Bloch 1794
(Characiformes, Erythrinidae) do rio Ceará-Mirim em Umari, distrito de Taipu-RN.
Dissertação de Mestrado, Universidade Federal do Rio Grande do Norte, Natal, Rio
Grande do Norte. 62p.
70
Silva Neto, P.B. Abate de tartarugas-da-amazônia. São Paulo: Pró-Fauna Assessoria e
Comércio Ltda. Convênio Empresa Pró-Fauna e Cenaqua-Ibama, 1998. 48p. Relatório.
Smith, N.J.H. 1979. Aquaitc turtles of Amazonia: An endangered resource. Biology
Conservation, 16(3): 165-179.
Snell, R.S. 1985. Histologia Clínica. Rio de Janeiro: Interamericana. 686pp.
Soini, P. 1997. Ecólongía y manejo de quelonios acuáticos en la Amazonia Peruana. In: Fang,
T.G.; Bodmer, R.E.; Aquino, R.; Valqui, M.H. (Eds). Manejo de fauna.
Souza, A.C. e Vogt, R.C. 2008. Analysis of the stomach contents of two species of turtles of
the Amazon: Peltocephalus dumerilianus and Podocnemis erythrocephala. In:
Abstracts. 6 th World Congress of Herpetology, Manaus.
Stevens, C.E. e Hume I.D. 1998. Contributions of microbes in vertebrate gastrointestinal tract
to production and conservation of nutrients. Physiol. Rev., 78(2): 393-427.
Vogt, R. C. 1980. New methods for trapping aquatic turtles. Copeia, (2): 368-371
Vogt, R. C. 1994. Temperature controlled sex determination as a tool for turtle conservation.
Chelonian Conservation and Biology. 1(2): 159-162
Vogt, R.C. 2001. Turtles of Rio Negro. In: Chao, N.L.; Petry, P.; Prang, G.; Sonneschien, L.;
Tlusty, M. (Eds). Conservation and management of ornamental fish resources of the Rio
Negro Basin, Amazônia, Brazil – Project Piaba. Universidade do Amazonas, Manaus,
Brasil. p. 245-262.
Vogt, R. C. 2008. Tartarugas da Amazônia. Wust ediciones, Peru. 104p.
Vogt, R.C.; Rebelo, G.; Moreira, G.; Fachín-Terán, A.; Gasnier, T.R.J.; Silveira, R.; Mann,
B.; Raposo, C.P.; Arnond, P.; Marques, A.S.; Silveira, I.L.M.; Amazonas, W.R.;
Castano, O.V.; Carrillo, C.A.M.; Escalona, T.; Gvada, H.; Sulrez, F.R. 1991.
Geographic Distribution: Podocnemis erythrocephala. Herpetological Review, 22: 25.
Vogt, R.C.; Sever, D.M.; Moreira, G. 1998. Esophageal papillae in Pelomedusid turtles. J.
Hepetology, 32(2): 279-282.
Work, T.M. 2000. Manual de Necropsia de Tortugas Marinas para Biologos en Refugios o
Areas Remotas. National Wildlife Health Center, Hawaii Field Station. 25pp.
71
Wyneken, J. 2001. The Anatomy of Sea Turtles. NOAA Technical Memorandum NMFSSEFSC-470, US Department of Commerce. 172pp.
Young, B. e Hearth, J.W. 2000. Histologia Funcional.Guanabara Koogan, Rio de Janeiro.
415pp.
Zar, J.H. 1996. Biostatistical analysis. Englewood Cliffs, Prentice-Hall. 662p.
Zentek, J. & Dennert, C. 1997. Feeding of reptiles: Practice and problems. Tierarztl. Prax.
Ausg. K. Klientiere. Emitiere., Hannover, 25(6): 684-688.
Zug, G.R. Vitt, L.J. Caldwell, J.P. 2001. Herpetology: An Introduction Biology of
Amphibians and reptiles. 2 ed. Florida: Academic Press. 630 pp.
72
ANEXOS
Anexo 1: Lista do material tombado
Espécie
Número do tombo
Podocnemis sextuberculata
INPA-H 21931 até 21935
Podocnemis sextuberculata
INPA-H 21960
Podocnemis sextuberculata
INPA-H 21964
Podocnemis sextuberculata
INPA-H 21965
Podocnemis sextuberculata
INPA-H 21969
Podocnemis sextuberculata
INPA-H 21970
Podocnemis sextuberculata
INPA-H 21971
Podocnemis sextuberculata
INPA-H 21974
Podocnemis sextuberculata
INPA-H 24165
Podocnemis sextuberculata
INPA-H 25567
Podocnemis sextuberculata
INPA-H 25568
Podocnemis sextuberculata
INPA-H 25571
Podocnemis erythrocephala
INPA-H 21936 até 21938
Podocnemis erythrocephala
INPA-H 21948
Podocnemis erythrocephala
INPA-H 21951
Podocnemis erythrocephala
INPA-H 21952
Podocnemis erythrocephala
INPA-H 21954
Podocnemis erythrocephala
INPA-H 23407
Podocnemis erythrocephala
INPA-H 25561 até 25566
Peltocephalus dumerilianus
INPA-H 21939 até 21947
Peltocephalus dumerilianus
INPA-H 22884 até 22888
Peltocephalus dumerilianus
INPA-H 25558 - 25559
Podocnemis unifilis
INPA-H 26169 até 26172
Podocnemis unifilis
INPA-H 26216 - 26217
Podocnemis unifilis
INPA-H 26294 - 26295
73
Podocnemis expansa
INPA-H 26174 até 26179
Podocnemis expansa
INPA-H 26210 até 26217
Podocnemis expansa
INPA-H 26291 até 26293
74
Anexo 2 : Técnicas histológicas de rotina
Fixação: Os tubos digestórios foram fixados durante 24hs, depois seccionados para obtenção
do esôfago, estomago e intestinos delgado e grosso. Após fixação, sofreram lavagem em água
corrente por aproximadamente 15 minutos, decorrido este tempo deu-se inicio a desidratação.
Desidrataçao: Foi realizada passando-se o fragmento através de uma serie crescente de
alcoóis, de modo a garantir total desidratação do material. As peças seguiram o seguinte
processo:
1. Alcool 70% -------------------------- 1h
2. Álcool 80% -------------------------- 1h
3. Alcool 90% -------------------------- 1h
4. Alcool 100% ------------------------- 1h
5. Alcool 100% ------------------------- 1h
Diafanização: Através desse processo, o álcool é substituído pelo xilol e as peças, por sua,
vez tendem a ficar transparentes. Seguindo o seguinte processo:
1. Xilol 1 -------------------------------- 1h
2. Xilol 2 -------------------------------- 1h
Inclusão em parafina: Passou-se a peça diafanizada por dois banhos de parafina liquida
mantida em estufa a 58°C, por uma hora cada.
Inclusão definitiva ou formação do bloco: Encheram-se pequenos moldes com para fina
lÍquida 50º.C - 55º.C Em seguida, tomou-se a peça e a cóloncou no interior do molde cheio de
parafina, como auxílio de uma pinça, orientando-a no sentido de que a superfície a ser cortada
coincidisse com o lado inferior do molde.
75
Anexo 3 : Colorações
3.1 Hematoxilina-Eosina (HE) – corante de rotina
1. Desparafinização
1. Xilol 1 - 5min
2. Xilol 2 - 5min
2. Hidratação
1. Alcool 100% - 1min
2. Álcool 90% - 1min
3. Alcool 70% - 1min
3. Hematoxilina – 710min
4. Água corrente – tirar excesso do corante
5. Eosina – 10seg
6. Desidratação
1. Alcool 80% - 1min
2. Alcool 100% - 1min
3. Alcool 100% - 1min
4. Alcool 100% - 1min
7. Xilol – 1mim
8. Montar lâminas
Resultados: roxo: núcleos; cor de rosa: citoplasma
76
3.2 Tricômio de Mallory – Fibras colágenas, cartilagem
1. Desparafinar e hidratar – idêntica ao processo para HE
2. Hematoxilina - idêntica ao processo para HE
3. Lavar
4. Solução fucsina ácida 0,5% - 10 min
5. Água destilada – banho
6. Solução ácido fosfomolibdico 1% - 5 seg
7. Água corrente - banho
8. Solução B (solução mãe*) – 30 seg
9. Montar lâminas
*Solução mãe – 1 ml do corante tricomio de Mallory p/ 3 ml de água destilada
Resultados: Laranja-amarelo: hemácias; Cinza: núcleos; Vermelho: fibras musculares; Azul:
tecido conjuntivo, membrana basal, retículo e fibras elásticas; Vermelho-escuros: nucléolos;
Vermelho-claro: fibrina
77
3.3 Ácido Periodico de Schiff (PAS) – Mucoproteína, membrana basal
1. Desparafinar e hidratar - idêntica ao processo para HE
2. Água corrente – 10 min
3. Água destilada – 5 min
4. Ácido periódico 1,0% - 7 min
5. Água corrente – 15 min
6. Água destilada – 5 min
7. Reagente de Shiff – 15 min
8. Água corrente – 15 min
9. Água destilada – lavagem rápida
10. Hematoxilina – 15 seg (contra corar)
11. Agua corrente – 10 min
12. Desidratar e montar
Resultados: Púrpura: Mucoproteína e mebrana basal.
78