Aula 07
GRUPO 14
GRUPO 14
1
P
Propriedades:
i d d
Metais
M t i X Não-Metais
Nã M t i
baixa energia de ionização
b i eletronegatividade
baixa
l t
ti id d
formam óxidos básicos e hidróxidos
alta energia de ionização
alta eletronegatividade
formam óxidos ácidos
Propriedades
p
Atômicas
Configuração Eletrônica e Estados de Oxidação
Configuração
Estados Oxid.
No coordenação
C
[He] 2s22p2
(II)
IV
Si
[Ne] 3s23p2
(II)
IV
4
(6)
Ge
[Ar] 3d104s24p2
II
IV
4
6
Sn
[Kr] 4d105s25p2
II
IV
4
6
Pb
[Xe] 4f14 5d106s26p2
II
IV
4
6
1
2
3
4
No de oxidação do Pb mais comum é +2 devido ao efeito do par inerte
Propriedades
p
Atômicas
Abundância
RC (Å)
C
320
0 77
0,77
1086
2354
4622
6223
3930
Si
277200
1,17
786
1573
3232
4351
1420
Ge
7
1,22
760
1534
3300
4409
949
Sn
40
1,40
707
1409
2943
3821
232
Pb
16
1,46
715
1447
3087
4081
327
(ppm)
1a
EI (kJ/mol)
2a
3a
4a
PF (C)
Ocorrência na
Natureza
Com exceção do Ge, todos os elementos desse grupo são bastante
difundidos e conhecidos:
Ge ocorre em concentração de traços associado a minérios de Carbono
e na forma de traços em minérios de zinco e de prata.
prata Obtido pela
redução do GeO2 com monóxido de carbono e alumínio.
Carbono ocorre nas jazidas de carvão, rochas carbonatadas como
calcita (CaCO3) e dolomita, petróleo etc.
O Carbono existe também em várias formas alotrópicas, entre elas o
grafite e o diamante os quais são obtidos na natureza ou podem ser
fabricados industrialmente.
•
Existem três formas cristalinas do carbono:
– grafita (macia e preta),
– diamante (claro,
(claro duro e forma uma rede covalente) e
– buckminsterfulereno (forma molecular do carbono, C60, as
moléculas são parecidas com bolas de futebol).
Ocorrência na
Natureza
Si é extremamente abundante na forma de sílica (SiO2) e em grande
número de silicatos (SiO32-).
Formas mais comuns de sílica ((SiO2)
Quartzo
Quartzito
Cristobalita
Ocorrência na
Natureza
SiO2 impuras
Ágata (C)
Ametista (Fe3+)
Ônix
Ocorrência na
Natureza
Apesar do Sn e do Pb serem relativamente raros, encontram-se
concentrados em minérios, facilitando a obtenção
O estanho é extraído da cassiterita (SnO2) e o Pb é extraído da galena (PbS2)
Cassiterita (SnO2)
Ocorrência na
Natureza
Galena (PbS)
Propriedades Químicas
Propriedades Químicas
Hidretos
O Carbono forma um número enorme de hidretos de cadeia aberta ou
cíclica, normal ou ramificada (alcanos, alcenos, alcinos, aromáticos etc). A
maior parte deles é pouco reativa.
O Silício forma um número limitado de hidretos saturados chamados
silanos (SinH2n+2). Possuem cadeia normal ou ramificada.
Os hidretos de Germânio (germanos) são semelhantes aos silanos, mas
menos inflamáveis e menos suscetíveis a hidrólise
O estanano (SnH4) é menos estável e difícil de preparar.
O plumbano
l b
(PbH4) é ainda
i d d
de mais
i difí
difícilil obtenção
bt
ã
Haletos
Todos os tetrahaletos são conhecidos (exceto o PbI4)
Com exceção do SnF4 e do PbF4, que são iônicos, os demais são
covalentes.
Quase todos são voláteis
Compostos oxigenados
Os óxidos de carbono diferem dos óxidos dos demais elementos do grupo por
apresentarem ligações múltiplas - entre o Carbono e Oxigênio.
São conhecidos cinco óxidos de Carbono: CO, CO2 , C3O2 , C5O2 e C12O9, além
dos ânions HCO3- e CO32 Existem dois óxidos de silício, o SiO e o SiO2, além dos ânions SiO44- e SiO32.
Óxidos de Sn (SnO e SnO2) e Pb (PbO e PbO2) são anfóteros e reagem com
álcalis formando estanatos e plumbatos.
O carbono é o único que forma ligações múltiplas com ele mesmo
Por que?
Os demais elementos do grupo não podem formar ligações
múltiplas porque seus raios atômicos são muito grandes, não
podendo superpor os orbitais p lado a lado, necessário para a
formação de ligações duplas.
Pequena Revisão...
Ligações
Pequena Revisão...
Ligações
Pequena Revisão...
Hibridização nos orbitais s e p
Carbono (1s2 2s2 2p2)
hib
1s2
2s2
2p2
1s2
sp3 (4)
Pequena Revisão...
Metano
+
Pequena Revisão...
Etano
Pequena Revisão...
Hibridização nos orbitais s e p
Carbono (1s2 2s2 2p2)
hib
1s2
2s2
2p2
1s2
sp2
p
Pequena Revisão...
Hibridização nos orbitais s e p
Carbono (1s2 2s2 2p2)
hib
1s2
2s2
2p2
1s2
sp
p
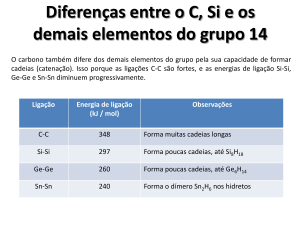
a capacidade de formar cadeias também está relacionada à energia
de ligação (estabilidade)
Ligação
Energia de
d lligação (k
(kJ/mol)
l)
Tendência
dê
a fformar cadeias
d
C-C
348
Grande
Si – Si
222
Forma algumas
Ge – Ge
167
Pequena
Sn - Sn
155
Não forma
•
O Si é bem maior do que o C e o orbital 3p é bem maior do que o orbital
2p, logo, a superposição entre orbitais 3p para formar uma ligação 3p é
significativamente pior do que para uma ligação 2p.
•
Já que a ligação Si-Si é bem mais fraca do que a ligação C-C, o Si
tende a formar ligações .
•
Exemplo: o CO2 é um gás, o SiO2 é uma rede sólida.
Métodos de Obtenção
Grafite: - aquecimento do carvão a altas temperaturas por vários dias
- passagem de alta corrente elétrica sobre barras de carvão em
vários dias
3C + SiO2
coque
SiC
+
2500 oC
2CO
C(grafite)
+
Si(g)
Estrutura: Folhas planas de átomos de carbono ligado covalentemente
em forma de hexágonos (hibridização sp2).
As
A folhas
f lh são
ã unidas
id por fforças iintermoleculares
t
l
l
ffracas.
Sólido escorregadio, condutor elétrico, lustroso, preto, sublima acima de
3500 oC.
Três dos quatro elétrons de valência de cada
Carbono estão envolvidos na formação das
ligações (hibridização sp2) e o 4o elétron forma
uma ligação .
Os elétrons estão deslocalizados por toda
camada, portanto há condução de eletricidade
dentro da mesma camada
camada, mas não de uma
camada a outra.
Métodos de Obtenção
• aquecimento do grafite a altas temperaturas (1600 oC) e pressões
(60.000 atm)
Propriedades
O diamante é incolor, isolante elétrico, extremamente inerte e sua
hibridização
ç é sp
p3
A fusão do diamante envolve ruptura de ligações covalentes fortes que
se estendem em todas as direções.
Em conseqüência da existência dessas ligações, seu PF é de 3930 C
Ce
ele é muito duro e bom condutor de calor.
A condutividade térmica é utilizada p/ identificar diamantes falsos.
Por que é tão diferente do Carbono – Grafite?
Estrutura cúbica do diamante
Sua hibridização é sp3
Emsley, J., Vaidade, Vitalidade, Viriliade, Rio de Janeiro,
JorgeZahar Editor, 2006.
http://www.lifegem.com/
Obtenção do Fulereno (C60)
Eletrodos de grafite
Descarga elétrica
Natureza covalente: solúvel em
solventes orgânicos
Solução vermelha
(cristais de
coloração
mostarda)
Separação por
cromatografia
Dissolução em
benzeno ou
solventes
hidrocarbonetos
Faíscas entre os eletrodos
Fuligem:
Negro de fumo +
clusters de
Carbono C60, C32,
C50, C70, C76 e C84
C60, C32, C50, C70, C76 e C84
Atmosfera
Inerte: Ar
Para evitar
formação de
CO e CO2
Nanotubos de Carbono
Catálise
a
b
c
Principais Compostos
Carbetos
São compostos de carbono com elementos menos eletronegativos (exceto
N, P, O, S e haletos). Tipos de carbetos:
- iônicos ou salinos (grupo 1, 2 e Al, metais nobres, Zn, Cd) – Ex.: Na2C2,
Ca2C, Zn2C.
2
((-CC-)
C C )2-
- intersticiais ou metálicos (elementos de transição)
São extremamente duros – Fe e C (aço) e W e C
(dureza próxima a do diamante)
- covalentes (SiC e B4C)
O SiC é duro e usado como abrasivo (carborundum)
Preparação
Por aquecimento
q
do metal ou de seu óxido com Carbono ou
hidrocarboneto
A hidrólise dos carbetos produz acetileno e o hidróxido do metal
n
2
2 M 2 C
[(
M
)]
[(
C
C
)
]n
o
2
2000 C
• Carbetos iônicos ou salinos reagem com água formando acetileno
Al2 (C2 ) 3 6 H 2O 2 Al (OH ) 3 3 CH CH
CaC2 2 H 2O Ca (OH ) 2 CH CH
Importante p/ produção de cianamida de cálcio
C
CaC2 N 2 1100
Ca ( NCN ) C
o
Fertilizante nitrogenado, fabricação de uréia
Principais Compostos
Cianetos
É obtido industrialmente pela reação de sodamina ou de carbonato de
sódio com Carbono em altas temperaturas
NaNH2 C
NaCN H2
Na 2CO3 4 C N2
2 NaCN 3 CO
são extremamente tóxicos
Principais Compostos
Haletos
Os fluorcarbonetos vão desde o CF4 (inertes, estáveis e utilizados como
l b ifi
lubrificantes,
t
solventes
l
t e iisolantes)
l t ) até
té o CI4 (instável,
(i tá l e sólido).
ólid )
Os clorofluorcarbonetos tais como CFCl3,
CF2Cl2 e CF3Cl são utilizados em
refrigeração e como propelentes de aerosóis
por serem inertes nas condições em que
são utilizados. Na alta atmosfera, reagem
com O3, motivo pelo qual estão tendo seus
usos banidos.
Principais Compostos
Haletos
- O tetracloreto de carbono é produzido a partir do dissulfeto de carbono
o
3 / 30 C
CS 2 3 Cl2 FeCl
CCl4 S 2Cl2
- O Carbono forma compostos halogenados de cadeia longa,
denominados p
polímeros ((PVC,, Teflon,, etc))
pressão
C2F4
CF2 n n HF
Principais Compostos
Óxidos de Carbono
CO: É formado quando C é queimado em atmosfera pobre de O2
C 1 / 2 O2 CO
Queima
Que
a ao ar
a com
co grande
g a de desprendimento
desp e d e to de ca
calor
o (é co
combustível)
bust e )
2CO O 2 2CO 2 H -565 kJ/mol
Vários óxidos de carbono são importantes combustíveis industriais
“gás de água” é uma mistura eqüimolar de CO e H2
“gasogênio”
gasogênio é uma mistura de CO e N2
“gás de iluminação” é uma mistura de CO, H2 , CH4 e CO2
O CO é um agente
g
redutor q
que p
pode ser utilizado na obtenção
ç
de
alguns elementos
fornos
Fe2O3 3 CO altos
2 Fe 3 CO2
37
Principais Compostos
CO: Complexos carbonílicos
C
Ni 4 CO 28
Ni (CO ) 4
o
C , pressão
Fe 5CO 200
Fe(CO )5
o
fotólise
2 Fe
F (CO ) 5
Fe
F 2 (CO ) 9 CO
Métodos de Obtenção
• O Silício puro é obtido da quartzita pela redução com carbono de alta pureza
SiO2 (s) + 2 C(s) Si (s) + 2 CO (g)
• O produto cru é exposto ao cloro, forma o tetracloreto de silício, que é
então destilado e reduzido com H2 até uma forma mais pura do elemento.
SiCl4 (l) + 2 H2 (g) Si (s) + 4 HCl (g)
• Para ser empregado como
semicondutor é necessário o silício
“ultrapuro” (menos de 1 átomo de
impureza por 1 bilhão de átomos de
Si).
O processo é conhecido por
refinamento de zona.
Por isso que os painéis de
Si para conversão de
energia solar em elétrica
são tão caros
O Processo
•
À medida que a espiral derrete o Si,
quaisquer impurezas se dissolvem e
descem pela espiral de aquecimento.
•
No fundo do cristal,
cristal a porção de Si
contendo todas as impurezas é
arrancada e descartada.
descartada
•
O cristal restante é ultrapuro.
Principais Compostos
SiO
É obtido
btid por redução
d ã de
d SiO2 por Si em altas
lt temperaturas
t
t
SiO2 ( s ) Si ( l )
2 SiO ( s )
SiO2 (dióxido de silício ou sílica)
O carbono pode formar duplas ligações. Isso faz com que o CO2 seja
uma molécula isolada
O Si não pode formar duplas ligações e isso faz com que o SiO2 forme
uma molécula tridimensional infinita
Principais Compostos
SiO2: molécula tridimensional infinita
- 1 átomo de Si
- 4 x ½ átomos de O
O SiO2 é quase inerte, reagindo apenas com HF e álcalis
SiO 2 4 HF SiF4 2 H2 O
SiF4 4 H2O 4HF Si(OH) 4 ou SiO 2 . 2 H2O
a sílica é utilizada na fabricação de lentes e prismas e é transparente a luz
ultravioleta
é utilizada na fabricação de utensílios de laboratório e transistores
Principais Compostos
SiO32-: Silicatos
estão presentes em grande abundância na crosta terrestre
podem ser preparados por fusão com carbonatos alcalinos
Na2CO3
CO2 Na2O
1500 o C
2 Na2O SiO2 Na2 SiO3
• Arranjos variados de oxiânions tetraédricos de silício.
•As
A diferenças
dif
entres
t
os vários
á i silicatos
ili t vêm
ê do
d número
ú
de
d cargas
negativas em cada tetraedro, o número de átomos de Oxigênio
compartilhados com outros tetraedros e a maneira com a qual as
cadeias e folhas de tetraedros se unem.
•As diferenças entre as estruturas internas destes sólidos levam a uma
ampla variedade de materiais, desde pedras preciosas a fibras.
Formas de Silicatos
[Si13O9]6-
[Si16O8]12Piroxênios (SiO32-)
Jade: NaAl(SiO3)
[Si14O17]8-
[Si18O24]16-
As cargas positivas faltantes são
completadas com cátions do grupo 1 e 2
Cristobalita: silicato com estrutura semelhante aos átomos na estrutura
do diamante.
diamante
Cristobalita
Diamante
Estruturas mais complexas (e também comuns) resultam quando
alguns íons Si4+ são substituídos por íons Al3+, formando os
aluminossilicatos.
A carga positiva faltante é completada com
cátions do grupo 1 e 2
2.
(Al2Si2O8)2-: posições ocupadas
igualmente por Al e Si
Aplicações
Cimento
Cerâmica: tijolo, azulejos e objetos cerâmicos de
maneira geral
Adesivos
Vidros
Isolantes elétricos e térmicos
Pedras semi-preciosas - joalheria
Silicones: cadeias longas de -O-Si-OSi-O- com as posições de ligação restante
sendo ocupadas por grupos orgânicos.
são estáveis ao calor
possuem propriedades hidrofóbicas
o estado
t d fí
físico
i depende
d
d d
do ttamanho
h
da cadeia polimérica:
- 20 a 500 unidades líquidas
- 6.000 a 7.000 un elastômeros
(polímeros, que na temperatura ambiente podem ser alongados
até duas ou mais vezes seu comprimento e retornam rapidamente ao seu
comprimento)
Silanos: SiH4 (hidreto de silício)
são fortes agentes redutores
queimam
i
ao ar, formando
f
d SiO2
explodem em atmosfera de Cl2, formando SiCl4 e depois SiO2 e HCl
os silanos
il
c// maior
i no de
d elétrons
lét
e forças
f
i t
intermoleculares
l
l
mais
i fortes,
f t
são menos voláteis que os alcanos análogos. Ex.: C3H8 (propano) é gás
e o Si3H8 (trissilano) é líquido (Te = 53oC).
Cadeias de até 4 átomos de Si
São mais reativos que os alcanos análogos
são facilmente hidrolisados em soluções alcalinas:
SiH4 ((g)) + 2
OHH2O(l)
SiO2 ((s)) + 4 H2 ((g))
Métodos de Obtenção
Eletrólise de solução aquosa de cloreto de estanho(II)
Cl2 é formado
C
o ado no
o
anodo
LIGAS METÁLICAS
Sn é formado
S
o ado no
o
catodo
Solda: 1/3 Sn e 2/3 Pb
Solda:
Bronze: 5
5--10% Sn +
Cu
Métodos de Obtenção
Galena
PbS
2 PbS + 3 O2 2 2 PbS
2 PbO
PbO + 2 SO2(g)
PbO + C + C
Pb + CO
BATERIAS DE CHUMBO
ANODO:
O O
Pb(s) + HSO4- PbSO4(s) + H+(aq) + 2eCATODO:
PbO2(s) + 3 H+(aq) + HSO4-(aq) + 2e2e PbSO4(s) + 2 H2O
Principais Compostos
• Hidretos: estabilidade decresce na família
GeH4 e SnH4 são sintetizados pela reação do tetracloreto
apropriado e LiAlH4 em solução de terathidrofurano.
Plumbano mais difícil sintetizar.
• Haletos: de Ge no de oxidação é +4
de Sn no de oxidação é +2 ou +4
de Pb no de oxidação é +2
Devido ao efeito do par inerte
• Óxidos: +2 tornam-se
tornam se mais estáveis descendo no grupo (do Ge até Pb)