UNIVERSIDADE DO EXTREMO SUL CATARINENSE - UNESC
CURSO DE CIÊNCIAS BIOLÓGICAS-BACHARELADO
ADRIANI PAGANINI DAMIANI
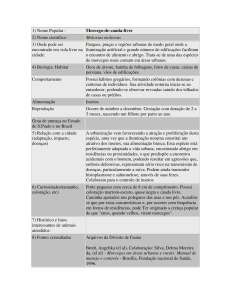
METAIS PESADOS E DANOS NO DNA DE CÉLULAS SANGUÍNEAS
DE MORCEGOS INSETÍVOROS EM ÁREAS DE MINERAÇÃO DE
CARVÃO DA BACIA CARBONÍFERA CATARINENSE
CRICIÚMA, NOVEMBRO DE 2010
ADRIANI PAGANINI DAMIANI
METAIS PESADOS E DANOS NO DNA DE CÉLULAS SANGUÍNEAS
DE MORCEGOS INSETÍVOROS EM ÁREAS DE MINERAÇÃO DE
CARVÃO DA BACIA CARBONÍFERA CATARINENSE.
Trabalho de Conclusão de Curso, apresentado
para obtenção do grau de Bacharel no curso de
Ciências
Biológicas
Bacharelado
da
Universidade do Extremo Sul Catarinense,
UNESC.
Orientadora: Profª Drª.Vanessa Moraes de
Andrade
Co-orientador: Prof. Dr. Jairo José Zocche
CRICIÚMA, NOVEMBRO DE 2010
2
ADRIANI PAGANINI DAMIANI
METAIS PESADOS E DANOS AO DNA DE CÉLULAS SANGUÍNEAS
DE MORCEGOS INSETÍVOROS EM ÁREAS DE MINERAÇÃO DE
CARVÃO DA BACIA CARBONÍFERA CATARINENSE.
Trabalho de Conclusão de Curso aprovado pela
Banca Examinadora para obtenção do Grau de
Bacharel, no Curso de Ciências BiológicasBacharelado da Universidade do Extremo Sul
Catarinense, UNESC, com Linha de Pesquisa
em Genética Toxicológica Ambiental.
Criciúma, 24 de novembro de 2010
BANCA EXAMINADORA
Prof ª Vanessa Moraes de Andrade – Doutorado em Genética e Biologia Molecular–
(UNESC) Orientador
Profª Maria Júlia F. Corrêa Angeloni –Mestre em Ciências da Saúde - (UNESC)
Profª Paula Rohr – Mestre em Genética e Biologia Molecular - (UFRGS)
3
Dedico
este
trabalho
com
profunda
admiração e respeito a meus pais, Irio
Damiani e Ivoneide Paganini Damiani, meus
irmãos Fernando e Sabrina, por todo amor,
carinho e dedicação durante esta pequena
jornada.
4
AGRADECIMENTOS
Primeiramente a Deus pela vida, e por mais esta conquista.
Agradeço a meus pais e meus irmão, que compartilharam comigo meus
ideias e os alimentaram, incentivando-me a prosseguir nesta jornada, fossem quais
fossem os obstáculos; a vocês que mesmo distantes mantiveram-se sempre ao meu
lado lutando comigo.
A minha orientadora Profª. Drª. Vanessa Moraes de Andrade pelos
ensinamentos na área da genética, por todo seu empenho, dedicação, confiança,
amizade e apoio durante estes anos de Iniciação Científica e desenvolvimento do
TCC.
Ao meu co- orientador Prof. Dr. Jairo José Zocche, pelos conhecimentos e
colaboração nas coletas e na realização deste trabalho.
Ao meu namorado Sandro de Souza Pereira, por ter permanecido a meu
lado nos momentos que mais precisei, me apoiando sempre e transmitindo
compreensão, carinho e amor.
Às minhas amiga do coração Giana, Gisele, Ionara, Mariana, Priscila e
Amanda pelo valor da nossa amizade que não foi provado apenas nos momentos de
alegria, mas principalmente nos momentos de dificuldades e tristezas, quando até as
lágrimas por terem sido compartilhadas, foram bem menos dolorosas, obrigada
mesmo por todos os ótimos momentos;
Aos meus amigos e companheiros do Laboratório de Biologia Celular e
Molecular, pelos momentos de descontração e alegria, em especial a Daniela Dimer
Leffa por todo carinho, amizade, dedicação e ajuda na realização desse trabalho, a
Bruna Pazzini e a Giana Hainzenreder pela amizade, companheirismo, fidelidade,
carinho e pelas gargalhadas mesmo nos momentos mais difíceis.
A todos meus colegas de classe que compartilharam os prazeres e
dificuldades desta jornada com os quais convivemos durante tantas horas e
carregamos a marca de experiências comuns que tivemos. Partamos confiantes em
busca de nossos ideais, no exercício de nossa profissão.
A todos os co-autores do artigo: Heavy metals and DNA damage in blood
cells of insectivore bats in coal mining areas of Catarinense coal basin, Brazil, que se
esforçaram o máximo pela realização deste trabalho.
5
“O que é o homem sem os animais, sem a
natureza? Se os animais e a natureza
desaparecerem o homem morrerá dentro de
uma grande solidão. Ensinai a vossos filhos
que a terra é a nossa mãe. Dizei a eles que a
respeitem, pois tudo que acontecer à Terra,
acontecerá aos filhos dela."
Seattle-1853
6
RESUMO
A mineração de carvão é um dos setores básicos da economia do país, contribuindo
de forma decisiva para o bem estar e a melhoria da qualidade de vida das presentes
e futuras gerações, é por natureza, transformadora do meio ambiente, provocando
degradação das áreas onde se encontra instalada. A mineração e a purificação de
minérios são um dos grandes causadores da disseminação mundial dos metais
pesados O objetivo do presente estudo foi examinar o teor dos metais pesados Cr,
Mn, Fe, Ni, Cu, Zn, Cd e Pb e teor de Al e Si no fígado, assim como danos no DNA
nas células sangüíneas de morcegos insetívoros da Bacia Carbonífera Catarinense.
Foram coletadas três espécies de morcegos (Molossus molossus,Tadarida
brasiliensis e Eptesicus diminutus) na área de mineração de carvão e duas na área
controle, ou seja, área livre de mineração (Molossus molossus,Tadarida
brasiliensis).O teor de metais pesados no fígado dos morcegos foi detectado de
acordo com a técnica de PIXE e os danos no DNA foram avaliados pelo Ensaio
Cometa. Os resultados mostram que os teores de Cr, Ni, Cu e Pb em M. molossus e
de Cu e Fe em T.brasiliensis na área de mineração de carvão foi maior do que os
encontrados nos animais da área controle. Em ambas as áreas foram observadas
diferenças nos teores de metais no fígado entre as espécies de morcegos. O índice
e a frequência de danos, parâmetros avaliados pelo Ensaio Cometa, mostraram
diferenças significativas maiores em E. diminutus em relação a M. molossus e
T.brasiliensis. Os valores de ambos os parâmetros ensaio cometa foram
significativamente maiores na área de mineração em relação à área de controle
apenas para T. brasiliensis. Concluímos que os morcegos insetívoros que vivem nas
áreas de mineração da Bacia carbonífera Catarinense podem ser utilizados como
bioindicadores para a detecção de biomagnificação de metais pesados em
ecossistemas terrestres e aquáticos que têm contato direto ou indireto com a
mineração de carvão.
Palavras-chave: Tadarida brasiliensis (I. Geoffroy, 1824),Molossus molossus
(Pallas, 1766), Eptesicus diminutus (Osgood, 1915), metais pesados, ensaio cometa
7
LISTA DE FIGURAS
FIGURA 1:Localização dos municípios na Bacia Carbonífera Catarinense. .............12
FIGURA 2 Corpos Cônicos de rejeitos em Santa Catarina .......................................14
FIGURA 3: Esquema geral propondo possíveis vias de indução da carcinogênese
por metais..................................................................................................................16
FIGURA 4: Representação esquemática da ordem sequencial de respostas ao
estresse causado por poluentes em um sistema biológico .......................................19
FIGURA 5: Tadarida brasiliensis (I. GEOFFROY, 1824............................................23
FIGURA 6: Molossus molossus (Pallas, 1766)..........................................................24
FIGURA 7: Eptesicus diminutus (Osgood, 1915). .....................................................25
FIGURA 8:Visualização do Ensaio Cometa ..............................................................27
FIGURA 9: localização das áreas de estudo no sul do estado de Santa Catarina....29
FIGURA 10: Etapas experimentais do Teste Cometa desde a coleta das células até
a leitura em microscópio óptico. ................................................................................31
FIGURA 11: Classes de Dano obtidas pelo Teste Cometa.......................................32
FIGURA 12: Almofariz com pistilo. ............................................................................32
FIGURA 13: Esquema mostrando a produção de raios-X induzida por um íon ........33
FIGURA 14:Índice de dano no DNA nas células sanguíneas das três espécies de
morcegos insetívoros estudados na área minerada (Siderópolis).............................37
FiIGURA 15: Frequência de dano no DNA nas células sanguíneas das três espécies
de morcegos insetívoros estudados na área minerada (Siderópolis)........................37
FIGURA16: Comparação entre o índice de dano (ID) e freqüência de danos no DNA
(FD) detectada em Molossus molossus e Tadarida brasiliensis na área controle
(Timbé do Sul, SC) e na área minerada (Siderópolis, SC) utilizando o ensaio
Cometa......................................................................................................................38
FIGURA 17: Principais mecanismos de genotoxicidade e mutagenicidade induzida
por metais..................................................................................................................44
8
LISTA DE TABELAS
TABELA 1:conteúdo de metais pesados (µg g -1 peso seco) em morcegos que
Vivem na área minerada e na área controle, no estado de Santa Catarina, Brasil ...36
9
SUMÁRIO
1 INTRODUÇÃO .......................................................................................................10
1.1 CARVÃO.............................................................................................................11
1.2 AGENTES GENOTÓXICOS ...............................................................................15
1.2.1 Metais pesados...............................................................................................15
1.3 BIOMARCADORES E BIOMONITORES............................................................18
1.3.1 Morcegos como bioindicadores ...................................................................21
1.4 CLASSIFICAÇÃO DAS ESPÉCIES UTILIZADAS NO TRABALHO ..................22
1.4.1 Tadarida brasiliensis (I. Geoffroy, 1824).......................................................23
1.4.3 Molossus molossus (Pallas, 1766) ...............................................................24
1.4.4 Eptesicus diminutus (Osgood, 1915)............................................................25
1.5 GENÉTICA TOXICOLÓGICA AMBIENTAL .......................................................26
1.5.1 Ensaio Cometa (EC) .......................................................................................26
2 OBJETIVOS...........................................................................................................28
2.1 Objetivo Geral....................................................................................................28
2.2 Objetivos Específicos .......................................................................................28
3 MATERIAIS E MÉTODOS .....................................................................................29
3.1 Descrição da Área de Estudo...........................................................................29
3.2 Coleta dos animais............................................................................................29
3.1.3 Ensaio Cometa (EC) .......................................................................................30
3.1.4 Análise química ..............................................................................................32
3.1.4 Análise estatística ..........................................................................................34
4 RESULTADOS.......................................................................................................35
4.1. Teor de metais pesados no fígado das diferentes espécies de morcegos
nas áreas estudadas:..............................................................................................35
4.2 Danos no DNA em sangue periférico das diferentes espécies de morcegos
nas áreas estudadas:..............................................................................................37
5 DISCUSSÃO ..........................................................................................................39
6 CONCLUSÃO ........................................................................................................46
REFERÊNCIAS.........................................................................................................47
ANEXO 1- Heavy metals and DNA damage in blood cells of insectivore bats in
coal mining areas of Catarinense coal basin, Brazil. ...........................................60
10
1 INTRODUÇÃO
A poluição é um sério problema ambiental que vem sendo enfrentado em
todo o mundo. Em um sentido amplo pode ser entendida, como a introdução de
qualquer matéria ou energia no meio ambiente, modificando suas características,
tornando-o impróprio aos organismos que normalmente abrigam, caracterizando-se
pela perda das condições propícias à vida em um determinado biótopo (LEMOS;
TERRA, 2003).
As fontes de poluição podem ser classificadas de várias formas,
dependendo do critério considerado: origem (doméstica, agricultura, indústria,
mineração); principais componentes (orgânica, metálica, salina); propriedades e
seus efeitos (tóxicas, putrefativa, inerte, coloidal). Como se pode ver, as fontes de
poluição não estão somente limitadas a descargas de substâncias químicas, outras
intervenções humanas também contribuem para as alterações, em alguns casos
inclusive, levando a profundas rupturas na estrutura e funcionamento do
ecossistema (SILVA; ERDTMANN; HENRIQUES, 2003).
Várias atividades antrópicas como a mineração, vêm criando problemas
ambientais no uso do solo e subsolo, além desta, destacam-se também a
urbanização desordenada, agricultura, pecuária, construção de barragens visando a
geração de hidroeletricidade, e o uso não controlado de água subterrânea, entre
outras (BARBOZA, 1995).
A mineração é considerada uma forma de poluição e quando comparada
a outras fontes de degradação do ambiente, como a agricultura e a pecuária, notase que ela afeta diretamente pequenas áreas. Contudo, os elementos solubilizados
dos rejeitos, se atingirem os cursos d’água, podem impactar negativamente áreas
localizadas a centenas de quilômetros da mineração (SALOMONS, 1995).
A mineração é, por natureza, transformadora do meio ambiente, e sendo
uma atividade de transformação, provoca a degradação das áreas onde se encontra
instalada,
principalmente
quando
executada
de
maneira
irresponsável
(FERNANDES, 2005).
A mineração é um dos setores básicos da economia do país, contribuindo
de forma decisiva para o bem estar e a melhoria da qualidade de vida das presentes
e futuras gerações, sendo fundamental para o desenvolvimento de uma sociedade
11
equânime, desde que seja operada com responsabilidade social, estando sempre
presente os preceitos do desenvolvimento sustentável (FARIAS, 2002).
1.1 CARVÃO
O carvão mineral é um combustível fóssil sólido que ocupa a primeira
colocação em abundância e perspectiva de vida útil, entre os recursos energéticos
não renováveis, sendo em longo prazo a mais importante reserva energética mundial
(BORBA, 2001). Apesar dos vários impactos ambientais, o carvão é mundialmente
utilizado como fonte de energia elétrica por conter como características: abundância
das reservas; distribuição geográfica das reservas; baixos custos e estabilidade nos
preços em relação a outros combustíveis (ANEEL, 2008).
O carvão mineral é formado a partir da matéria orgânica de vegetais
depositados em bacias sedimentares, onde ocorre a ação da pressão e temperatura
em ambiente sem contato com o ar em decorrência de soterramento e atividade
orogênica. Os restos vegetais ao longo do tempo geológico se solidificam,
enriquecendo-se em carbono e perdendo oxigênio e hidrogênio, sendo esse
processo denominado carbonificação (BORBA, 2001).
Sabe-se que 90% das reservas mundiais de carvão mineral, estão
localizadas no hemisfério norte (BRACK, 2003). O Brasil dispõe de uma das maiores
reservas de carvão da América Latina, e os depósitos de maior importância
econômica que apresentam o carvão sub-betuminoso e betuminoso estão na bacia
do Paraná (Formação Rio Bonito, do Permiano Médio) localizada no sul do País, nos
estados do Rio Grande do Sul, Santa Catarina e Paraná (BORBA, 2001; SOARES et
al., 2006). Em Santa Catarina a descoberta de reservas de carvão provocou
profundas modificações no ambiente (MARTINS, 2005). Santa Catarina e Rio
Grande do Sul detêm conjuntamente 99,8% das reservas carboníferas do país
(DNPM, 2004).
As jazidas catarinenses ocorrem nos seguintes municípios: Orleans,
Lauro Muller, Urussanga, Siderópolis, Criciúma, Içara, Nova Veneza, Maracajá,
12
Araranguá, Forquilhinha e Treviso, municípios estes, inseridos na bacia carbonífera
catarinense (MILIOLLI, 2009), (Figura 1).
50º0’W
50º0’W
49º 45’W
49º 45’W
49º 30’W
49º 30’W
49º 15’W
49º 15W
49º0’W
49º0’W
48º 45’W
48º 45’W
Figura 1: Localização dos municípios na Bacia Carbonífera Catarinense.
Fonte: CETEM, 2001).
Os primeiros trabalhos de exploração de carvão no estado Catarinense
ocorreram na região de Lauro Muller, no ano de 1861, quando o Visconde de
Barbacena recebeu do Imperador D. Pedro II a concessão para explorar o carvão
mineral. Até 1884 predominavam as pequenas produções, com extração totalmente
manual (CETEM, 2001). O início das atividades de produção de carvão mineral
intensificou-se, sobretudo, a partir da década de 40, após instalação da Companhia
Siderúrgica Nacional (CSN) no ano de 1945 (SOARES; TRINDADE, 2002).
Este mineral constitui dois terços dos recursos energéticos não
renováveis nacionais, sendo suas reservas vinte vezes maiores do que as do
petróleo e setenta e cinco vezes superiores às do gás natural. Santa Catarina dispõe
de reserva de 4,3 bilhões de toneladas, o que corresponde a 13 % do total do País
(SANCHEZ; FORMOSO, 1990).
O carvão encontra-se depositado em jazimentos superficiais (aflorante –
40 metros) e profundos (além de 50 metros). Esta classificação é dada em função do
custo-benefício econômico de sua exploração que determina a forma de mineração
13
a céu aberto ou subterrânea. Embora distintas no modo de extração do minério,
cada forma emprega uma série de técnicas que têm gerado vários impactos
ambientais (DNPM, 2004).
A exploração do carvão em Santa Catarina é feita em minas subterrâneas
e a céu aberto, na qual a profundidade da camada carbonífera é critério para
seleção entre um ou outro método de lavra. Sendo que a lavra subterrânea é
utilizada quando a jazida de carvão se encontra em camadas mais profundas (cerca
de 30m até aproximadamente 120 m) e lavra a céu aberto é utilizada, quando a
jazida de carvão se encontra próxima à superfície do solo até, aproximadamente,
30m de profundidade (KLEIN, 2006).
No sul do estado de Santa Catarina, a lavra mecanizada teve início por
volta de 1940 (CETEM, 2001) e desde então, assim como a mineração de subsolo,
tem provocado alterações físicas, químicas e biológicas nos ecossistemas
associados às áreas de mineração, comprometendo os recursos hídricos, o solo e à
biota de forma direta numa extensão que varia de 2000 a 6000 ha (COSTA, 2004;
2005; 2007; COSTA; ZOCCHE; ZOCCHE-DE-SOUZA, 2007; ZOCCHE-DE-SOUZA,
2007; FREITAS, 2007).
A extração do carvão teve impacto positivo no desenvolvimento
econômico da região sul de Santa Catarina, mas por outro lado, os danos
ambientais assumiram proporções gigantescas (CAROLA, 2002; KOPEZINSKI,
2000).
Municípios que obtinham rendas agrícolas anteriormente à mineração
viram que após a abertura das minas a qualidade dos recursos naturais (ar, água,
solo, flora, fauna) mudaram radicalmente. A mineração a céu aberto, sem cuidados
ambientais, executada na Bacia Carbonífera Catarinense até meados da década de
80, consistia na retirada da cobertura vegetal, do solo e dos estéreis da mineração,
até encontrar as camadas de carvão. A vegetação e o solo eram depositados na
base e as camadas superiores de folhelhos e estéreis da mineração no topo de
pilhas, geralmente cônicas (figura 2), gerando a inversão de camadas litológicas e
criando uma paisagem estéril, denominada de paisagem lunar (ALEXANDRE, 1999).
14
Figura 2 Corpos Cônicos de rejeitos em Santa Catarina
Fonte: BELOLLI, 2002.
Nos dias atuais, muitos campos de mineração já não se encontram mais
ativos, mas infelizmente, o término da lavra não significa o fim do processo poluidor,
nem o esgotamento da fonte geradora de poluição, pois, os rejeitos carboníferos
oriundos do processo, os quais compõem o passivo ambiental gerado, continuam
reativos por muito tempo, disponibilizando íons metálicos (As, Cd, Cu, Ni, Pb, Zn, Al,
Cr, Mn, Co, entre outros) comprometendo assim, o restabelecimento das
comunidades vegetais terrestres e aquáticas (ZOCCHE, 2005).
O carvão tem sido descrito como o mais significante poluente de todas as
energias fósseis, contendo uma mistura heterogênea de mais de 50 elementos,
incluindo os óxidos e outros elementos como sílica, hidrocarbonetos aromáticos
policíclicos (HAP), metais pesados e cinzas (LÉON et al., 2007). Esses elementos
podem ser incorporados ao carvão através da absorção pelas plantas que o
originaram, estando portanto, associados à fração orgânica do mesmo (SILVEIRA, et
al 2009), ou ainda, associados à fração inorgânica do mineral, por adsorção às
argilas por meio da água que circulava no ambiente de deposição ou, incorporados
junto ao material sedimentar, que se depositou sobre o banco de carvão em
sucessivas camadas ao longo do tempo (ZOOCHE, 1989).
Desse modo as áreas de mineração de carvão e depósitos de rejeitos
apresentam alterações físicas: por modificar as condições de habitat do ambiente
físico como suporte de vida; químicas, pois expõem materiais tóxicos, os quais em
15
contato
com
outros
elementos
ocasionam
mudanças
no
ambiente
e
conseqüentemente nas espécies que neles se instalam e biológicas, pois eliminam
espécies, limitam o estabelecimento de novas e restabelecimento de antigas,
interferindo
na
composição
das
cadeias
alimentares
e
nas
relações
de
interdependência (LAWREY, 1976).
Apesar das condições extremas geradas nestes locais, observa-se que
uma série de espécies vegetais se desenvolvem espontaneamente, absorvendo os
elementos disponíveis, inclusive os metais pesados (ZOCCHE; PORTO, 1993;
COSTA, 2005; 2007; ZOCCHE-DE-SOUZA, 2007; FREITAS, 2007).
1.2 AGENTES GENOTÓXICOS
1.2.1 Metais pesados
Embora não exista uma definição clara de o que é um metal pesado, o
mesmo é freqüentemente definido com um peso atômico de 50 (BISHIT et al.,1976)
e densidade acima de 4,5 g/cm3 (KUNTZE, 1986) ou mais, 5.0 g/cm3 (JÄRUP,
2003). Sendo assim, na maioria dos casos, peso atômico e densidade são tomadas
como definições de metais pesados (BISHIT et al.,1976).
O grupo dos metais pesados também chamados de metais-traço é
constituído por alguns metais que são considerados essenciais do ponto de vista
biológico em percentagem muito pequena (PRONCHOW; PORTO, 2000). Quando
presentes em grandes concentrações podem apresentar alta toxicidade aos
organismos vegetais e animais produzindo efeitos danosos, (BAUMGARTEN;
POZZA, 2001) ocasionando também, impactos negativos a ecossistemas terrestres
e aquáticos, constituindo-se assim, em contaminantes ou poluentes de solo e água
(GUILHERME et al., 2005).
Os metais pesados podem ser encontrados em todos os compartimentos
do ecossistema, sempre existiram no planeta e nunca se esgotam. São oriundos de
fontes naturais e/ou antrópicas como intemperismo de rochas, deposição
atmosférica, lançamentos de efluentes urbanos, industriais e agrícolas, além da
16
lixiviação de resíduos contaminados, sendo a mineração e a purificação de minérios
um dos grandes causadores da sua disseminação mundial (PASCALICCHIO, 2002).
Alguns ambientes aquáticos podem produzir formas orgânicas de metais
pesados, permitindo assim a sua provável incorporação na cadeia alimentar, como
uma forma mais tóxica (O'
SHEA, 2001). Minas a céu aberto podem acumular água,
formando lagos, com níveis potencialmente tóxicos de metais pesados que são
colocados à disposição dos animais através de bebida ou alimento, podendo dar
início a contaminação das cadeias alimentares (O'
SHEA, 2001).
Os metais pesados podem causar efeitos adversos em sistemas
biológicos, entre eles, genotoxicidade e carcinogenicidade (PARAÍBA, 2006). Além
disso, podem produzir quebras na fita-dupla de DNA (DSBs) indiretamente, através
do estresse oxidativo, como descrito por Gastaldo et al. (2009). O estresse oxidativo
ocorre quando há um desequilíbrio, criado pela excessiva geração de oxidantes ou
uma diminuição de antioxidantes (GUO; YANG; WU, 2008).
Segundo Benassi (2004), metais como ferro, cobre, cádmio, cromo,
níquel, entre outros, possuem a capacidade de produzir espécies reativas de
oxigênio (EROs), e quando essas espécies são formadas intracelularmente, elas
podem induzir peroxidação lipídica, dano ao DNA, depleção de grupamentos tióis,
alterar vias de transdução de sinais e a homeostase do cálcio (figura 3).
Figura 3: Esquema geral propondo possíveis vias de indução da carcinogênese por metais.
Adaptada de Galaris e Evangelou (2002).
17
De acordo com o esquema acima, os metais podem provocar dano ao
DNA de forma direta ou indireta pela formação das EROs. A geração das EROs
pode ser afetada pelos metais por muitas vias. Por exemplo, através da reação de
Fenton (Fe2+ + H2O2
Fe3+ + HO• + HO-), da indução do processo inflamatório,
ou através da formação intermediária de tioradicais (RSH + Cu2+
RS• + Cu++
H+). A maior parte do dano ao DNA é reparada pelo eficiente mecanismo celular de
reparo, enquanto que uma pequena parte do dano resulta em mutação. Mudanças
nos níveis das EROs também influenciam no equilíbrio redox intracelular, afetando
fortemente as vias de transdução de sinais, as quais ativam ou inativam vários
fatores de transcrição. Tanto a mutação quanto os fatores de transcrição podem
modular a expressão de uma variedade relevante de genes para a transformação
celular, conduzindo finalmente ao desenvolvimento do câncer (BENASSI, 2004).
Várias reações celulares são influenciadas e/ou afetadas pela presença
de metais. Lesões oxidativas do DNA desempenham um papel importante em várias
doenças, incluindo câncer e envelhecimento precoce (GRISHAM, 1994; BECKMAN;
AMES, 1998; COLLINS,1999; DURACKOVA, 2008 ).
Os metais pesados oriundos das atividades de lavra e beneficiamento do
carvão na Região Carbonífera Catarinense são principalmente: arsênio (As), bário
(Ba), cádmio (Cd), chumbo (Pb), cobre (Cu), ferro (Fe), manganês (Mn), mercúrio
(Hg), níquel (Ni), prata (Ag), selênio (Se) e zinco (Zn). Sendo que para muitas destas
substâncias químicas há evidências de mutagenicidade e carcinogenicidade em
humanos e/ou animais de laboratório (AGOSTINI; WAJNTAL, 1993).
Ao serem absorvidos e metabolizados pelas plantas, esses elementos
químicos tornam-se disponíveis aos animais que os ingerem ao se alimentarem das
raízes, cascas, caules, folhas, néctar, pólen, resina, frutos ou sementes (animais
herbívoros) e de outros animais (carnívoros de primeira e de segunda ordem) que
têm contato com as áreas mineradas (HENDRIKS et al., 1995). O homem assim
como outros animais, pelo fato de ocupar os níveis mais elevados da cadeia
alimentar, ao ingerir, produtos oriundos de áreas contaminadas com elementos
nocivos, como os metais está passivo de sofrer riscos á saúde (WALKER et al.,
2002).
As populações humanas que vivem no entorno e a jusante das áreas
mineradas de carvão no sul de Santa Catarina, utilizam ervas para a medicina
caseira, exploram pastagens que se desenvolvem sobre áreas mineradas não
18
restauradas, para o alimento do gado, utilizam os recursos hídricos para a produção
de arroz irrigado , assim como, a vegetação que se desenvolve sobre áreas
mineradas como pasto apícola (COSTA, 2004; 2005; 2007; ZOCCHE, 2005;
ZOCCHE-DE-SOUZA, 2007; FREITAS, 2007). Na Bacia Carbonífera Catarinense
ainda não foram desenvolvidos estudos que tratem da biomagnificação de metais
pesados nos ecossistemas de áreas de mineração do carvão.
Monitorar o impacto ecológico e os danos à saúde humana, como por
exemplo, o câncer e mutações herdáveis, é problemático devido principalmente a
complexidade e ao custo decorrente da identificação das substâncias químicas
envolvidas, também, pelo fato de que os organismos na natureza não estão
expostos a um único composto, e sim, a uma complexa mistura destes, gerando um
problema na qual, estudos epidemiológicos falham no que se refere à estipulação do
tempo pois algumas anomalias necessitam de um longo período de exposição e
condições de exposição para se expressarem (TICE, 1995).
A investigação dos riscos deletérios a que a população humana está
exposta pode ser desenvolvida de forma indireta, ou seja, por meio de estudos com
outros organismos de topo de cadeia, por meio da avaliação de danos citotóxicos e
genotóxicos fornecendo assim, indicação da contaminação da cadeia alimentar
(ZOCCHE, 2005).
1.3 BIOMARCADORES E BIOMONITORES
Avaliar a quantidade de poluentes presentes no ambiente e nos animais
por si só não é suficiente, havendo a necessidade de se detectar e avaliar o impacto
destes poluentes nos organismos expostos, devido ao fato de existirem diferenças
na forma de metabolizar os xenobióticos. Para se poder detectar e avaliar os efeitos
biológicos utilizam-se biomarcadores. A utilização de biomarcadores para detecção
de contaminação ambiental iniciou-se no Brasil no final dos anos 90 (BAINY;
WOODIN; STEGEMAN, 1999).
Vários são os parâmetros biológicos que podem estar alterados como
conseqüência da interação entre o agente químico e o organismo (AMORIN, 2003),
entretanto, biomarcadores podem ser definidos como sistemas indicadores que
19
geralmente incluem subsistemas de um organismo completo, usados para indicar
um alvo específico.( SILVA, ERDTMANN,HENRIQUES,2003)
De acordo com Amorin (2003), o biomarcador compreende toda
substância ou seu produto de biotransformação, assim como qualquer alteração
bioquímica precoce, cuja determinação nos fluidos biológicos, tecidos ou ar exalado,
avalie a intensidade da exposição e o risco à saúde.
Existem biomarcadores moleculares, celulares e ao nível de indivíduo. As
duas características mais importantes dos biomarcadores são: a) permitem
identificar as interações que ocorrem entre os contaminantes e os organismos vivos;
b) possibilitam a mensuração de efeitos sub-letais. Esta última característica permite
pôr em prática ações remediadoras ou, melhor ainda, ações preventivas. Daí a
importância e o interesse atual de incorporação da análise de biomarcadores em
programas de avaliação da contaminação ambiental (JESUS, 2008).
Uma questão que pode ser respondida por biomarcadores é se há
contaminação ambiental em grau suficiente para causar efeitos fisiológicos. Se a
resposta for positiva, investigações adicionais podem ser justificadas para
determinar a natureza e o grau de contaminação (WALKER et al., 1996). A ordem
seqüencial de resposta ao estresse causado por um poluente em um sistema
biológico é visualizado na figura 4. (JESUS, 2008)
Figura 4: Representação esquemática da ordem seqüencial de respostas ao estresse causado por
poluentes em um sistema biológico (adaptado de VAN DER OOST et al., 2003).
20
O efeito em nível hierárquico superior é sempre precedido por mudanças
no processo biológico. Desta forma, o biomarcador é utilizado como um sinal prévio
refletindo a resposta biológica causada por uma toxina (JESUS, 2008).
Biomonitores, também conhecidos por organismos sentinela, vêm sendo
utilizados há muito tempo para alertar as pessoas sobre ambientes perigosos. Na
seleção de um biomonitor os principais aspectos a serem observados são: (a) os
animais devem dividir o mesmo ambiente com o homem; (b) responder de forma
semelhante a químicos tóxicos; e (c) desenvolver patologias similares como resposta
a estes efeitos (SILVA; ERDTMANN; HENRIQUES, 2003).
A
principal
vantagem
de
se
utilizar
organismos
sentinela
para
monitoramento ambiental, comparado ao método tradicional físico-químico, é a
informação que ele pode dar em relação à exposição acumulativa em organismos e
populações sobre a resposta de letalidade e sub-letalidade, além de detectar efeitos
indiretos (BROMENSHENK; SMITH; WATSON, 1995).
Os organismos mais susceptíveis aos agentes impactantes possuem
algumas características que os distinguem dos demais, tornando-se um bioindicador
de ambientes e da qualidade do ar, quando indicam a umidade do ar, acidez do solo
e pH, além de demonstrarem alta sensibilidade a poluentes, apresentam capacidade
de reter contaminantes atmosféricos em suas células, funcionando também como
biomonitores (OLIVEIRA et al., 2007).
Biomarcadores quando combinados com biomonitores podem criar um
sofisticado sistema alvo múltiplo para detectar uma variedade de perigos ambientais
de forma rápida e economicamente viável, em um único organismo teste (SILVA;
ERDTMANN; HENRIQUES, 2003).
Diversos organismos que podem ser utilizados como biomonitores e/ou
bioindicadores: bivalves Dreissena polymorpha (KLOBUCAR et al, 2003), animais
marinhos e de água doce (LEE; STEINERT, 2003), animais vertebrados aquáticos
como peixes (ANDRADE et al., 2004), Artemia salina (SVENSSON et al, 2005 ),
microcrustáceos como Daphnia magna (ALVES; SILVANO, 2006), moluscos (SILVA,
2007; LEFFA et al,2010), bactérias Salmonella typhimurium e Escherichia coli,
anelídeos, artrópodes,vegetais, plantas como Allium cepa, Tradescantia, Vicia faba
(KOVALCHUK; KOVALCHUK, 2008), Baccharis trimera (SOUZA; COSTA; ZOCCHE,
2007),
anfíbios
e
répteis
(BRANDÃO,
2002),
aves
como
os
pombos
21
(SCHILDERMAN et al., 1997), e mamíferos como Ctenomys torquatus (SILVA et al.,
2000), Rattus rattus e Mus musculus (LÉON et al., 2007).
Todos estes organismos respondem de maneira muito particular, a uma
variedade de alterações no ambiente em que vivem, fornecendo dados fisiológicos,
bioquímicos, genéticos e comportamentais (SHUGART, 1994).
1.3.1 Morcegos como bioindicadores
Em áreas de mineração de carvão, morcegos insetívoros podem ser
usados como bioindicadores de riscos à saúde humana, pois estes animais estão no
mesmo nível trófico da cadeia alimentar, como os seres humanos (JONES et al.,
2009). Além disso, os morcegos utilizam o espaço acima de córregos, lagoas ou
matas ciliares como locais de alimentação (O'
SHEA et al. 2001; FUKUI et a. 2006;
SWIFT, 2009).
Os efeitos dos elementos tóxicos sobre os morcegos, podem se dar de
forma direta por meio da exposição direta, ou de forma indireta onde, manifestam-se
através da reestruturação ecológica das biocenoses, que podem alterar o
suprimento alimentar, o hábitat físico, a disponibilidade e qualidade da água entre
outros fatores. Águas correntes e lagos podem sofrer alterações na turbidez, nos
processos de sedimentação e de transferência de elementos de um compartimento
para outro, os quais causam impactos à vida aquática reduzindo assim as fontes de
alimentos dos morcegos e/ou provocando o fenômeno de biomagnificação de
elementos tóxicos na cadeia alimentar (SMOLDERS et al., 2003).
A contaminação de insetos terrestres por metais pesados, ingeridos no
forrageamento de plantas de áreas mineradas é elevada, resultando em uma
possível exposição dos morcegos que os ingerem. Esses podem ainda estar
expostos a metais que entram nos sistemas aquáticos por meio da lixiviação e
drenagem superficial, os quais são absorvidos pelos insetos aquáticos emergentes,
podendo a contaminação ocorrer em distâncias consideráveis a jusantes das áreas
mineradas (WICKHAM et al., 1987; AXTMAN et al., 1997).
Alguns metais, como por exemplo, o Cd, pode ser progressivamente
acumulado com a idade em morcegos, sem, contudo, haver manifestações visíveis
22
da toxicidade. Estes animais podem viver entre 20 anos ou mais, podendo tornar-se
particularmente suscetíveis aos efeitos deletérios (WALKER et al., 2002).
É provável que alguns morcegos possam acumular metais pesados e
outros elementos tóxicos provenientes de fontes de mineração pela exposição ao
longo da cadeia alimentar. Poucos estudos têm considerado a exposição e impactos
potenciais de metais pesados tóxicos, tais como Hg, Pb e Cd sobre os morcegos
(MA; TALMAGE, 2001).
Pesquisas em áreas de mineração de carvão onde haja exposição de
morcegos devem ser desenvolvidas no sentido de avaliar a concentração de metais
pesados nestes animais. Estes estudos devem envolver pesquisas que tratem da
interpretação dos efeitos deletérios associados à concentração de metais em tecidos
animais. Estudos relacionados à concentração e genotoxicidade de metais pesados
em células do tecido sangüíneo e hepático devem ser realizados no sentido de
investigar o grau de exposição direta dos morcegos a concentrações crescentes de
metais pesados na cadeia alimentar (CLARK, et al., 1982).
Morcegos insetívoros que vivem em áreas de mineração de carvão
podem, portanto, ser um ótimo indicador ecológico do risco potencial que as
populações humanas que vivem em tais áreas estão submetidas, sobretudo, pela
acumulação de determinados elementos não essenciais e potencialmente tóxicos
em seus tecidos (CLARK et al., 1982).
1.4 CLASSIFICAÇÃO DAS ESPÉCIES UTILIZADAS NO TRABALHO
Os morcegos pertencem ao Reino Animalia, Filo Chordata, Classe
Mammalia,
Ordem
Chiroptera.
Esta
ordem
inclui
os
únicos
mamíferos
verdadeiramente voadores. No Brasil ocorrem cerca de 150 espécies distribuídas em
nove famílias. Os quirópteros, de um modo geral, apresentam um período de
desenvolvimento embrionário relativamente longo, quando considerado o tamanho
dos indivíduos, e a maioria das espécies produz apenas um filhote por gestação.
Sua importância ecológica está na sua alta diversidade e abundância nas regiões
tropicais (PASSOS, 2003).
23
1.4.1 Tadarida brasiliensis (I. Geoffroy, 1824)
Os morcegos da espécie Tadarida brasiliensis (I. GEOFFROY, 1824)
(figura 5), pertencem a família Molossidae. Esta espécie tem uma ampla distribuição
sendo encontrada no sul do Brasil, Bolívia, Argentina, Chile, Texas, Porto Rico e
Cuba (BARQUEZ, 2010).
Figura 5: Tadarida brasiliensis (I. GEOFFROY, 1824).
Fonte:Marta Fabian.
Em relação ao habitat, ocorre em grande variedade de habitats, são
espécies insetívoras apresentando uma alimentação diversificada, nas diferentes
regiões onde é encontrada (BARQUEZ, 2008) no Texas tem uma alimentação
baseada em mariposas, besouros, moscas,percevejos e formigas (ROSS 1961;
WHITAKER, 1996). Em Cuba, Silva-Taboada (1979) indicou que a dieta consistia em
Dipteros (70,7%), Hymenopteros (formigas) (29,6%), Lepidopteros (25,9%),
Homopteros (18,5%), Coleopteros (7,4%) e Odonatos (7,4%). Rodríguez Durán et al.
(1993) sugeriram que T.brasiliensis em Porto Rico poderia ter hábitos alimentares
semelhantes aos encontrada em Cuba.
São animais migratórios e que formam grandes colônias, mas podem
formar pequenas (BARQUEZ, 2010.)
O nascimento dos filhotes ocorre entre o final da primavera e o início do
verão (CAGLE, 1959; TWENTE, 1956; MARQUES; FABIAN, 1994).
24
1.4.3 Molossus molossus (Pallas, 1766)
Molossus molossus (Pallas, 1766), pertencem a família Molossidae, ocorre do
México ao Paraguai, Uruguai e norte da Argentina, com registros para o Suriname,
Peru, Guianas, Venezuela e Trinidad e Tobago (KOOPMAN 1993, NOWAK 1994).
Segundo Marinho-Filho;Sazima (1998) esta espécie é amplamente difundida no
Brasil e ocorre em cinco grandes biomas (Amazônia, Mata Atlântica, Cerrado,
Caatinga e Pantanal).
Conhecido popularmente como morcego-de-cauda-livre (figura 6), pode ser
encontrado na cidade, em parques, praças e regiões urbanas, de modo geral onde a
iluminação artificial e grande número de edificações facilitam o encontro de alimento
e abrigo. Trata-se de uma das espécies de morcegos mais comuns em áreas
urbanas (BREDT, 1996).
Figura 6: Molossus molossus (Pallas, 1766).
Fonte: Merlin D. Tuttle
Seu habitat é geralmente em buracos de árvore, bainha de folhagens,
forro de casas, caixas de persianas e vãos de edificações. Possuem hábitos
gregários, formando colônias com dezenas e centenas de indivíduos. Sua atividade
noturna inicia-se ao entardecer, podendo-se observar revoadas saindo dos telhados
de casas ou prédios (BREDT, 1996).
Alimenta-se de insetos; reproduz-se de outubro a dezembro e a gestação
tem duração de 2 a 3 meses, nascendo um filhote ao ano. São pequenos com cerca
de 8 cm de comprimento. Possuem coloração marrom-escura, quase negra e cauda
livre. Caminham apoiados nos polegares das asas e nos pés (BREDT, 1996).
25
1.4.4 Eptesicus diminutus (Osgood, 1915)
Eptesicus diminutus (Osgood, 1915), pertencem a família Vespertilioninae,
(Figura 7), ocorre na Venezuela, Uruguai, Paraguai, norte da Argentina e Brasil
(SIMMONS, 2005). Segundo Reis et al. (2007), no Brasil esta espécie ocorre nos
seguintes estados: Distrito Federal, Bahia, Espírito Santo, Maranhão, Minas Gerais,
Paraná, Santa Catarina, Rio Grande do Sul e São Paulo.
Figura 7: Eptesicus diminutus (Osgood, 1915).
Fonte: Fernando Carvalho
As espécies brasileiras deste gênero são de tamanho pequeno médio
(antebraço geralmente variando de 30 a 36,5 mm), de coloração bastante variada
(castanha em diferentes tons, enegrecida ou acinzentada) e podem apresentar
ventre acinzentado (BARQUEZ et al 1999).
Alimentam-se de insetos em geral capturando-os no vôo, (REIS, et al 2007;
BARCLAY; BRIGHAN, 1991). Estudos realizados na Argentina, com o conteúdo
estomacal deste mamífero indicaram o consumo preferencial de coleópteros
(BARQUEZ, et al 1999) e no Brasil Reis et al (1999) registraram a preferência por
lepidópteros e dípteros. Ocupam abrigos como buracos ocos e cascas de árvores,
bem como construções humanas (BARQUEZ, et al 1999; EISENBERG; REDFORD,
1999).
26
1.5 GENÉTICA TOXICOLÓGICA AMBIENTAL
A genotoxicidade é o setor da genética que estuda os fatores que alteram
a base genética da vida, em sua estrutura físico-química, o DNA (ácido
desoxirribonucléico),
sendo
este
processo
chamado
de
mutagênese.
A
genotoxicidade estuda como o organismo se encontra exposto a algum agente de
toxicidade, analisando o que perturba a vida ou induz a morte, tanto em nível de
célula como de organismo. É uma especialidade recente que se situa entre
toxicologia e genética, por isso é também denominada genética toxicológica (SILVA;
ERDTMANN; HENRIQUES, 2003).
A genética toxicológica engloba o estudo dos possíveis agentes
causadores de genotoxicidade e seus mecanismos de ação. Quando estes agentes
estão inseridos ou têm repercussão no meio ambiente ou na biota podemos
especializar o conceito de genética toxicológica para genética toxicológica ambiental
(BORTOLOTTO, 2007).
Dentro dessa área da ciência existem os bioensaios que são utilizados para o
monitoramento da genotoxicidade ambiental, dentre eles o Teste Cometa (SILVA,
ERDTMANN, HENRIQUES, 2003)
1.5.1 Ensaio Cometa (EC)
O teste cometa está sendo utilizado para estudos de toxicogenética
devido a suas peculiaridades e vantagens quando comparado a outros testes para
detecção de substâncias genotóxicas, entretanto, esse teste não detecta mutações,
mas sim lesões genômicas que, após serem processadas, podem resultar em
mutação. Diferente das mutações essas lesões são passíveis de correção, e dessa
maneira esse teste também pode ser utilizado para estudos de reparo no DNA
(GONTIJO; TICE, 2003).
O Ensaio Cometa ou gel de eletroforese em célula única (SCGE) foi
introduzido pela primeira vez por Östling e Johanson (1984) através da técnica
microeletroforética para visualização direta dos danos no DNA em células
27
individuais. Nessa técnica observou-se que nas células irradiadas, após a corrente
elétrica com pH neutro, partes do DNA foram arrastadas do seu núcleo e fragmentos
produzidos por crosslinks (ligações cruzadas) e quebras duplas na fita de DNA
(DSB) migraram mais, resultando na imagem de um “cometa” (Figura 8)
(FAIRBAIRN; OLIVE; O’NEIL, 1994).
Figura 8:Visualização do Ensaio Cometa.
Fonte: autor
Os cometas são classificados geralmente em categorias que variam de
quatro a cinco e a identificação de dano no DNA se dá através do comprimento de
migração e/ou a proporção relativa de DNA na cauda em relação ao centro (TICE et
al., 2000).
Este teste de genotoxicidade apresenta vantagens sobre outros testes,
pois ele inclui: sensibilidade para detecção de níveis de dano no DNA; exige um
número reduzido de células por amostras; flexibilidade; baixo custo; facilidade de
aplicação; habilidade para conduzir estudos usando pequenas amostras da
substância teste; e possui um período de tempo relativamente curto para obtenção
de resultados. Devido a essas características esse teste é amplamente utilizado para
pesquisar áreas que variam das humanas até biomonitoramento ambiental, aos
processos de reparo do DNA na genética toxicológica (TICE et al., 2000).
28
2 OBJETIVOS
2.1 Objetivo Geral
Examinar o teor dos metais pesados Cr, Mn, Fe, Ni, Cu, Zn, Cd e Pb e
teor de Al e Si no fígado, assim como danos no DNA nas células sangüíneas de
morcegos insetívoros da Bacia Carbonífera Catarinense.
2.2 Objetivos Específicos
•
Determinar o conteúdo de metais pesados em morcegos insetívoros;
•
Comparar o teor de metais pesados nos tecidos dos morcegos
existentes na área de mineração de carvão com a área controle e com dados
contidos na literatura;
•
Comparar os danos do DNA registrados nas áreas de mineração de
carvão com a área controle;
29
3 MATERIAIS E MÉTODOS
3.1 Descrição da Área de Estudo
O estudo foi realizado em duas cidade do sul de Santa Catarina (figura 9),
uma sob a influência direta da mineração do carvão: Siderópolis (28º35’ S e 49º 25’
W) que está localizada na bacia carbonífera catarinense e a segunda, Timbé do Sul
(28º 49'S e 49º 50'W), localizada a 50 Km ao sul de Siderópolis, definida como área
controle para efeitos comparativos, pois está localizada em uma região livre da
influência da mineração (SANTA CATARINA, 2004).
Figura 9: localização das áreas de estudo no sul do estado de Santa Catarina
Área controle ( ) está localizada em Timbé do Sul (28º 49'S e 49º 50'W).
Área minerada ( ) está localizada em Siderópolis (28º35’ S e 49º 25’ W)
Fonte: Autor
3.2 Coleta dos animais
Foram coletados 8 morcegos adultos da espécies M. molossus (Pallas,
1766), na área
minerada e 17 na área controle. Já a espécie T.brasiliensis (I.
30
Geoffroy, 1824), foram coletados em número de 25 na área minerada e 15 na área
controle, enquanto que a espécie E. diminutus (Osgood, 1915) teve 32 animais
capturados na área minerada e nenhum na área controle. Todos os exemplares
serviram de amostras para análises de metais e avaliação de danos ao DNA.
A seleção das espécies para análise foi baseada no tipo de dieta
(exclusivamente insetívoros), abundância na área, tamanhos semelhantes e colônias
formadas com grande número de indivíduos. A captura dos animais foi por meio de
coletas manuais (através de pessoas especializadas, que conheciam as espécies
identificando-as), ocorreram em abrigos (telhados de residências) com redes de
neblina e puçá instalados nos locais de saída dos animais. Foram realizadas no
período noturno das 20:00 às 21:00, em fevereiro e março de 2008 na estação do
verão no hemisfério sul. Após a captura, os indivíduos foram acondicionados
individualmente
em
sacos
de
algodão
devidamente
identificados,
sendo
posteriormente levados para o Laboratório de Biologia Celular e Molecular da
Universidade do Extremo Sul Catarinense para a coleta de sangue periférico e
fígado. Para a coleta sangüínea os animais foram “anestesiados” em câmara de gás
contendo éter, após foi retirado o sangue por meio de punção cardíaca. As amostras
foram acondicionadas individualmente em microtubos contendo solução de heparina
(apenas para o sangue) e mantidos sob refrigeração até o momento da preparação
para submissão ao teste de genotoxicidade. Ao término desse processo os
indivíduos sofreram eutanásia (conforme recomendado pelo Conselho Brasileiro de
Medicina Veterinária e Colégio Brasileiro de Experimentação Animal) para a
remoção do fígado, na qual foi utilizado para a dosagem de metais pesados.
3.1.3 Ensaio Cometa (EC)
Segundo Fairbairn et al. (1994), o Ensaio Cometa é um teste de
genotoxicidade capaz de detectar danos no DNA induzidos por agentes alquilantes,
intercalantes e oxidantes.
O protocolo utilizado na execução do teste foi baseado na versão alcalina
desenvolvido por Singh et al., (1988) e Meehan et al.(2003). Foi coletado
31
aproximadamente 10 L de sangue periférico de cada animal, sendo que 5 L de
cada amostra foram embebidos em 95 L de agarose Low Melting Point (0,75%),
essa mistura foi colocada em lâmina de microscópico (duas lâminas por animal ou
seja, duplicata), pré-revestida com cobertura de 300 L de agarose normal (1,5 %) e
após foi coberta com uma lamínula.
Depois da solidificação em geladeira por aproximadamente 5 minutos, as
lamínulas foram cuidadosamente retiradas e depois as lâminas foram imersas em
tampão de lise (2,5 M NaCl, 100 mM EDTA e 10 mM Tris, pH 10,0-10,5, com adição
na hora do uso de 1% de Triton X – 100 e 10% de DMSO) com alta concentração de
sais e detergentes a fim de lisar as células, removendo o seu conteúdo
citoplasmático e membrana nuclear, por no mínimo uma hora ou até duas semanas.
Posteriormente, as lâminas são imersas em um tampão de pH 13 de acordo com
Tice (1995) (300 mM NaOH e 1 mM EDTA, pH 13), por 20 minutos. Tal processo
visa o desenovelamento das cadeias de DNA, pelo rompimento das estruturas
secundárias
e
terciárias
presentes
no
núcleo
celular.
Imediatamente
ao
desenovelamento, as lâminas são submetidas a uma corrente elétrica por mais 20
minutos, 25v e 300 mA,de modo a induzir a migração para fora do núcleo dos
segmentos de DNA livres, resultantes de quebras Finalmente as lâminas são
coradas com nitrato de prata (VILLELA,et al, 2006). (Figura 10).
Figura 10: Etapas experimentais do Teste Cometa desde a coleta das células até a leitura em
microscópio óptico.
Fonte: Autor.
32
Quanto à observação ao microscópio, foram analisadas 100 células por
indivíduo (50 de cada lâmina duplicada). As células também foram classificadas,
visualmente, em cinco classes, de acordo com o tamanho da cauda: sem danos –
classe 0; até danos máximos – classe 4. Assim, o Índice de Danos de cada grupo
estudado variou de zero (100X0; 100 células observadas completamente sem
danos) a 400 (100X4; 100 células observadas com dano máximo) (COLLINS, 2004).
A freqüência de danos (FD em %) foi calculada em cada amostra com base no
número de células com cauda versus o número de células sem cauda (Figura11).
.
Figura 11: Classes de Dano obtidas pelo Teste Cometa.
Fonte: VILLELA et al., 2006
3.1.4 Análise química
Os fígados foram secos em estufa a 60 ºC por 48 h, misturados para
formar amostras compostas (pool) por espécie nas área amostradas, macerados
utilizando um almofariz com pistilo (figura 12) e finalmente prensado em pastilhas.
Figura 12: Almofariz com pistilo.
Fonte: Autor
33
As amostras foram então analisadas quanto o teor total de metais
pesados (espressos como µg g-1) induzida pela técnica de emissão de raio X (PIXE)
(HE et al., 1993; JOHANSSON et al., 1995).
Durante as últimas décadas, foram realizadas diversas descobertas na
determinação de elementos traço em amostras ambientais e outros materiais
biológicos usando técnicas nucleares. A técnica de PIXE (Produção de raios-X
induzida por um íon) (Figura 13) é usada para análise do conteúdo de metais em
amostras, apresentando alta sensibilidade e simplicidade, caracterizando vários
elementos ao mesmo tempo. Segundo Johansson (1995) essa técnica possibilita
identificação e quantificação simultânea de boa parte dos elementos da tabela
periódica com relativa rapidez. Permite medir quantitativamente concentrações de
elementos até o limite de uma parte por bilhão (HE, 1993).
Figura 13: Esquema mostrando a produção de raios-X induzida por um íon
Esta técnica se destaca por exigir uma pequena quantidade de material
para análise e oferecer resultados muito rápidos e precisos (HE, 1993). A amostra a
ser analisada é irradiada por partículas carregadas produzidas por um acelerador.
Os raios-X emitidos pela desexcitação dos átomos na amostra são analisados e sua
composição é determinada. Usam-se feixes de prótons de 1 a 3 MeV para ejetar
elétrons de camadas internas de átomos da amostra. Quando as resultantes
vacâncias são preenchidas espontaneamente por elétrons de camadas mais
externas são emitidos os raios-X característicos (HE, 1993).
Os raios-X característicos induzidos pelas reações são detectados por
dois detectores, um de germânio hiperpuro (resolução de energia de 175 eV a 5,9
keV) e outro de silício-lítio (160 eV a 5,9 keV) (FRANKE, 2006).
34
A padronização do protocolo adotado neste trabalho seguiu os
procedimentos descritos por Johansson et al (1995). Os espectros de raios-X são
analisados utilizando o código GUPIX, desenvolvido na Universidade de Guelph
(Maxwell et al., 1989; Maxwell et al., 1995; Campbell et al., 2000). Através da técnica
de padronização, responsável pela análise quantitativa dos elementos, as áreas dos
picos dos raios-x são convertidas em concentrações elementares utilizando-se o
programa GUPIX e o resultado final é expresso em partes por bilhão (µg g-1). Uma
amostra padrão de fígado bovino da NIST (material de referência 1577b) é utilizada
para o procedimento de padronização da análise das amostras de fígado (FRANKE,
2006).
As análises de metais utilizando a técnica de PIXE foram realizadas no
Instituto de Física da Universidade Federal do Rio Grande do Sul.
3.1.4 Análise estatística
Todos os dados para o índice e frequência de danos no DNA são
apresentados como média e desvio padrão. A normalidade das variáveis foi avaliada
pelo teste de Kolmogorov-Smirnov.
As análises estatísticas para Índice e Freqüência de Dano entre as três
espécies e diferença entre morcegos expostos na área controle e na área minerada
foi avaliado utilizando Teste U de Wilcoxon-Mann-Whitney. O nível crítico para
rejeição da hipótese nula foi considerando um P valor de 5%, duas vias, e o pacote
estatístico utilizado foi o Bioestat 5.0.
35
4 RESULTADOS
Este trabalho resultou em um artigo científico intitulado: Heavy metals and
DNA damage in blood cells of insectivore bats in coal mining areas of Catarinense
coal basin, Brazil, publicado na revista Environmental Research, em 4 de junho de
2010 (Anexo 1).
4.1. Teor de metais pesados no fígado das diferentes espécies de morcegos nas
áreas estudadas:
A tabela 1 mostra os resultados das análises do fígado em peso seco
(µg.g-1) com base em cada espécie de morcego em ambas as áreas estudadas. Os
teores de Cr (5,7 ± 3,2 µg.g-1), Ni (4,3 ± 3,0 µg.g-1), Cu (27,3 ± 6,5 µg.g-1) e, Pb (5,8
± 2,8 µg.g-1) em fígados de M. molossus e de Fe (1,032 ± 33 µg.g-1) e Cu (232 ± 7,3
µg.g-1) em fígados de T. brasiliensis na área de mineração de carvão foram
superiores aos das espécimes coletadas na área de controle.
Os teores de metais pesados no fígado das espécies de morcegos variou
entre ambas as áreas estudadas (Tabela 1). Na área controle, foram encontradas
somente duas das três espécies de morcegos analisadas no presente estudo. M.
molossus tiveram os maiores teores de Fe (1,673 ± 31 g.g-1) e Cd (4,8 ± 2,7 g.g-1),
enquanto T. brasiliensis apresentaram os maiores teores de Al (27,8 ± 11,1 g.g-1),
Ni (4,2 ± 2,7 g.g-1) e Zn (132,3 ± 11,5 g.g-1). Em contraste, o conteúdo de Si, Mn e
Cu no fígado foram similares em ambas as espécies. As duas espécies continham
Cr e Pb. Al e Ni em M. molossus e os níveis de Cd em T. brasiliensis foram iguais ou
inferiores ao limite de detecção (LoD).
36
Tabela 1:Conteúdo de metais pesados (µg g -1 peso seco) em morcegos que vivem na área
minerada e na área controle, no estado de Santa Catarina, Brasil
Metais
Pesados
Área controle (Timbé do Sul)
Espécie/conteúdo(µg.g-1)
Área minerada (Siderópolis)
Espécie/conteúdo (µg.g-1)
± incerteza
± incerteza
Al *
M. molossus
(n = 08)
15,6
T. brasiliensis
(n = 25)
27,8 ± 11,11
SI *
4,8 ± 4,4
7,6 ± 4,2
Cr
9,53
5,3
M. molossus T. brasiliensis E. diminutus
(n = 17)
(n = 15)
(n = 32)
15,9
19,0 ± 13,6
35,1 ± 11,3
5,6 ± 4,6
5,7 ± 3,2
7,8 ± 5,7
10,9
26,6 ± 4,7
6,2
Mn
34,8 ± 10,1
26,3 ± 8,1
13,6 ± 8,2
30,4 ± 11,1
59,5± 10,7
Fe
1,673 ± 31
918 ± 19
1,059 ± 24
1,032 ± 33
2,340 ± 32
4,2 ± 2,7
4,3 ± 3,0
Ni
9,05
5,6
8,6 ± 3,7
Cu
20,3 ± 6,7
15,5 ± 4,9
27,3 ± 6,5
23,2 ± 7,3
28,8 ± 6
Zn
116,2 ± 13,9
132,3 ± 11,5
79,6 ± 11,8
141,4 ± 19,7
113,8 ± 11,8
Cd
4,8 ± 2,7
Pb
6,36
3,0
4,0 ± 2,2
4,05
3,92
5,8 ± 2,8
7,32
3,6 ± 2,2
5,41
N.D. = amostras com respectivo conteúdo igual ou abaixo do limite de detecção (LOD). * não é
considerado metal pesado. ( ) O erro mostrado se reflete as incertezas nas medidas PIXE.
Na área de mineração de carvão, os maiores teores de Al (35,1 ± 11,3
-1
µg.g ), Si (26,6 ± 4,7 µg.g-1), Mn (59,5 ± 10,7 g µg.g-1), Fe (2,340 ± 32 µg.g-1) e Ni
(8,6 ± 3,7 µg.g-1) foram registrados em E. diminutus, enquanto os maiores teores de
Cr (5,7 ± 3,2 µg.g-1) e Pb (5,8 ± 2,8 µg.g-1) foram registradas em M. molossus, além
disso, T. brasiliensis, obteve o maior teor de Zn (141,4 ± 19,7 µg.g-1). Os teores de
Cu foram similares nas três espécies, enquanto que o teor de Cd embora tenha sido
igual ou inferior ao limite de detecção (LoD) em T. brasiliensis, não variou entre as
outras duas espécies.
37
4.2 Danos no DNA em sangue periférico das diferentes espécies de morcegos nas
áreas estudadas:
Os resultados dos danos no DNA das três espécies estudadas na área de
mineração para índice de danos (ID) e freqüência de danos (FD), são demonstrados
nas figuras 14 e 15 respectivamente.
160
*
140
Índice de danos (0-400)
120
100
80
60
40
20
0
E. dimunutus
M. molossus
T. brasiliensis
Figura 14:Índice de dano no DNA nas células sanguíneas das três espécies de morcegos insetívoros
estudados na área minerada (Siderópolis). Diferença significativa em relação a M. molossus *P = 0,01
e T. brasiliensis P<0.0001. (Teste U de Wilcoxon-Mann-Whitney, bicaudal.)
Frequência de danos (%)
60
*
50
40
30
20
10
0
E. dimunutus
M. molossus
T. brasiliensis
Figura 15: Frequência de dano no DNA nas células sanguíneas das três espécies de morcegos
insetívoros estudados na área minerada (Siderópolis). Diferença significativa em relação a M.
molossus *P = 0,01 e T. brasiliensis P<0.0001. (Teste U de Wilcoxon-Mann-Whitney, bicaudal.)
Os resultados mostram que M.molossus e T. brasiliensis tiveram valores
38
semelhantes, enquanto E. diminutus teve valores significativamente maiores que as
duas primeiras espécies (Kruskal-Wallis, P < 0.001) em ambos os parâmetros do
Ensaio Cometa (ID e FD).
A figura16 mostra a comparação entre os resultados obtidos para as
espécies M. molossus e T.brasiliensis, na área de mineração de carvão e área
controle.
*
*
Figura 16: Comparação entre o índice de dano (ID) e freqüência de danos no DNA (FD) detectada em
M. molossus e T. brasiliensis na área controle (Timbé do Sul, SC) e na área minerada (Siderópolis,
SC) utilizando o ensaio Cometa.* Diferença significativa em relação ao grupo controle com P 0,05
(Mann-Whitney U, bicaudal).
Somente T. brasiliensis teve resultados significativamente maiores nos
danos ao DNA na área minerada em comparação com a área controle (Teste-U,
Mann-Whitney, P < 0,05) em ambos os parâmetros do ensaio cometa (ID e FD). M.
molossus não mostrou diferenças estatisticamente significativas entre a área
minerada e a área controle.
39
5 DISCUSSÃO
A mineração de carvão é uma atividade com um alto potencial de poluição
ambiental. Toda a mineração modifica o terreno no processo de extração mineral e
deposição de rejeitos. O bem mineral extraído não retorna mais ao local de onde foi
retirado, ficando em circulação causando diversos males para o meio ambiente e os
seres que o habitam (KOPEZINSKI, 2000).
Os rejeitos de carvão apresentam principalmente metais pesados e os
óxidos, que através dos seus potenciais tóxico e genotóxico acabam acarretando
mudanças profundas nas células, tecidos, populações e ecossistemas (SÁNCHEZCHARDI et al., 2006; SÁNCHEZ-CHARDI et al.,2008).
Este é o primeiro estudo que relata o teor de metais pesados em fígados
de morcegos insetívoros em uma bacia de carvão do Brasil. Infelizmente as
informações sobre as concentrações de metais pesados em morcegos em todo o
mundo não são suficientes para permitir comparações adequadas entre as espécies
(HICKEY; FENTON, 2001).
Embora os elementos químicos, Al e Si não sejam considerados metais
pesados, decidimos incluí-los no presente estudo devido à reconhecida toxicidade
do alumínio em todas as formas vivas, conforme relatado por vários autores (EXLEY
et al, 1991;. KANDIAH; KIES, 1994 ; JULKA et al, 1996;. BISHOP et al, 1997) e o
papel de ambos na absorção pelas plantas (CHARLES et al, 1991; COCKER et al,
1997; COCKER et al, 1998).
Nossos resultados demonstraram variações nos níveis de metais pesados
no fígado entre M. molossus e T. brasiliensis em ambas as áreas estudadas (Tabela
1). Infelizmente, E.diminutus não foi registrada na área de controle, e por isso não
puderam ser feitas comparações mais apropriadas.
Na área controle, os maiores teores de Fe e Cd e de Al, Ni e Zn foram
encontrados em M. molossus e T. brasiliensis, respectivamente. Por outro lado, na
área minerada, os maiores teores de Al, Si, Mn, Fe e Ni foram registrados em E.
Diminutus, enquanto os níveis mais altos de Cr e Pb foram observados em M.
Molossus, e T. brasiliensis obteve o maior teor de Zn. Quando são comparados
apenas M. molossus e T. brasiliensis, é possível observar que os níveis de Cr, Ni,
40
Cd e Pb foram maiores em M. molossus do que em T. brasiliensis, enquanto os
níveis de Al e Zn foram maiores em T . brasiliensis do que em M. molossus.
O conteúdo hepático de Cr, Ni, Cu e Pb em M. molossus e de Fe e Cu em
T. brasiliensis de ambas as áreas (minerada e controle) não são compatíveis uns
com os outros, isto é, além de ser maior na área minerada, os valores não se
sobrepõem, quando as incertezas são levadas em conta. Esta é uma clara indicação
de que os valores comparados são intrinsecamente diferentes, e que as atividades
de mineração de carvão estão liberando estes metais pesados no meio ambiente. O
mesmo fato ocorreu com Al, Si, Mn, Fe e Ni encontrados em E. diminutus, quando
comparados com os valores das outras duas espécies estudadas. O conteúdo
desses elementos em E. diminutus excedeu os níveis detectados nas outras duas
espécies da área de mineração (Tabela 1).
As diferentes atividades de mineração e o processamento de minério
subseqüentes, produzem um conjunto de potenciais contaminantes. Além dos
efeitos da mineração e deposição de rejeitos, os processos de extração e refino
representam ameaças devido à liberação de contaminantes (O'
SHEA, 2001;. LEFFA
et al, 2010). Os efeitos de contaminantes ambientais sobre os morcegos podem ser
efetuados através da exposição direta ou indireta, devido à reestruturação ecológica
que pode alterar o suprimento de comida, o ambiente físico, a disponibilidade e
qualidade da água, entre outros fatores (O'
SHEA, 2001).
Outras possíveis explicações para nossos resultados, podem ser o tipo de
dieta com insetos longe da área de mineração. Enquanto E. Diminutus se alimenta
nas áreas ao redor de seu abrigo (ZORTÉA; ALHO, 2008), M. molossus e T.
brasiliensis podem voar longas distâncias, alimentando-se até mesmo sobre a
superfície dos corpos d’água (ESBÉRARD, 2003; DAVIS; GARDNER , 2007).
Todas as espécies amostradas no estudo são exclusivamente insetívoras
(OJEDA; MARES, 1989; EGER, 2007; DAVIS; GARDNER, 2007;. RAMÍREZCHAVES et al, 2008), no entanto, informações disponíveis sobre os hábitos
alimentares destas três espécies são escassos. M. molossus alimenta-se de insetos
aéreos que pertencem principalmente às ordens Coleoptera, Lepidoptera, Zygoptera,
Orthoptera, Hemiptera, Homoptera, Diptera e Hymenoptera (EGER, 2007;.
RAMIREZ-CHAVEZ et al, 2008), embora possa completar a sua dieta com
escorpiões, aranhas e outros artrópodes terrestres (DECHMANN et al., 2010). T.
brasiliensis é um generalista, alimentando-se com as mesmas ordens usadas por M.
41
molossus exceto Zygoptera e incluindo em sua dieta Ephemeroptera, Odonata,
Thysanoptera, Neuroptera e Pscoptera (FABIÁN et al., 1990), principalmente nas
cidades. Com exceção da dieta insetívora (DAVIS & GARDNER, 2007), quase nada
se sabe sobre a biologia de E. diminutus que se alimenta principalmente de insetos,
moscas e lepdopteras (BIANCONI; PEDRO, 2007).
Um dado importante, é que os morcegos insetívoros realmente precisam
beber água e, portanto, as espécies estudadas podem vir a ingerir água
contaminada com metais pesados das áreas de mineração de carvão. Os morcegos
acumulam elementos químicos quando se alimentam de insetos que habitam as
águas contaminadas (O'
SHEA et al., 2001). Insetos que vivem em áreas de
mineração podem acumular vários elementos não essenciais e podem assim tornarse um importante transmissor de metais pesados para os morcegos (O'
SHEA, 2001;
WALKER et al, 2007).
Além disso, os morcegos geralmente consomem entre 40% e 100% da
sua massa corporal caçando suas presas a noite (HICKEY; FENTON, 1996) e
algumas espécies se alimentam preferencialmente de insetos emergentes, como
Trichoptera, que passam sua fase larval nos sedimentos, (BRIGHAM; FENTON,
1991) onde os metais pesados podem estar acumulados.
Fatores como estação do ano, fase reprodutiva, sexo e idade das presas
utilizadas como alimento e habitat podem estar envolvidos na bioacumulação de
metais pesados nos morcegos (PAEZ-OSUNA; RUIZ-FERNÁNDEZ 1995). No
presente estudo, comparamos danos no DNA entre os sexos em uma mesma
espécie, mas não obtivemos resultados significativos e, portanto, esta variável foi
negligenciada. Considerando a idade dos exemplares capturados no presente
estudo, os morcegos amostrados foram apenas adultos, mas a idade exata dos
indivíduos não foi avaliada. Todos os machos capturados estavam reprodutivamente
ativos, e as fêmeas grávidas foram excluídas do estudo.
Supomos que o acúmulo de metais pesados nos morcegos estudados,
quando comparado com outras espécies, seja devido ao fato de que é mais provável
considerar diferenças na exposição alimentar e degradação dos habitats presentes
nas áreas de mineração de carvão,embora esse acúmulo possa resultar da variação
e asimilação inter-espécie (WALKER et al. 2007). A variação do teor de metais
pesados entre as espécies, na mesma área, pode refletir-se no comportamento de
forrageamento, os padrões de uso do habitat ou a diferenças fisiológicas entre as
42
espécies. A variação nas áreas estudadas reflete-se na qualidade ambiental e na
biomagnificação de metais pesados em toda a cadeia alimentar. É possível supor
que a concentração de alguns metais pesados no fígado das três espécies de
morcegos insetívoros, reflete-se na biodisponibilidade destes metais nas áreas de
mineração de carvão. Assim é possível também, considerar que os níveis desses
elementos nos alimentos que são ingeridos pelos morcegos são igualmente
elevados.
Níveis de alumínio variando entre 15,9 a
35,1 g.g-1 foram registrados
nos fígados das três espécies de morcegos encontradas na área de mineração de
carvão. Os resultados do Al de ambas as áreas são compatíveis, porque
sobrepõem-se quando as incertezas são levadas em conta. Estes níveis foram
inferiores aos encontrados por Hickey et al. (2001) na pele de morcegos insetívoros
de Ontário e Quebec, no Canadá, onde o nível variou de 4,8-70 g.g-1.
Méndez e Alvarez-Castañeda (2000), relataram níveis de Mn entre 0,58 e
7,15 g.g-1, Fe entre 1,026 e 2,045 g.g-1, e teores de Zn entre 44 e 211 g.g-1 em
morcegos ictiófagos. Estes valores de Mn e Fe são mais baixos que os encontrados
no presente estudo e o nível de Zn encntrado por eles é mais alto (Tabela 1). Por
outro lado, Hickey et al. (2001) registraram teores elevados de Zn 101,3-314,6 g.g-1
e de Fe 72-220 g.g-1, na pele de morcegos insetívoros de Ontário e Quebec, no
Canadá.
As concentrações de chumbo e cobre encontradas no fígado dos
morcegos estudados variou entre 5,8-7,32 g.g-1 e 23,2-28,8 g.g-1 respectivamente.
Estes valores ficaram dentro dos intervalos citados por Streit e Nagel (1993) no
fígado de morcegos insetívoros adultos (Pb 2,95-38,5 g.g-1, e Cu 15,7-32,0 g.g-1),
mas o conteúdo de Cu registrado por Hoenerhoff e Williams (2004) no fígado de 16
de morcegos frugívoros e hematófagos foi maior do que o registrado neste estudo.
Por outro lado, encontramos concentrações de Cd (3,6-4,0
g.g-1) (tabela 1)
inferiores as registradas por Méndez e Castañeda-Alvarez (2000) nos fígados de
morcegos ictiófagos adultos, ficando entre 1,5-14,4
g.g-1, e superiores aos
relatados por Streit e Nagel (1993), que variou entre 0,044-1,53 g.g-1.
Não foram encontrados dados na literatura sobre o Si, Cr e Ni em
morcegos para que pudessemos comparar com nossos resultados.
Praticamente todos os metais podem causar toxicidade quando ingerido
em altas quantidades, mas diversos elementos, como Pb, Fe, Mn, Cu, Cd, Ni e Al
43
são muito abrangentes, podendo produzir toxicidade até mesmo em concentrações
muito baixas (BROOKS , 1983; BEYERSMANN; HARTWIG, 2008).
A contaminação de insetos terrestres por metais ingeridos quando se
alimentam de plantas em áreas de mineração é de fato, a eventualidade que resulta
em uma possível exposição dos morcegos que se alimentam destes insetos. Além
da possibilidade de contaminação por esses insetos que ocorrem especificamente
aos arredores das operações de mineração, os morcegos podem ser expostos a
metais que entram em sistemas aquáticos de escoamentos e drenagem e são
captados por insetos que emergem da água (O'
SHEA, 2001). A contaminação de
grupos emergentes de insetos aquáticos por metais, tem sido demonstrada em
diferentes regiões geográficas que estão sob a influência das atividades de
mineração de diferentes categorias (WICKHAM et al, 1987;. CAIN et al, 1992;. SAIKI
et al. 1995; AXTMANN et al, 1997;. CAIN et al, 2000).
Os morcegos freqüentemente coexistem com os seres humanos em
ambientes urbanos e agrícolas (BRIGHAM; FENTON, 1991), expondo-se aos
contaminantes que eles carregam (CLARK, 1979), os morcegos
e os insetos
aquáticos presentes nos ambientes de mineração, tornam-se possíveis vias para a
transferência de contaminantes de sedimentos aquáticos para o ecossistema
terrestre (CURRIE et al., 1997).Os morcegos insetívoros estão em níveis tróficos
superiores e podem ser vistos como excelentes indicadores, devido sua relação
entre o contaminante e / ou perturbações ambientais e os níveis tróficos (ALLEVA et
al., 2006). O acúmulo de comida e a capacidade metabólica, aumentam posições na
cadeia alimentar, e morcegos insetívoros são suscetíveis para mostrar as
conseqüências de poluentes antes dos organismos de níveis tróficos inferiores,
como insetos herbívoros ou aves (JONES et al., 2009).
Nossos resultados revelaram diferenças entre as espécies, nas
concentrações de metais pesados (tabela 1), no índice e freqüência de danos no
DNA (figura 14 e 15). Os maiores níveis de concentração de Al, Si, Mn, Fe, Ni e Cu
foram encontrados em E. diminutus na área de mineração de carvão. No ensaio
cometa diferenças significativas no índice e freqüência de danos nesta espécie
também foram detectados em comparação com as outras duas espécies. Altos
níveis de metais pesados em plantas e animais podem causar uma variedade de
efeitos agudos e crônicos em seres humanos e outros vertebrados (ILO, 1983),
especialmente em áreas mineradas e industrializadas. Portanto, é necessário se
44
obter informações que até então não são disponíveis, sobre os níveis de metais em
diferentes estágios nos alimentos terrestes (HSU et al., 2006).
Exposições crônicas e / ou agudas aos metais pesados podem dar origem
a uma variedade de doenças patológicas em animais. Embora os estudos
experimentais ou epidemiológicos dos efeitos deletérios desses elementos em
morcegos insetívoros não tenham sido realizados, os efeitos são, até certo ponto
compatíveis entre os mamíferos na literatura sobre toxicologia (O'
SHEA, 2001).
O acúmulo de metais pesados e outros poluentes por organismos pode
ter efeito bastante abrangente, já que possibilita o transporte dos contaminantes nos
diversos níveis tróficos da cadeia alimentar de tal forma que os predadores
apresentam as maiores concentrações, ou seja, este efeito culmina com a
ocorrência das maiores taxas de contaminação nos níveis mais altos da cadeia
alimentar (consumidores secundários e terciários) (BROWN, 1975). Nestes
organismos, os principais mecanismos relacionados com a genotoxicidade
provocada por metais pesados são: o estresse oxidativo, a inibição do sistema de
reparo, a ativação da sinalização mitótica e mudanças na modulação dos genes
(BEYERSMANN; HARTWIG, 2008) (Figura 17).
Figura 17: Principais mecanismos de genotoxicidade e mutagenicidade induzida por metais.
(Adaptado de BEYERSMANN; HARTWIG, 2008).
Alguns metais podem acumular-se gradualmente nos órgãos-alvo em
morcegos, contudo sem manifestações visíveis de toxicidade. Várias espécies de
morcegos vivem 20 anos ou mais (ARLETTAZ et al. 2002), e como resultado, essa
45
longevidade pode torná-los suscetíveis aos efeitos deletérios dos metais pesados
(WALKER et al., 2007). Pesquisas devem ser realizadas em áreas onde os
morcegos são intensamente expostos a metais pesados com o intuito de avaliar a
concentração desses elementos em determinados órgãos específicos. Esses
estudos
envolvem
a
investigação
interdisciplinar
sobre
a
histopatologia,
biomarcadores fisiológicos de exposição e também incluem outras abordagens que
lidam com a interpretação dos efeitos deletérios associados à concentração de
metais nos tecidos dos animais. O exame de guano poderia ser visto como um
passo inicial para avaliar o grau de contaminação dos morcegos e suas fontes de
alimento com metais (CLARK et al, 1982), e deve ser complementado com estudos
relacionados à concentração e genotoxicidade de metais pesados em células de
sangue, fígado, e / ou estudos de níveis hormonais basais.
Em nosso estudo, quando comparamos os resultados obtidos para as três
espécies estudadas na área de mineração de carvão, observamos que E.diminutus
foi a espécie com o maior dano de DNA. Ainda não temos amostras destas espécies
provenientes da área controle, no entanto estes resultados fornecem dados basais
de metais pesados em três espécies de morcegos. Em relação à avaliação de
genotoxicidade das duas espécies estudadas, em ambas as áreas (figura16),
apenas T. brasiliensis apresentou resultados significativamente maior na área de
mineração de carvão em relação ao seu controle. Este efeito nocivo provavelmente é
devido à presença de níveis mais elevados de Fe e Cu na área de mineração de
carvão, em comparação com a área de controle.
Os morcegos insetívoros que vivem em áreas de mineração de carvão,
portanto, podem ser bons indicadores do potencial ecológico que as populações
humanas que vivem nessas áreas estão expostas, principalmente pelo acúmulo de
certos elementos não essenciais e potencialmente tóxicos em seus tecidos. No
entanto, a ligação entre a saúde humana e a presença de metais pesados no
ambiente é ainda mais complexa porque os seres humanos, ao contrário dos
animais selvagens, são muito móveis e suas dietas (ou até mesmo água potável)
não são necessariamente derivadas desses locais (BROOKS, 1983).
Estudos que podem detectar precocemente anormalidades genéticas em
células de morcegos expostos a níveis anormais de poluentes ambientais são de
grande importância, podendo servir como um mecanismo sentinela na tomada de
decisões da reabilitação dos impactos ambientais das atividades humanas.
46
6 CONCLUSÃO
Este estudo é a primeira avaliação dos teores tóxicos de metais pesados
em morcegos no Brasil. Nossos resultados sugerem que os níveis de Al, Si, Mn, Fe
e Ni em E. diminutus, oferecem contribuição para o índice e freqüência de danos no
DNA desta espécie.
Os resultados encontrados neste estudo, mais uma vez, apontam para a
sensibilidade do Ensaio Cometa e da técnica de PIXE, advertindo contra uma
possível contaminação das espécies de morcegos que habitam áreas de mineração.
Embora estes resultados sejam preliminares, eles sugerem que os morcegos
insetívoros que vivem na bacia carbonífera de Santa Catarina podem ser utilizados
como bioindicadores para a detecção de biomagnificação de metais pesados em
ecossistemas terrestres e aquáticos que têm contato direto ou indireto com a
mineração de carvão.
Estudos adicionais com uma amostra maior e mesmo com outras
espécies de morcegos devem ser realizados a fim de verificar os resultados obtidos
neste trabalho preliminar, e para testar novas hipóteses que têm sido formuladas.
47
REFERÊNCIAS
AGOSTINI, J. M. S.; WAJNTAL, A. Analise citogenetica em trabalhadores de
minas de carvão mineral de Criciuma-SC. 1993. 158f. Tese (Doutorado em
Citogenética). Área de concentração: Biologia - Universidade de São Paulo, São
Paulo, [1993].
ALEXANDRE, N. Z. Diagnóstico ambiental da região carbonífera de Santa Catarina:
degradação dos recursos naturais. Revista Tecnologia e Ambiente, v. 5, n. 2, p.
35-53, 1999.
ALLEVA, E.; FRANCIA, N.; PANDOLFI, M.; DE MARINIS, A.M.; CHIAROTTI, F.;
SANTUCCI, D. Organochlorine and heavy-metal contaminants in wild mammals and
birds of Urbino-Pesaro Province, Italy: An analytic overview for potential bioindicators
Archives of Environmental Contamination and Toxicology, v.51, p.123-134,
2006.
ALVES, A. C. B.; SILVANO, S. Avaliação da sensibilidade de Daphnia magna
Straus, 1820 (Cladócera, Crustácea) ao dicromato de potássio. Revista Instituto
Adolfo Lutz, v.65, n.1, p. 59-61, 2006.
AMORIM, L. C. A. Os biomarcadores e sua aplicação na avaliação da exposição aos
agentes químicos ambientais. Revista Brasileira de Epidemiologia, v.6, n.2, p. 158170, 2003.
ANDRADE, V. M. de; SILVA, J. da; SILVA, F. R. da; HEUSER, V. D.; DIAS, J.
F.;YONEAMA, M. L.; FREITAS, T. R. O. de. Fish as bioindicators to assess the
effects of pollution in two southern Brazilian rivers using the Comet assay and
micronucleus test. Environmental and Molecular Mutagenesis, v. 44, n. 5, p. 459468, 2004.
ANEEL. Carvão Mineral, 2008. Disponível em: <http://www.aneel.gov.br.html.>
Acesso em: 10 jun. 2009.
ARLETTAZ, R. ; CHRISTE, P. ; DESFAYES, M. 33 years, a new longevity record for
a European bat. Mammals, , v.66, p.44-442, 2002.
AXTMANN, E.V.; CAIN, D. J.; LUOMA, S.N. Effect of tributary inflows on the
distribution of trace metals in finegrained bed sediments and benthic insects of the
Clark Fork River, Montana. Environmental Science and Technology, São Paulo, n.
31, p. 750-758,1997.
BAINY, A.C.D.; WOODIN, B.R.; STEGEMAN, J.J. Elevated levels of multiple
cytochrome P450 forms in tilapia from Billings Reservoir São Paulo, Brazil.Aquatic
Toxicology, São Paulo, v. 44, p. 289-305, 1999.
BARBOZA, F. L. M.; GURMENDI, A.C. Economia mineral no Brasil. Brasília:
DNPM. 1995.
48
BARCLAY,R.M.R; BRIGHAN,R.M. Prey detection dietary niche breadth, and body
size in bats so small? The American naturalist, Chicago, v.137, p. 693-703. 1991.
BARQUEZ, R.; DIAZ, M.; GONZALEZ, E.; RODRIGUEZ, A.; INCHÁUSTEGUI, S.;
ARROYO-CABRALES, J. 2008. Tadarida brasiliensis. In: IUCN 2010. IUCN Red List
of Threatened Species. Version 2010.3. <www.iucnredlist.org>. Acessado em 06
Out. 2010.
BARQUEZ,R,M; MARES, M. A; BRAUN,J,K.The bats of Argentina. Special
Publications Museus of Texas tech University. Lubbock,v. 42, p.1-275,1999.
BAUMGARTEN, M. G. Z.; POZZA, A. S.. Qualidade de Águas: descrição de
parâmetros químicos referidos na legislação ambiental. Rio Grande: FURG,
166p. 2001.
BECKMAN, K. B.; AMES, B.N. The free radical theory of aging matures.
PHYSIOLOGICAL REVIEWS, v.78, n. 2, p. 547-581, 1998.
BELOLLI, M. História do carvão de Santa Catarina. Santa Catarina: Imprensa
Oficial, 2002.
BENASSI, J. C. O uso de bioindicadores e biomarcadores na avaliação do
processo de remediação de efluente de lixiviação de carvão mineral utilizando
microesferas de quitosana. 2004. 106 f. Dissertação (Mestrado em Biotecnologia)
– Universidade Federal de Santa Catarina, Florianópolis, [2004].
BEYERSMANN, D.; HARTWIG, A. Carcinogenic metal compounds: recent insight
into molecular and cellular mechanisms. Archives of Toxicology, v.82, p. 493-512,
2008.
BIANCONI, G.V.; PEDRO, W.A.. Família Vespertilionidae. In: Reis, N.R., Peracchi,
A.L., Pedro, W.A., Lima, I.P. Morcegos do Brasil. Londrina, 253p, 2007.
BISHIT, S. S., SHARMA, C. P.; KUMAR, A. Plant responses excess concentration of
heavy metal. Geophytol. V. 6, p. 296-307, 1976.
BISHOP, N.J., MORLEY, R., DAY, J.P.; LUCAS A. Aluminum neurotoxicity in
preterm infants receiving intravenous-feeding solutions.New England Journal of
Medicine.v.336,p.1557-1561, 1997.
BORBA, R. F. Carvão Mineral. Balanço Mineral Brasileiro, Porto Alegre, out, 2001.
Disponível em: <http://www.dnpm.gov.br,htm>. Acesso em: 28 set. 2009.
BORTOLOTTO, T. Avaliação da atividade tóxica e genotóxica de percolados do
aterro sanitário municipal de sombrio, Santa Catarina, utilizando Artemia sp. E
Allium cepa L. 2007. 79 f. Trabalho de Conclusão de Curso (Graduação em
Ciências Biológicas - Bacharelado) - Universidade do Extremo Sul Catarinense,
Criciúma [2007].
49
BRACK, W. Effect-directed analysis: a promising tool for the identification of organic
toxicants in complex mixtures? Analytical and Bioanalytical Chemistry, 2003.
BRANDÃO, R. A. Avaliação Ecológica Rápida da Herpetofauna nas Reservas
Extrativistas de Pedras Negras e Curralinho, Costa Marques, RO. Brasil Florestal,
n. 74, p. 61-73, 2002.
BREDT, A.; MOREIRA D. S. da.; Morcegos em áreas urbanas e rurais: Manual de
manejo e controle - Brasília, Fundação nacional de Saúde,1996.
BRIGHAM, R.M.; FENTON, M.B. Convergence in foraging strategies by two
morphologycally and phylogenetically distinct nocturnal aerial insectivores. Journal of
Zoology. London, v. 223, p.475–489, 1991.
BROMENSHENK, J.J.; SMITH, G. C.; WATSON, V.J. Assessing ecological risks in
terrestrial systems with honey bees. In: Butterworth, B.E.; Corkum, L. D.; GuzmánRincón, J. Biomonitors and Biomarkers as Indicators of Environmental Change,
New New York: Plenum Press, p. 9-30, 1995.
BROOKS, R.R. (Ed.), Biological methods of prospecting for minerals, 1rd. ed.
Willey, Califórnia, 322p. 1983.
BROWN, R. E. Significance of trace metals and nitrates in sludge soils. Journal
WPCF, v. 47, n.12, p. 2863-2875, 1975.
CAGLE, F.R.A. Texas colony of beats. Tadarida mexicana. Journal of
mammalogy.Lawrence, v.31, n.4, p.400-402, 1950.
CAIN, D.J.; LUOMA, S.N.; CARTER, J.L.; FEND, S.V.. Aquatic insects as
bioindicators of trace element contamination in cobble-bottom rivers and streams.
Can. Journal of Fisheries and Aquatic Science, v.49, p. 2141-2154, 1992.
CAIN, D.J.; CARTER, J.L.; FEND, S.V.; LUOMA, S.N.; ALPERS, C.N.; TAYLOR,
H.E., Metal exposure in a benthic macroinvertebrate, Hydropsyche californica related
to mine drainage in the Sacramento River. Can. Journal of Fisheries and Aquatic
Science, v.57,p. 380-390, 2000.
CAMPBELL, J.L.; HOPMAN, T.L.; MAXWELL, J.A.;NEJEDLY, Z. The Guelph PIXE
software package III: alternative proton database Nuclear Instruments and Methods
in Physics Research,v. 170, p.193-204. 2000.
CAROLA, C. R. Dos subterrâneos da história: as trabalhadoras das minas de
carvão de Santa Catarina (1937-1964). Florianópolis. Editora da UFSC, 2002.
CETEM. Centro de Tecnologia Mineral. Projeto conceitual para recuperação
ambiental da Bacia Carbonífera Sul Catarinense. Relatório Técnico elaborado
para o SIECESC. v.1 e 2, 2001.
50
CHARLES, A.L.; CRAIG, D.K.; VALERIO, M.G.; MCCANDLESS, J.B.; BOGOROCH,
R. A Subchronic inhalation toxicity study in rats exposed to silicon carbide whiskers.
Society of Toxicology, v.16, p.128-146, 1991.
CLARK, D.R. JR. Lead concentrations: bats vs. terrestrial small mammals collected
near a major highway. Environmental Science & Technology, v.13, p. 338-341,
1979.
CLARK, D. R., Jr.; LAVAL, R. K.; TUTTLE, M. D. Estimating pesticide burdens of
bats fromguano analyses. Bulletin of Environmental Contamination and
Toxicology, Costa Rica, n.29, p. 214-220,1982.
COCKER, K.M., HODSON, M.J., EVANS, D.E., SANGSTER, A.G. Interaction
between silicon and aluminum in Triticum aestivum L. (cv. Celtic). Journal of Plant
Physiology, v.45, p. 285-292, 1997.
COCKER, K.M.; EVANS, D.E.; HODSON, M.J. The amelioration of aluminium toxicity
by silicon in higher plants: solution chemistry or an in plant mechanism? Journal of
Plant Physiology, v. 104,p. 608-614, 1998.
COLLINS, A.R.,. The comet assay for DNA damage and repair: principles,
applications, and limitations. Molecular Biotechnology, v,26, p. 249-261,2004.
COLLINS, A.R.. Oxidative DNA damage, antioxidants, and cancer. BioEssays,
v.21,p. 238-246, 1999.
COSTA, S. Estrutura da vegetação herbáceo-arbustiva dos solos construídos
em áreas mineradas de carvão a céu aberto e a relação de Axonopus
obtusifolius (Raddi) Chase com Mn e Pb. 2007. 157 f. Dissertação (Mestrado em
Ciências Ambientais)- Programa de Pós-Graduação em Ciências Ambientais,
Universidade do Extremo Sul Catarinense, Criciúma, [2007].
COSTA, S. Estudo da concentração de metais pesados no solo e nas plantas
de áreas de mineração de carvão. 2004. 39f. Relatório Final (Programa de
Iniciação Científica), Universidade do Extremo Sul Catarinense, Criciúma,[ 2004].
COSTA, S. Metais pesados (Pb, Mn e Zn) em áreas de mineração de carvão a
céu aberto reabilitadas: concentração em plantas utilizadas como forrageiras
pelo gado bovino. 2005. 38f. Relatório Final (Programa de Iniciação Científica),
Universidade do Extremo Sul Catarinense, Criciúma, [2005].
COSTA, S.; ZOCCHE, J. J.; ZOCCHE-DE-SOUZA, P. Absorção de metais pesados
(Zn e Pb) por Axonopus obtusifolius (Radi) em áreas degradadas pela mineração de
carvão, SC, Brasil. Revista Brasileira de Biociências, n.5, p.765-767, 2007.
CURRIE, R.S.; FAIRCHILD, W.L.; MUIR, D.C.G. Remobilization and export of
cadmium from lake sediments by emerging insects. Environmental Toxicology &
Chemistry, v.16,p. 2333–2338, 1997.
51
DAVIS, W.E.; GARDNER, A.L.; Genus Eptesicus Rafinesque, 1820., In: Gardner,
A.L. Mammals of South America. The University of Chicago Press, p. 440-450.
2007.
DECHMANN, D.K.N.; KRANSTAUBER, B.; GIBBS, D.; WIKELSKI, M. Group Hunting
- A reason for Sociality in Molossid Bats? PLoS ONE.v.5,p.1-7, 2010.
DNPM. Departamento Nacional de Produção Mineral. Informe Mineral:
Desenvolvimento & Economia mineral.Brasília, Ed.Abril -2004.. Disponível em.
<www.dnpm.gov.br/informe mineral> acesso em 25 set. 2009.
URA KOVÁ Z. Oxidants, antioxidants and oxidative stress. In: A GVOZDJÁKOVÁ
(Ed.). Mitochondrial medicine. Mitochondrial metabolism, diseases, diagnosis and
therapy. Springer, Amsterdam, p 19-49, 2008.
EGER, J.L. Family Molossidae P. Gervais, 1856. In: Gardner, A.L. Mammals of
South América. The University of Chicago Press, p. 399-436, 2007.
EISENBERG,J.F; REDFORD,K.H. Mammals of the Neotropics. The Central
Neotropics: Ecuador, Peru, Bolivia, Brazil. University of Chicago, Press. Chicago.
609 p. 1999.
ESBÉRARD, C.E.L. Diversidade de morcegos em área de Mata Atlântica regenerada
no sudeste do Brasil. Revista Brasileira Zoociências, v.5,p.189-204, 2003.
EXLEY, C.; CHAPPELL, J.S.; BIRCHALL, J.D.. A mechanism for acute aluminium
toxicity in fish. Journal of Theoretical Biology, v.151,p. 417-428, 1991.
FABIÁN, M.E.; HARTZ, S.M.; ARIGONY, T.H.A. Alimentação de Tadarida
brasiliensis (Geoffroyi, 1824) na região urbana de Porto Alegre, RS, Brasil
(Chiroptera, Molossidae). Revista Brasileira de Biologia, v.50, p.387-392, 1990.
FAIRBAIRN, D. W; OLIVE, P.L; O’NEIL, K.L. The comet assay: a comprehensive
review. Mutation Research. Canadá, n. 339, p. 37-59, 1994.
FARIAS, C.; GOMES, E. Mineração e meio ambiente: relatório preparado para o
CGEE. Porto Alegre, 2002. Disponível em: <http://www.cgee.org.br>. Acesso em: 03
de maio. 2010.
FERNANDES, K. A; Estudo de caso: processos utilizados para Recuperação das
áreas impactadas com rejeito de Carvão. 2005. 45f. Monografia (Especialização em
Gestão de Recursos Naturais)- Curso de Pós-Graduação, Universidade do Extremo
Sul Catarinense, Criciúma, [2005].
FRANKE, S. I. R. Suco de laranja e vitamina c: efeito sobre a estabilidade
genômica. 2006. 226 f.Tese de doutorado(Doutorado em Biologia Celular e
Molecular)- Centro de Biotecnologia do Estado do Rio Grande do Sul, Universidade
Federal do Rio Grande do Sul, [2006].
52
FREITAS, M. Alterações anatômicas em raízes e folhas de Typha domingensis
pers. (TYPHACEAE) e a concentração de Zn e Mn nos efluentes da mineração e
do beneficiamento de carvão. 2007. 85 f. Dissertação (Mestrado em Ciências
Ambientais)– Programa de Pós-Graduação em Ciências Ambientais, Universidade
do Extremo Sul Catarinense, Criciúma, [2007].
FUKUI, D.; MURAKAMI, M.; NAKANO, S.; AOI, T. Effect of emergent aquatic insects
on bat foraging in a riparian forest. Journal Animal Ecology, v. 75, p. 1252-1258,
2006.
GALARIS, D.; EVANGELOU, A. The role of oxidative stress in mechanisms of
metalinduced carcinogenesis. Critical Reviews in Oncology Hematology, v. 42, p.
93-103, 2002.
GASTALDO, J.; VIAU, M.; BOUCHOT, M.; JOUBERT, A.; CHARVET, A.; FORAY, N.
Induction and repair rate of DNA damage: A inified model for describing effects of
external and internal irradiation and contamination with heavy metals. Journal of
Theoretical Biology, v. 251. p. 68-81, 2009.
GONTIJO, Á.M. de M.C.; TICE, R. Teste do micronúcleo em medula óssea de
roedores in vivo. In: RIBEIRO, L. R.; SALVADORI, D. M.F.; MARQUES, E.K. (Ed.).
Mutagênese Ambiental. Canoas: Editora da Ulbra,. p. 247-271, 2003.
GRISHAM, M. B. Oxidants and free radicals in inflammatory bowel disease. Lancet,
v. 24, p. 859-861, 1994.
GUILHERME, L. R. G.; MARQUES, J. J.; PIERANGELI, M. A. P.; ZULIANI, D. Q.;
CAMPOS, M. L.; MARCHI, G. Elementos traço em solos e sistemas aquáticos. In:
VIDAL – TORRADO, P. et al., Tópicos em ciência do solo, Volume IV. Viçosa,
Sociedade Brasileira de Ciência do solo, p. 345-390, 2005.
GUO L.; YANG, J. Y.; WU, C. F. Oxidative DNA Damage Induced by Ethanol in
Mouse Peripheral Leucocytes. Basic & Clinical Pharmacology & Toxicology, p.
1742- 7843, 2008.
HE, F. Target preparation for trace element determination of biological materials
using techniques. Nuclear Instruments and Methods in Physics Research, v. 334,
p. 238-245, 1993.
HE, F.; BUOSO, M. C.; BURATTINI, E.; FAZINIC, S.; GALASSINI, S.; HAQUE,
A.M.I.; JAKSIC, M.; MOSCHINI, G. Target preparation for trace element
determination of biological materials using techniques. Nuclear Instruments and
Methods in Physics Research,v.334, p. 238-245, 1993.
HENDRIKS, A. J.; MA, C. W.; BROUNS, J. J. de.; RUITER-DIJKMAN, E. M.; GAST,
R. Modelling and monitoring organochlorine and heavy metal accumulation in soils,
earthworms, and shrews in Rhine-delta floodplains. Archives of Environmental
Contamination and Toxicology, New York, v. 29, n.1, p.115-127,1995.
53
HICKEY, M.B.C; FENTON, M.B. Behavioural and thermoregulatory responses of
female hoary bats, Lasiurus cinereus (Chiroptera: vespertilionidae), to variations
in prey availability. Ecoscience,v.3,p. 414–422, 1996.
HICKEY, M.B.C.; FENTON, M.B. Behavioural and thermoregulatory responses of
female hoary bats, Lasiurus cinereus (Chiroptera: vespertilionidae), to variations in
prey availability. Ecoscience,v.3, p.414–422, 2001.
HOENERHOFF, M.; WILLIAMS, K. Copper-associated hepatopathy in a Mexican fruit
bat (Artibeus jamaicensis) and establishment of a reference range for hepatic copper
in bats. Journal of Veterinary Diagnostic Investigation,v.16, p.590–593, 2004.
HSU, M.J.; SELVARAJ, K.; AGORAMOORTHY, G. Taiwan’s industrial heavy metal
pollution threatens terrestrial biota. Environmental Pollution.,v.143, p.327-334, 2006.
ILO (International Labour Office),. Biological monitoring. In: Parmeggiani, L.(Ed.),
Encyclopedia of Occupational Health and Safety. ILO Publications, Geneva,
271p. 1983.
JÄRUP, L. Hazards of heavy metal contamination. British Medical Bulletin.London,
v. 68, p. 167-182, 2003.
JESUS, T. B. de; CARVALHO, C. E. V. de. Utilização de Biomarcadores em Peixes
como Ferramenta para Avaliação de Contaminação Ambiental por Mercúrio (Hg).
Oecologia Brasiliensis, v.12, n.4, p. 680- 693, 2008.
JOHANSSON, S.A.; CAMPBELL, J.L.; MALMQVIST, K.G. (Eds.), Particle-induced
X-ray emission spectrometry (PIXE), 1rd ed. John Wiley and Sons, New York, p. 118. 1995.
JONES, G.; JACOBS, D.S.; KUNZ, T.H.; WILLIG, M.R.; RACEY, P.A. Carpe noctem:
the importance of bats as bioindicators. Endangered Species Resolution, v.8, p. 93115, 2009.
JULKA, D.; VASISHTA, R.K.; GILL, K.D. Distribution of aluminum in different brain
regions and body organs of rat. Biological Trace Element Research. v.52, p. 18192, 1996.
KANDIAH, J.; KIES, C. Aluminum concentrations in tissues of rats: effect of soft drink
packaging. BioMetals, v.7,p 57–60, 1994
KLEIN, A. S. Áreas Degradadas pela Mineração de Carvão no Sul de Santa
Catarina: Vegetação Versus Substrato. 2006. 87 f. Dissertação (Mestrado em
Ciências Ambientais) Programa de Pós-Graduação em Ciências Ambientais.
Universidade do Extremo Sul Catarinense,Criciúma, [2006].
KLOBU AR, G.I.V.; PAVLICA, M.; ERBEN, R.; PAPEŠ, D. Application of the
micronucleus and comet assays to mussel Dreissena polymorpha haemocytes for
genotoxicity monitoring of freshwater environments. Aquatic Toxicology, v.64, p.1523, 2003.
54
KOOPMAN, K.F. Order Chiroptera. In Mammals species of the world: a
taxonomic and geographic reference. 2nd ed. Edited by D.E. Wilson and D.M.
Reeder. Smithsonian Institution Press, Washington, D.C. p. 137–241, 1993.
KOPEZINSKI, I. Mineração X meio ambiente: considerações legais, principais
impactos ambientais e seus processos modificadores. Porto Alegre: Editora da
Universidade. 103p. 2000.
KOVALCHUK, I.; KOVALCHUK, O. Transgenic Plants as Sensors of Environmental
Pollution Genotoxicity, v. 8, p. 1539-1558, 2008.
KUNTZE, H. Behavior of heavy metals in soils. In: Bender, F. (Ed.), Geo-resources
and environment: proceedings of the fourth international symposium held in
Hannover, Schweizerbart'sche Verlagsbuchhandlung, Califórnia, p. 25-40, 1986.
LAWREY, J. D. The relative decomposition potential of habitats variously affected by
surface coal mining. Canadian Journal Botanic,Canadá, v. 55, p. 1544-1552, 1976.
LEE, R.F.; STEINERT, S. Use of the single cell gel electrophoresis/comet assay for
detecting DNA damage in aquatic (marine and freshwater) animals. Mutation
Research, v.544, p.43-64, 2003.
LEFFA, D.D.; DAMIANI, A.P.; SILVA, J.da; ZOCCHE, J.J.; SANTOS, C.E.dos;
BOUFLEUR, L.A.; DIAS, J.F; ANDRADE, V.M.de. Evaluation of the Genotoxic
Potential of the Mineral Coal Tailings Through the Helix aspersa (Müller, 1774).
Environmental Contamination and Toxicology, p.1-8, In press, 2010.
LEMOS, C.T.; TERRA, N. R. Poluição – causas, Efeitos e Controle. In: Silva J,
Erdtmann B, Henriques JAP, editors. Genética Toxicológica. Porto Alegre: Alcance.
p 117-144, 2003.
LEÓN, G.; PÉREZ, L. E.; LINARES, J. C.; HARTMANN, A.; QUINTANA, M.
Genotoxic effects in wild rodents (Rattus rattus and Mus musculus) in an open coal
mining area. Mutation Research, v. 630, p. 42-49, 2007.
MA, W.C., TALMAGE, S. Insectivora. In: Shore, R.F., Rattner, B.A. (Eds.),
Ecotoxicology of wild mammals, 1rd ed. John Wiley & Sons, Chichester, p.123158, 2001.
MARINHO-FILHO, J. S. & SAZIMA, I. Brazilian bats and conservation biology: a first
survey. In: Bat biology and conservation. Kunz, T. H., and P. A. Racey (eds).
Smithsonian Institution Press, 1998.
MARQUES, R.V. FABIAN,M.E. Ciclo reprodutivo de Tadarida brasiliensis
(Chiroptera, Molossidae) em Porto Alegre, Brasil. Revista de zoologia, n.77, p.4556, 1994.
MARTINS, A. A. Sócio-economia do carvão em Santa Catarina: uma
contribuição ao estudo de sua trajetória. 2005.186 f.Dissertação (Mestrado em
Economia), Universidade Federal de Santa Catarina, Florianópolis, [2005].
55
MAXWELL, J.A.; CAMPBELL, J.L.; TEESDALE, W.J.The Guelph PIXE software
package. Nuclear Instruments and Methods in Physics Research, v.43, p.218-230,
1989.
MAXWELL, J.A.; TEESDALE, W.J.; CAMPBELL, J.L. The Guelph PIXE software
package II Nuclear Instruments and Methods in Physics Research,v.95, p. 407421, 1995.
MEEHAN, K. A.; TRUTER, E. J.; SLABBERT, J. P.; PARKER ,M. I. Evaluation of
DNA damage in a population of bats (Chiroptera) residing in an abandoned monazite
mine. África do Sul, Mutation Research, v. 557, n. 2004, p. 183–190, 2003.
MÉNDEZ, L.; ALVAREZ-CASTAÑEDA, S.T. Comparative analysis of heavy metals in
two Species of Ichthyophagous bats Myotis vivesi and Noctilio leporinus. Bull.
Environmental Contamination and Toxicology, v.65, p.51-54, 2000.
MILIOLI, G; SANTOS,R.dos.; ZANETTE,V.C.Mineração de carvão, meio ambiente
e desenvolvimento sustentável no sul de Santa Catarina.Curitiba: Juruá, p 315,
2009
NOWAK, R. M. Walker’s bats of the world. The Johns Hopkins University Press,
London. p. 287, 1994.
O’SHEA, T.J. Impacts of mine related contaminants on bats. In: Vories, K.C.,
Throgmorton, D.(Eds.), Proceedings of bat conservtion and mining: a technical
interactive forum held. U.S. Dept. of Interior, Office of Surface Mining, St. Louis, p.
205-216, 2001.
O'
SHEA, T.J.; EVERETTE, A.L.; ELLISON, L.E. Cyclodiene insecticide, DDE, DDT,
arsenic and mercury contamination of big brown bats (Eptesicus fuscus) foraging at a
Colorado Superfund site. Archives of Environmental Contamination and
Toxicology, v. 40, p. 112-120, 2001.
OLIVEIRA, F. de.; PEREIRA, F; EUGÊNIA C.; LIMA, E. S. de; SILVA, N. H. da.;
FIGUEIREDO, R. C. B. Influência de poluentes atmosféricos em Belo Jardim (PE)
utilizando Cladonia verticillaris (líquen) como biomonitor. Química Nova, Recife, v.
30, n. 5, p. 1072-1076, 2007.
OJEDA, R.A.; MARES, M.A. A Biogeographic Analysis of the Mammals of Salta
Province, Argentina: Patterns of Species Assemblage in the Neotropics. Special
Publications. The Museum Texas Tech University,v.27, p 1–66,1989.
ÖSTLING, O.; JOHANSON K. J. Microelectrophoretic study of radiation-induced DNA
damages in individual mammalian cells, Biochem. Biophys. Research
Communications, v.123, p. 291-298, 1984.
PÁEZ-OSUNA, F.; RUIZ-FERNÁNDEZ, C. Comparative bioaccumulation of trace
metals in Penaeus stylirrostris in Estuarine and Coastal Environments. Estuar.
Coastal and Shelf Science, v.40, p.35-44, 1995.
56
PARAÍBA, L. C.; BOEIRA, C. R.; JONSSON, C. M.; CARRASCO, J. M. Fator de
bioconcentração de poluentes orgânicos de lodos em frutos de laranjeiras. Revista
ecotoxicologia e meio ambiente, Curitiba, v. 16, p. 125-134, 2006.
PASCALLICCHIO, A. E. Contaminação por Metais Pesados: Saúde Pública e
Medicina Ortomolecular. São Paulo: Anna Blume, 2002.
PASSOS, FC; et al. Frugivoria em morcegos (Mammalia, Chiroptera) no Parque
Estadual Intervales, sudeste do Brasil.Revista Brasileira de Zoologia. São
Paulo,v.3, n.20, p. 511–517, 2003.
PRONCHOW, T. R.; PORTO, M.L. Avaliação de uma área de rejeitos da mineração
de carvão com vistas a bioindicadores vegetais para metais pesados. In: CENTRO
DE ECOLOGIA DA UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL. Carvão
e meio ambiente.: Editora da Universidade. Porto Alegre, p. 673-694, 2000
REIS,N,R; PERACCHI,A,L; SEKIAMA, M.L. Morcegos da fazenda Monte Alegre.
Revista Brasileira de zoologia. Paraná, v.16, n.2, p. 501-505, 1999.
REIS,N.R; PERACCHI, A.L; PEDRO, A.W; LIMA, I.P. Morcegos do Brasil.
Biblioteca nacional, Londrina Pr. 256p. 2007.
RODRÍGUEZ-DURÁN, A.; LEWIS, A. R.; MONTES, Y. Skull morphology and diet of
Antillean bat species. Carib. Journal Science,v. 29, p.255-261, 1993.
ROSS, A. Notes on food habits of bats. Journal of Mammalogy, v. 42, p.6671, 1961.
SAIKI, M.; CASTLEBERRY, D.T.; MAY, T.W.B.; MARTIN, A.; BULLARD, F.N.
Copper, cadmium, and zinc concentrations in aquatic food chains from the upper
Sacramento River (California) and selected tributaries. Archives of Environmental
Contamination and Toxicology, v.29, p.484-491, 1995.
SALOMONS, W. Environmental impact of metals derived from mining activities:
Processes, predictions, prevention. Journal of Geochemical Exploration. 52, 5231995.
SANCHEZ, J. C. D.; FORMOSO, M. L. L. Utilização do carvão e meio
ambiente.Porto Alegre: CIENTEC, 1990. 34p.
SÁNCHEZ-CHARDI, A.; MARQUES, C.C.; GABRIEL, S.L.; CAPELA-SILVA,
F.;CABRITA, A. S.; LÓPES-FUSTER, M. J.; NADAL, J.; MATHIAS, M. L.
Haematology, genotoxicity, enzymatic activity and histopathology as biomarkers of
metal pollution in the shrew Crocidura russula. Environmental Pollution, 2006.
Disponível em:<http://www.elsevier.com/locate/envpol.htm> Acesso em 10 out. 2010.
SANCHEZ-CHARDI, A.; MARQUES, C. C.; NADAL, J.; MATHIAS, M. da L. Metal
bioaccumulation in the greater white-toothed shrew, Crocidura russula, inhabiting na
abandoned pyrite mine site. Chemosphere, v.67, p.121-130, 2008.
57
SANTA CATARINA. 2004. Disponível em:
<http://www.sc.gov.br/municipioararangua.htm>. Acesso em: 15 set. 2009.
SCHILDERMAN, P. A. E. L., HOOGEWERFF, J. A., SCHOOTEN, F., MAAS, L. M.,
MOONEN, E. J. C., OS, B. J. H., WIJNEN, J. H., KLEINJANS, J. C. S. Possible
Relevance of Pigeons as an Indicator Species for Monitoring Air
Pollution.Environmental Health Perspectives, v. 105, n. 3, p. 322-330, 1997.
SHUGART, L.R. Biological monitoring. In: RENZONI, A., MATTEI, N., LARI, L.
FOSSI, M.C.(eds.), Contaminants in the environment: a multidisciplinary assessment
of risks to man and others organisms. CRC press, New York,p. 29-36, 1994.
SILVA, F. R. da. Genotoxidade Ocasionada Pelas Folhas do Fumo (Nicotina
Tabacum) – Expostas ou Não a Agrotóxicos – Em Cantareus aspersus.2007. 83
f. Dissertação (Mestrado em Genética e Biologia Molecular). Universidade Federal
do Rio Grande do Sul. Porto Alegre, [2007].
SILVA, J. da; FREITAS, T. R. O. de; HEUSER, V.; MARINHO, J. R..; ERDTMANN,B.
Genotoxicity Biomonitoring in Coal Regions Using Wild Rodent Ctenomys torquatus
by Comet Assay and Micronucleus Test. Environmental and Molecular
Mutagenesis, v. 35, p. 270-278, 2000a.
SILVA, J.; ERDTMANN, B.; HENRIQUES, J. A. P. Genética toxicológica. Porto
Alegre: Alcance, 2003, p 424.
SILVA-TABOADA, G. Los murciélagos de Cuba.Academia de las Ciencias de
Cuba. La Habana,Cuba, 429p, 1979.
SILVEIRA, F; DEFAVERI, T, M.; RICKEN, C; ZOCCHE, J.J; PICH,C.T. Toxicity and
genotoxicity evaluation of acid mine drainage treatment using artemia sp. and
geophagus brasiliensis as bioindicators. Revitalizing the Environment: Proven
Solutions and Innovative Approaches. p. 1725-1742, 2009
SIMMONS,N.B. Order Chiroptera. In: WILSON, D.E; REEDER,D.M. (Eds). Mammal
species of the world: a taxonomicand geographic referenc. 3 ed. Hopkins University
Press, Baltimore, v.1 p.312-529, 2005.
SINGH, N.P.; MCCOY, M.T.; TICE, R.R.; SCHNEIDER, E.L.. A simple technique for
quantitation of low levels of DNA damage in individual cells. Experimental Cell
Research,v.175, p.184-191, 1988.
SMOLDERS, A. J. P.; LOCK, R. A. C.; VAN DER VELDE, G.; MEDINA HOYOS, R.
I.; ROELOFS, J. G. M. Effects of mining activities on heavy metal concentrations in
water, sediment, and macroinvertebrates in different reaches of the Pilcomayo River,
South America. Archives of Environmental Contamination and Toxicology, v. 44,
n. 3, p. 314-323, 2003.
SOARES, E. R.; MELLO, J. V. de.; SCHAEFER, C. E. G. R.; COSTA, l. M. da. Cinza
e carbonato de cálcio na mitigação de drenagem ácida em estéril de mineração de
carvão. Revista Brasileira de Ciência e Solo, v. 30, p. 171-181, 2006.
58
SOARES, P. S. M.; TRINDADE, R. B. E. Recuperação ambiental de áreas
mineradas: uma experiência de gestão. Anais eletrônicos do XIX ENTMH – Recife,
2002. disponível em: http://www.cetem.gov.br/publicacao/CTs/CT2002-05500.pdf>Acesso em: 20 set. 2010.
SOUZA; COSTA; ZOCCHE. Baccharis trimera Less. DC. como Indicadora da
Recuperação de Áreas Mineradas de Carvão. Revista Brasileira de Biociências,
Porto Alegre, v. 5, n. 1, p. 702-704, 2007.
STREIT, B.; NAGEL, A. Element assessment in tissue samples from European bats
(Microchiroptera). Fresenius Environmental Bulletin,v.2, p.162–167, 1993.
SVENSSON, B.M., MATHIASSON, L., MARTENSSON, L., BERGSTRÖM, S.
Artemia salina as test organism for assessment of acute toxicity of leachate water
from landfills. Environmental Monitoring and Assessment, v.102, p.309-321,
2005.
SWIFT, S.M. Roosting and foraging behaviour of Natterer’s bats (Myotis nattereri)
close to the northern border of their distribution. Journal Zoology, v. 242, p. 375384, 2009.
TICE, R. R.; AGURELL, E.; ANDERSON, D.; BURLINSON, B.; HARTMANN, A.;
KOBAYASHI, H.; MIYAMAE, Y.; ROJAS, E.; RYU, J. C.; SASAKI, Y. F. Single Cell
Gel/Comet Assay: Guidelines for In Vitro and In Vivo Genetic Toxicology Testing.
Environmental and Molecular Mutagenesis, v. 35, p. 206-221, 2000.
TICE, R.R. Applications of the single cell gel assay to environmental biomonitoring
for genotoxic pollutants. In: BUTTERWORTH, B. E.; CORKUM, L. D.; GUZMÁNRINCÓN, J. (Ed.). Biomonitors and Biomarkers as Indicators of Environmental
Change. New York: Plenum Press, p. 69-79, 1995.
TWENTE,J.W.Ecological observations on a colony of Tadarida mexicana. Journal of
mammalogy.Lawrence, v.37, n11, p.42-47, 1956.
VAN DER OOST, R, BEYER, J, VERMEULEN, NPE. Fish bioaccumulation and
biomarkers in environmental risk assessment: a review. Environmental Toxicology
and Pharmacology, v.13,p. 57-149, 2003.
VILLELA, I.V.; OLIVEIRA, I.M.DE.; SILVA, J.DA.; HENRIQUES, J. A.P. DNA damage
and repair in haemolymph cells of golden mussel (Limnoperna fortunei) exposed to
environmental contaminants. Mutation Research,v.605, p.78-86, 2006.
WALKER, C.H.; HOPKIN, S.P.; SIBLY, R.M.; PEAKALL, D.B. Principles of
Ecotoxicology. Taylor & Francis, Bristol, PA 1996.
WALKER, L. A., BAILEY, L. J., SHORE, R. F. The importance of the gut and its
contents in prey as a source of cadmium to predators. Environmental Toxicology
and Chemistry, v. 21, p. 76-80, 2002
59
WALKER, L.A.; SIMPSON, V.R.; ROCKETT, L.; WIENBEURG, C.L.; SHORE, R.F.
Heavy metal contamination in bats Britain. Environmental Pollution, v.48,p.483-490,
2007.
WHITAKER, J. O, Jr. Food habits of bats from Indiana. Canadian Journal of Zoology,
v. 50, p.877-883, 1996.
WICKHAM, P.; VAN de WALLE, E.; PLANAS, D. Comparative effects of mine wastes
on the benthos of an acid and an alkaline pond. Environmental Pollution, Canada,
n.44, p. 83-99,1987.
ZOCCHE, J. J. Comunidades vegetais de campo e sua relação com a
concentração de metais pesados no solo em áreas de mineração de carvão a
céu aberto, na Mina do Recreio - Butia - RS. 1989. 159 f. Dissertação (Mestrado
em Ecologia)- Curso de Pós-Graduação em Ecologia, Universidade Federal do Rio
Grande do Sul, Porto Alegre, [1989].
ZOCCHE, J. J. Metais pesados (Fe, Mn e Zn) no solo construído e na vegetação das
antigas bacias de decantação do lavador de Capivari, Capivari de Baixo, SC. In:
SIMPÓSIO NACIONAL E CONGRESSO LATINO-AMERICANO DE
RECUPERAÇÃO DE ÁREAS DEGRADADAS, 6., 2005. Curitiba. Anais.Curitiba:
SOBRADE. p.117-124, 2005.
ZOCCHE, J. J.; PORTO, M. L. Florística e fitossociologia de campo natural sobre
banco de carvão e áreas mineradas, Rio Grande do Sul, Brasil. Acta Botânica
Brasílica, Porto Alegre, v. 6, n. 2, p. 47-84, 1993.
ZOCCHE-DE-SOUZA, P. Metais pesados em áreas de mineração de carvão: o
uso potencial de banhados biológicos construídos no biopolimento da água de
drenagem ácida de Mina, tratada por processos físicoquímicos. 2007. 17 f.
Relatório de Iniciação Científica (Programa de Iniciação Científica), Universidade do
Extremo Sul Catarinense, Criciúma, [2007].
ZORTÉA, M.; ALHO, C.J.R. Bat diversity of a Cerrado habitat in central Brazil.
Biodiversity conservation, v. 17,p. 791–805, 2008.
60
ANEXO 1
Heavy metals and DNA damage in blood cells of insectivore bats in coal mining
areas of Catarinense coal basin, Brazil.
O artigo pode ser encontrado on line no site:
http://www.ncbi.nlm.nih.gov/pubmed/20655518