CARACTERISTICAS DO
CARBONO
O átomo de carbono apresenta certas particularidades que
o tornam diferente dos demais elementos químicos; esse
fato foi percebido na metade do século XIX, inicialmente
por Kekulé, e possibilitou uma melhor compreensão da
estrutura das substâncias orgânicas.
Dentre as principais características do átomo de carbono
devemos citar:
O CARBONO É TETRAVALENTENTE
O número atômico do carbono é 6, e sua configuração
eletrônica apresenta dois elétrons na camada K e quatro
elétrons na camada L. Tendo quatro elétrons em sua última
camada eletrônica, o carbono os compartilha com quatro
elétrons de outros átomos, para que se complete o octeto,
atingindo-se a configuração estável. Formam-se, desse
modo, quatro ligações covalentes.
A tetravalência do carbono foi reconhecida já em 1858 por
Kekulé (é o denominado primeiro postulado de Kekulé). Por
exemplo, a estrutura do metano (CH4) é:
Além disso, é importante destacar que as quatro valências
do carbono são iguais entre si. Assim, por exemplo, as
quatro fórmulas exemplificadas a seguir representam, na
realidade, um único composto, de fórmula molecular CH3Cl:
A igualdade entre as quatro valências do carbono é
conhecida como segundo postulado de Kekulé.
O CARBONO PODE FORMAR LIGAÇÕES MULTIPLAS
Nos exemplos anteriores (CH4 e CH3Cl), vimos o carbono
formando uma única ligação — ligação simples — com
cada átomo de hidrogênio ou de cloro. Entretanto, um
átomo de carbono pode estabelecer duas ou três ligações
com um segundo átomo, formando, respectivamente, uma
ligação dupla ou uma ligação tripla. Por exemplo:
O CARBONO LIGA-SE A VÁRIAS CLASSES DE ELEMENTOS QUÍMICOS
O carbono está na coluna 4A, no “meio” do 2º período da
Tabela Periódica:
O carbono fica, portanto, a “meio caminho” entre os metais
e os não - metais, isto é, entre os elementos eletropositivos
e os eletronegativos.
Não sendo nem eletropositivo nem eletronegativo, o
carbono pode ligar-se ora a elementos eletropositivos
(como o hidrogênio), ora a elementos eletronegativos (como
o oxigênio).
Na verdade, o hidrogênio sempre aparece nos compostos
orgânicos típicos (são poucas as exceções, como, por
exemplo, CCl4, C2Cl6, CCl2F2, etc.); depois do hidrogênio,
os elementos mais frequentes, em compostos orgânicos,
são o oxigênio e o nitrogênio.
Por esse motivo, o carbono, o hidrogênio, o oxigênio e o
nitrogênio costumam ser chamados de elementos
organógenos, que significa “elementos formadores de
compostos orgânicos”.
É comum encontrarmos, ainda, outros elementos
químicos, como enxofre, fósforo, halogênios (flúor, cloro,
bromo, iodo) e até certos metais (como o ferro, o magnésio
etc.) ligados a um átomo de carbono.
Desse fato resulta o costume de se classificarem os
compostos orgânicos em:
• Compostos binários, quando encerram dois elementos
químicos (por exemplo: C e H);
• Compostos ternários, quando encerram três elementos
químicos (por exemplo: C, H e O);
• Compostos quaternários, quando encerram quatro
elementos químicos (por exemplo: C, H, O e N); e assim por
diante.
O CARBONO PODE FORMAR CADEIAS
O átomo de carbono tem uma capacidade extraordinária de
se ligar a outros átomos — de hidrogênio, de carbono, de
oxigênio, de nitrogênio etc.—formando encadeamentos ou
cadeias curtas ou longas e com as mais variadas
disposições (esse fato é conhecido como terceiro postulado
de Kekulé). São exatamente essas cadeias que irão
constituir o “esqueleto” das moléculas das substâncias
orgânicas.
Existem outros elementos químicos que conseguem formar
encadeamentos, como, por exemplo, o enxofre, o fósforo
etc.
Entretanto, nenhum elemento químico apresenta a
capacidade de formar cadeias tão longas, variadas e
estáveis como o carbono.
A capacidade de formar cadeias juntamente com as
características anteriormente descritas (tetravalência,
formação de ligações simples, duplas e triplas, e ligação
com elementos eletropositivos ou eletronegativos) explicam
a razão de o carbono ser capaz de formar um número
enorme de compostos.
CLASSIFICAÇÃO DOS ÁTOMOS DE CARBONO EM UMA CADEIA
Conforme a posição em que se encontram na cadeia, os
átomos de carbono classificam-se em:
1. Carbono primário: quando está ligado apenas a um outro
átomo de carbono
2. Carbono secundário: quando está ligado a dois átomos de
carbono
3. Carbono terciário: quando está ligado a três outros átomos
de carbono
4. Carbono quaternário: quando está ligado a quatro outros
átomos de carbono
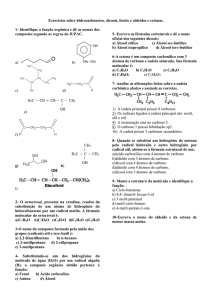
Por exemplo, na cadeia orgânica simplificada a baixo:
• são carbonos primários: 1, 7, 8, 9, 10, 12 e 13;
• são carbonos secundários: 5 e 6;
• são carbonos terciários: 2, 4 e 11;
• é carbono quaternário: 3.
TIPOS DE CADEIA ORGÂNICA
A existência de uma grande variedade de cadeias orgânicas
nos obriga a classificá-las segundo vários critérios:
1. Quanto ao fechamento da cadeia;
2. Quanto à disposição dos átomos;
3. Quanto aos tipos de ligação;
4. Quanto à natureza dos átomos
QUANTO AO FECHAMENTO DA CADEIA
• Cadeia aberta ou acíclica: Quando o encadeamento dos
átomos não sofre nenhum fechamento.
Cadeia fechada ou cíclica: Quando há fechamento na cadeia,
formando-se um ciclo, núcleo ou anel.
QUANTO À DISPOSIÇÃO DOS ÁTOMOS
• Cadeia normal: Quando o encadeamento segue uma
sequencia única só aparecendo carbonos primários e
secundários.
Cadeia ramificada: Quando na cadeia surgem ramos ou
ramificações. Além de carbonos primários e secundários
devemos ter carbonos terciários e/ou quaternários.
QUANTO AO TIPO DE LIGAÇÃO
• Cadeia saturada: Quando só existem ligações simples entre os
átomos de carbono.
(Esta última é saturada porque a dupla ligação está fora da
cadeia ocorrendo entre o carbono e o oxigênio.)
• Cadeia insaturada: Quando, além das ligações simples,
aparecem ligações duplas ou triplas.
QUANTO À NATUREZA DOS ÁTOMOS
Cadeia homogênea: Quando na cadeia só existem átomos de
carbono.
(Esta última é homogênea porque o oxigênio está fora da cadeia.)
• Cadeia heterogênea: Quando na cadeia, além dos átomos de
carbono, existem outros átomos (heteroátomos).
É importante entender que as quatro classificações
anteriores são independentes, isto é, uma não exclui as
outras. Exemplificando:
TIPOS DE CADEIA DOS AROMATICOS
Dentre as numerosas cadeias cíclicas que aparecem na
Química Orgânica, uma das mais importantes é a que se
denomina núcleo (ou anel) benzênico, nome proveniente do
composto mais simples que apresenta esse anel — o
benzeno (C6H6):
O anel benzênico forma os denominados compostos
aromáticos, que se subdividem em:
a) compostos aromáticos mononucleares ou mononucleados,
quando contêm um único anel benzênico; por exemplo:
b) compostos aromáticos polinucleares ou polinucleados,
quando contêm vários anéis benzênicos, que se subdividem em:
• polinucleares isolados, quando os anéis não possuem átomos
de carbono em comum, como, por exemplo:
• polinucleares condensados, quando os anéis possuem
átomos de carbono em comum, como, por exemplo:
O número de compostos aromáticos conhecido é tão grande que
praticamente determinou, dentro da Química Orgânica, uma nova
divisão, denominada Química dos Aromáticos. Disso resulta
outra classificação muito comum, que divide os compostos
orgânicos em:
1. compostos alifáticos (os que têm cadeias abertas);
2. compostos alicíclicos (os que têm cadeias cíclicas que não
sejam anéis benzênicos);
3. compostos aromáticos (os que têm anéis benzênicos).
REFERÊNCIAS
1. Feltre, Ricardo, 1928- .Química / Ricardo Feltre. — 6. ed. —
São Paulo : Moderna, 2004.