Exercícios
Aula 14/03/2017
Química Geral 1
Química Licenciatura
Exercícios trabalhados em aula
1.
Dê o nome de cada um dos seguintes elementos:
(a) C
(b) K
2.
(c) Cl
(d) P
(e) Mg
(f) Ni
Dê o símbolo de cada um dos seguintes elementos:
(a) Bário
(b) Titânio
(c) Cromo
3.
(d) Chumbo
(e) Arsênio
(f) Zinco
Em cada um dos pares seguintes, indique qual é uma substância elementar e qual é um composto.
Substância
composto
elementar
(a)
Na
NaCl
(b)
açúcar
carbono
(c)
ouro
cloreto de ouro
4.
Um ingrediente do fluido anti-congelante para radiadores de automóveis possui uma densidade de 1,11
3
g/cm a 20 °C.
(a) Se você precisa de exatamente 500 mL desse líquido, qual é a massa necessária do composto, em
gramas?
(b) A composição percentual desta substância com massa molar de 62,07 g/mol é 38,70 % de carbono,
9,74 % de hidrogênio, e 51,55 % de oxigênio. Qual a sua fórmula empírica e qual a sua fórmula
molecular?
5.
Um químico necessita de 2,00 g de um composto líquido com densidade de 0,718 g/cm . Que volume do
composto é necessário?
6.
Muitos laboratórios usam 25°C como a temperatura padrão. Qual é essa temperatura em Kelvin?
7.
Faça as seguintes conversões de temperatura:
3
°C
K
a)
214
_____
b)
_____
10
c)
11
_____
d)
-59
_____
Prof. Udo Sinks
1
Exercícios
Aula 14/03/2017
Química Geral 1
8.
Química Licenciatura
-9
As distâncias moleculares são geralmente dadas em nanômetros (1 nm = 1 × 10 m) ou em picômetros (1
-12
-10
pm = 1 × 10 m). Entretanto, a unidade angstrom (Å) é por vezes utilizada, onde 1 Å = 10 m (o angstrom
não é uma unidade do SI).
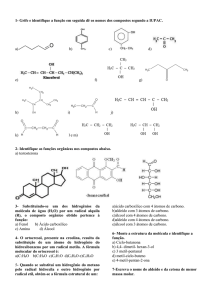
(a) Se a distância entre o átomo de Pt e o átomo de N na droga para quimioterapia anticâncer cisplatina é
de 1,97 Å, qual é essa distância em nanômetros? E em picômetros?
H 2N
1,97 Å
NH2
Pt
Cl
Cl
cisplatina
(a)
(b) Qual a massa molar do composto?
(c) Calcule a composição percentual de cisplatina!
9.
O tetracloreto de carbono, CCl4, um composto líquido comum, tem uma densidade de 1,58 g/cm3. Se você
3
colocar um pedaço de garrafa plástica de refrigerante (d= 1,37 g/cm ) e um pedaço de alumínio (d = 2,70
3
g/cm ) em CCl4 líquido, o plástico e o alumínio flutuarão ou afundarão?
10. Dê os nomes e os símbolos para:
(a) três elementos que são metais:
(b) quatro elementos que são não-metais! Indique se é um gás um sólido ou um líquido a 25°C:
(c) Dois elementos que são metalóides!
(d) Dois elementos líquidos:
11. Dê os nomes e os símbolos de dois metais alcalino-terrosos:
12. O titânio e o tálio possuem símbolos que são facilmente confundidos um com o outro. Dê o símbolo, o
número atômico, a massa atômica e o número do grupo e do período de cada um deles. São metais,
metalóides ou não-metais?
13. Em cada caso, decida o que representa uma massa maior:
(a) 0,5 mol de Na ou 0,5 mol de Si
(b) 9,0 g de Na ou 0,5 mol de Na
(c) 10 átomos de Fe ou 10 átomos de K
14. Dê os símbolos e os números de massa de cada um dos seguintes átomos:
A
Z
X
A = número de massa
Z = número atômico
X = símbolo do elemento
(a) Magnésio com 15 nêutrons
(b) Titânio com 26 nêutrons
(c) Zinco com 32 nêutrons
Prof. Udo Sinks
2
Exercícios
Aula 14/03/2017
Química Geral 1
Química Licenciatura
15. Quantos elétrons, prótons e nêutrons existem no átomo de
24
(a) Mg
119
(b)
Sn
232
Th
(c)
13
(d) C
2
(e) H
16. O cobalto (Co) tem três isótopos radioativos usados em estudos médicos. Os átomos desses isótopos têm
30, 31 e 33 nêutrons, respectivamente. Dê o símbolo para cada um desses isótopos!
A
Z
X
A = número de massa
Z = número atômico
X = símbolo do elemento
17. Revendo a tabela periódica:
(a)
(b)
(c)
(d)
(e)
(f)
(g)
Dê o nome e o símbolo de um elemento do grupo 2A!
Dê o nome de um elemento do terceiro período!
Que elemento está no segundo período do grupo 3A?
Que elemento está no terceiro período do grupo 6A?
Qual halogênio está no quinto período?
Dê o nome do não-metal no grupo 6A no terceiro período!
Qual elemento alcalino-terroso está no segundo período?
18. Dê a formula para cada um dos seguintes compostos binários de não metais:
(a) dióxido de carbono
(b) triodeto de nitrogênio
(c) dicloreto de enxofre
(d) trifluoreto de boro
(e) Água
(f) hidrazina
19. Nomeie os seguintes compostos binários, compostos de não-metais:
(a) N2F4
(b) HBr
(c) BCl3
(d) P4O10
(e) BCl3
Prof. Udo Sinks
3
Exercícios
Aula 14/03/2017
Química Geral 1
Química Licenciatura
Exercícios adicionais
20. Qual dos compostos tem a maior massa: 0,5 mol de BaCl2 ou 0,5 mol de SiCl4?
21. Qual composto tem a maior porcentagem de em massa de oxigênio, água (H2O) ou metanol (CH3OH)?
22. Escreve a fórmula molecular de cada um dos seguintes compostos:
(a) Um composto orgânico, o heptanol, tem 7 átomos de carbono, 16 átomos de hidrogênio e 1 átomo de
oxigênio:
(b) A vitamina C, ácido ascórbica, tem seis átomos de carbono, oito átomos de hidrogênio e seis átomos
de oxigênio por molécula
(c) A molécula do aspartame, um adoçante artificial, tem 14 átomos de carbono, 18 átomos de
hidrogênio, 2 átomos de nitrogênio e 5 átomos de oxigênio:
23. Dê a massa molar (M em g/mol) de cada um dos seguintes compostos:
(a)
(b)
(c)
(d)
Oxalato de cálcio: CaC2O4:
Benzaldeído: C6H5CHO:
K4Fe(CN)6:
Co(NH3)5(NO2)Cl2:
24. Calcule a porcentagem em massa de cada um dos elementos nos seguintes compostos:
(a) PbS, sulfeto de chumbo(II)
(b) C3H8 propano
(c) C10H14O, carvona, encontrada no óleo da semente da alcaravia
Prof. Udo Sinks
4