ISSN 1984-6428
ONLINE
www.orbital.ufms.br
| Vol 4 | | Suppl. 1 | |April 2012 |
Abstract of IV WSO
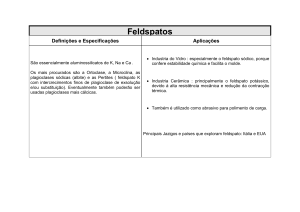
Estudos visando a síntese total da pirenoforina
Everaldo F. Santos Filho*, Italo Ricardo S. Araujo, Mirela Garcia, Jefferson L. Princival
Laboratório de Catálise Orgânica, Depto. de Química Fundamental, UFPE. Av. Prof.
Moraes Rego, 1235 - Cidade Universitária, Recife - PE - CEP: 50670-901
_______________________________________________________________________
RESUMO: Macrodiolídeos são compostos macrocíclicos que apresentam em sua estrutura dois
grupos ésteres contidos em uma cadeia cíclica. Dentre essa classe de compostos, a Pirenoforina
(1) apresenta atividade antifúngica, e é produzida a partir do fungo patogênico Pyrenophora
avenae. Como essa substância, oriunda da natureza, é isolada em pequenas quantidades, uma
forma de síntese assimétrica empregando uma metodologia simples e eficiente seria de grande
interesse. A rota sintética proposta inicia-se com a proteção do álcool propargílico 3, empregandose DHP e um catalisador neutro constituído por feldspato. O composto 5 obtido desta reação, foi
então submetido à reação ácido base entre o próton acetilênico de 5 e 1 eq. de n-BuLi, levando a
formação do acetileto 5A. A reação de adição 1,2- entre 5A e a γ−valerolactona (6), leva a
formação da alquinona 7 em 67 % de rendimento. Posteriormente, o composto 7 foi submetido à
reação de cetalização empregando o mesmo catalisador de feldspato, onde se observa a formação
do cetal 8, e remoção do grupo THP do álcool de forma concomitante. O produto dessa reação (8)
foi então submetido à reação de redução da tripla ligação à olefina, com configuração E, levando a
formação de 9. Atualmente, as condições de obtenção de 10, via reação de oxidação utilizando
reagente de Jones, estão sendo otimizadas. O composto 10, obtido como descrito, esta sendo
submetido à reação de macrolactonização. Para isso, diferentes condições, incluindo o uso de
enzimas estão sendo estudadas. Além disso, um estudo envolvendo a síntese enantiosseletiva da
(R,R)-(-)-pirenoforina, empregando-se a resolução cinética enzimática da mistura racêmica do
composto 8, está em andamento no grupo.
Palavras-Chave: síntese orgânica, macrodiolídeo, pirenoforina, catalisadores ácidos de feldspato.
Study Toward the Total Synthesis of Pyrenophorin
ABSTRACT: Macrodiolides are macrocyclic compounds containing two ester groups in a cyclic
chain. Of this class of compounds, Pyrenophorin (1) shows antifungal activity, and is produced
from the pathogenic fungus Pyrenophora avenae. As this substance, derived from nature, is
isolated in small quantities, an asymmetric synthesis using a simple and efficient methodology
would be of great interest. The proposed synthetic route starts with the protection of propargyl
alcohol 3 using DHP and feldspar as catalyst. Compound 5 obtained in this reaction was then
subjected to acid-base reaction between the acetylenic proton and 1 eq. n-BuLi, leading to
formation of the acetylide 5A. The 1,2- addition reaction between 5A and γ-valerolactone (6) leads
to the formation of alkinone 7 in 67% yield. Subsequently, compound 7 was subjected to a
ketalization reaction using the same feldspar catalyst. Ketal 8 was formed under concomitant
removal of the THP group. The product of this reaction (8) was then submitted to a reduction
reaction of the triple bond to form olefin 9 with E configuration. Currently, the conditions for
obtaining 10 by oxidation using Jones reagent, are being optimized. Compound 10,
obtained as
*
Corresponding author. E-mail: [email protected]
Santos Filho et al.
Abstract of IV WSO
described, is being subjected to a macrolactonization reaction. Various conditions including the use
of enzymes are being studied. In addition, a study involving the enantioselective synthesis of
(R,R)-(-)-pyrenophorin, using enzymatic kinetic resolution of the racemic mixture of compound 8,
is in progress in the group.
Keywords: organic synthesis, macrodiolide, pyrenophorin, acid catalysts feldspar
Scheme 1
Conference website: http://ivwso.ufms.br
116
114
Orbital Elec. J. Chem., Campo Grande,
4 (Suppl. 1): 115-116, 2012