Laboratório
Novartis
Apresentação de Xolair
Pó para solução injetável - via subcutânea. Embalagem contendo 1 frascoampola + 1 ampola diluente. Cada frasco-ampola contém 150 mg de
omalizumabe
Xolair - Indicações
Xolair (omalizumabe) é indicado para adultos e crianças (a partir de 12 anos
de idade) com asma alérgica persistente moderada a grave cujos sintomas
são inadequadamente controlados com corticosteróides inalatórios. Xolair
têm demonstrado uma diminuição na incidência de exacerbações de asma
nestes pacientes. Segurança e eficácia não foram estabelecidas em outras
condições alérgicas.
Contra-indicações de Xolair
Hipersensibilidade à substância ativa ou a qualquer outro componente do
produto. Este medicamento é contra-indicado para menores de 12 anos de
idade.
Reações adversas / Efeitos colaterais de
Xolair
Durantes os estudos clínicos, as reações adversas mais comuns foram
reações no local de injeção (incluindo dor no local de injeção, inchaço,
eritema e prurido) e cefaléias. Quanto à gravidade, na sua maioria, as
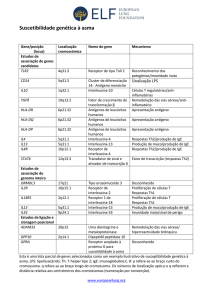
reações foram de leves a moderadas. A Tabela 5 lista as reações adversas
registradas em estudos clínicos na população total de segurança tratada com
Xolair por classe de órgão e sistema e por freqüência. As freqüências são
definidas como: comum (> 1/100; < 1/10), incomum (> 1/1000; < 1/100), rara
(< 1/1000). Tabela 5 - Reações adversas Infecções e infestações Raras
Infecções parasitárias Doenças do sistema imunológico Raras Reação
anafilática e outras condições alérgicas Doenças do sistema nervoso
Comuns Incomuns Cefaléia Vertigem, sonolência, parestesia, síncope
Doenças vasculares Incomuns Hipotensão postural, eritema Doenças
respiratórias, torácicas e do mediastino Incomuns Faringite, tosse,
broncoespasmo alérgico Doenças gastrointestinais Incomuns Náusea,
diarréia, sinais e sintomas dispépticos Doenças de pele e tecidos
subcutâneos Incomuns Urticária, rash, prurido, fotossensibilidade Doenças
gerais e condições do local de administração Comuns Incomuns Reações no
local da injeção tais como dor, eritema, prurido, inchaço Aumento de peso,
fadiga, inchaço dos braços, sintomas de gripe As freqüências de reações
adversas no grupo de pacientes em tratamento ativo foram muito similares
àquelas observadas no grupo controle. Eventos alérgicos Assim como com
qualquer proteína, podem ocorrer reações locais ou sistêmicas. Nos estudos
clínicos, as freqüências de todos eventos do tipo alérgico foram similares
para ambos os grupos de tratamento da população total de estudo.
Malignidades Durante os estudos clínicos, houve um desequilíbrio numérico
nos cânceres originados no grupo ativo de tratamento em comparação com o
grupo controle. O número de casos observados foi incomum (< 1/100) em
ambos os grupos. Plaquetas Nos estudos clínicos, poucos pacientes tiveram
contagem de plaquetas abaixo do limite inferior do nível normal de
laboratório. Nenhuma destas mudanças foi associada a episódios de
sangramento ou a uma diminuição de hemoglobina. Nenhum padrão de
redução persistente na contagem plaquetária tem sido reportado em
humanos, como foi observado em primatas nãohumanos (veja Dados de
segurança pré-clínicos-). Outros dados de laboratório Durante os estudos
clínicos, não houve evidências de mudanças clinicamente relevantes em
testes de segurança de laboratório.
Xolair - Posologia
Dose e freqüência apropriadas de Xolair são determinadas pelo nível sérico
basal de IgE (UI/mL), medido antes do início do tratamento, e pelo peso
corpóreo (kg). Antes da dose inicial, pacientes devem ter seu nível de IgE
determinado por qualquer dosagem sérica de IgE total para determinação da
dose. Com base nestas medidas, 150 a 375 mg de Xolair em 1 a 3 injeções
devem ser necessários para cada administração. Veja a Tabela 2 para
conversões e as Tabelas 3 e 4 para a determinação das doses. Para doses
de 225 ou 375 mg, Xolair 150 mg deve ser usado apenas com metade da
dose (75 mg), equivalente a 0,6 mL da solução preparada, para completar a
dose recomendada. Tabela 2: Conversão de dose para número de frascosampola, número de injeções e volume total de injeção para cada
administração Dose (mg) - Número de frascos-ampola - Número de injeções Volume total de injeção (mL) 150 - 1- 1 - 1,2 225 - 1,5 - 2 - 1,8 300 - 2 - 2 2,4 375 - 2,5 - 3 - 3,0 Tabela 3: ADMINISTRAÇÃO A CADA 4 SEMANAS.
Dose de Xolair (mg por dose) administrado por injeção subcutânea a cada 4
semanas (continua na bula original)
Xolair - Informações
Farmacodinâmica Grupo farmacoterapêutico: outras drogas sistêmicas para
doenças obstrutivas das vias respiratórias. Omalizumabe é um anticorpo
monoclonal humanizado derivado de DNA recombinante que se liga
seletivamente à imunoglobulina E (IgE). O anticorpo é uma IgG1 kappa que
contém regiões de estrutura humana com as regiões determinantes
complementares de um anticorpo murino humanizado que se ligam à IgE. A
cascata alérgica inicia-se quando a IgE ligada aos receptores FceRI de alta
afinidade na superfície dos mastócitos e basófilos sofre ligação cruzada por
um alérgeno. Isto resulta na degranulação destas células efetoras e na
liberação de histaminas, leucotrienos, citocinas e outros mediadores. Estes
mediadores são responsáveis pela fisiopatologia da asma alérgica, incluindo
edema das vias respiratórias, contração do músculo liso e alteração da
atividade celular associada ao processo inflamatório. Eles também
contribuem para os sinais e sintomas da doença alérgica, tais como
broncoconstrição, produção de muco, sibilos, dispnéia, opressão torácica,
congestão nasal, espirros, prurido, rinorréia e prurido nasal, lacrimejamento.
Omalizumabe liga-se à IgE e evita a sua ligação ao receptor FceRI de alta
afinidade, reduzindo assim a quantidade de IgE livre que está disponível para
desencadear a cascata alérgica. O tratamento de indivíduos atópicos com
omalizumabe resultou em uma marcante diminuição do número de
receptores FceRI em basófilos. Além disso, a liberação de histamina in vitro
dos basófilos isolados de indivíduos tratados com Xolair foi reduzida em
aproximadamente 90% após estimulação com um alérgeno, comparado aos
valores de pré-tratamento. Em estudos clínicos, níveis séricos de IgE livre
foram reduzidos de forma dose-dependente em uma hora após a primeira
dose e mantidos entre doses. A redução média da IgE sérica livre foi maior
do que 96% usando doses recomendadas. Níveis séricos de IgE total (ou
seja, ligada e não ligada) aumentaram após a primeira dose devido a
formação do complexo omalizumabe:IgE que tem uma taxa de eliminação
mais lenta comparada com a IgE livre. Nas 16 semanas após a primeira
dose, a média dos níveis séricos de IgE total foi 5 vezes mais alta em relação
aos níveis de pré-tratamento quando usados ensaios padrões. Após a
interrupção da administração de Xolair, o aumento de IgE total e a redução
de IgE livre induzidos por Xolair foram reversíveis, sem rebote observado
nos níveis de IgE após remoção da droga. Níveis de IgE total não retornaram
aos níveis de pré-tratamento por até um ano após a descontinuação de
Xolair.