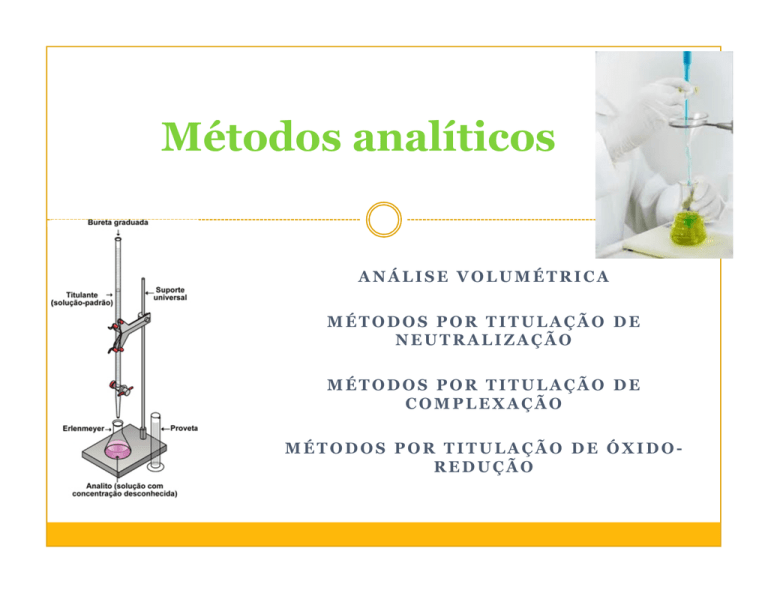
Métodos analíticos
ANÁLISE VOLUMÉTRICA
MÉTODOS POR TITULAÇÃO DE
NEUTRALIZAÇÃO
MÉTODOS POR TITULAÇÃO DE
COMPLEXAÇÃO
MÉTODOS POR TITULAÇÃO DE ÓXIDOREDUÇÃO
Reações de Neutralização
Escreva as reações balanceadas entre o ácido e a base :
a) H2SO4 + NaOH
b) HCl + NaOH
c) HI + Ba(OH)2
d) H3PO4 + NaOH
e) H3PO4 + Sb(OH)5
f) H2SO4 + Fe(OH)3
g) C2O2H4 + NaOH
h) C2O2H4+ Ca(OH)2
i) H3PO4+ Al(OH)3
Volumetria de Neutralização
Volumetria de neutralização envolve a titulação de
espécies químicas ácidas com uma solução padrão
alcalina (ALCALIMETRIA) e titulação de espécies
químicas básicas com uma solução padrão ácidas
(ACIDIMETRIA).
As soluções padrões devem ser padrões primários
ou padronizadas no caso de padrões secundários.
O ponto de final é determinado por um indicador
químico (INDICADOR ÁCIDO - BASE) ou um
método instrumental.”
Volumetria de Titulação
Na volumetria de neutralização a concentração
crítica variável no decorrer da titulação é espécie
H3O+
A curva de titulação representa a variação
logarítmica da concentração de H3O+ em função do
volume da solução padrão adicionada.
pH X VOLUME DA SOLUÇÃO PADRÃO
PORQUE CONSTRUIR A CURVA DE TITULAÇÃO?
Verificar o comportamento do sistema e determinar
a pH nas proximidades do ponto de equivalência
para escolher o indicador adequado.
Titulação de ácido fraco com base forte
Na titulação de 100 mL de ácido acético 0,1 M com
NaOH 0,1M, consideramos:
Antes de iniciar a Reação: só temos a solução de
ácido acético = HAc
HAc, Ka 1,75 x 10-5, da teoria de equilíbrio:
1,32x10-3 mol.L-1
Então:
pH = -log 1,32x10-3 =2,88
Titulação de ácido fraco com base forte
Com a adição de 10,0 mL de NaOH
o valor do pH será igual:
No início da reação:
HAc + NaOH
NaAc + H2O,
Ac +HOH
Hac + OHHAc +HOH
H3O+ + Ac-
1,75X10-5 = (H3O+) x 0,0091
0,082
H3O+ =1,57x10-4
0,1x0,1 0,01x0,1
HAc + NaOH
NaAc + H2O
0,01
0,001
0,009
0
0,001
HAc = 0,009/0,11=0,082
NaAC= 0,001/0,11=0,0091
Ka= (H3O+) x (Ac-)
(HAc)
pH=3,80
-
Titulação de ácido fraco com base forte
No ponto de equivalência:
Quando uma quantidade de 100 mL de NaOH 0,1
M foi adicionado a 100 mL de ácido acético 0,1M.
Neste ponto todo ácido reage com toda a base.
Quantidade de base= 0,1x0,1= 0,01
HAc + NaOH
NaAc + H2O
0,01
0,01
0
0
0,01
Ac +HOH
Hac + OHAc-= 0,01/0,2=0,05M
Titulação de ácido fraco com base forte
Ac-= Ac- - OH- = Ac Kb = (HAc) x (OH-)
(Ac-)
Kb= 1x10-14/1,75x10-5
Kb=5,71 x 10-10
HAc=OH-
OH=5,34x10-6
mol/L
pOH= 5,27
pH= 14-5,27= 8,73
Após o ponto de equivalência: qual o pH com a adição
de 110 mL de NaOH a 100 mL de ácido acético 0,1 M.
HAc + NaOH
0,01
NaAc + H2O
0,011
0,001
0,01
OH- = 0,001/0,21=0,005M, neste ponto apenas a
concentração de excesso de base é considerada.
pOH= -log0,005= 2,30
pH= 14-2,30=11,69
Exercícios – Volumetria de Neutralização
1) Um técnico de laboratório esta padronizando uma solução de H2SO4
com uma solução de base padronizada e com concentração igual a
0,12N, sabendo que o volume de base gasto para titular 10 mL de ácido
foi igual a 5,5 mL qual será a concentração real da solução de ácido
sulfúrico.
2) O
ácido fosfórico é utilizado como conservante em refrigerantes a base
de cola. Uma solução de concentração duvidosa foi comprada para
utilização como parte do xarope. Então 15 mL desta solução foram
adicionados em balão de 500 mL e o volume foi completado com água
destilada. Uma alíquota de 25 mL foi titulada com NaOH C=0,5M, fc=
0,9804 e gastou-se um volume de 65,8 mL. Qual a concentração em
mol/L da solução desconhecida?
H3PO4 + 3 NaOH
Na3PO4 + 3H2O
Exercícios – Volumetria de Neutralização
3) Um aluno deseja avaliar o PN (poder de neutralização) de uma fonte de calcário. Para
realizar a análise o aluno pesa 1,04 g de calcário e dilui para 250 mL em balão
volumétrico, usando uma solução de HCl 0,5 M. Uma alíquota de 50 mL desta solução foi
transferida para um erlenmeyer e cerca de 50 mL de água e 3 gotas de fenolftaleína a
0,5% foi acrescentada. O aluno titulou esta alíquota com uma solução de NaOH 0,1M e o
volume gasto no ponto de equivalência foi de 9,8 mL. Com base neste resultado e nas
equações abaixo calcule o valor de PN para o calcário analisado.
CaCO3 + 2 HCL
H2CO3
CaCO3 + 2HCl
H2CO3 + CaCl2
H2O + CO2
H2O + CO2 + CaCL2
HCl + NaOH
NaCl + H2O
4) A cafeína pode ser dosada em meio não aquoso com ácido perclórico. Uma amostra de
chá pesando 14,5235g foi colocada em um béquer e acrescentaram-se 12,5 mL de
anidrido acético em aquecimento e sob contante agitação. Após 30 minutos a solução foi
transferida para um balão de 100 mL e completada com anidrido acético. Então uma
alíquota de 50 mL foi titulada com ácido perclórico de concentração 0,0051 M e fc=
0,901, gastando 5,3 mL. Encontre a quantidade de cafeína no chá em mg/Kg (ppm).
HClO4 + C8H10N4O2
Produtos , 1 mol HClO4 para 1 mol de cafeina,
Cfc.V(L)=m(g)/Massa Molar
Formação de complexos –
Titulação Complexométrica
PROF. RENATA P. H.
BRANDELERO
Complexos
Os métodos titulométricos baseados na formação de
complexos, algumas vezes denominados métodos
complexométricos, têm sido utilizados há mais de
um século. O crescimento verdadeiramente notável na
sua aplicação analítica, baseado em uma classe
particular de compostos de coordenação chamados
quelatos ou complexos, iniciou-se nos anos 1940.
Um quelato é produzido quando um íon metálico
coordena-se com dois ou mais grupos doadores de
um único ligante para formar um anel heterocíclico de
cinco ou seis membros de um composto orgânico.
Formação de complexos
Quelato é um composto químico
formado por um íon metálico
ligado por várias ligações
covalentes a uma estrutura
heterocíclica de compostos
orgânicos como aminoácidos,
peptídeos ou polissacarídeos.
O nome quelato provém da
palavra grega chele, que significa
garra ou pinça, referindo-se à
forma pela qual os íons metálicos
são “aprisionados” no composto
As reações de complexação envolvem a ligação
entre íon metálico (M) com um quelato chamado
de ligante (L)
M(H2O) + L
M(H2O)(n-1)L + H2O
n é o número de coordenação do íon metálico e
corresponde ao máximo de ligante monodentados que
pode se ligar a ele.
Monodentado – possui um par de elétrons para ligação
com o íon.Ex. H2O ou NH3
Polidentado - contem mais de um átomo doador .
Bidentado, (2 átomos doador ) tridentado (3 átomos
doador), tetradentado (4 átomos doador), pentadentado (5
átomos doador), hexadentado (6 átomos doador).
Ligação coordenada
Ligações de coordenação foram estabelecidas pela
TEORIA DE ALFRED WERNER (1893 –
Universidade de Zurique). Nesta teoria considerase a valência primária e a valência secundárias.
A maior parte dos elementos possuem dois tipos de
valência:
a) Valência primária (número de oxidação);
b) Valência secundária (número de coordenação);
1) Todo elemento tende a satisfazer tanto suas valências
primárias quanto as valências secundárias;
2) A valência secundária apresenta direções fixas no
espaço.
Ligação coordenada
Werner deduziu que no CoCl3.6NH3 os três cloros atuam
como tendo valências primárias e as seis moléculas de
amônia com valência secundária. Em termos atuais, os
três cloros são iônicos, ou seja, íons cloretos, por isso
precipitam como AgCl; os seis ligantes NH3 formam
ligações coordenadas com o íon Co3+, originando o íon
complexo [Co(NH3)6]3+:
•
A teoria de Werner diz que as ligações coordenadas são formadas entre os
ligantes e o íon metálico central do complexo, isto é, o ligante doa um par de
elétrons ao íon metálico.
•
Compostos de coordenação podem ser formados facilmente com os metais
de transição, pois estes possuem orbitais d disponíveis que podem
acomodar os pares de elétrons doados pelos ligantes.
•
O número de ligações coordenadas formadas depende, sobretudo, do
número de orbitais vazios de energia adequada. A regra do número
atômico efetivo (NAE) diz que quando se forma um complexo, há
adição de ligantes até que o número de elétrons do átomo metálico central
mais o número de elétrons cedidos pelos ligantes seja igual ao número de
elétrons do gás nobre seguinte.
Exemplo: K4[Fe(CN)6], hexacianoferrato(II) de
potássio: Um átomo de ferro possui 26 elétrons, de
modo que o íons central Fe2+ possui 24 elétrons, o gás
nobre seguinte, ao ferro, é o criptônio, com 36 elétrons; a
adição de seis pares de elétrons dos seis ligantes CNeleva o número atômico efetivo do Fe2+, no complexo
[Fe(CN)6]4-, temos 24 + (6 x 2) = 36.
Compostos de Coordenação ou Complexos
Metálicos são compostos formados através de
interações ácido base de Lewis.
Os Íons Metálicos são ácidos de Lewis (espécies
receptoras de pares elétrons).
Os Ligantes são bases de Lewis (espécies
doadoras de pares de elétrons).
Número de coordenação (NC): o número de
ligantes ligados ao metal.
EDTA (ácido
etilenodiaminotetracético)
Ácido etilenodiaminotetracético (EDTA)
O EDTA (HO2CCH2)2NCH2CH2N(CH2-CO2-H)2 é um
poderoso agentes complexante e é facilmente obtido
comercialmente. A estrutura espacial do ânion com
6 átomo doadores de elétrons, permite satisfazer o
número de coordenação de seis, freqüentemente,
encontrado nos íons metálicos e formar na quelação
anéis de 5 átomos que são mais estáveis e
apresentam pouco tensão.
A complexometria de EDTA geralmente faz uso de
uma solução de
dihidrogenoetilenodiaminotetracético (H2Y2-) di
sódico
Complexometria com EDTA
As reações entre H2Y-2 e os íons metálicos sempre
reagem na proporção de (1:1) independente da carga do
cátion. Em qualquer dos casos, 1 mol H2Y-2 reage com
um íon-grama de Mn+ formando uma molécula grama
de MY (4-n)- e dois íons-gramas de H+:
M+2 + H2Y-2
MY-2 + 2H+
M+3 + H2Y-2
MY- + 2H+
M+4 + H2Y-2
MY + 2H+
Ou seja, a expressão geral pode ser escrita como:
Mn+ + H2Y-2
MY(4-n)- + 2H+
Constante de formação do complexo EDTA
Considerando a reação global de formação de
complexos :
Mn+ + H2Y-2
MY(4-n)- + 2H+, podemos
escrever a expressão da constante de
formação como:
Constante de formação de complexo EDTA em
função do cátion
Estrutura de um
complexo
metal/EDTA. Note
que o EDTA se
comporta como um
ligante hexadentado
em que seis átomos
doadores estão
envolvidos nas
ligações com o cátion
metálico bivalentes
Reações de EDTA
Efeito do pH : para evitar a competição entre o íon
hidrogeniônico e os cátions, as titulações com EDTA
são geralmente realizadas em condições alcalinas,
principalmente quando o complexo cátion e EDTA
não é muito estável.
Podemos considerar o seguinte equilíbrio:
Reações de EDTA
oA dissociação do complexo é controlada pelo pH
da solução. Quanto mais estável for o complexo,
menor o pH no qual a titulação de íon metálico
pode ser feita. Em geral estes são estáveis em meio
alcalino ou fracamente ácido.
oComplexos de EDTA com Ca+2 e Mg+2 são estáveis
em pH 8-10. Complexos de EDTA com Fe+2 e Al+3
são estáveis a pH 4 -6.
Constante de Formação Efetiva
Constante de Formação Efetiva
Equilíbrios de formação
Isolando as
concentrações:
Cr – concentração não complexada
Efetivamente a parte de EDTA não complexada com
o metal existe sob as várias formas. A concentração
total do EDTA livre pode ser definida como:
Constante de Formação Efetiva
A constante de formação efetiva (k´MY) pode ser e escrita da
seguinte forma:
Com a expressão da constante efetiva de formação é possível
calcular a quantidade de metal que será complexada por EDTA em
uma titulação em um determinado pH. Observe que 1/ α é a fração
de EDTA não complexada que corresponde a Y-4, assim em pH 12
este valor aproxima-se de 1 e nestas condições K`MY=KMY. Em
valores de pH mais ácidos α torna-se maior e o valor de K`MY
diminui.
pH e formação de complexos estáveis de EDTA
Titulações Complexométricas
A titulação complexométricas são utilizadas em uma gama de
aplicações com a função de permitir quantificar o teor de íons
metálicos em solução.
A titulação com EDTA é a aplicação mais importante para
quantificar íons metálicos em água ou em solos.
Na titulação com EDTA este é o titulante e o titulado é a solução
de íon metálico. O indicador utilizado é um indicador metálico
(metalocrômicos), e detecta a mudança da concentração do
íon metálico.
O indicador reage com o cátion e forma quelatos coloridos com
cor diferente da cor do indicador, no ponto de equivalência a cor
muda bruscamente uma vez que todo metal foi complexado no
EDTA, aparecendo a cor do indicador. Na titulação de cálcio e
magnésio usa-se como o indicador o negro de eriocromo (pH 10)
que passa de rosa para azul.
Indicadores
Os indicadores são seletivos para alguns cátion, ou seja
devem reagir com o indicador formando complexos
estáveis e coloridos, porém menos estável que quando o
cátion reage com o EDTA.
No ponto de equivalência todo metal antes complexado
pelo indicador é complexado pelo EDTA, ocorrendo um
alteração da cor que corresponde à cor do indicador livre,
ou seja, sem metal quelados.
Nas titulações Ca+2, usa-se o calcon e nas Ca+2 e Mg+2
usa-se o negro de eriocromo, o calcon é seletivo ao cálcio,
enquanto o negro de eriocromo pode complexar cálcio e
magnésio. A cor da solução de indicador depende: da sua
concentração, da concentração do metal e do pH.
Efeito do pH e do pM sobre a cor do
indicador
Titulações com EDTA
As titulações com EDTA não são seletivas, assim
as condições utilizadas na titulação é o que torna a
metodologia seletiva, a escolha do indicador e do
pH torna a ligação entre o EDTA e o íon metálica
mais seletiva, a titulação do EDTA com solução de
concentração conhecida do íon metálico é
utilizada para determinar o teor do íons de
interesse.
Indicadores para titulações com EDTA
Os indicadores são compostos orgânicos que formam
quelatos com íons metálicos em um faixa de pM
característico de um cátion em particular e do corante.
Indicadores metalocrômicos – são compostos cuja cor
muda quando eles se ligam a um íon metálico.
• Para um indicador ser utilizável, é necessário que a
estabilidade do complexo metal-indicador seja menor
que a estabilidade do complexo metal-EDTA. Caso isso
não ocorra, o EDTA não conseguirá deslocar o metal do
complexo com o indicador.
• Se um metal não se dissocia livremente de um
indicador diz-se que o metal bloqueou o indicador. O
negro de eriocromo T é bloqueado pelo Cu2+, Ni2+, Co2+,
Fe3+ e Al3+.
Curvas de Titulação de Complexação
•A curva de titulação é um gráfico de pM versus o volume de EDTA
adicionado, e o cálculo divide-se em quatro etapas distintas.
•1ª Etapa: Antes do início da titulação: O pM é dado pela concentração
inicial do metal livre.
•2ª Etapa: Antes de atingir o ponto de equivalência: Nesta região há um
excesso de Mn+ em solução após o EDTA ter sido consumido. A
concentração do íon metálico livre é igual à concentração do excesso de
metal que não reagiu. O metal provindo da dissociação do complexo é
desprezível.
•3ª Etapa: No ponto de equivalência: Há exatamente a mesma quantidade
de EDTA e de metal em solução. Pode-se tratar a solução como se tivesse
sido preparada pela dissociação do complexo puro.
•4ª Etapa: Após o ponto de equivalência: Nesta etapa há um excesso de
EDTA e praticamente todo o íon metálico está na forma complexada. A
concentração do íon metálico livre se dá pelo deslocamento do equilíbrio.
Aplicações da Titulação de Complexação
Quinhentos miligramas de uma rocha carbonatada foram tratados em
HCl à quente, e após a solubilização dos constituintes o material foi
filtrado, recebido em balão volumétrico de 500 ml e o volume completado
com água destilada. Dez mililitros dessa solução foram titulados com
solução de EDTA 0,01 M em presença de solução tampão pH 10,0, KCN
e trietanolamina e consumiram 10,0 mililitros da citada solução quelante.
Outros 10,0 mililitros da citada solução foram titulados a pH 12,5, em
presença de KCN e trietanolamina e consumiu 5,0 ml da solução de
EDTA 0,01 M. Qual a porcentagem de CaO e MgO da rocha
carbonatada?
Dados: Ca = 40; Mg = 24; O = 16.
Titulações de Óxido-Redução
Permangonometria, Dicromatometria,
Iodometria
Reações de Óxido-redução
As reações de oxido-redução são aquelas que se processam quando
ocorre transferência de elétrons de um reagente para o outro. A
redução ocorre quando um reagente ganha elétrons e vai para um
estado de oxidação mais negativo. E a oxidação ocorre quando um
reagente perde elétrons elevando sua oxidação para um estado mais
positivo. A reação de oxido-redução é obtida pela soma das meia
reação de redução e da meia reação de oxidação. O reagente que
perde elétrons é chamado de agente redutor e o reagente que
ganha elétrons é chamado de agente oxidante.
No exemplo abaixo estão expressas as duas meias reações
envolvidas no processo de uma reação de oxido redução.
Cuo
Cu0 + 2 Ag+
Cu2+ + 2 e- (oxidação)
2 Ag+ + 2 e2 Ag0 (redução)
Cu2+ + 2 Ag0 (reação de oxidoredução)
Oxidação
Na+
Na+ + e-
2 Cl-
Cl2 + 2e-
2OH + Cl
ClO + OH- +2e
Redução
Ca2+ +2e
Ca
H 2O2 + 2e
2 (OH-)
3 H2O + SO3-2 + 6eS-2 + 6 OH-
Reações de Oxido-redução
Ex. 1
Ex. 2
Agente de redução/oxidação
Agente redutor – é o elemento que
sofre a oxidação (perde elétrons), o
seu número de nox aumenta, pois é
oxidado.
Agente oxidante – é o elemento que
sofre a redução o seu número de
nox diminui (ganha elétrons), é o
agente redutor.
Balanceamento de reações redox
ATRIBUA NOX A TODOS OS ÁTOMOS
VERIFIQUE QUAL GANHA E QUAL PERDE ELÉTRONS
IQUALE OS ELÉTRONS DO REDUTOR E DO OXIDANTE
ADICIONE COEFICIENTE ESTEQUIOMÉTRICOS NOS
ÁTOMOS QUE PERDERAM E GANHARAM ELÉTRONS.
BALANCEI TODOS OS OUTRO, DEIXE O E H PARA O
FINAL
BALANCEI A CARGA PARA FICAR A MESMA DE AMBOS
OS LADOS DA EQUAÇÃO ADICIONANDO H+(MEIO
ÁCIDO) OU OH- (MEIO ALCALINO)
BALANCEIO O ÍON O ADICIONANDO ÁGUA, VEJA SE OS
ÁTOMOS DE H ESTÃO BALANCEADOS.
Balanceamento de reações redox
MnO2 + KClO3 + KOH
K2MnO4 + KCl +H2O
Comece atribuindo o número de nox de cada elemento (alguns elementos tem nox
fixo assim oxigênio é (-2), hidrogênio é (+1), metais alcalinos (+1), metais alcalinos
terrosos (+2), elementos simples tem carga igual a zero, .a soma dos nox de todos os
elementos que compões a molécula é igual a carga do composto, se o composto é
neutro então a soma deve ser igual a zero.
MnO2 – Mn será +4
KClO3 – Cl será +5
K2MnO4 – Mn será +6
KCl – Cl será -1
Assim observe o Mn oxida e o Cl reduz, ou seja cada átomo de Cl ganhou 6e- , sendo
que cada átomo de Mn deve perder 2e-, assim se multiplicarmos o Mn por 3
teremos 3 átomos e 3x2e-= 6e- que o Mn irá fornecer para a redução do Cl. Ou seja a
estequiometria da reação é de 3MnO2: 1KClO3, está estequiometria da reação não
deve ser mudada.
Agora deve-se prosseguir o balanceamento para que o número de átomos seja igual
de ambos os lados da equação, desta forma o balanceamento da equação fica:
3 MnO2 + KClO3 + 6KOH
3 K2MnO4 + KCl + 3 H2O
Potencial de eletrodo
As reações de oxido-redução podem ser expressas em
relação ao seu potencial, ou seja, conforme a
capacidade do reagente (no estado sólido ou líquido)
sofrer uma oxidação ou uma redução. O potencial de
uma meia reação não pode ser medido isoladamente,
mas pode ser determinado em relação a um potencial
eletrodo padrão de hidrogênio, outros eletrodos
como os de prata-cloreto ou eletrodo de calomelano
podem ser utilizados quando o potencial de eletrodo
de hidrogênio não pode ser utilizado.
Potencial de eletrodo padrão
Cr2O7 + 14H++6e
MnO4-+8H+ + 5e
2Cr+3 + 7 H2O Eo= 1,33V
Mn+2 + 4 H2O Eo= 1,51 V
Potencial das reações
O potencial de uma reação de oxido redução pode ser obtido somando os potenciais
das semi-reações envolvidas, no sistema.
O2/Fe+2 as meias reações de redução envolvidas são:
O2(g) + 4H+ + 4e2H2O (l) Eo= 1,230 V
Fe+2 + 2eFe(s)
Eo = -0,440 V
Como o oxigênio é o melhor oxidante o ferro deve ser oxidado pelo oxigênio e o
valor do Eo deve inverter o sinal.
Fe0 (s)
Fe+2 + 2eE0= 0,440 V
Somando as duas semi-reações temos a reação global da oxido-redução. Não se deve
esquecer que as reações de oxido-redução devem ser balanceadas e que o índice
estequiométrico não altera o valor do potencial. Desta forma temos:
O2(g) + 4H+ + 4e- 2H2O (l) Eo= 1,230 V
2 Fe0
2 Fe+2 + 4eE0= 0,440 V
(observe que as reações foram balanceadas pois o número de elétrons doados pelo
oxidante deve ser o mesmo número de elétrons que o redutor recebe).
Somando as duas semi-reações temos:
O2 + 4H+ + 2 Fe0
2 H20 + 2Fe2+ E0 = 1,670 V
Volumetria de Óxido-redução
Volumetria de oxido-redução ou titulação de óxido-
redução são métodos analíticos cujo princípio da
metodologia está ligado à detecção do ponto de
equivalência no momento da reação no qual todos os
elétrons foram transferidas entre o redutor e o
oxidante. Este momento da reação pode ser medido
tanto pelo potencial da reação ou por uma alteração
de cor do indicador da reação de óxido-redução,
determinando o ponto de equivalência é possível
utilizar o cálculo volumétrico para determinar a
quantidade de um analito de interesse que participa
das reações de oxido-redução.
Aplicações
Alguns métodos como o que estima a DQO (demanda
química de oxigênio) de água, o que determina o teor de
carbono orgânico nos solos, os que determinam o teor de
hipoclorito em detergentes clorados, teor de Fe2+ em
medicamento e alimentos, o teor de vitamina C são
exemplos de aplicações da titulometria de óxido-redução.
Podemos resumir os métodos de titulometria redox
conforme o titulante utilizado, assim denomina-se de
permangonometria os métodos que utilizam o
permanganato (KMnO4) como titulante, em
dicromatometria quanto usa-se o dicromato (K2Cr2O7) e
em iodometria quando usa-se o iodo (I2) como titulante.
Equação de Nerst
A concentração dos reagentes oxidados e reduzidos pode ser
relacionada com o potencial de uma meia-célula através da Equação de
Nerst dada abaixo:
Curva de titulação
Considere que uma reação de oxido redução ocorre
entre ferro e o césio e que o processo é realizado
através de adição de uma volume de Ce+4 0,1 M em
100 mL de Fe+2 0,1 M por um processo de
titulométrico, calcule o potencial no ponto de
equivalência e a concentração de Fe+2 e Ce +4 neste
ponto.
Dados : Fe3+ + e- ⇌ Fe2+ E°= 0,700 V ; Ce4+ + e- ⇌
Ce3+ E°= 1,46 V
A reação ocorre entre Ce+4 e Fe+2, ou seja, ambos são
reagentes na reação global.
Fe+2 ⇌ Fe3+ + e- Eo= -,0,7
Ce4+ + e- ⇌ Ce3+ E°= 1,46 V
Fe2+ + Ce4+ ⇌ Fe3+ + Ce3+ E= (-0,7) + (1,46) = 0,76
Ponto de Equilíbrio
No ponto de equilíbrio o número de mol do Fe2+ =
número de mol Ce4+
Molaridade Ce4+. Vg Ce4+ = Molaridade Fe2+ . V titulado Fe2+
Molaridade Fe2+= 0,1 mol.L-1
V titulado Fe2+ = 0,1 L
0,1 . Vg Ce4+= 0,1x 0,1
Vg Ce4+= 0,1 L ou 100 mL , ou seja quando adicionar 100
mL de Ce+4 nos 100 mL de Fe+2 0,1 mol.L-1 a reação está
no ponto de equivalência. Desta forma a concentração de
Ce4+ =0,1 mol.L-1 e de Fe2+ = 0,1 mol.L-1.
Para calcular o valor de E da reação de óxido-redução
deve-se utilizar a equação de Nerst.
E cátodo= E0 Ce4+ - 0,0592 log( (Ce 3+)/(Ce 2+)) ... 1,46 0,0592 log( (Ce 3+)/(Ce 4+))
E ânodo= E0 Fe2+ - 0,0592 log ( Fe 2+)/(Fe 3+)) .... 0,7 0,0592 log ( Fe 2+)/(Fe 3+))
Somando tudo:
2E = 1,46 +0,7 -0,0592 log ((Fe2+) (Ce3+)) / ((Fe3+)
(Ce4+))
Como no ponto de equivalência as concentrações são
igual log 1=0 o valor de E fica igual a:
2E= 0,70 + 1,46 onde E= 1,08V.
Curva Titulométrica
No gráfico abaixo está representada a curva de
titulação obtida titulando 100 mL de Fe 2+ 0,1 mol.L-1
com Ce4+.
Ponto de
Equivalência
Indicadores de reações de óxido-redução
Como verificamos o valor de E= 1,08V no ponto de
equivalência e conhecendo estes valores podemos
escolher o melhor indicador para utilizar na titulação.
Os indicadores de óxido-redução marcam a mudança
brusca de potencial de oxidação na vizinhança do ponto
de equivalência em uma titulação de óxido-redução. Um
indicador ideal deve variar sua cor nitidamente na região
de potencial determinada no ponto de equivalência da
titulação.
Os indicadores de óxido redução são substâncias que
realizam reações de óxido-redução reversíveis e seu
potencial não deve mudar com a concentração das
formas reduzidas e oxidadas.
Indicadores
Um dos melhores indicadores de reações de óxido-
redução é o complexo 1-10 fenantrolina-ferro (II),
estes indicador quando combinado com o ferro (II)
está no estado reduzido e apresenta cor vermelha
intensa, porém em presença de oxidantes fortes o íon
ferro é oxidado para Fe (III) e nestas condições a cor
do composto é azul pálida. O potencial redox padrão
é de 1,14V e em condições ácidas é de 1,06V. Na
Tabela 2, estão indicadores algumas sustâncias que
atuam como indicadores a mudança da cor e o
potencial formal em meio ácido.
Fonte: Vogel, 2002.
Permangonometria
Baseada no uso do permanganato de potássio como titulante,
devido ao seu alto poder de oxidação. As soluções aquosas de
KMnO4 não são completamente estáveis,porque o íon MnO4- tende
a oxidar a água.
MnO4- + 4H+ + 3 eMnO2 + 2 H2O Eº = 1,70 V
O2 + 4 H+ + 4 e2 H2O Eº = 1,23 V
Reação favorecida:
4MnO4- +2H2O
4MnO2 + 4H+ + 3O2 (reação lenta)
Devido a estas características é necessário ter alguns cuidados com
as soluções aquosas de KMnO4:
a) Preparo especial
b) Filtração para remoção do dióxido de manganês em cadinho de
vidro sinterizado
c) Estocagem em frasco escuro
d) Repradronização periódica.
Permangonometria
2KMnO4(aq) + 8H2SO4(aq) + 5Na2C2O4(aq)
5Na2SO4(aq) + K2SO4(aq) + 2MnSO4(aq) + 10CO2(g)
+ 8H2O(l)
2 MnO4-(aq) + 3 Mn+2(aq) + 2 H2O(l) 5
MnO2(aq) + 2H+(aq)
O H2SO4 é o reagente apropriado para acidificar a
solução porque o íon sulfato não sofre a ação de
permanganato.
Permangonometria
Permangonometria: cálculos volumétricos
Um técnico preparou uma solução de KMnO4 e a
padronizou com 0,1550 g de Na2C2O4 (MM = 134 g/mol).
Na padronização foram gastos 26,5 mL do titulante. Em
seguida, o técnico dissolveu 0,179 g de um medicamente
para anemia, contendo Fe(II) e o titulou com uma
solução padronizada, gastando 17,82 mL. Calcule a % de
Fe (MM = 56 g/mol) no medicamento.
DADOS: 2 MnO4- + 5 H2C2O4 + 6 H+ → 2 Mn2+ + 10 CO2
+ 8 H2 O
1 MnO4- + 5 Fe2+ + 8 H+ → Mn2+ + 5 Fe3+ + 4 H2O
R= 48,82% (anote a resolução)
Iodometria
I2 + 2e
2I- E= 0,52
Direto : a solução de iodo é oxidante.
Indireto: utiliza-se o iodeto de potássio como redutor, após a tiulação direta é
realizada entre o iodo liberado e o tiossulfato.
Indicador utilizado é o amido.
Exemplo:
Um estudante dissolveu 0,092 g de KIO3 (MM = 214 g/mol) diretamente em
um erlenmeyer com 50 mL de água. Em seguida, o estudante adicionou 1,0 g de
KI e 10 mL de H2SO4 1:8 e titulou a solução com Na2S2O3 recém preparada,
utilizando suspensão de amido como indicador. Sabendo que foram gastos 25,5
mL de titulante para obter a viragem, qual foi a concentração molar de
tiossulfato encontrado pelo estudante?
DADOS: IO3– + 5 I– + 6 H+ ⇌ 3 I2 + 3 H2O ;
DADOS: I2 + 2 (S2O3)-2– ⇌ 2 I- + (S4O6)-2 ;
Curva de Titulação
O processo de titulação ocorre com alteração no valor o
potencial da reação de oxidação á medida que o titulante
é adicionado na amostra, assim antes do ponto de
equivalência tem-se um potencial que aumenta
lentamente até que a reação alcance o ponto de
equivalência e sobe bruscamente após este momento da
reação. Como observamos é possível determinar o valor
do potencial da reação no ponto de equivalência, bem
como antes e após este momento. Estes cálculos
permitem determinar as curvas de titulação que são
gráficos onde o valor do potencial da reação é
relacionado com o volume adicionado do titulante.