Micro/Imuno/Parasitologia – Aula 3
I – História da Microbiologia:
Em 1665 Robert Hooke começou a pesquisar as primeiras células com um microscópio
primitivo, baseando-se na teoria celular (todo organismo vivo é formado de uma unidade
fisiológica e morfológica fundamental, chamada célula).
Em meados de 1700. Leewenhoek conseguiu observar microorganismos mais
detalhadamente por possuir um microscópio mais potente.
De 1700 a 1850 prevaleceu a teoria da abiogênese ou de geração espontânea (vida surgir a
partir de matéria “morta”). Esta teoria ganhou força por cientistas perceberem que, mesmo em
recipientes completamente tampados, ainda assim ‘surgiam’ organismos vivos. (hoje
sabemos que isso ocorria pois os recipientes não eram devidamente esterilizados, e
consequentemente os microrganismos anaeróbios conseguiam se replicar.
Em 1861 Pasteur derruba a teoria da abiogênese, afirmando e provando que com a correta
esterilização e embalo não é possível surgir vida. O método utilizado foi, basicamente, de
esterilizar dois recipientes e apenas ‘limpar’ um terceiro. Nos 3 foi colocado caldo de carne
(matéria orgânica “morta”) e um dos recipientes esterilizado e o ‘limpo’ foram lacrados e
deixados por algum tempo. Observou-se a replicação microbiológica no recipiente que não foi
lacrado e no “limpo”, enquanto o recipiente esterilizado e lacrado continuou sem
microrganismos. Essa técnica de esterilização e embalo ficou conhecida como
“Pasteurização”, e é muito utilizada para alimentos e condimentos. Com Pasteur também
surgiram diversas outras técnicas de assepsia.
Em1886 Robert Koch relacionou e mostrou que microorganismos podem ser causadores de
patologias. Para isso, estudou o sangue retirado de indivíduos bovinos infectados com uma
doença e notou a presença de bactérias. Cultivou-as e inoculou-as em indivíduos saudáveis,
os quais vieram a desenvolver a mesma patologia, comprovando sua teoria.
Em meados do ano 2000 surgiu a PCR, técnica de “Reação em Cadeia pela Polimerase”,
conhecida como exame de DNA, muito importante em identificação e diferenciação de
indivíduos de mesmo gênero, mas com características morfofisiológicas muito semelhantes
entre diferentes espécies, sua diferença estando por exemplo em diferentes patologias ou
anti-bióticos funcionais. Ela consiste, através de variações de temperatura, na multiplicação
em escala geométrica das fitas de DNA, produzindo mais de um bilhão de cópias após 30
ciclos.
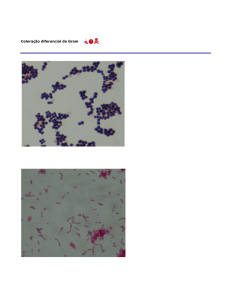
II – Coloração de GRAM e sua exceção
1) GRAM (+) – apresentam em sua totalidade camadas sobrepostas de peptídeos glicanos.
2) GRAM (-) – apresetam uma camada de peptídeo glicano, lipoproteínas, fosfolípide e
lipopolissacarídeos. Devido à estes, tem resistência elevada contra antibióticos, principalmente do
grupo das penicilinas.
3) Exceção ao GRAM:
BAAR – Bactérias álcool/ácido resistentes
Dentre as bactérias, existem algumas que não possuem ou possuem poucos constituintes se
tratando de parece celular(maior parte lipídeos, 60% ácido micólico). Algumas micobactérias, como
Mycobacterium tuberculosis e Mycobacterium leprae são resistentes ao processo de coloração de
GRAM, tornando-o inefetivo. Para estas é utilizado o processo de coloração de BAAR, ou método de
Ziehl-Neelsen, ou então método de coloração à quente.
Coloração de BAAR
1
2
3
4
5
6
7
8
9
10
11
12
Preparar um esfregaço homogêneo, delgado e identificado em uma lâmina nova
desengordurada, limpa e seca;
Deixar secar à temperatura ambiente;
Fixar o material do esfregaço passando 3 a 4 vezes pela chama do bico de Bunsen;
Cobrir a totalidade da superfície do esfregaço com solução de Fucsina fenicada,
previamente filtrada ou filtrado sobre a lâmina no momento da coloração;
Deixar agir por cerca de 5 minutos, aquecendo brandamente utilizando algodão
umedecido em álcool ou com a chama do bico de Bunsen, passando lentamente por
baixo da lâmina, até que se produza emissão de vapores e, quando estes são visíveis,
cessar o aquecimento. Repetir essa operação até completar três emissões sucessivas.
Evitar a fervura e secagem do corante (adicionar mais corante, se preciso, dentro deste
período para evitar que a lâmina seque porque o esfregaço precisa estar coberto
permanentemente durante o aquecimento.). Este aquecimento deve ser intermitente,
pois é importante manter a solução aquecida durante o tempo previsto;
Lavar em água corrente para eliminar a Fucsina. Toma-se a lâmina pelo extremo
numerado, inclinar para frente e lavar deixando cair um jato d’água de baixa pressão
sobre a película corada, de maneira que essa não se desprenda;
Cobrir toda a superfície do esfregaço com a solução de Álcool-ácido. Tomar a lâmina
entre o polegar e o indicador e fazer um movimento de vai-e-vem, de modo que o Álcoolácido vá descorando suavemente a Fucsina. Se o esfregaço estiver ainda com a cor
vermelha ou rosada, descora-se novamente. Considera-se descorado o esfregaço,
quando suas partes mais grossas conservarem somente um ligeiro tom rosado. Essa
operação dura, em geral, dois minutos;
Terminada a fase de descoloração e eliminado o Álcool-ácido, lavar a lâmina da mesma
forma como se procedeu depois da coloração com a Fucsina, com cuidado para não
desprender a película;
Cobrir toda a superfície do esfregaço com solução de Azul de metileno durante 30
segundos a 1 minuto;
Lavar, da mesma forma como se indicou para a Fucsina, tanto o esfregaço como a parte
inferior da lâmina;
Colocar a lâmina com o esfregaço para cima, sobre o papel limpo, para secar à
temperatura ambiente ou estufa a 35º C;
Observar ao microscópio com objetiva de imersão (100 x).
III – Meios de cultura:
1º Definição e composição:
-Meio de cultura é o material composto por todos os nutrientes necessários para o crescimento de
microrganismos em laboratório.
-Para o crescimento de determinado grupo de M.O., precisamos saber tudo o que aquele grupo
necessita: pH, temperatura, nutrientes e % de O2.
-Podem ser realizados em ensaios ou placa de Petri (mais comum).
*O local deve estar esterilizado.
*Constiuído de microrganismos e ágar (polissacarídeo obtido de algas marinhas).
--Para preparar o ágar, prepare a solução do mesmo e deixe em banho Maria a 50ºC.
eventualmente o ágar tornar-se-á sólido, estando pronto para o uso.
2º Meios especiais de cultivo:
Meios redutores – usado principalmente para bactérias anaeróbicas.
Meio diferencial – meio com diferente nutrientes (obtido geralmente com adição de sangue na
produção do ágar – ágar sangue). Geralmente bactérias de infecção de garganta.
Meio de enriquecimento – amostra de fezes supeita de infecções entéricas. É um meio rico
em nutrientes essenciais para o grupo de bactérias específico da suspeita.
Cobaias – usado para bactérias que não se desenvolvem em meios de cultura.