Universidade Tecnológica Federal do Paraná
Campus Campo Mourão
Coordenação de Alimentos
Disciplina de Microbiologia
Profa. Márcia R. F. G. Perdoncini
2. Treinar técnicas fixadas e coradas de
preparação de bactérias para exame
microscópico;
3. Treinar
manuseio
adequado
do
microscópio óptico composto;
4. Diferenciar bactérias de acordo com a
morfologia (forma e arranjo) de suas
células.
AULA PRÁTICA n°
MATERIAIS E MÉTODOS
Preparações microscópicas a fresco, fixadas
simples e coloração de Gram.
Corantes utilizados: cristal violeta e azul de
metileno. Solução salina estéril.
Coloração simples
Técnica de coloração a fresco
- Flambar rapidamente uma lâmina de
microscopia limpa, nos dois lados, “cortando”,
lentamente, a chama do bico de Bunsen;
- Flambar a alça de repicagem ao rubro e, a
seguir, deixá-la esfriar, conservando-a, todavia,
perto da chama;
- Tomar o tubo com a suspensão de leveduras,
agitá-lo levemente com a mão esquerda e com o
dedo mínimo e anular da mão direita, remover o
tampão de algodão da boca do tubo;
- Flambar a boca do tubo de cultura;
- Introduzir a alça de repicagem, presa entre o
polegar e o indicador da mão direita, no interior
do tubo, até tocar a suspensão;
- Flambar novamente a boca do tubo de cultura;
- Tomar uma lâmina (anteriormente preparada)
com a mão e depositar em seu centro uma
gotícula da suspensão;
- Pingar uma gota de azul de metileno a pequena
distância da suspensão e, sobre a lâmina,
colocar uma lamínula;
- Observar ao microscópio na objetiva de 40x.
INTRODUÇÃO
Preparações
microscópicas
compreendem
técnicas
de
tratamento
de
espécimes
microbianos em lâminas a serem examinadas ao
microscópio. Células microbianas podem ser
examinadas vivas, a fresco, sobre lâminas, com
auxílio ou não de corantes, vitais, ou podem ser
fixadas pelo calor sobre a lâmina e coradas com
corantes químicos específicos.
A visualização microscópica a fresco é difícil
devido ao tamanho reduzido e ao índice de
refração dos microrganismos que se aproximam
ao da água, tornando-os praticamente incolores,
quando suspensos em um meio aquoso.
Apesar
da
dificuldade
de
visualização,
preparações microscópicas a fresco são úteis
para observar a viabilidade e algumas atividades
celulares, como motilidade e fissão binária, e
para observar o tamanho e a forma natural das
células microbianas.
Para diferenciar os microrganismos em grupos
específicos com o propósito de diagnosticar e de
estudar suas propriedades, utilizam-se corantes e
técnicas
de
coloração
que
constituem
ferramentas
essenciais
nas
preparações
microscópicas. Um corante é, geralmente, um
sal, no qual um dos seus íons é um cromóforo.
Se o cromóforo é positivo, o corante é básico,
como é o caso do azul de metileno, do cristal
violeta ou da fucsina. Se o cromóforo é negativo,
o corante é ácido, como o ácido pícrico.
Corantes básicos, carregados positivamente, são
ideais para corar bactérias, porque os ácidos
nucléicos e alguns componentes da parede
celular apresentam carga negativa e são atraídos
por cromóforos catiônicos.
Nas técnicas de coloração simples, células
microbianas fixadas sobre uma lâmina são
coradas com um único corante.
OBJETIVOS
1. Preparar
lâminas
a
fresco
para
observação de algumas amostras de
leveduras;
Técnica de coloração simples com material
sólido
- Colocar no centro da lâmina uma pequena gota
de solução fisiológica com a alça de repicagem;
- Transferir uma pequena alíquota da cultura
sólida para a lâmina, colocar sobre ela uma gota
de solução fisiológica e espalhar o material com
movimentos circulares (esfregaço);
- Em seguida, “cortar”, lentamente, a lâmina na
chama do bico de Bunsen, a fim de que o
material fique bem aderente à lâmina (fixação);
- Cobrir a lâmina com o esfregaço fixado com o
cristal violeta por 1 minuto e, em seguida, lavar
com água;
- Observar ao microscópio na objetiva de 100x.
OBS. Quando a cultura estiver em meio líquido,
não utilizar solução fisiológica para o esfregaço.
Para fazê-lo, utiliza-se a alíquota da cultura
diretamente na lâmina que deve ser cortada
sobre o bico de Bunsen até secar, repetindo-se a
operação cinco vezes.
EXERCÍCIOS DE FIXAÇÃO
1. Descreva detalhadamente o processo de
esfregaço, a partir de uma cultura bacteriana
sólida.
2. Qual a diferença entre o esfregaço de cultura
sólida e o de cultura líquida?
3. Como se faz a fixação de um esfregaço
bacteriano? Qual é a finalidade da fixação?
4. Esquematize as preparações a fresco e as
preparações coradas simples observadas.
Coloração a fresco
Coloração simples
Técnicas de coloração de Gram
INTRODUÇÃO
Corantes são substâncias que possuem a
propriedade de transmitir sua cor a outros corpos.
As colorações em microbiologia são de vital
importância, pois funcionam como opção na
identificação presuntiva dos diversos agentes
patogênicos.
Preparações coradas são comumente usadas no
exame microscópio de bactérias e de fungos em
microbiologia, em que esfregaços de material são
submetidos à ação de um ou mais corantes após
a fixação.
A maioria das bactérias é corada pelo método de
Gram, que permite observar sua morfologia e
fornece
informações
a
respeito
do
comportamento do material celular diante de
corantes básicos (corantes de Gram). Essa
técnica separa as bactérias em dois grupos:
Gram-positivas e Gram-negativas.
A coloração é chamada de Gram devido ao Dr.
Christian Gram, que descreveu pela primeira vez
esse processo de coloração em 1884, ao fazer
uma referência à composição da parede celular.
As bactérias Gram-positivas possuem uma
espessa camada de peptidioglicano e de ácido
teicóico; enquanto as Gram-negativas possuem
uma fina camada de peptidioglicano sobre a qual
se encontra uma camada de lipoproteínas, de
fosfolipídeos,
de
proteínas
e
de
lipopolissacarídios.
A coloração de Gram envolve a aplicação de
quatro reagentes: cristal violeta (CV) e lugol (iodo
metálico e iodeto de potássio) (I), que formam um
complexo insolúvel (CV-I); álcool-acetona, que
funciona como solvente de lipídios e desidratante
de proteínas, e fucsina ou safranina.
O tratamento com álcool-acetona extrai os
lipídios,
resultando
no
aumento
da
permeabilidade da parede celular das bactérias
Gram-negativas. Assim, o complexo cristal
violeta-iodo (CV-I) pode ser retirado, e as
bactérias Gram-negativas são descoradas. A
parede celular das bactérias Gram-positivas, em
virtude de sua composição, torna-se desidratada
durante o tratamento com álcool. Além disso, a
permeabilidade é reduzida, e o complexo CV-I
não pode ser extraído. Finalmente, utiliza-se
fucsina ou safranina que funciona como corante
básico de contraste (contracorante). O tratamento
com fucsina ou safranina não altera a cor roxa
das Gram-positivas, ao passo que as Gramnegativas, descoradas pelo álcool, tornam-se
avermelhadas.
OBJETIVOS
1. Aprender a técnica de coloração de Gram;
2. Aprender os fundamentos da coloração de
Gram;
3. Comparar a estrutura da parede celular
das bactérias Gram-positivas e Gramnegativas.
MATERIAIS E MÉTODOS
A. Materiais
Cultura
de
bactérias
Gram-positivas
(Streptococcus, Staphylococcus, Bacillus);
Cultura
de
bactérias
Gram-negativas
(Escherichia coli, Pseudomonas, Salmonella);
- Tubos com salina estéril.
- Cristal violeta (corante);
- Lugol (mordente);
- Álcool-acetona (descorante);
- Fucsina ou safranina (corante).
B. Método
- Fazer um esfregaço bem homogêneo, fixar pelo
calor e esperar esfriar (conforme roteiro de aula
prática parte 1);
- Cobrir com cristal violeta, e deixar agir por 1
minuto;
- Lavar rapidamente com água;
- Cobrir com solução de lugol durante 2 minutos;
- Lavar em água corrente;
- Lavar a lâmina com álcool-acetona até que não
se desprenda mais corante da preparação
(aproximadamente 15 segundos);
- Lavar rapidamente a lâmina com água;
- Corar com fucsina durante 30 segundos;
- Lavar a lâmina com água e, em seguida, deixar
secar ao ar ou entre papel de filtro;
- Observar ao microscópio, focalizando com a
objetiva de imersão (100x).
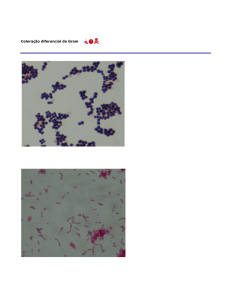
Figura 1:
Figura 2
EXERCÍCIOS DE FIXAÇÃO
(continuação da parte 1)
5. Descreva a técnica de coloração de Gram.
6. Explique por que as bactérias Gram-negativas
apresentam coloração diferente das bactérias
Gram-positivas.
7. Preencha o quadro a seguir:
Microrganismo
Forma Arranjo Cor Gram
Referências
OKURA, M. H. & RENDE, J. C. Microbiologiaroteiros de aulas práticas. São Paulo: Tecmedd,
2008.
NOTA:
Qualquer processo de coloração segue basicamente três
passos:
1.
2.
8. Qual tipo de bactéria (gram negativa ou gram
positiva) está representada na figura 1 e 2?
•
•
3.
Preparo do esfregaço: O esfregaço é a
colocação dos microrganismos na lâmina de
vidro para serem submetidos à coloração.
Deve ser oval e delgado.
Fixação do esfregaço: serve para fixar os
microrganismos do esfregaço na lâmina de vidro,
para que posteriormente não sejam removidos
durante o processo de coloração.
Este procedimento faz com que o protoplasma
das células dos microrganismos se coagule,
aderindo- os desta forma na lâmina.
A forma mais utilizada de fixação de esfregaço, é
passá-lo pela chama umas três vezes. Há também
outros processos utilizando produtos químicos.
Coloração
propriamente
dita:
são
os
procedimentos de cada técnica de coloração.