UNIVERSIDADE ANHANGUERA DE SÃO PAULO
SILVANA COELHO DE ARRUDA BARBOSA
ESTUDO DA AÇÃO SINÉRGICA DE NOVOS COMPOSTOS NA
DOENÇA DE CHAGAS EXPERIMENTAL
SÃO PAULO
2015
SILVANA COELHO DE ARRUDA BARBOSA
PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA E
INOVAÇÃO EM SAUDE
ESTUDO DA AÇÃO SINERGICA DE NOVOS COMPOSTOS NA
DOENÇA DE CHAGAS EXPERIMENTAL
Dissertação apresentada ao Programa
de Mestrado em Biotecnologia e
Inovação em Saúde da Universidade
Anhanguera de São Paulo, como
requisito parcial à obtenção do Título
de Mestre em Biotecnologia.
Orientadora: Profa. Dra. Márcia
Regina Machado dos Santos
SÃO PAULO
2015
DEDICATÓRIA
Dedico este trabalho a DEUS, pois sem Ele
nada seria. Ele o autor da minha fé, razão da
minha esperança. Só tenho a agradecer por tudo
que tenho e por tudo que sou. Maravilhoso és
Tu em minha vida.
AGRADECIMENTOS
Não é fácil mais considero a elaboração de uma dissertação de mestrado um produto coletivo
embora sua redação, responsabilidade e estresse sejam predominantemente individuais. Várias
pessoas contribuíram para que este trabalho chegasse a bom termo. A todas elas registro
minha gratidão. Foi há dois anos que comecei algo... Algo que agora apresento com um
sentimento de alívio como há muito não sentia!
Hoje eu sei que a aprendizagem é muito importante... e aprender o que ainda não sei é uma
tarefa árdua e incessante. Ah! E como existem coisas a serem aprendidas! E por isso serei
sempre aprendiz. Eu creio que esta parte de agradecimentos é uma tarefa difícil, pois muitas
vezes cometemos injustiças e por esquecimento não mencionamos nomes de pessoas que
também contribuíram para o trabalho. Nada na vida conquistamos sozinhos. Sempre
precisamos de outras pessoas para alcançar os nossos objetivos. Muitas vezes um simples
gesto pode mudar a nossa vida e contribuir para o nosso sucesso.
Meus sinceros e eternos agradecimentos...
A Deus
Deus por sempre me iluminar, guiar e principalmente proteger... graças a ele... mesmo quando
penso ter tomado decisões erradas, tudo acabava dando certo.
À minha família
A você mãe Judith Deboletto, minha rainha que esteve comigo a todo o momento,
incentivando e sempre acreditando que eu poderia mais. Sonhou junto comigo e hoje
compartilha este momento de conquista comigo, te amo mãe.
Ao meu marido, que me apresentou o mundo como um universo de conhecimentos, deixando
como meta a sede de buscar sempre mais e mais. Não tenho palavras! Obrigado por tudo!
Guilherme, filho amado, “Teu lábio sorriu para todos os ventos e o mundo inteiro ficou feliz”
(Cecília Meireles). Sempre será assim. Sou grata pela compreensão. Amor infinito!
Minha orientadora
Minha gratidão especial á você professora Dra Márcia Regina Machado dos Santos, anjo
que me acolheu com muito carinho. Só foi possível completar esse caminhar porque você me
motivou, apoiou, me ensinou. Quando meus olhos percorrem este estudo, não sei onde
começa o meu falar e inicia-se o seu. Isso me agrada porque “juntas” concretizamos esta
dissertação, por isso, esse trabalho e tão meu quanto seu. Que este trabalho represente mais
um passo na nossa caminhada profissional e pessoal. Saiba que nessa vida eu encontrei
pessoas queridas uma delas foi você.
A minha amiga especial
Irmã para todas as horas, companheira de laboratório, Dra. Norma Andrade Ikeda, a gota de
água que faltava. Obrigada amiga pela dedicação, profissionalismo, apoio, compreensão e
principalmente, pela amizade, e descontração indispensável durante a realização deste
trabalho. Valeu florzinha foi um prazer inenarrável!
Aos docentes
A todos os docentes do programa de pós graduação em Biotecnologia e inovação e saúde, que
participaram ativamente do desenvolvimento deste trabalho, fornecendo todo seu
conhecimento para a conclusão desta pesquisa e sempre me encorajaram para continuar,
mesmo diante das dificuldades.
Norma Andrades Ikeda, Suzana Nogueira Diniz, Camillo Anauate Netto, Fábio Dupart
Nascimento, Hugo Roberto Lewgoy, Marcia Regina Machado dos Santos, Marcela Rocha de
Oliveira Carrilho, Maria Cristina Marcucci Ribeiro , Niraldo Paulino , Paulo Celso Pardi, José
Agustín Pablo Quincoces Suárez, Luis Carlos Marques, Regina Mara Silva Pereira, Claudete
Justina Valduga, Sérgio de Mendonça, Andréa Anido Anido de Carvalho.
Aos amigos e colegas de trabalho
Meu muito obrigado por toda a força e apoio, que somente os reais amigos são capazes de
oferecer, sem pedir nada em troca, apenas pelo simples prazer de me ver vencer.
Cristina Santos, Ècio Veríssimo, Artur de Castro, Janaina Iannicelli, Hebert Ricci, Caroline
Stoppa, Ivair Donizete, Patricia Benvenuti, Bianca Oliveira, Sandra Aparecida, Lucineide da
Silva, João Barbosa Lima, Benvinda Ferreira, Maricéu Cunha, Alfredo Ribeiro, Manoela
Leão, José Raimundo, Marcos José da Silva.
"A melhor de todas as coisas é aprender. O
dinheiro pode ser perdido ou roubado, a
saúde e força podem falhar, mas o que você
dedicou á sua mente é seu para sempre"
Louis L. Amour
SUMÁRIO
1
INTRODUÇÃO ........................................................................................................... 15
2
REVISÃO DA LITERATURA ................................................................................... 17
2.1 A doença de chagas ................................................................................................ 17
2.2 Transmissão ........................................................................................................... 18
2.3 Taxonomia ............................................................................................................. 19
2.4 Formas evolutivas .................................................................................................. 20
2.5 Ciclo evolutivo ....................................................................................................... 21
2.6 Fases da doença de chagas ...................................................................................... 23
2.6.1 Fase aguda ..................................................................................................... 23
2.6.2 Fase crônica ................................................................................................... 24
2.6.3 Fase latente ou indeterminada ........................................................................ 25
2.7 Mecanismos de invasão celular............................................................................... 25
2.8 Tratamento ............................................................................................................. 27
2.9 Cumarinas .............................................................................................................. 28
2.10 Complexos metálicos............................................................................................. 30
3
OBJETIVOS ............................................................................................................... 32
3.1 Objetivo geral......................................................................................................... 32
3.2 Objetivos específicos .............................................................................................. 32
4
METODOLOGIA ....................................................................................................... 33
4.1 Material biológico .................................................................................................. 33
4.2 Compostos utilizados ............................................................................................. 33
4.3 Avaliação da citotoxidade em células vero ............................................................. 33
4.3.1 Infecção das células vero com T. cruzi........................................................... 34
4.4 Avaliação da atividade dos compostos contra as formas amastigotas das cepas G, CL
e Esmeraldo do T. cruzi .......................................................................................... 35
4.5 Avaliação da atividade antiparasitária in vivo ......................................................... 37
4.5.1 Procedência dos animais ................................................................................ 37
4.5.2 Infecção dos animais com T. cruzi ................................................................. 37
4.5.3 Grupos de tratamento .................................................................................... 38
4.5.4 Avaliação da parasitemia ............................................................................... 38
4.5.5 Eutanásia dos animais ................................................................................... 39
4.6 Análise do perfil de citocinas .................................................................................. 39
5
RESULTADOS ........................................................................................................... 40
5.1 Avaliação da atividade antiparasitária dos compostos em células vero infectadas com
as cepas G e CL e Esmeraldo .................................................................................. 41
5.2 Estudos in vivo ....................................................................................................... 46
5.2.1 Fase aguda .................................................................................................... 46
5.2.2 Análise da parasitemia dos animais infectados com a cepa G na fase aguda ... 46
5.2.3 Análise da parasitemia nos animais infectados com a cepa CL na fase aguda. 47
5.3 Estudos in vivo fase crônica .................................................................................... 48
5.4 Análise da parasitemia nos animais infectados com a cepa G na fase crônica .......... 48
5.5 Análise da parasitemia nos animais infectados com a cepa CL na fase crônica........ 48
5.6 Quantificação das citocinas IL-1, IL-12, IFN-beta e TNF-alfa no soro dos animais
com doeça de chagas fase crônica. .......................................................................... 49
6
DISCUSSÃO ............................................................................................................... 54
7
CONCLUSÕES ........................................................................................................... 57
8
REFERÊNCIAS BIBLIOGRÁFICAS ....................................................................... 58
LISTA DE QUADROS
Quadro 1. Atividade citotóxica e índice de segurança dos compostos metálicos em células
VERO e formas epimastigotas das cepas G e CL do T. cruzi ................................................ 31
Quadro 2. Esquema de tratamento na fase aguda .................................................................. 38
Quadro 3. Esquema de tratamento na fase crônica ................................................................ 38
Quadro 4. Esquema das associações dos compostos utilizados ............................................. 40
Quadro 5. Índice de infecção das células VERO infectadas com a forma amastigota do T.
cruzi cepa G. ........................................................................................................................ 41
Quadro 6. Índice de infecção das células VERO infectadas com a forma amastigota do T.
cruzi cepa CL. ...................................................................................................................... 42
Quadro 7. Índice de infecção das células VERO infectadas com a forma amastigota do T.
cruzi cepa Esmeraldo. .......................................................................................................... 43
10
LISTA DE FIGURAS
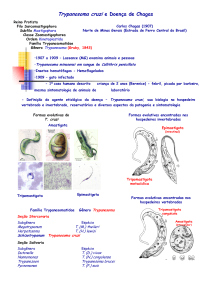
Figura 1. Carlos Chagas, descobridor da doença. .................................................................. 17
Figura 2. Espécies de Triatomíneos com mais frequência no Brasil. Fonte: .......................... 18
Figura 3. Taxonomia do protozoário T. cruzi. ....................................................................... 19
Figura 4. Forma Tripomastigota. .......................................................................................... 20
Figura 5. Forma Amastigota. ................................................................................................ 21
Figura 6. Forma Epimastigota. ............................................................................................. 21
Figura 7. Ciclo de vida do T. cruzi.. ..................................................................................... 23
Figura 8. “Sinal de Romaña”. ............................................................................................... 24
Figura 9. Ativação e transdução de sinal em tripomastigotas metacíclicas ............................ 26
Figura 10. Estrutura química do Nifurtimox (3-metil-4-5 (nitrofurfurilidenoamina) ............. 27
Figura 11: Estrutura química do Benzonidazol (N-benzil-2-nitroimidazol acetamida) .......... 28
Figura 12: Estrutura química da cumarina (A) e 4-hidroxi-3-nitrocumarina .......................... 29
Figura 13. Teste colorimétrico do MTT. ............................................................................... 34
Figura 14. Lâminas contendo lamínulas com células VERO infectadas com cepa CL. .......... 36
Figura 15. Células VERO infectadas com a forma amastigota do T. cruzi............................. 36
Figura 16. Atividades das associações em cepas G e CL. ..................................................... 40
Figura 17. IF de células Vero com a forma amastigota da cepa G do T. cruzi. ...................... 42
Figura 18. IF de células Vero com a forma amastigota da cepa CL do T. cruzi.. ................... 43
Figura 19. IF de células Vero com a forma amastigota da cepa Esmeraldo do T. cruzi.. ........ 44
Figura 20. % de inibição do IF das três diferentes cepas do T. cruzi ..................................... 45
Figura 21. Parasitemia na fase aguda – infecção com a cepa G do T. cruzi, .......................... 47
Figura 22. Parasitemia na fase aguda – infecção com a cepa CL de T. cruzi ......................... 47
11
Figura 23. Parasitemia na fase crônica – infecção com a cepa G do T. cruzi ......................... 48
Figura 24. Parasitemia na fase crônica – infecção com a cepa CL do T. cruzi ....................... 49
Figura 25. Concentração de IL-1β (pg/ml) – infecção com a cepa G. .................................... 50
Figura 26. Concentração de IL-12 (pg/ml) – infecção com a cepa G. .................................... 51
Figura 27. Concentração de IFN-γ (pg/ml) - infecção com a cepa G ..................................... 52
Figura 28. Concentração de TNF-α (pg/ml) – infecção com a cepa G ................................... 53
12
LISTA DE ABREVIATURAS
4H3NC
4H3NC-Cu
4H3NC-Fe
4H3NC-Ni
4H3NC-Zn
AMPc
BZ
DMSO
DMEM
DNA
EDTA
gp35/50
gp82
HEPES
IP3
IF
IC50
LIT
MTT
NADH
PBS
rpm
RPMI
SFB
T. cruzi
TEMED
Tris-HCl
4-hidroxi-3-nitrocumarina
4-hidroxi-3-nitrocumarina-Cu2+
4-hidroxi-3-nitrocumarina- Fe2+
4-hidroxi-3-nitrocumarina- Ni2+
4-hidroxi-3-nitrocumarina- Zn2+
Adenosina 3’, 5’-monofosfato cíclico
Benzonidazol
Dimetilsulfóxido
Dulbecco’s Modified Eagle Medium
Ácido desoxirribonucleico
Ácido etilenodiaminotetraacético
Glicoproteina 35 e 50 kDa de T. cruzi
Glicoproteina 82 KDa de T.cruzi
(4-(2-hydroxyethyl)-ácido 1-piperazineethanesulfonic)
Receptor trisfosfato de inositol
Índice de infecção
Concentração inibitória de 50%
Liver Infusion Triptase
3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazólio /triptose
Nicotinamida adenina dinucleotídeo
Tampão Salina fosfato
Rotações por minuto
Roswell Park Memorial Institute - 1640 meio para cultivo de células
Soro fetal bovino
Trypanosoma cruzi
Tetramethylethyldiamine
(hidroxymethyl) aminomethane hydrochloride
13
RESUMO
A doença de Chagas ou Tripanossomíase Americana é uma infecção parasitária causada pelo
protozoário flagelado Trypanosoma cruzi. Foi descoberta no Brasil por Carlos Chagas, ao
examinar uma menina doente, encontrou tripanossomos em seu sangue. Posteriormente nas
fezes de insetos existentes na região e em sangue de animais mamíferos, constatou também a
presença dos mesmos parasitas. Neste estudo foi relatada a susceptibilidade de diferentes
cepas do protozoário Trypanosoma cruzi a compostos metálicos e suas associações na
eliminação de forma amastigotas, responsável pela fase crônica da doença. Usando
combinações de compostos metálicos que resultaram maiores índices de segurança (IS),
analisamos sinergia no tratamento de camundongos infectados pelas cepas G e CL de T.cruzi,
estudando a ação na fase aguda e crônica da doença de Chagas. Os estudos in vitro foram
realizados com as duas cepas G e CL nas formas amastigotas de T. cruzi tratados com
benzonidazol, cumarina, 4-hidroxi-3-nitrocoumarin (4H3NC) e 4H3NC associado com metais
(cobre, ferro, zinco ou níquel). A utilização de compostos relacionados com o tratamento de
amastigotas mostrou uma maior eficácia em relação ao benzonidazol, assim como diferenças
entre as cepas. Análise in vivo do sinergismo de ação dos compostos associados com zinco e
ferro apresentou resultados muito promissores. Um total de 64 animais foi dividido em grupos
que foram infectados com cepas de T. cruzi G e CL e depois tratadas com protocolos
diferentes para a doença de Chagas aguda e crônica. A parasitemia foi realizada a cada 72
horas a partir do sétimo dia, por contagem do número de parasitas / mL em uma gota de
sangue obtida a partir da cauda do animal. A análise mostrou significância na atividade antiamastigota de compostos 4H3NC-Cu, cumarina e 4H3NC-Fe em comparação ao controle e
benzonidazol em diferentes linhagens. Estudos in vivo de sinergismo de ação dos compostos
para a fase aguda da doença de Chagas experimental mostrou maior eficácia do que o
tratamento com benzonidazol. Na fase aguda da doença de Chagas experimental, in vivo, o
tratamento com a associação do benzonidazol com a 4H3NC-Fe controlou a parasitemia
inibindo significativamente a multiplicação dos parasitos nos animais infectados com a cepa
G as associações do benzonidazol com 4H3NC-Fe e 4H3NC-Zn diminuiram em 40% o
número de parasitos circulantes. Para a cepa CL os achados demonstram o potencial
antiparasitário das associações contra as cepas G e CL do T.cruzi.
Palavra chave: doença de Chagas, fase aguda e crônica, sinergismo
14
ABSTRACT
American trypanosomiasis or Chagas disease is a parasitic infection caused by the
flagellate protozoan Trypanosoma cruzi. It was discovered in Brazil by Carlos
Chagas, to examine a sick girl, found trypanosomes in their blood. Later in the feces
of insects of the region and the blood of mammals, also found the presence of these
parasites. This study reported the susceptibility of different strains of the protozoan
Trypanosoma cruzi the metal compounds and their associations in the elimination of
amastigotes, responsible for the chronic phase of the disease. Using combinations of
metallic compounds resulting increased security indices (IS), we analyze synergy in
the treatment of mice infected with strains G and T. cruzi CL, studying the action in
acute and chronic Chagas disease. In vitro studies were performed with both strains
G and CL in amastigotes of T. cruzi treated with benznidazole, Coumarin, 4-hydroxy3-nitrocoumarin (4H3NC) and 4H3NC associated with metals (copper, iron, zinc, or
nickel) . The use of compounds related to the treatment of amastigotes showed
greater effectiveness in benznidazole, as well as differences between the strains. In
vivo analysis of synergism of action of the compounds associated with zinc and iron
showed very promising results. A total of 64 animals were divided into groups that
were infected with T. cruzi G or CL and then treated with various protocols for acute
and chronic Chagas' disease. The parasitemia was performed every 72 hours from
the seventh day by counting the number of parasites / ml in a drop of blood obtained
from the tail of the animal. The analysis showed significance in the anti-amastigote
activity 4H3NC-Cu compounds, coumarin and 4H3NC-Fe compared to the control
and benznidazole in different lineages. In vivo synergistic action of compounds to the
acute phase of experimental Chagas disease show greater efficacy than treatment
with benznidazole. In the acute phase of experimental Chagas' disease, in vivo,
treatment with the combination of benznidazole with 4H3NC Fe-controlled
parasitaemia significantly inhibiting the multiplication of parasites in animals infected
with strain G; benznidazole the associations with 4H3NC-Fe-Zn and 4H3NC
decreased by 40% the number of circulating parasites. For the CL strain findings
demonstrate the potential antiparasitic associations against strains G and T. cruzi
CL.
Keyword: Chagas disease, acute and chronic phase, synergism
15
1 INTRODUÇÃO
A doença de Chagas foi descoberta em 1909, pelo médico e cientista brasileiro Carlos
Chagas. Primariamente, ocorre apenas nas Américas, em virtude da distribuição do vetor estar
restrita a este continente. Entretanto, são registrados casos em países não endêmicos por
outros mecanismos de transmissão ou pela migração intensa de latino-americanos para outros
continentes (FIOCRUZ, 2013).
No Brasil, atualmente predominam os casos crônicos de doença de Chagas decorrentes
de infecções adquiridas no passado. No entanto, nos últimos anos, a ocorrência de doença de
Chagas aguda tem sido observada nos estados da Amazônia Legal (Acre, Amazonas, Amapá,
Rondônia, Roraima, Pará, parte do Tocantins, Maranhão e Mato Grosso), com ocorrência de
casos isolados em outros estados. Estima-se que existam aproximadamente 12 milhões de
portadores da doença crônica nas Américas, cerca de 2 a 3 milhões no Brasil. Segundo dados
da Organização Mundial da Saúde (OMS), cerca de 8 milhões de pessoas estão infectadas
com a doença de Chagas no mundo e 25 milhões encontram-se em áreas de risco para a
enfermidade (AGÊNCIA FIO CRUZ DE NOTÍCIAS, 2013).
A doença de Chagas é uma das principais causas das doenças do coração na América
Latina, sendo a principal causa de morbidade e mortalidade que ocorre de 5 a 30 anos após a
infecção primária em cerca de 30% dos indivíduos infectados (NETO, 1999). É uma doença
de evolução crônica, debilitante, que determina no homem quadros clínicos com
características e consequências muito variadas.
Essa doença constitui um grande problema social e sobrecarrega os órgãos de
previdência social, com um montante de aposentadorias precoces nem sempre necessárias. De
acordo com a Organização Mundial de Saúde (OMS) e o banco Mundial, são gastos mais de
seis bilhões de dólares por ano no tratamento dessa doença, pois, essa enfermidade faz com
que o indivíduo se torne debilitado e incapaz, sendo uma das principais causas da
aposentadoria antecipada (DIAS; LOYOLA; BRENER, 1985; LOPES; CHAPADEIRO,
1986).
Historicamente, por motivos econômicos, a indústria farmacêutica não tem investido
na pesquisa e desenvolvimento de novos compostos contra as doenças negligenciadas, como a
doença de Chagas. O único medicamento de referencia no Brasil atualmente é o benzonidazol
que possui eficácia limitada à fase aguda, bem como efeitos colaterais severos e a resistência
desenvolvida por algumas cepas do Trypanosoma cruzi. Assim, existe uma necessidade
urgente de novas estratégias de tratamento, como a utilização de compostos naturais e
16
sintéticos com potencial atividade biológica e que possam ser administrados conjuntamente
aos tratamentos atuais, visando um sinergismo de ação antiparasitária e diminuição dos efeitos
colaterais (TEIXEIRA; 1987).
17
2 REVISÃO DA LITERATURA
2.1 A doença de chagas
A doença de Chagas ou Tripanossomíase Americana é uma infecção parasitária
causada pelo protozoário flagelado Trypanosoma cruzi. Foi descoberta no Brasil por Carlos
Chagas, pesquisador do Instituto Oswaldo Cruz, em 1909, cujo nome da doença é dado em
sua homenagem. Este brasileiro descobriu a doença e descreveu praticamente todos os seus
aspectos. Quando Carlos Chagas realizava uma campanha contra a malária que atingia
operários na construção de um trecho da Estrada de Ferro Central do Brasil, ao norte de Minas
Gerais, ao fazer exames de uma menina doente, encontrou tripanosomos em seu sangue. Ao
examinar posteriormente as fezes de insetos existentes na região e o sangue de animais
mamíferos, constatou também a presença dos mesmos parasitas. Desta forma, Carlos Chagas
pode descrever o agente causador, o transmissor e o modo de transmissão da doença, como
também comprovar a existência de vertebrados que são reservatórios silvestres e domésticos
do parasita, esclarecendo assim os aspectos básicos da epidemiologia da doença. A
transmissão do parasito para humanos ou outros animais é normalmente feita por meio do
inseto triatomíneo hematófago popularmente chamado de “barbeiro” (MAYA, 2006).
Figura 1. Carlos Chagas, descobridor da doença em seu Laboratório no Instituto Oswaldo Cruz.
Fonte: Revista Vive Latinoamérica (15 de abril de 2014)
18
2.2 Transmissão
A transmissão do parasito para humanos ou outros animais é normalmente feita por
meio do inseto triatomíneo. O inseto vetor transmissor possui hábito noturno e se alimenta,
exclusivamente, do sangue de animais vertebrados. Vivem em frestas de casas de pau a pique,
camas, colchões, depósitos, ninhos de aves, troncos de árvores, dentre outros locais, sendo
que tem preferência por locais próximos à sua fonte de alimento.
Nessas habitações criaram-se condições ideais favoráveis para a vida de várias
espécies de triatomíneos. O barbeiro é também conhecido por outras denominações, tais
como: “chupança” ou “bicho de parede”, “fincão”, “bicudo” ou “chupão”. Originalmente
silvestres ou exóticos, eles aí se domiciliaram e passaram a transmitir a infecção aos
moradores e aos seus animais domésticos (REY, 2001).
Existem mais de 100 espécies de insetos triatomíneos no continente americano e
muitos desses são responsáveis pela manutenção do ciclo selvático da doença. No Brasil, os
vetores mais importantes para a doença de Chagas são: Rhodnius prolixus, Panstrogilus
megistus e Triatoma infestans. Em 2013, o Laboratório Nacional e Internacional de
Referência em Taxonomia de Triatomíneos do Instituto Oswaldo Cruz (IOC/Fiocruz)
identificou um novo triatomíneo, o Triatoma pintodia.
Figura 2. Espécies de Triatomíneos com mais frequência no Brasil. Fonte:
Acervo pessoal – Adaptação feita do site:
http://web.stanford.edu/group/parasites/ParaSites2004/Trypanosomiasis/vector.htm
19
A transmissão pode também ocorrer por transfusão de sangue, transplante de órgãos,
aleitamento materno, durante a gestação, ingestão de formas parasitárias em alimentos
contaminados e de forma acidental, quando ocorre por meio de outros vetores ou pelo contato
direto com as fezes infectadas de triatomíneos (DIAS, 1992).
2.3
Taxonomia
O agente etiológico da doença de Chagas, o protozoário flagelado T. cruzi, pertence à
ordem Kinetoplastida, família Trypanosomatidae, gênero Trypanosoma, e espécie
Trypanosoma cruzi, conforme o esquema representado na Figura 3.
Figura 3. Taxonomia do protozoário T. cruzi.
Fonte: Acervo pessoal – Construção Cmap Tools
20
2.4
Formas evolutivas
Pela observação por microscopia óptica do T. cruzi é possível à identificação de três
formas evolutivas bem definidas:
a)
Forma Tripomastigota: forma alongada (podendo se apresentar como formas finas e
largas), com cinetoplasto arredondado, localizado na região posterior ao núcleo; flagelo
emergindo da bolsa flagelar (não visível ao microscópio óptico) que se localiza lateralmente,
na região posterior do parasito. O flagelo emerge e se adere ao longo do corpo do parasito,
tornando-se livre na região anterior. Esta forma é infectante e pode ser encontrada no inseto
vetor (porção posterior do intestino, no reto); sangue e espaço intercelular dos hospedeiros
vertebrados; Por microscopia eletrônica de transmissão podemos ver que a sua superfície é
bastante rugosa (AGUIAR, 2008).
Figura 4. Forma Tripomastigota.
Fonte: http://slideplayer.com.br/slide/353039
b)
Forma Amastigota: forma arredondada, com cinetoplasto em forma de barra ou
bastão na região anterior ao núcleo, flagelo curto (não visível ao microscópio óptico) que
emerge da bolsa flagelar. Esta forma pode ser encontrada no interior das células de
hospedeiros infectados (Figura 5). Por microscopia eletrônica de transmissão sua superfície é
bastante rugosa. Todos os membros da família Tripanossomatidae apresentam um flagelo que
emerge de uma área de invaginação da membrana que reveste o corpo celular e forma a bolsa
flagelar. Na forma amastigota o flagelo é muito curto, muitas vezes permanecendo no interior
da bolsa flagelar, razão pelo qual às vezes não é visto ao microscópio óptico, o que levou à
criação do termo amastigota (sem flagelo) para erroneamente designar a forma intracelular
multiplicativa do T. cruzi e de Leishmania sp. (SOUZA, 2008b, apud, AGUIAR, 2008).
21
Figura 5. Forma Amastigota.
Fonte: http://slideplayer.com.br/slide/353039/
c)
Forma Epimastigota: forma alongada, com cinetoplasto em forma de barra ou bastão
localizado anteriormente ao núcleo (Figura 6). O flagelo emerge da bolsa flagelar com
abertura lateral, e percorre aderido a parte do corpo do parasito, tornando-se livre na região
anterior. Pode ser encontrado no tubo digestivo do inseto vetor. Por microscopia eletrônica de
transmissão sua superfície é bastante lisa, exceto na região mais especializada do
citóstomo(SOUZA, 2008b, apud, AGUIAR, 2008).
Figura 6. Forma Epimastigota.
Fonte: http://slideplayer.com.br/slide/353039
2.5 Ciclo evolutivo
Considerando-se o ciclo natural da infecção, o parasito estaria primitivamente restrito
aos pequenos mamíferos e marsupiais selvagens das matas e campos da América, desde a
Patagônia até o Sul dos Estados Unidos. Com o início da colonização espanhola e portuguesa,
desmatamentos, queimadas, introdução de novas espécies de animais e mudanças de hábitos,
levaram á redução do habitat dos triatomíneos, levando-os a invadirem os espaços ocupados
pelos colonos e suas criações de animais (REY, 2001).
O ciclo evolutivo completo do T. cruzi ocorre em duas etapas, como descrito na figura
7: uma no interior do hospedeiro invertebrado, denominado vetor e outra no interior do
hospedeiro vertebrado, mamíferos em geral (REY, 2001). Envolve formas proliferativas e
22
formas altamente diferenciadas com capacidade infectante. Os insetos hematófagos (subfamília Triatominae,) são responsáveis pela transmissão da doença de Chagas para os
hospedeiros mamíferos.
Nos triatomíneos ocorrem as formas epimastigotas (proliferativas) e tripomastigotas
metacíclicas. A primeira diferenciação do parasito no inseto vetor ocorre no estômago, onde o
tripomastigota transforma-se em epimastigota poucas horas após a ingestão. A segunda
diferenciação do parasito no tubo digestivo do vetor se dá quando os epimastigotas se
transformam em tripomastigotas metacíclicos, sendo esta a forma infectante para o
hospedeiro vertebrado (DE SOUZA, 2000; CARLIER, TORRICO, 2003). Após o repasto
sanguíneo, estes insetos depositam suas fezes contendo as formas tripomastigotas metacíclicas
do protozoário próximo ao orifício de picada. As formas tripomastigotas chegam ao interior
das células onde ocorre a diferenciação em amastigotas, que por proliferação, formam ninhos.
A entrada dos protozoários nas formas metacíclicas por lesões na pele ou através de mucosas
resulta em posterior invasão de células do hospedeiro, tais como macrófagos, fibroblastos e
células musculares estriadas e lisas. Após a diferenciação em tripomastigotas, ocorre a ruptura
da célula e a liberação os parasitos no meio extracelular (BRENNER e ANDRADE, 2008, p.
13).
No sangue periférico dos hospedeiros mamíferos, as formas tripomastigotas são
compostas de duas populações pleomórficas principais: a fina ou alongada e a arredondada.
Após a invasão celular, as formas tripomastigotas, em todas as cepas, são englobadas no
vacúolo parasitóforo, onde, são internalizados, permanecendo um período, para, em seguida,
se diferenciarem à forma amastigota, sendo posteriormente liberadas (REY, 2001).
A forma amastigota é a responsável pela proliferação intracelular do parasito e, após
alguns ciclos de replicação, estas se diferenciam novamente nas formas tripomastigotas, que
são liberadas, podendo atingir a corrente sanguínea após a ruptura celular. Devido á sua
motilidade, as formas tripomastigotas são capazes de infectar outras células ou tecidos,
fechando o ciclo quando um triatomíneo não infectado fizer seu repasto sanguíneo (REY,
2001).
23
Figura 7. Ciclo de vida do T. cruzi. (1) O parasito presente no intestino do vetor ainda na forma epimastigota,
(2) se diferencia para a forma tripomastigota (forma infectante) quando chega às fezes do inseto, (3) que é levado
à corrente sanguínea do hospedeiro.
2.6 Fases da doença de chagas
2.6.1 Fase aguda
A fase aguda da doença de Chagas é mais comum em crianças, inicia-se quando o
inseto vetor elimina as fezes contendo as formas tripomastigotas infectantes na pele. No local
da penetração do T.cruzi ocorre um edema dos gânglios linfáticos (ROBERTS; JANOVY,
2009; FOX, 2011).
O Trypanosoma cruzi pode evadir-se do sistema imune por vários mecanismos,
incluindo a indução de efeitos supressores nas células T, invasão de células fagocíticas, como
macrófagos e adaptação ao microambiente intracelular, evitado uma resposta de anticorpos. A
entrada de T. cruzi em macrófagos é mediada por lisossomos recrutados para o local de
entrada na membrana plasmática (SACKS; SHER, 2002). Em metade dos casos, a forma
tripomastigota penetra no corpo através da conjuntiva do olho, caracterizando o denominado
sinal de Romaña (Figura 8). A conjuntiva e a pálpebra sucumbem ao edema; há um acúmulo
de líquido intersticial nestas áreas. Ocorre também o edema do nódulo linfático anterior dos
ouvidos, como uma característica do sinal de Romaña. Durante esta fase aguda, o T. cruzi
24
circula no sangue e pode ser transportado para qualquer órgão do corpo (TORTORA;
NIELSEN, 2012).
Figura 8. “Sinal de Romaña”.
Fonte: http://medicinabaseadaemresidencia.blogspot.com.br/2013/02/diagnostico-diferencial.
Tripomastigotas podem ser detectados por testes sorológicos na fase aguda
(GALVÃO-CASTRO, 1984). Estas formas penetram nas células do sistema circulatório,
transformam-se em amastigotas e se reproduzem. Os parasitos penetram nas células do baço,
fígado, da mucosa intestinal e sistema linfático e nas células musculares lisas e esqueléticas
cardíacas. Os músculos cardíacos são normalmente invadidos, e até 80% das células
ganglionares cardíacas ou massas de células nervosas, podem ser destruídas. As contrações
do coração permitem a circulação do sangue oxigenado no corpo por causa de autoestimulação, impulsos autonômicos gerados e conduzidos por tecido nervoso. Se o tecido
nervoso, que não sofre divisão celular, for danificado, ou seja, destruído pelo T. cruzi, o
músculo cardíaco não mais se contrai, e, eventualmente, esta condição é fatal (ROBERTS;
JANOVY, 2009).
No interior da célula, os parasitos transformam-se em amastigotas reproduzindo-se por
divisão binária até a destruição das células hospedeiras, com a liberação dos parasitos. Assim,
os parasitos, invadirão outras células ou se transformarão em formas intermédias, como
promastigotas e epimastigotas, nos espaços intersticiais. Algumas destas formas intermédias
irão converter-se em tripomastigotas e entrar na corrente sanguínea podendo infectar outros
órgãos (CAMPBELL; REECE, 2009).
2.6.2 Fase crônica
A fase crônica da doença de Chagas é mais comum em adultos. Esta fase caracterizase por uma grande variedade de sintomas. Em regiões endêmicas, a doença de Chagas pode
ser responsável por até 70% das mortes por problemas cardíacos. Outros órgãos comumente
invadidos incluem o esôfago e cólon. De forma semelhante ao coração, o tônus muscular e os
25
neurônios ao longo dos órgãos são destruídos. Os órgãos perdem sua função, tornando-se
frouxos e extremamente alargados, e no caso do cólon e do esôfago ocorre a dificuldade ou
impossibilidade da passagem dos alimentos e do bolo fecal. Esta patologia pode ser fatal,
especialmente quando a pessoa infectada não pode deglutir devido à impossibilidade de
passagem de alimentos pelo aparelho digestivo. Estas condições progressivas são chamadas
megaesôfago e megacólon (ROBERTS; JANOVY, 2009).
O tropismo tecidual, ou a resposta do tecido afetado devido á presença de T. cruzi, no
coração e órgãos intestinais não é completamente compreendido, apesar de quase um século
de pesquisa da doença de Chagas.
2.6.3 Fase latente ou indeterminada
A fase de latência da doença de Chagas, outro aspecto da infecção por T. cruzi, é
apenas parcialmente compreendida. Esta fase é interessante devido ao fato de que o indivíduo
infectado não demonstra quaisquer sintomas clínicos, por muitos anos. A infecção é detectada
por exames sorológicos com resultados positivos (GALVÃO-CASTRO, 1984).
2.7 Mecanismos de invasão celular
As membranas do tripanossoma e das células do hospedeiro interagem ao iniciar a
infecção. Todos os tipos de células cultivadas de mamíferos são passíveis de invasão por T.
cruzi, porém apenas as formas tripomastigotas podem penetrar em células que não
desenvolvam grande atividade fagocitária. A eficiência com que isso se dá depende da
natureza da célula e da linhagem do tripanossomo (REY, 2001).
O estabelecimento da infecção por T. cruzi, depende de uma série de eventos
envolvendo interações de diversas moléculas do parasito com componentes do hospedeiro.
Durante a internalização de tripomastigotas, vias de transdução de sinal são ativadas tanto no
parasito como na célula alvo, acarretando a mobilização de cálcio (Ca2+). Para adesão, o
tripomastigota utiliza as glicoproteínas de superfície como a gp82 e gp35/50, que são
moléculas indutoras de sinal de Ca2+. O contato de glicofosfolipídeos de membrana do T.
cruzi com a célula hospedeira via receptores Toll–like induz a via de sinalização de inositol
fosfato (IP3) e IP3–kinases, produzindo agregação de vesículas lisossomais na membrana
plasmática, favorecendo a entrada do parasito na célula. Simultaneamente, sinais proinflamatórios são produzidos através de interferon gama (INF-interleucina 12 (IL-12) e
fator de necrose tumoral (TNF-, que consequentemente eleva níveis de óxido nítrico (NO)
26
intracelular, essencial para atividade parasiticida do macrófago. Por outro lado o parasito
produz uma resposta inflamatória direcionada para evasão do sistema imune do hospedeiro,
como indução de apoptose em diversas células e imunossupressão do hospedeiro (MAYA,
2006).
Em isolados de T. cruzi cepa CL que entram na célula hospedeira de maneira
dependente de gp82, a proteína quinase assim como a fosfolipase C do parasito são ativadas e
Ca2+ é liberado de reservatórios sensíveis a IP3. Enquanto em isolados de T. cruzi cepa G que
se ligam às células alvo através de gp35/50, a via de sinalização envolvendo adenilil ciclase
parece ser estimulada, com liberação de Ca2+ de acidocalciossomos. (Figura 9). Além disso,
dependendo do isolado de T. cruzi, sinais inibitórios mediados por gp90 específica de
tripomastigota podem ser desencadeados tanto na célula hospedeira como no parasito. O
repertório de moléculas de tripomastigota de cultura de tecido implicadas na invasão celular
inclui glicoproteínas de superfície da família gp85, com membros contendo sítios de ligação à
laminina e citoqueratina 18, enzimas como a cruzipaína, trans-sialidase e uma oligopeptidase
B que gera um agonista de Ca2+ a partir de uma molécula precursora (YOSHIDA, 2006).
Figura 9. Ativação de diferentes vias de transdução de sinal em tripomastigotas metacíclicas de T. cruzi.
isolados, durante a invasão da célula hospedeira. Na cepa CL altamente invasiva, o reconhecimento da molécula
de superfície gp82 por seu receptor leva à ativação proteína quinase (PTK), fosforilação de p175, ativação da
PLC, geração de IP3, culminando com a liberação mediada por IP3 de Ca2+, provavelmente do retículo
endoplasmático. Os componentes da cepa G que sinalizaram a cascata provocada na superfície da célula por
gp35/50, são praticamente desconhecidas; AMPc gerados pela guanilatociclase podem estar envolvidos, e
acidocalcisomas parece ser a fonte de cálcio necessária para a internalização do parasito.
Fonte: YOSHIDA, 2006.
27
2.8 Tratamento
O desenvolvimento de medicamentos eficientes contra a doença de Chagas continua
sendo um desafio para pesquisadores de todo o mundo. Existem dois medicamentos que
foram utilizados para o tratamento da infecção por T. cruzi, o nifurtimox e o benzonidazol.
Devido à toxidade do nifurtimox o seu uso está suspenso no Brasil. Estes medicamentos
possuem efeitos colaterais importantes que afetam aproximadamente 40% dos pacientes,
sendo algumas vezes necessária a sua suspensão (URBINA, 2003; FIOCRUZ, 2014).
O mecanismo de ação do nifurtimox (Figura 10) envolve a produção de radicais livres,
por meio da redução do grupamento nitro, o que leva á morte do parasito (URBINA, 1999).
Como consequência, os tecidos do hospedeiro também podem ser lesados e ocorrer reações de
hipersensibilidade, anorexia, vômitos, polineurite e depressão da produção de células da
medula óssea. O principal mecanismo de ação do nifurtimox contra o T. cruzi é a produção do
radical livre hidroxila (OH•) (URBINA, 2003).
Figura 10. Estrutura química do Nifurtimox (3-metil-4-5 (nitrofurfurilidenoamina)
traidro-4H-1, tiazina 1-1 dióxido).
O benzonidazol (figura 11) apresenta eficácia acima de 80% na fase aguda e diminuiu
para 8% a 30% na fase crônica. O sucesso da terapêutica reside em alguns pontos tais como:
esquema terapêutico prolongado, reações adversas, variabilidade genética dos parasitos e
cepas naturalmente resistentes aos fármacos; mostrando a necessidade do desenvolvimento de
novos fármacos que, por um lado, apresentem menor toxicidade, e por outro, maior eficácia
na fase crônica (OLIVEIRA at al., 2008). Seu mecanismo de ação ainda não está totalmente
elucidado,
podendo ocorrer
por
modificação
covalente das
macromoléculas por
intermediários nitroreduzidos, ou por outras interações de nitroredução com os componentes
do parasito (URBINA; DOCAMPO, 2003; DOCAMPO; MORENO, 1984). O benzonidazol
incrementa a fagocitose, aumenta a mortalidade do T. cruzi por meio da indução de produção
da citocina interferon gama (INF-γ) e da inibição da NADH-fumarato redutase do parasito
(DOCAMPO; MORENO, 1984). A droga distribui-se no meio extra e intracelular, agindo
28
tanto sobre as formas tripomastigotas como sobre as formas amastigotas (POLAK; RICHLE,
1978, apud, OLIVEIRA et al., 2008; SILVEIRA et al., 2000, apud, OLIVEIRA et al., 2008).
Figura 11: Estrutura química do Benzonidazol (N-benzil-2-nitroimidazol acetamida)
Como a maioria das infecções parasitárias, a patologia da doença de Chagas é
extremamente complexa. Existem duas principais manifestações da doença de Chagas, a fase
aguda e crônica. Alguns indivíduos experimentam uma fase latente da doença, em que
sintomas clínicos não estão presentes (GALVÃO-CASTRO et al., 1984).
2.9 Cumarinas
As cumarinas são compostos naturais que apresentam um amplo espectro de
atividades biológicas (SANDHU et al, 2014). O primeiro representante desta classe química
foi isolado por Vogel, em 1820, da espécie Coumarona odorata. Esses metabólitos estão
presentes em diferentes partes das plantas tanto nas raízes como nas flores e frutos e podem
estar distribuídos em diferentes famílias de Angiospermae como Apiaceae, Rutaceae,
Asteraceae, nas quais são encontradas com ampla ocorrência. Também estão presentes em
Fabaceae, Oleaceae, Moraceae e Thymeleaceae, entre outras, onde suas ocorrências são
menores (RIBEIRO; KAPLAN, 2002). Mais de 1300 cumarinas foram identificadas como
metabólitos secundários de plantas, bactérias e fungos. A função das cumarinas não está bem
clara, embora seja sugerido que possam atuar como reguladores do crescimento das plantas,
bacteriostáticos, fungiostáticos ou mesmo que sejam produtos de excreção (IRANSHAHI,
2009; BOGDAL, 1998).
A cumarina demonstrou atividade anti-inflamatória em macrófagos murinos
RAW264.7 estimulados por LPS in vitro e em edema de pata em camundongos (HUANG;
DENG; LIÃO, 2012). Inibe a produção das enzimas ciclooxigenase e lipoxigenase e a geração
de ânion superóxido. Algumas cumarinas são antagonistas da vitamina K, exibindo atividade
anticoagulante (FYLAKTAKIDOU, et al. 2004; HIRSH; DALEN; ANDERSON, 2001).
29
A maior parte das cumarinas foi isolada de plantas, porém algumas foram isoladas de
microorganismos, constituindo uma fonte para a produção de antibióticos como a
novobiocina, metabólito da bactéria Streptomyces niveus (HESTRIN; FEINGOLD; AVIGAD,
1995).
Uma grande variedade de produtos naturais têm sido descritos como agentes anti-HIV
e compostos contendo núcleo de cumarina estão entre eles, inibindo inclusive a atividade da
transcriptase reversa do HIV (PATIL; FREYER; EGGLESTON, 1993). Cumarinas
apresentam atividade antitumoral inibindo a migração, invasão e metástase em câncer de
mama, pela inibição de metaloproteinases de matriz e apresentaram citotoxicidade contra
linhagens de células leucêmicas e de melanoma in vitro (YANG, et al., 2010; CHAKTHONG
et al., 2012). Possuem ainda atividade anti-hipertensiva, anti-tuberculose, anticonvulsivante,
antiadipogênica e anti-hiperglicemiante (KWON et al., 2011; IRANSHAHI et. al., 2009;
BASILE et al., 2009).
Compostos derivados da cumarina, como a 4-hidroxi-3-nitrocumarina (4H3NC), têm
sido utilizados no tratamento de doenças como o câncer. A 4H3NC foi utilizada no tratamento
do melanoma maligno, evitando a sua recorrência. Rehman e colaboradores (2013)
demonstraram a atividade antimicrobiana e citotóxica de compostos derivados da
nitrocumarina (REHMAN et al., 2013).
A
B
Figura 12: Estrutura química da cumarina (A) e 4-hidroxi-3-nitrocumarina-(Sigma-Aldrich) (B)
30
2.10 Complexos metálicos
Desde os tempos antigos os metais têm sido utilizados com sucesso para o tratamento
de diversas doenças. Uma das características dos metais é seu potencial redox, especialmente,
íons de metais de transição capazes de alternar entre vários estados de oxidação (GAUTIER et
al., 2009).
Compostos contendo metais oferecem muitas vantagens sobre os compostos
convencionais no desenvolvimento de novos compostos medicinais. Estas vantagens devemse à capacidade de coordenar-se a ligante em uma configuração tridimensional, permitindo,
assim, gerar grupos funcionais que podem ser delineados para alvos moleculares definidos
(FRICKER, 2007; MEGGERS, 2009).
Complexos baseados em metais oferecem um rico microambiente para a obtenção de
uma variedade molecular com diferentes geometrias e números de coordenação o que não
pode ser realizado com compostos baseados com carbono (YAN, et al., 2005; COHEN, 2007;
OTT; GUST, 2007).
A capacidade de sofrer reações de troca de ligantes oferece uma infinidade de
possibilidade de interação com moléculas biológicas, como demonstradas pela forma de
interação com DNA. O delineamento de agentes terapêuticos baseados em metais, não fica
restrito apenas aos metais selecionados pela natureza e podem-se obter vantagens das
propriedades únicas de metais não essenciais, incluindo os metais de transição de primeira e
segunda séries e metais que podem conferir utilidades adicionais não encontradas na natureza
(HAAS; FRANZ, 2009).
O composto de coordenação consiste de um átomo central ligado a íons ou moléculas,
denominados de ligantes que têm a propriedade de doar elétrons a esse átomo. Os compostos
de coordenação apresentam um metal de transição ao qual se coordena a diferentes ligantes.
Os metais apresentam a propriedade de interação com o DNA e seus sítios contendo átomos
de oxigênio e nitrogênio. A coordenação dos metais a ácidos nucleicos pode resultar em
efeitos terapêuticos como a atividade anticarcinogênica (GARETH, 2003).
Os metais ocorrem nos sistemas biológicos como íons livres ou ligados
covalentemente a moléculas biológicas. Os metais têm propensão a perder elétrons formando
íons com carga positiva (cátions) que são mais solúveis em fluidos orgânicos. Os íons
metálicos apresentam deficiência de elétrons, ao passo que biomoléculas como proteínas e
DNA são ricas em elétrons. Esta oposição de cargas gera uma atração que leva à interação
entre íons metálicos e as moléculas biológicas (BENITE, 2007).
31
Em estudos preliminares, Lozano (2011) avaliou a cumarina e os compostos 4H3NC,
4H3NC-Fe, 4H3NC-Ni, 4H3NC-Zn, 4H3NC-Cu, benzonidazol e associações sobre as formas
epimastigotas e amastigotas do T.cruzi, demonstrando a ação citotóxicas dos compostos sobre
as células VERO e células VERO infectadas com a forma amastigota do T.cruzi. Os valores
das IC50 dos compostos (em µM) e dos índices de seletividade (IS) estão expressos no quadro
1. A partir destes dados, buscou-se uma variação na combinação das concentrações dos
compostos, com potencial atividade antiparasitária contra as cepas G e CL e Esmeraldo do T.
cruzi.
Quadro 1. Atividade citotóxica e índice de segurança dos compostos metálicos em células
VERO e formas epimastigotas das cepas G e CL do T. cruzi
Compostos
Células VERO
IC50 (µM)
Cumarina
4H3NC
4H3NC- Fe
4H3NC- Ni
4H3NC- Zn
4H3NC- Cu
Benzonidazol
786,84
662,66
>378,40
270,27
100
247,41
514,54
T. cruzi cepa G
IC50
(µM)
68,4
362,1
20
24,4
100
186,2
38,4
Índice de
segurança(IS) *
11,2
1,8
18,92
11,1
1
1,32
13,4
T.cruzi cepa CL
IC50
(µM)
68,4
120
20
12,2
50
268,96
19,2
Índice de
segurança(IS) *
11,2
5,5
18,92
11,6
2
0,91
26,8
Fonte: Lozano (2011) modificado
*O índice de segurança (IS) é obtido pelo cálculo da relação entre a IC50 das células VERO e a IC50 das formas
epimastigotas.
32
3 OBJETIVOS
3.1 Objetivo geral
Estudar a susceptibilidade de diferentes cepas do protozoário T. cruzi, aos complexos
metálicos da 4-hidroxi-3-nitrocumarina (4H3NC) com Zn, Fe, Cu e Ni na associação com
Benzonidazol na eliminação do parasito intracelular em experimentos in vitro e in vivo.
3.2 Objetivos específicos
Determinar a IC50 dos complexos metálicos da 4-hidroxi-3-nitro cumarina contra as
formas amastigotas das cepas G e Cl do T. cruzi;
Comparar a atividade antiparasitária dos complexos metálicos da 4-hidroxi-3-nitro
cumarina com a atividade da droga usual de tratamento da doença de Chagas, o
benzonidazol;
Avaliar o sinergismo de ação dos complexos metálicos da 4-hidroxi-3-nitrocumarina
associados ao benzonidazol, na forma intracelular das cepas G, CL e Esmeraldo do T.
cruzi.
Estudar em camundongos Swiss, infectados com T. cruzi cepas G e CL, a ação sinérgica
do tratamento com os complexos metálicos da 4-hidroxi-3-nitrocumarina que obtiveram
índice de seletividade (IS) > 10.
Avaliar o perfil de citocinas dos animais infectados com as cepas G e CL do T. cruzi
tratados com os complexos metálicos da 4-hidroxi-3-nitrocumarina.
33
4 METODOLOGIA
4.1 Material biológico
Neste trabalho, foram utilizadas células VERO que são fibroblastos provenientes de
uma linhagem derivada do rim do macaco verde africano (Cercopithecus aethiops) e três
cepas do T. cruzi, a cepa G, representante do grupo I integrante do ciclo silvestre isolada de
Didelphis marsupialis na região amazônica, Brasil (YOSHIDA, 1983); a cepa CL,
representante do grupo VI integrante do ciclo doméstico isolada de Triatoma infestans no Rio
Grande do Sul, Brasil (BRENER; CHIARI, 1963); e a cepa Esmeraldo, representante do
grupo II isolado de humanos no Brasil (BRISSE et al., 2000, ZINGALES et al., 1998),
gentilmente cedidas pelo Dr. José Franco da Silveira do Departamento de Microbiologia,
Imunologia, Parasitologia da UNIFESP (Universidade Federal de São Paulo).
4.2 Compostos utilizados
Nos experimentos in vitro foi utilizado o benzonidazol (LAFEPE), cumarina (2H-1Benzopirano-2-ona-Sigma-Aldrich), 4-hidroxi-3-nitrocumarina (4H3NC-Sigma-Aldrich) e
quatro complexos metálicos (4H3NC-Zn, 4H3NC-Cu, 4H3NC-Fe, 4H3NC-Ni) sintetizados
pelo grupo da Dra. Regina Mara Silva Pereira do Laboratório de Química de Coordenação do
Programa de Pós-graduação em Farmácia da Universidade Anhanguera de São Paulo. Para o
preparo da solução de benzonidazol um comprimido de 100 mg de Lafepe-Benzonidazol®
foi macerado em cadinho e diluído em solvente dimetilsulfóxido (DMSO). A cumarina, 4
hidroxi-3-nitrocumarina (4H3NC) e seus complexos metálicos foram diluídos em DMSO.
4.3 Avaliação da citotoxidade em células vero
A citotoxicidade dos compostos nas células VERO foi avaliada pelo método do MTT.
Este teste colorimétrico baseia-se na capacidade das células viáveis converterem o sal de
tetrazólio solúvel (MTT) num precipitado de formazan insolúvel. As células VERO foram
cultivadas em garrafas de cultura de células de 75 cm2, em meio RPMI 1640 (Sigma-Aldrich)
1 mg/L de estreptomicina, 1000 UI/L de penicilina-estreptomicina (Sigma-Aldrich) e 10% de
soro fetal bovino (GIBCO), em estufa a 37°C com 5% de CO2 até atingirem a
semiconfluência. Posteriormente, 1x105 células/mL foram plaqueadas em placas de 24 poços,
foto representada na figura 13, incubadas em estufa a 37ºC, 5% de CO2, durante 24 horas. Após
esse período, foi retirado o sobrenadante e adicionado novo meio e os compostos em diferentes
34
concentrações: benzonidazol (38,4µM), cumarina (68,4 e 136,8 µM), 4H3NC (241,38 e 362
µM), 4H3NC-Fe (126, 25,2 e 50,4 µM), 4H3NC-Ni (24,4, 48,8 µM), 4H3NC-Zn (60,4, 120,88
µM), 4H3NC-Cu (124,10 e 186,2 µM), ao grupo controle sem tratamento, foi adicionado apenas
meio RPMI. As placas foram incubadas por 24 horas. Após esse período, foi retirado o
sobrenadante e adicionados 100µL de solução de MTT (0,5 mg/mL) aos poços e as placas
foram incubadas por 4 horas, em estufa de CO2 a 37ºC. O sobrenadante foi retirado e
adicionados 100 μL de DMSO para a dissolução dos cristais. A leitura das absorbâncias foi
realizada em espectrofotômetro em comprimento de onda de 570 nm em leitor de microplacas
(LABTECH-4000).
A
B
Figura 13. Teste colorimétrico do MTT. Cristais de formazan (A) e a dissolução em DMSO (B).
Fonte: Acervo pessoal.
4.3.1 Infecção das células vero com T. cruzi
As células VERO (1x105 células/mL) foram cultivadas em garrafas de cultura de 75
cm2, em meio RPMI 1640 (Sigma-Aldrich) suplementado com 10 mM HEPES (N[2Hydroxyethyl]piperazine-N’-[2-ethanesulfonic acid]), 24 mM de bicarbonato de sódio, 1
35
mg/L de estreptomicina, 1000 UI/L de penicilina-estreptomicina (Sigma-Aldrich) e 10% de
soro fetal bovino (GIBCO), em estufa a 37°C com 5% de CO2 até atingirem a
semiconfluência. As formas tripomastigotas metacíclicas com as cepas G e CL, infectivas,
foram obtidas de culturas das formas epimastigotas, ambas cultivadas em meio LIT- Liver
Infusion Tryptase (0,5% de infusão de fígado, 0,5% de triptose, 0,4% de NaCl, 0,04% de KCl,
0,8% de fosfato de sódio, 0,2% de glicose, 0,001% de hemina e 10% de soro fetal bovino),
incubadas por 10 dias, em tubo cônico estéril de 50 ml permitindo a diferenciação do parasito.
Essas formas foram utilizadas para infectar as culturas de células VERO. As culturas de
células VERO foram infectadas pela adição de 1x105 parasitos/mL, contendo em torno de
40% de formas tripomastigotas metacíclicas, diretamente na garrafa contendo as células. Após
a infecção, as garrafas de cultura foram incubadas em estufa, a 37°C, com 5% de CO2 por 24
horas, o meio foi trocado e novamente as garrafas foram encubadas até o aparecimento dos
ninhos de amastigotas intracelulares.
4.4
Avaliação da atividade dos compostos contra as formas amastigotas
das cepas G, CL e Esmeraldo do T. cruzi
As células VERO foram infectadas pelas formas tripomastigotas, como descrito
anteriormente.
Após um período de aproximadamente 5 dias de incubação, as formas
tripomastigotas sofreram diferenciação em amastigotas intracelulares e multiplicaram-se.
Após o aparecimento das formas amastigotas intracelulares foram adicionados 3,5 mL de
tripsina 0,05%/EDTA 0,02%, para descolamento das células e o sobrenadante contendo as
células foi recolhido em tubo cônico estéril de 50 mL e centrifugado a 3500 rpm por 5
minutos.
As células infectadas foram contadas em câmara de Neubauer e 1x105 células/mL
foram plaqueadas em placas de 24 poços, contendo lamínulas de 13 mm estéreis, incubadas
por 24 h, a 37°C, com 5% de CO2. Após esse período, foram adicionados os compostos em
diferentes concentrações e as placas foram incubadas por 24h, a 37°C, com 5% de CO2. As
culturas foram observadas em microscópio invertido, para avaliação de possíveis alterações
provocadas pelos compostos sobre as células e os parasitos. O meio de cultura das placas foi
retirado e as lamínulas lavadas duas vezes, com 2 mL de PBS (Phosphate-buffered saline )
1X (137mM de NaCl, 2,7mM KCl, 4,3mM de Na2HPO4, 1,47mM KH2PO4 com pH 7,4).
Posteriormente, foi adicionado metanol 100% nos poços, por 2 minutos, para preservar a
integridade celular e procedeu-se à lavagem das lamínulas com 2 mL de PBS. As células
36
aderidas foram coradas adicionando-se aos poços 500 μL de Giemsa (04 gotas/ml em água
destilada), por aproximadamente 20 minutos, e em seguida lavadas com água destilada. As
lamínulas foram distribuídas sobre papel toalha para secagem por 24h e na sequência fixadas
sobre lâminas de microscopia com o auxílio de cola entellan representado na figura 14.
Figura 14. Lâminas contendo lamínulas com células VERO infectadas com cepa CL.
Fonte: Acervo Pessoal
As lamínulas, em triplicatas, foram analisadas em microscópio óptico no aumento de
40x. A atividade dos compostos foi avaliada pela contagem de 200 células VERO por
lamínula totalizando 600 células por triplicata, considerando-se o número de células
infectadas e o número de amastigotas intracelulares, para determinação do índice de infecção
(IF).
Figura 15. Células VERO infectadas com a forma amastigota do T. cruzi.
Fonte: Acervo Pessoal
37
O IF foi calculado utilizando a seguinte fórmula: definidos como a porcentagem de
células infectadas X o numero médio de amastigota intracelular.
IF=% de células infectadas x n° de amastigotas/n° de células infectadas
4.5 Avaliação da atividade antiparasitária in vivo
4.5.1 Procedência dos animais
Os testes in vivo foram realizados após os estudos in vitro. Nesse estudo, foram
utilizados 64 camundongos Swiss, machos com 45 dias de idade e peso aproximado de 3040g, provenientes da ANILAB-Animais de laboratório (Paulínia-São Paulo). Todos os
experimentos in vivo foram realizados em conformidade com as normas e procedimentos
estabelecidos pelo Colégio Brasileiro de Experimentação Animal (COBEA), tendo sido
aprovados pelo Comitê de Ética em Experimentação Animal (CEUA) da UNIAN.
Universidade Anhanguera de São Paulo, protocolo: 006/13
4.5.2 Infecção dos animais com T. cruzi
Foram infectados 32 animais com 106 parasitos da cepa G (formas tripomastígotas
metacíclicas) e 32 animais com 106 parasitos da cepa CL (formas tripomastígotas
metacíclicas). Os animais infectados com as cepas G e CL foram divididos em quatro grupos:
grupo controle sem tratamento e três grupos de tratamento, conforme descrito nos quadros 1e
2. Os parasitos foram inoculados em um volume de 100µl, intraperitonealmente, e os animais
foram observados durante 70 dias, incluindo a fase aguda e crônica da doença. Os animais
foram mantidos no laboratório de farmacologia experimental (LAFE) em caixas de
polipropileno, alimentados com ração comercial especifica para a espécie e água “ad
libitum”.
38
4.5.3 Grupos de tratamento
Na fase aguda os animais infectados com as cepas G e CL foram tratados no 4°, 5º, 7º,
8º e 11° dia de infecção totalizando cinco dias (Quadro 2).
Quadro 2. Esquema de tratamento na fase aguda
Grupos de tratamento
Dose administrada
Controle sem tratamento
------(n=3)
Benzonidazol (n=3)
10 mg/100µl
Benzonidazol + 4H3NC-Zn
10 mg/100µl + 1,5mg/ 150 µl
(n=5)
Benzonidazol + 4H3NC-Fe
10 mg/100µl + 1,32mg/ 200 µl
(n=5)
Volume total
------------100µl
250µl
300µl
Fonte: Acervo Pessoal
Na Fase crônica, os animais infectados com as cepas G e CL foram tratados com seis
doses no 25°,26º, 27º, 28º, 33º e 40° dias de infecção (Quadro 3).
Quadro 3. Esquema de tratamento na fase crônica
Grupos de tratamento
Dose administrada
Controle sem tratamento
Volume total
-------
-------------
Benzonidazol (n=3)
10 mg/100µl
100µl
Benzonidazol + 4H3NC-Zn
10 mg/100µl + 1,5mg/ 150 µl
250µl
10 mg/100µl + 1,32mg/ 200 µl
300µl
(n=3)
(n=5)
Benzonidazol + 4H3NC-Fe
(n=5)
Fonte: Acervo Pessoal
Os compostos foram administrados pela técnica de gavagem com o auxílio de uma
cânula intragástrica.
4.5.4 Avaliação da parasitemia
Na fase aguda, a parasitemia foi avaliada no 4º, 11º, 18º dias de infecção e na fase
crônica, no 33º, 40º, 49º, 60º, 70º dias. A parasitemia é avaliada pela contagem do número de
parasitos no sangue coletado da cauda do animal. O número de parasitos por mililitro de
39
sangue foi determinado por contagem direta, em microscópio óptico, em lâmina de vidro, de
acordo com a técnica descrita por Brener (1962). O pico de parasitemia ocorre entre o 7 e o
18 dia de infecção. Após esse período, observa-se o declínio da parasitemia e o início da fase
crônica.
4.5.5 Eutanásia dos animais
Os animais foram eutanasiados com uma dose letal de tiopental sódico (ThiopentaxCristália®) 2,5% (0,1 ml/10g peso corporal) no 18º dia na fase aguda e no 70º dia na fase
crônica. Os órgãos foram coletados para análises histológicas futuras.
4.6 Análise do perfil de citocinas
O efeito dos compostos no perfil de citocinas foi analisado no soro dos animais
infectados com as cepas G e CL do T. cruzi. Os animais infectados foram tratados com os
compostos, no esquema descrito anteriormente, e ao final do período experimental o sangue
foi coletado para a análise das citocinas: IL-1β, IL-12, IFN-γ e TNF-α, no soro dos animais,
por imunoensaio, com a utilização do Mouse Cytokine 10-Plex Panel- NOVEX
lifetechnologies, em colaboração com a Dra. Leda Talib (LIM 27-HC-USP).
40
5 RESULTADOS
Os compostos metálicos foram preliminarmente associados ao benzonidazol para avaliar
sinergismo de ação destes compostos.
Na Figura 16 representada em (A), porcentagem de viabilidade celular das células
VERO tratadas com os compostos A a F. Em (B), índice de infecção (IF), com as formas
amastigotas de T. cruzi cepa G e CL.
Figura 16. Os dados mostram a diferentes atividades das associações A, B e C, na cepa G e das associação E e
F na cepa CL comparado ao benzonidazol. A associação C mostra um resultado melhor que o benzonidazol
nas duas cepas.
Fonte: Lozano (2011) modificado.
A partir desses estudos a atividade de associações com diferentes concentrações dos
compostos metálicos está descrito no quadro 4 o esquema das associações com as respectivas
concentrações em micromolar (µM).
Quadro 4. Esquema das associações dos compostos utilizados
Compostos metálicos associados
A1, A2
38,4 µM-Benzonidazol + 68,4 / 136,8 µM- Cumarina
B1, B2
38,4 µM-Benzonidazol + 241 / 362,1 µM- 4H3NC
C1, C2,C3
38,4 µM-Benzonidazol + 12,6 / 25,2 / 50,4 µM- 4H3NC-Fe
D1, D2
38,4 µM-Benzonidazol + 24,4 / 48,8 µM 4H3NC-Ni
E1, E2
38,4 µM-Benzonidazol + 60,4 / 120,8 µM- 4H3NC-Zn
F1, F2
38,4 µM-Benzonidazol + 124,13 / 186,2µM- 4H3NC-Cu
Fonte: acervo pessoal
41
5.1 Avaliação da atividade antiparasitária dos compostos em células vero
infectadas com as cepas G e CL e Esmeraldo
O índice de infecção foi um dos parâmetros utilizados para avaliar o efeito dos
compostos nas células infectadas com as formas amastigotas do T. cruzi. Os quadros 5, 6 e 7
expressam os dados utilizados para o cálculo do IF.
Quadro 5. Índice de infecção das células VERO infectadas com a forma amastigota do T.
cruzi cepa G.
Concentração
% Células
Nº
Nº Células
Compostos
(µM)
Infectadas
Amastigota Infectadas
IF*
---S/ tratamento
64,8
2301
389
383,5
38,4
Benzonidazol
19,8
897
145
149,5
68,4
A1
42,5
1123
255
187,2
136,8
A2
46,2
1330
277
221,7
241
B1
43,5
1227
261
204,5
362,1
B2
63,3
1683
380
280,5
12,6
C1
33,7
1278
202
213,0
25,2
C2
33,0
1117
198
186,2
50,4
C3
36,3
1300
218
216,7
24,4
D1
39,2
1151
235
191,8
48,8
D2
39,5
1576
237
262,7
60,4
E1
26,5
1002
159
167,0
121
E2
20,2
737
121
122,8
124,13
F1
29,8
881
179
146,8
186,2
F2
20,0
677
120
112,8
Fonte: Acervo Pessoal
*O índice de infecção (IF) é calculado pela fórmula: % células infectadas x n°amastigotas intracelulares/n°células infectadas.
De acordo com dados apresentados no gráfico da Figura 17, observa-se que as células
infectadas com a cepa G e tratadas com todas as associações apresentaram diminuição do IF,
em comparação às células infectadas do grupo controle sem tratamento. As associações E2,
F1 e F2, por sua vez, diminuíram o IF, em mais de 60% ao do grupo tratado com o composto
benzonidazol 61%.
42
Figura 17. Índice de infecção de células Vero com a forma amastigota da cepa G do T. cruzi. Tratamentos:
benzonidazol 38,4 µM e suas associações com compostos metálicos. A1: benzonidazol 38,4 µM e cumarina
68,4 µM ;A2: benzonidazol 38,4 µM e cumarina 136,8 µM; B B1: benzonidazol 38,4 µM e 4H3NC 241 µM; B2:
benzonidazol 38,4 µM e 4H3NC 362,1 µM; C1: benzonidazol 38,4 µM e 4H3NC-Fe 12,6 µM; C2: benzonidazol
38,4 µM e 4H3NC-Fe 25,2 µM; C3: benzonidazol 38,4 µM e 4H3NC-Fe 50,4; D1: benzonidazol 38,4 µM e
4H3NC-Ni 24,4 µM; D2: benzonidazol 38,4 µM e 4H3NC-Ni 48,8 µM; E1: benzonidazol 38,4 µM e 4H3NCZn 60,4 µM; E2: benzonidazol 38,4 µM e 4H3NC-Zn 120,8 µM; F1: benzonidazol 38,4 µM e 4H3NC-Cu
124,13 µM; F2: benzonidazol 38,4 µM e 4H3NC-Cu 186,2 µM.
Fonte: Acervo Pessoal
Nas células VERO infectadas com a cepa CL do T.cruzi, observa-se uma diminuição
dos IFs entre 15,7% e 67% nos diferentes grupos de tratamento, em comparação ao controle
sem tratamento, que está representado no quadro 6 abaixo.
Quadro 6. Índice de infecção das células VERO infectadas com a forma amastigota do T.
cruzi cepa CL.
Compostos
S/ tratamento
Benzonidazol
A1
A2
B1
B2
C1
C2
C3
D1
D2
E1
E2
F1
F2
Concentração
(µM)
---38,4
68,4
136,8
241
362,1
12,6
25,2
50,4
24,4
48,8
60,4
121
124,13
186,2
% Células
Infectadas
41,8
16,6
22,8
27,7
25,7
32,6
20,6
24,1
2,0
21,0
17,3
21,1
12,0
1083
1154
Nº
Amastigota
1889
702
1021
1384
1591
1526
1088
819
620
707
663
622
619
195
184
Nº Células
Infectadas
279
72
150
180
172
208
140
155
13
138
116
134
75
164,3
154,3
IF*
283,2
161,4
154,9
212,9
238,2
238,8
160,5
127,2
94,4
107,6
99,0
98,0
99,0
164,3
154,3
Fonte: Acervo Pessoal
*O índice de infecção (IF) é calculado pela fórmula: % células infectadas x n°amastigotas intracelulares/n°células infectadas.
43
A figura 18 mostra a comparação do IF obtidas nas células VERO infectadas com a
cepa CL do T.cruzi. E diferentemente tratados as associações C2, C3, D1, D2, E1 e E2
apresentaram índices de infecção de 12 a 24% menores que o benzonidazol.
Figura 18. Índice de infecção de células Vero com a forma amastigota da cepa CL do T. cruzi. Tratamentos:
benzonidazol 38,4 µM e suas associações com compostos metálicos. A1: benzonidazol 38,4 µM e cumarina
68,4 µM ;A2: benzonidazol 38,4 µM e cumarina 136,8 µM; B1: benzonidazol 38,4 µM e 4H3NC 241 µM; B2:
benzonidazol 38,4 µM e 4H3NC 362,1 µM; C1: benzonidazol 38,4 µM e 4H3NC-Fe 12,6 µM; C2: benzonidazol
38,4 µM e 4H3NC-Fe 25,2 µM; C3: benzonidazol 38,4 µM e 4H3NC-Fe 50,4; D1: benzonidazol 38,4 µM e
4H3NC-Ni 24,4 µM; D2: benzonidazol 38,4 µM e 4H3NC-Ni 48,8 µM; E1: benzonidazol 38,4 µM e 4H3NCZn 60,4 µM; E2: benzonidazol 38,4 µM e 4H3NC-Zn 120,8 µM; F1: benzonidazol 38,4 µM e 4H3NC-Cu
124,13 µM; F2: benzonidazol 38,4 µM e 4H3NC-Cu 186,2 µM.
Fonte: Acervo Pessoal.
Nas células VERO infectadas com a cepa Esmeraldo do T. cruzi, observa-se uma
diminuição do índice de infecção entre 12% e 46% nos grupos tratados com os diferentes
compostos, em comparação ao grupo controle sem tratamento.
Quadro 7. Índice de infecção das células VERO infectadas com a forma amastigota do T.
cruzi cepa Esmeraldo.
Compostos
S/ tratamento
Benzonidazol
A1
A2
B1
B2
C1
C2
C3
D1
D2
E1
E2
F1
F2
Concentração
(µM)
---38,4
68,4
136,8
241
362,1
12,6
25,2
50,4
24,4
48,8
60,4
121
124,13
186,2
% Células
Infectadas
34,3
21,0
37,5
44,7
37,0
75,5
53,1
75,0
50,6
85,5
45,7
62,6
59,9
63,8
50,5
Nº
Amastigota
576
798
896
616
765
589
440
518
620
504
334
561
869
866
1200
Nº Células
Infectadas
71
88
186
122
184
210
78
156
130
177
101
166
145
157
247
IF*
278,3
190,0
180,6
225,6
153,9
211,9
299,3
249,0
241,2
243,5
151,1
211,7
359,1
352,0
245,4
Fonte: Acervo Pessoal
*O índice de infecção (IF) é calculado pela fórmula: % células infectadas x n°amastigotas intracelulares/n°células infectadas.
44
A figura 19 mostra a comparação dos IFS obtidos nas células VERO infectadas com a
cepa Esmeraldo do T. cruzi. Em comparação ao benzonidazol, os tratamentos com os
compostos A1, B1 e D2 apresentaram diminuição dos índices de infecção em 3%, 13% e 14%
respectivamente. O composto D2 (benzonidazol 38,4 M e 4H3NC-Ni 48,8 µM) mostrou
melhor resultado, sendo, portanto, um composto potencial para teste futuros, devendo ser
verificada diferentes concentrações do produto, no intuito de sabermos o que ocorre ao
aumentarmos ou diminuirmos a quantidade de níquel presente no composto e, além disso,
verificar a quantidade de cumarina necessária em prol de melhores resultados. Esta variação
vai nos permitir comprovar a eficácia desse composto na hostilização da cepa Esmeraldo para
diferentes doses.
Figura 19. Índice de infecção de células Vero com a forma amastigota da cepa Esmeraldo do T. cruzi.
Tratamentos: benzonidazol 38,4 µM e suas associações com compostos metálicos. A1: benzonidazol 38,4 µM e
cumarina 68,4 µM ;A2: benzonidazol 38,4 µM e cumarina 136,8 µM; B1: benzonidazol 38,4 µM e 4H3NC 241
µM; B2: benzonidazol 38,4 µM e 4H3NC 362,1 µM; C1: benzonidazol 38,4 µM e 4H3NC-Fe 12,6 µM; C2:
benzonidazol 38,4 µM e 4H3NC-Fe 25,2 µM; C3: benzonidazol 38,4 µM e 4H3NC-Fe 50,4; D1: benzonidazol
38,4 µM e 4H3NC-Ni 24,4 µM; D2: benzonidazol 38,4 µM e 4H3NC-Ni 48,8 µM; E1: benzonidazol 38,4 µM
e 4H3NC-Zn 60,4 µM; E2: benzonidazol 38,4 µM e 4H3NC-Zn 120,8 µM; F1: benzonidazol 38,4 µM e
4H3NC-Cu 124,13 µM; F2: benzonidazol 38,4 µM e 4H3NC-Cu 186,2 µM. O índice de infecção (IF) é
calculado pela fórmula: % células infectadas x n°amastigotas intracelulares/n°células infectadas.
Fonte: Acervo Pessoal.
A inibição do IF foi calculada para cada cepa utilizada: [IF associação X 100/ IF
controle menos 100%] a figura 20 resume a porcentagem de inibição do índice de infecção,
obtidos para as cepas G, CL e Esmeraldo de T.cruzi considerando 100% IF dos respectivos
controles sem tratamento em cada cepa.
45
Figura 20. Porcentagem de inibição do IF das três diferentes cepas do T. cruzi nos tratamentos realizados benzonidazol,
associação de compostos em diferentes concentrações: A1: benzonidazol 38,4 µM e cumarina 68,4 µM ;A2: benzonidazol
38,4 µM e cumarina 136,8 µM; B1: benzonidazol 38,4 µM e 4H3NC 241 µM; B2: benzonidazol 38,4 µM e 4H3NC
362,1 µM; C1: benzonidazol 38,4 µM e 4H3NC-Fe 12,6 µM; C2: benzonidazol 38,4 µM e 4H3NC-Fe 25,2 µM;
C3: benzonidazol 38,4 µM e 4H3NC-Fe 50,4; D1: benzonidazol 38,4 µM e 4H3NC-Ni 24,4 µM; D2:
benzonidazol 38,4 µM e 4H3NC-Ni 48,8 µM; E1: benzonidazol 38,4 µM e 4H3NC-Zn 60,4 µM; E2:
benzonidazol 38,4 µM e 4H3NC-Zn 120,8 µM; F1: benzonidazol 38,4 µM e 4H3NC-Cu 124,13 µM; F2:
benzonidazol 38,4 µM e 4H3NC-Cu 186,2 µM. Abaixo do gráfico estão numericamente representados as
porcentagens de inibição.
A comparação da porcentagem de inibição dos IF em relação ao controle sem
tratamento demonstrou que na cepa G as associações E2, F1 e F2, causaram uma diminuição
de IF maior que 60%, resultado semelhante ao benzonidazol. Na cepa CL, as associações C3,
D1, D2, E1 e E2 também apresentaram mais de 60% de diminuição do índice de infecção,
enquanto o benzonidazol só diminuiu o índice de infecção em 43 %, mostrando menor
atividade que as associações testadas. Nos estudos com a cepa Esmeraldo, o benzonidazol
diminuiu o índice de infecção em 32% e as associações A1, B1 e D2, 35%, 45% e 46%,
respectivamente, o que evidencia uma maior resistência desta cepa aos tratamentos,
comparada à G e Cl.
Considerando que foram utilizados 13 diferentes associações de compostos para
tratamento das formas amastigotas de três cepas de T. cruzi e que, dentre elas oito mostraram
diminuição do IF acima de 60 %, em pelo menos uma das cepas (Figura 20), foram escolhidas
duas diferentes associações para continuidade dos testes in vivo. A associação E2 por ter
apresentado resultados mais promissores nas cepas G e CL e a associação C3, pela maior
atividade na cepa CL.
46
5.2 Estudos in vivo
A partir dos dados obtidos em amastigotas as associações dos compostos A1, B1, C3,
D1, D2, E1, E2 e F2 mostraram-se promissoras para continuidade dos estudos in vivo do
sinergismo de ação no tratamento da doença de Chagas experimental em modelos animais.
Para racionalização do número de animais a serem utilizados nos experimentos, foram
selecionamos as associações C3 e E2, em comparação ao benzonidazol, para os tratamentos
de camundongos Swiss infectados com duas cepas T.cruzi das cepas G e CL estudando a fase
aguda e crônica da Doença de Chagas. A atividade dos compostos foi avaliada pelo
monitoramento da parasitemia nos animais infectados durante a fase aguda e na fase crônica
pela avaliação do perfil das citocinas no soro desses animais.
5.2.1 Fase aguda
Na fase aguda, a parasitemia dos animais infectados pelas cepas G e CL foi monitorada
do 4° ao 18° dia. O tratamento foi realizado do 4° ao 11° dia e após este período, no 18° dia,
os animais foram eutanasiados e o sangue foi coletado para análise do perfil de citocinas no
soro.
5.2.2 Análise da parasitemia dos animais infectados com a cepa G na fase aguda
Erro! Fonte de referência não encontrada.A figura 21 mostra o monitoramento da
parasitemia nos animais dos diferentes grupos de tratamento, a partir do 4º dia de infecção
com a cepa G do T. cruzi. O pico de parasitemia ocorreu no 11º dia nos animais do grupo sem
tratamento e benzonidazol . Observa-se que, o tratamento com a associação C3 controlou a
parasitemia na fase aguda inibindo significativamente a multiplicação dos parasitos, em
comparação ao grupo controle sem tratamento e ao benzonidazol. No grupo tratado com a
associação E2 observa-se um aumento sucessivo da parasitemia do 7° ao 18° dia quando foi
finalizado o experimento na fase aguda.
47
Parasitemia/ml X 1000
25000
20000
S/ Tratamento
15000
BZ
C3
10000
E2
5000
0
4º
7º
11º
14º
18º
DIAS
Tratamento
Figura 21. Parasitemia dos grupos de camundongos na fase aguda da doença de Chagas, infectados com a cepa G do T.
cruzi, tratados com os compostos benzonidazol, C3: benzonidazol 38,4 µM e 4H3NCFe 50,4 µM e ; E2: benzonidazol 38,4
µM e 4H3NCZn 60,4 µM.
5.2.3 Análise da parasitemia nos animais infectados com a cepa CL na fase aguda
A parasitemia nos grupos de animais infectados com a cepa CL de T.cruzi foi
acompanhada do 4º até 18º dia. A Erro! Fonte de referência não encontrada.22 mostra que o pico de
parasitemia ocorreu no 14° dia para animais dos grupos sem tratamento, benzonidazol e C3, já
no grupo E2, observa-se que o pico de parasitemia ocorre no 11º dia. Ressalta-se que, o
tratamento com a associação de compostos C3 e E2 diminuiu em 40% o número de parasitos
circulantes, em relação ao grupo controle sem tratamento e ao grupo tratado com
Parasitemia/ml X 1000
benzonidazol.
40000
35000
30000
25000
20000
15000
10000
5000
0
s/ trat.
BZ
C3
E2
4º
7º
Tratamento
11º
14º
18º
DIAS
Figura 22. Parasitemia na fase aguda da doença de Chagas nos diferentes grupos de camundongos infectados com a cepa CL
de T. cruzi, tratados com os compostos benzonidazol, C3: benzonidazol 38,4 µM e 4H3NCFe 50,4 µM; E2: benzonidazol
38,4 µM e 4H3NCZn 60,4 µM.
48
5.3 Estudos in vivo fase crônica
A parasitemia dos grupos de animais para o estudo na fase crônica da doença de
Chagas experimental foi acompanhada do 4º dia até a cronifícação, que é caracterizado pela
diminuição do número de parasitos no sangue circulante. Os animais foram tratados,
conforme descrito anteriormente, com 6 doses de C3 e E2 do 25º ao 40º de infecção. A fase
crônica foi interrompida no 70º dia e foi coletado o sangue dos animais para dosagem de
citocinas no soro.
Análise da parasitemia nos animais infectados com a cepa G na fase crônica
3 mostra que os grupos de animais infectados com a cepa G e tratados com
benzonidazol e com os complexos metálicos mantiveram níveis muito baixos de parasitemia
em comparação ao grupo sem tratamento, no qual se observa um aumento dos parasitos no
Parasitemia/ml X 1000
sangue circulante.
40000
35000
30000
25000
S/ Tratamento
BZ
20000
15000
10000
5000
0
C3
E2
4º
7º
11º
14º
18º
25º
33º
40º
49º
60º
70º
DIAS
Tratamento
Figura 23. Parasitemia na fase crônica em camundongos infectados com a cepa G do T. cruzi, tratados com os compostos
benzonidazol, C3: benzonidazol 38,4 µM e 4H3NCFe 50,4 µM; E2: benzonidazol 38,4 µM e 4H3NCZn 60,4 µM.
5.4 Análise da parasitemia nos animais infectados com a cepa CL na fase
crônica
A parasitemia na fase crônica dos animais infectados com a cepa CL apresenta um
pico no 7º e no 11º dias e uma diminuição no 25º, 33º e 40º dias, mantendo-se estável do 40º
ao 70º dia de infecção. O grupo de animais tratados com o benzonidazol apresentou uma
diminuição da parasitemia no 25º dia e um aumento no 33º dia e manteve-se estável até o 40º
dia. Por outro lado, o grupo sem tratamento apresentou uma diminuição da parasitemia no 33º
dia, mantendo-se estável até o 70º dia. Em comparação aos demais grupos de tratamento, o
49
grupo E2 apresentou pico de parasitemia no 11º dia com uma diminuição no 40º dia,
Parasitemia/ml X 1000
mantendo-se estável ate o 70º dia de infecção.
45000
40000
35000
30000
25000
20000
15000
10000
5000
0
S/Tratament
o
BZ
C3
E2
4º
7º
11º
14º
18º
25º 33º 40º
Tratamento
49º
60º
70º
DIAS
Figura 24. Parasitemia na fase crônica em camundongos infectados com a cepa CL do T. cruzi, tratados com os compostos
benzonidazol, C3: benzonidazol 38,4 µM e 4H3NCFe 50,4 µM e ; E2: benzonidazol 38,4 µM e 4H3NCZn 60,4 µM.
5.5 Quantificação das citocinas IL-1, IL-12, IFN-beta e TNF-alfa no soro
dos animais com doeça de chagas fase crônica.
A fase aguda da doença de Chagas caracteriza-se por uma alta parasitemia com
ativação exacerbada do sistema imune, incluindo elevados níveis plasmáticos de citocinas tipo
Th1, principalmente TNF-α e IFN-γ, associadas com a resistência à infecção pelo parasito,
bem como uma ativação importante de células T e B e processos inflamatórios severos
relacionados com o parasitismo (MACHADO, et al, 2014). Neste trabalho, foi avaliado o
perfil de citocinas de camundongos infectados pelas cepas G em CL do T. cruzi tratados com
os compostos associados, em comparação com o benzonidazol e com o grupo controle não
tratado. Para isso, foram quantificadas as citocinas IL-1β, IL-12, IFN-γ e TNF-α no soro dos
animais na fase crônica da Doença de Chagas.
No gráfico representado na figura 25 (A), mostra que o perfil de citocinas IL-1β no
soro dos animais infectados com a cepa G do T. cruzi na fase crônica e tratados com a
associação C3 teve uma diminuição em relação ao grupo sem tratamento. A figura (B) mostra
o perfil das citocinas IL-1β no soro dos animais infectados com a cepa CL do T.cruzi na fase
crônica. O grupo benzonidazol e E2 teve uma diminuição de expressão de IL-1β em relação
ao grupo sem tratamento. Porem a associação C3, na cepa CL teve aumento de expressão em
relação ao grupo sem tratamento.
50
A
IL-1 (pg/mL)
150
100
50
0
Sem tratam.
Benzonidazol
C3
E2
Tratamentos
B
80
IL-1 (pg/mL)
60
40
20
0
Sem tratam.
Benzonidazol
C3
E2
Tratamentos
Figura 25. Representa a concentração de IL-1β (pg/ml) no soro dos animais infectados com a cepa G em (A) e na cepa CL
em (B) do T.cruzi na fase crônica e tratados com os compostos: benzonidazol 38,4µM; C3( benzonidazol 38,4 µM e 4H3NCFe 50,4 µM); E2( benzonidazol 38,4 µM e 4H3NC-Zn 60,4 µM), em comparação com o grupo controle sem tratamento,
ANOVA (p= 0.2778) seguido de teste Tukey-kramer de múltiplas comparações (p>0.05).
As figuras do perfil das citocinas IL-12 infectados com as cepas G em (A), nos mostra
que a associação C3 diminuiu a expressão em comparação ao grupo sem tratamento. Os
compostos benzonidazol e E2 mantiveram níveis iguais ao grupo sem tratamento. A figura CL
em (B) mostra que o perfil de citocinas IL-12 no soro dos animais infectados com T.cruzi na
fase crônica tratados com o benzonidazol mantive níveis iguais ao grupo sem tratamento e as
associações C3 e E2 tive um aumento em comparação ao grupo sem tratamento.
51
A
IL-12 (pg/mL)
300
200
100
0
Sem tratam .Benzonidazol
C3
E2
Tratamentos
B
250
IL-12 (pg/mL)
200
150
100
50
0
Sem tratam. Benzonidazol
C3
E2
Tratamentos
Figura 26. Representa a concentração de IL-12 (pg/ml) no soro dos animais infectados com a cepa G em (A) e na cepa CL
em (B) do T.cruzi na fase crônica e tratados com os compostos: benzonidazol 38,4µM; C3( benzonidazol 38,4 µM e 4H3NCFe 50,4 µM); E2( benzonidazol 38,4 µM e 4H3NC-Zn 60,4 µM), em comparação com o grupo controle sem tratamento,
ANOVA (p= 0.2778) seguido de teste Tukey-kramer de múltiplas comparações (p>0.05).
As figuras do perfil das citocinas IFN-ɣ para as cepas G e CL, mostra que o
benzonidazol tanto para a cepa G, quanto para a cepa CL não teve muita diferença comparado
ao grupo sem tratamento, mas em relação ao composto C3 na cepa G diminui e na cepa CL
aumenta, diferente do composto E2 que na cepa G aumenta e na cepa CL diminui comparado
ao grupo sem tratamento.
52
A
IFN- (pg/mL)
200
150
100
50
0
Se m tratam .Be nzonidazol
C3
E2
Tratame ntos
B
IFN- (pg/mL)
80
60
40
20
0
Sem tratam.
Benzonidazol
C3
E2
Tratamentos
Figura 27. Representa a concentração de IFN-γ (pg/ml) no soro dos animais infectados com a cepa G em (A) e na cepa
CL em (B) do T.cruzi na fase crônica e tratados com os compostos: benzonidazol 38,4µM; C3( benzonidazol 38,4 µM e
4H3NC-Fe 50,4 µM); E2( benzonidazol 38,4 µM e 4H3NC-Zn 60,4 µM), em comparação com o grupo controle sem
tratamento, ANOVA (p= 0.2778) seguido de teste Tukey-kramer de múltiplas comparações (p>0.05).
As figuras do perfil das citocinas TNF-α para as cepas G e CL, mostram que o
benzonidazol para a cepa G diminui pouco e para a cepa CL aumenta pouco, já o composto
C3diminui na cepa G e aumenta na cepa CL. Na cepa G tratada com o composto E2 ele
diminui e na cepa CL mantém igual ao grupo sem tratamento.
53
A
TNF- (pg/mL)
150
100
50
0
Sem tratam. Benzonidazol
C3
E2
Tratamentos
400
TNF- (pg/mL)
B
300
200
100
0
Sem tratam. Benzonidazol
C3
E2
Tratamentos
Figura 28. Representa a concentração de TNF-α (pg/ml) no soro dos animais infectados com a cepa G em (A) e na cepa CL
em (B) do T.cruzi na fase crônica e tratados com os compostos: benzonidazol 38,4µM; C3( benzonidazol 38,4 µM e
4H3NC-Fe 50,4 µM); E2( benzonidazol 38,4 µM e 4H3NC-Zn 60,4 µM), em comparação com o grupo controle sem
tratamento, ANOVA (p= 0.2778) seguido de teste Tukey-kramer de múltiplas comparações (p>0.05).
54
6 DISCUSSÃO
A doença de Chagas permanece um grave problema de saúde pública na América
Latina, mesmo após mais de um século de pesquisas. O nifurtimox e o benzonidazol são as
únicas drogas disponíveis para o tratamento desta doença, sendo que o primeiro não é mais
utilizado no Brasil (SESTI-COSTA et al, 2014). O tratamento com benzonidazol durante a
fase aguda da doença é capaz de curar aproximadamente 60% dos pacientes. No entanto, as
taxas de cura não excedem 20%, na fase crônica, mesmo em pacientes tratados durante mais
de 10 anos. Além disso, o tratamento é longo e provocando vários efeitos colaterais como
cefaléia, anorexia, distúrbios gástricos, hepatotoxicidade e mielossupressão, dentre outros.
Dessa forma, surge a necessidade de desenvolver novos compostos para o tratamento da
doença de Chagas com maior eficácia e menor toxicidade.
A associação de compostos é uma importante forma de aumentar a eficácia de drogas
já existentes, mas que apresentam diferentes mecanismos de ação, no tratamento de
determinadas doenças, especialmente no controle de doenças infecciosas. Em comparação à
monoterapia, a terapia que utiliza a combinação de diferentes compostos, pode apresentar
aumento nos índices de cura, reduzir o tempo de tratamento, diminuir os efeitos colaterais e
impedir a resistência dos parasitos ao tratamento (RODRIGUES, 2014). Neste trabalho, foi
avaliada a atividade antiparasitária de compostos cumarínicos complexados com os metais de
transição ferro, zinco, cobre e níquel em associação ao benzonidazol, com o objetivo de
estudar o potencial efeito sinérgico desses compostos buscando assim, menor toxicidade pela
utilização de menores concentrações do benzonidazol, agregando também, os potenciais
efeitos biológicos atribuídos aos compostos naturais complexados a metais de transição.
Os compostos avaliados neste estudo apresentaram sinergismo de ação contra as
formas amastigotas intracelulares do T. cruzi, quando associados ao benzonidazol, que é o
composto de escolha utilizado, atualmente, para o tratamento da doença de Chagas. O
mecanismo de ação do benzonidazol ocorre pela formação de radicais livres e/ou metabólitos
eletrofilicos em uma reação que culmina na formação do radical hidroxila, ao qual se atribui o
efeito tripanocida, por mecanismos que envolvem a ligação a lipídeos, proteínas e ao DNA do
T. cruzi. O benzonidazol também aumenta a fagocitose e lisa o T. cruzi, através de um
mecanismo dependente de IFN-γ e inibe o crescimento do T. cruzi através da inibição da
enzima NADH-fumarato redutase, relacionada ao processo de geração de energia (DIAS et al,
2009).
55
Compostos naturais têm demonstrado potencial como novos agentes para o tratamento
da doença de Chagas. Reyes-Chilpa e colaboradores avaliaram a atividade de cumarinas
derivadas da espécie mammea sp contra as formas epimastigotas e tripomastigotas do T. cruzi.
Essas cumarinas apresentaram atividade antiparasitária e neste estudo, sugere-se que as
cumarinas podem afetar a mitocôndria e a mitose (REYES-CHILPA, et al, 2008). O óleo
essencial de Cinnamon verum apresentou atividade antiparasitária contras as formas
epimastigotas, tripomastigotas e amastigotas do T. cruzi, o eugenol e a cinnamaldeído são os
principais constituintes desse óleo essencial. Sua atividade pode ser associada à sua
lipofilicidade, formando ligações covalentes com resíduos de aminoácidos inativando
proteínas afetando as funções celulares. A ação contra o T. cruzi pode ser atribuída à adição
de um tiol aldeído ao componentes que contem enxofre nas enzimas tripanotiona e
tripanotiona redutase, promovendo um desequilíbrio redox no citosol no interior do
tripanosoma (AZEREDO et al, 2014).
Uma das principais propriedades dos compostos naturais é a atividade antioxidante e a
complexação destes compostos com metais de transição aumenta seu potencial antioxidante
(KOSTYUK et al, 2004). Apesar do benzonidazol atuar como agente indutor de estresse
oxidativo na eliminação do T. cruzi, nota-se, neste trabalho, que a sua associação com os
compostos cumarínicos complexados a metais de transição potencializou sua atividade
antiparasitária in vitro e in vivo, sugerindo que as propriedades antagônicas do benzonidazol,
indutor da formação de radicais livre e dos complexos metálicos, com propriedades
antioxidantes, colaboraram sinergisticamente, para um aumento da atividade antiparasitária.
O benzonidazol tem ação tripanossomicida contra todas as formas de parasita e tem
atividade significativa em fase aguda, com até 80% de cura dos pacientes tratados. Embora,
sua eficácia varie de acordo com a área geográfica, provavelmente devido a diferenças na
susceptibilidade de drogas entre diferentes cepas T. cruzi e a existência de cepas naturalmente
resistentes aos compostos utilizados no tratamento (SÁNCHEZ-SANCHO, 2010). Entretanto,
muitos compostos possuem limitações importantes como a sua própria baixa atividade
antiparasitária na forma crônica da doença. Na fase crônica, a decisão de tratamento do
paciente com esses drogas tripanocidas deve ser individualizado, avaliando-se os possíveis
riscos e benefícios para o paciente (NETO- MARIN GUEDES 2003, CALDAS;, et al 2008).
O nivel de citocinas demonstrou na doença de Chagas, após a infecção, o aumento
inicial da parasitemia é contido por citocinas pró-inflamatórias e mediadores liberados por
macrófagos e células natural killer. Estas respostas imunes inata são seguidas por ativação
policlonal de linfócitos e aparecimento de imunidade adquirida contra o parasita mediada por
56
células T CD4 +. Os estudos com camundongos imunodeficientes indicam que tanto as
células CD4 + e CD8 + T são igualmente essenciais para o controle de parasitemia e
sobrevivência do hospedeiro (TARLETON RL, 2000). A persistência do parasita depende de
uma combinação de fatores, incluindo a liberação de moléculas que interferem com as
respostas imunes. T. cruzi suprime a ativação de linfócitos, um efeito que depende da
densidade de parasitas. Portanto, a supressão induzida por moléculas do parasita é mais
relevante na fase aguda, quando a concentração dessas moléculas pode ser bastante elevada.
Além disso, a depleção de células T pode ser observada no pico da parasitemia (MALECKAR
JR, et al, 1983, CHAUSSABEL D, et al 2003) Juntos, esses fatores contribuem para a
imunossupressão, e promover a difusão da infecção. Este retardo na resposta de células T
CD8 + poderia ser responsável pela disseminação sem controle do parasita no hospedeiro.
57
7 CONCLUSÕES
Estudos de atividades dos compostos cumarinicos complexados com metais contra o
T. cruzi permitiu-nos chegar as seguintes conclusões:
As células infectadas com a cepa G do T. cruzi e tratadas com as associações E1, E2 e
F2 apresentaram diminuição do índice de infecção comparável ao do composto
benzonidazol;
As células infectadas com a cepa CL do T. cruzi e tratadas com as associações A1,C2,
C3, D1, D2, E1, E2 e F2 apresentaram índices de infecção menores que o
benzonidazol;
As células infectadas com a cepa Esmeraldo do T. cruzi e tratadas com as associações
A1, B1 e D2 apresentaram índices de infecção menores que o benzonidazol;
O tratamento com a associação C3 controlou a parasitemia na fase aguda da doença de
Chagas experimental, in vivo, inibindo significativamente a multiplicação dos
parasitos nos animais infectados com a cepa G, em comparação ao benzonidazol;
O tratamento com a associação de compostos C3 e E2 diminuiu em 40% o número de
parasitos circulantes nos animais infectados com a cepa CL na fase aguda da Doença
de Chagas, em comparação benzonidazol;
Embora sem significância estatística ocorre um aumento no nível de citocinas pro
inflamatórias nos animais infectados com a cepa CL de T.cruzi na fase crônica nos
grupos controles B2 e E2.
O tratamento dos animais na fase crônica da Doença de Chagas com benzonidazol e
associação C3 mostrou uma diminuição em 33% e 58% nos níveis de IL-1β nos soros,
corroborando nossa hipótese de sinergismo de ação do composto 4H3NC-Fe com o
benzonidazol. Por outro lado também verificamos uma diminuição na expressão de
IL-12 nos animais do grupo C3 infectados com a cepa G e aumento nos infectados
com a cepa CL.
58
8 REFERÊNCIAS BIBLIOGRÁFICAS
AGÊNCIA FIO CRUZ DE NOTÍCIAS. Doença de Chagas: a doença / agentes causadores.
2013. Disponível em: http://www.agencia.fiocruz.br/doen%C3%A7a-de-chagas. Acesso em:
21 jul 2014.
AGUIAR, C. S. Aplicações dos sorotestes elisa e western blotting na avaliação de
reatividade cruzada no diagnóstico diferencial de infecções causadas por Trypanosoma
cruzi e leishmania chagasi em soros caninos de área endêmica na bahia. Dissertação de
Mestrado.
Salvador
–
Bahia,
2008.
Disponível
em:
<http://www.mevtropical.ufba.br/arquivos/dissertacoes/2006/Cristiane%20Silva%20Aguiar1.
pdf.> Acesso em 29 abr 2014.
BENITE, A. M. C. Uma Visão da química bioinorgânica medicinal. Quimica Nova, 2007;
30(8):2062-2067.
BRISSE, S.; BANABÉ, C.; TIBAYRENC, M.; et al. Identificatin of six Trypanosoma cruzi
plylogenetic lineages by random amplified polymorphic DNA and multilocus enzyme
electrophoresis. 2000 Int. J. parasitol; 30. 35-44.
BRENER, Z.; CHIARI. E. Variações morfológicas observadas em diferentes amostras de
Trypanosoma cruzi. Revista Instituto Médico Tropical São Paulo, v. 5, n. 5, p. 220-224,
set./out. 1963.
CAMPBELL, N. A.; REECE, J. B. Biology. 8th Ed. Pearson Benjamin Cummings Publishing
Company. San Francisco, CA. Pages 236-237. 2009.
CHAKTHONG, S.; WEAARYEE, P.; PUANGPHET, P.; et al. Alkaloid and coumarins
fromthe green fruits of Aeglemarmelos. Phytochemistry, 2012. Vol. 75, p. 108–113.
CHAUSSABEL, D.; PAJAK, B.; VERCRUYSSE, V.; BISSEYE, C.; GARZE, V.; HABIB,
M.; et al. Alteration of migration and maturation of dendritic cells and T-cell depletion
in the course of experimental Trypanosoma cruzi infection. Lab Invest 2003; 83: 13731382.
COHEN, S. M. New approaches for medicinal applications of bioinorganic chemistry.
Curr Opin Chem Biol. 2007. 11:115–20. [PubMed: 17276132]
DIAS, J. C. P.; LOYOLA, C. C. P.; BRENER, Z. Doença de Chagas em Minas Gerais:
Situação atual e perspectivas. Rev Bras Malariol Doenças Trop. 37: 7-28, 1985.
DIAS, J. C. P. Epidemiology of Chagas Disease. In: Wendel S, Brener Z, Camargo ME &
Rassi A. Chagas disease (American Trypanosomiasis): Its impact on transfusion and
clinical medicine. ISBT Brazil 92-São Paulo, 1992.
59
DOCAMPO, R.; MORENO, S. N. Free radical metabolites in the mode of action of
chemotherapeutic agent and phagocytic cells on Tryponosoma cruzi. Rev Infect Dis 6:
223-238, 1984.
FERREIRA, M. E.; NAKAYAMA, H.; DE ARIAS, A. R.; SCHININI, A.; DE BILBAO, N.
V.; SERNA, E.; LAGOUTTE, D.; SORIANO-AGATON, F.; POUPON, E.;
HOCQUEMILLER, R.; FOURNET, A. Effects of canthin-6-one alkaloids from
Zanthoxylum chiloperone on Trypanosoma cruziinfected mice. J. Ethnopharmacol., 2007,
109, 258-63
FIOCRUZ. Fundação Oswlado Cruz. Doença de Chagas: estudos avaliam eficácia do
benzonidazol em pacientes crônicos. 2013. Disponível em: <http://portal.fiocruz.br/ptbr/content/doen%C3%A7a-de-chagas-estudos-avaliam-efic%C3%A1cia-do-benzonidazolem-pacientes-cr%C3%B4nicos>. Acesso em: 18 de mai 2014.
FOX, S. I. Human Physiology, 12th Ed. McGraw-Hill Publishing Company, New York, NY,
2011.
FRICKER, S. P. Metal based drugs: from serendipity to design. Dalton Trans, 2007. 4903–
17. [PubMed: 17992275]
FYLAKTAKIDOU, K. C.; HADJIPAVLOU-LITINA, D. J.; LITINAS, K. E.;
NICOLAIDES, D. N.. Natural and synthetic coumarin derivatives with
antiinflammatory/antioxidant activities. Current Pharmaceutical Design, 2004. vol. 10, nº.
30, p. 3813–3833.
GALVAO-CASTRO, B.; SA-FERREIRA, J. A.; PIRMEZ, C. Immunopathological aspects
of American Trypanosomiasis: the role of immune complexes in the pathogenesis of the
disease. Memórias do Instituto Oswaldo Cruz, 79:69-76, 1984.
GARETH, T. Química Medicinal: uma introdução. 1ª ed. Guanabara: Rio de Janeiro: 2003.
GAUTIER, A.; TEYSSOT, M. L.; JARROUSSE, A. S.; MANIN, M.; CHEVRY, A.;
ROCHE, S.; NORRE, F.; BEAUDOIN, C.; MOREL, L.; BOYER, D.; MAHIOU, R. MetalNHC complexes: a survey of anti-cancer properties. Dalton Trans. 2009 Sep 21;
(35):6894-902. doi: 10.1039/b906308k. Epub 2009 Jul 10.
HAAS, K.L.; FRANZ, K. J. Application of metal coordination chemistry to explore and
manipulate cell biology. Chem Rev. 2009; 109:4921–60. [PubMed: 19715312]
HESTRIN, S.; FEINGOLD, D. S.; AVIGAD, G. Synthesis of sucrose and other -Dfructofuranosyl aldosides by levansucrase. Journal of the American Chemical Society,
1995. vol. 77, no. 24, p. 6710.
HIRSH, J.; DALEN, J. E.; ANDERSON, D. R. Oral anticoagulants: mechanism of action,
clinical effectiveness, and optimal therapeutic range. Chest, 2001. Supplement, p. 8S–21S.
HUANG, G. J.; DENG, J. S.; LIAO, J. C. Inducible nitric oxide synthase and
cyclooxygenase-2 participate in anti-inflammatory activity of imperatorin from Glehnia
littoralis. Journal of Agricultural and Food Chemistry, 2012. vol. 60, no 7, p. 1673–1681.
60
TRANSHAHI, M.; ASKARI, M.; SAHEBKAR, A.; HADJIPAVLOU-LITINA, D.
Evaluation of antioxidant, anti-inflammatory and lipoxygenase inhibitory activities of
the prenylated coumarin umbelliprenin. vol. 17. DARU, 2009. nº. 2, p. 99–103.
KOSTYUK, V. A.; POTAPOVICH, A. I.; STRIGUNOVA, E. N.; KOSTYUK, T. V.;
Afanas'ev IB. Experimental evidence that flavonoid metal complexes may act as mimics
of superoxide dismutase. Arch Biochem Biophys, 2004; 428(2):204-8.
KWON, O. S.; CHOI, J. S.; ISLAM, M. N.; et al., Inhibition of 5-lipoxygenase and skin
inflammation by the aerial parts of Artemisia capillaris and its constituents. Archives of
Pharmacal Research, 2011. Vol. 34, nº. 9, p. 1561–1569.
LOZANO, V. F. Avaliação da atividade antiparasitária e efeito sinérgico de compostos
cumarínicos comparados ao benznidazol em duas cepas de Trypanosoma cruzi. 99 f.
2011. Dissertação (Mestrado em Biotecnologia) Universidade Bandeirante de São Paulo,
2011.
MACHADO, J. R.; SILVA, M. V.; BORGES, D. C,; SILVA, C. A. da; RAMIREZ, L. E.;
REIS, M. A.; CASTELLANO, L. R.; RODRIGUES, V.; RODRIGUES, D. B. R.
Immunopathological Aspects of Experimental Trypanosoma cruzi Reinfections. BioMed
Research International.Volume 2014 (2014), Article ID 648715, 9 pages. Disponível em:
<http://dx.doi.org/10.1155/2014/648715>. Acesso em 18 dez 2014.
MAYA, J. D. at al. Mode Of action of natural and synthetic drugs against Trypanosoma
cruzi and their interaction with the mammalian host. Comp Biochem Physiol A Mol
Integr Physiol 146: 601-620, 2006.
MEGGERS, E. Targeting proteins with metal complexes. Chem Commun (Camb). 2009.
1001–10. [PubMed: 19225621]
MALECKAR, JR; KIERSZENBAUM, F. Inhibition of mitogen-induced proliferation of
mouse T and B lymphocytes by bloodstream forms of Trypanosoma cruzi. J Immunol
1983; 130: 908-911.
NETO, E. C. Doença de Chagas: Novos conhecimentos na patogênese da doença de
chagas. Biotecnologia Ciência & Desenvolvimento. Revista Eletrônica núm. 09. Jul/Ago
1999. Disponível em: <http://www.biotecnologia.com.br/revista/bio09/chagas.pdf>. Acesso
em: 15 fev. 2013.
OLIVEIRA, M. F.; NAGAO-DIAS, A. T.; PONTES, V. M. O.; JÚNIOR, A. S. S.; COELHO,
H. L. L.; COELHO, I. C. B. Tratamento Etiológico da Doença de Chagas no Brasil. Vol.
37 (3): 209-228. jul.-set. 2008.
OTT, I.; GUST, R. Non platinum metal complexes as anti-cancer drugs. Arch Pharm
(Weinheim), 2007. 340:117–26. [PubMed: 17315259]
PATIL, A. D.; FREYER, A. J.; EGGLESTON, D. S. The inophyllums, novel inhibitors of
HIV-1 reverse transcriptase isolated from the Malaysian tree, Calophyllum inophyllum
Linn. Journal of Medicinal Chemistry, 1993. vol. 36, nº. 26, p. 4131–4138.
61
REHMAN, S.; IKRA, M. M.; BAKER, R. J.; ZUBAIR, M.; AZAD, E.; MIN, S.; RIAZ, K.;
MOK, K. H.; REHMAN, S.U. Synthesis, characterization, in vitro antimicrobial, and
U2OS tumoricidal activities of different coumarin derivatives. Chem. Cent. J. 2013 Apr
15;7(1):68. doi: 10.1186/1752-153X-7-68.
REY, L. Tripanossomíase por Trypanosoma cruzi: ecologia, epidemiologia e controle. In.:
Parasitologia. 3. ed. Rio de Janeiro: Guanabara Koogan, 2001. cap. 13, p. 179-199.
REYES-CHILPA, R.; ESTRADA-MUÑIZ, E.; VEGA-AVILA, E.; ABE, F.; KINJO, J.;
HERNÁNDEZ-ORTEGA, S. Trypanocidal constituents in plants: Mammea-type
coumarins. Mem. Inst. Oswaldo Cruz, 2008.
RIBEIRO, C. V. C.; KAPLAN, M. A. C. Tendências evolutivas de famílias produtoras de
cumarinas em angiospermae. Quim. Nova, Vol. 25, Nº. 4, 533-538, Rio de Janeiro, 2002.
ROBERTS, L. S.; JANOVY Jr. J. Foundations of Parasitology, 8th Ed. McGraw-Hill
Publishing Company, Dubuque, Iowa. p. 61-80, 2009.
RODRIGUES, J. H.; UEDA-NAKAMURA , T.; CORRÊA, A. G.; SANGI, D. P.;
NAKAMURA, C. V. A quinoxaline derivative as a potent chemotherapeutic agent, alone
or in combination with benznidazole, against Trypanosoma cruzi. US National Library of
Medicine National Institutes of Health. PubMed., 2014.
SACKS, D.; SHER, A. Evasion of innate immunity by parasitic protozoa. Nature,
3(11):1041-1047, 2002.
SANDHU, D.; BANSAL, Y.; SILAKARI, O.; BANSAL, G. Coumarin hibrids as novel
therapeutic agents. Bioorg, Med. Chem. 2014 May 22. pii: S0968-0896(14)00381-2.
Disponível em: http://www.ncbi.nlm.nih.gov/pubmed/24934993. Acesso em: 09 jun 2014.
SÁNCHEZ-SANCHO, F; CAMPILLO NE, PÁEZ JA. Chagas disease: progress and new
perspectives.2010;17(5):423-52. Curr Med Chem.
SESTI-COSTA, R.; CARNEIRO Z. A.; SILVA M. C.; SANTOS, M.; SILVA, G. K.;
MILANEZI, C.; DA SILVA, R. S.; SILVA, J. S.; Ruthenium complex with benznidazole
and nitric oxide as a new candidate for the treatment of chagas disease.
10.1371/journal.pntd.0003207. Collection 2014
TARLETON, R. L.; GRUSBY, M. J.; ZHANG, L. Increased susceptibility of Stat4deficient and enhanced resistance in Stat 6-deficient mice to infection with Trypanosoma
cruzi. J Immunol 2000; 165: 1520-1525.
TEIXEIRA, A. R. L. Doença de Chagas e outras doenças por tripanossomos. Brasília,
Editora Universidade de Brasília, 1987. 161 p
TORTORA, G. J.; NIELSEN, M. T. Principles of Human Anatomy. 12th edition, ohn Wiley
& Sons, Inc. Hoboken, New Jersey. Pages 723-724, 2012.
URBINA, J. A. Parasitological cure of Chagas disease: is it possible? Is it relevant? Mem.
Inst. Oswaldo Cruz 94 (Suppl.1): 349-355, 1999.
62
URBINA, J. A.; DOCAMPO, R. Specific Chemotherapy of Chagas disease: controversies
and advances. Trends Parasitol 19:495-501, 2003.
YAN, Y. K.; MELCHART, M.; HABTEMARIAM, A.; SADLER, P. J. Organometallic
chemistry, biology and medicine: ruthenium arene anticancer complexes. Chem
Commun (Camb), 2005. 4764–76. [PubMed: 16193110]
YANG, D.; WANG, G. U.; TANG, Q.; Effects of osthole on migration and invasion in
breast cancer cells. Bioscience, Biotechnology and Biochemistry, 2010. vol. 74, nº. 7, p.
1430–1434.
YOSHIDA, N. Surface antigens of metacyclic trypomastigotes of Trypanosoma cruzi.
Infect Immun. 1983 May; 40(2): 836-839.
YOSHIDA, N. Molecular basis of mammalian cell invasion by Trypanosoma cruzi. An.
Acad. Bras. de Ciênc. Vol.78 n. 1 Rio de Janeiro Mar. 2006.
ZINGALES, B.; SOUT, R. P.; MANGIA, R. H. et al. American Trypanosomiasis in Brasil
based on dimorphism of rRNA and mini-exon sequences. 1998 Int.J parasitol; 28: 105-12.
63
ANEXOS
Padronização do ensaio de citocinas (Mouse Cytokine 10-Plex Panel-Novex®)
64