Química Geral 2002/2003
Eng. Aeroespacial e Biomédica
1º Exame 30/6/2003
1. (1.0 val) O Césio é muito utilizado em células fotoeléctricas e câmaras de
televisão uma vez que pode ser utilizado em quase todo o espectro visível: até
660 nm. Numa célula fotoeléctrica qual é a velocidade dos fotoelectrões
ejectados pelo césio se se usar luz amarela de sódio (589 nm)?
2. (1.5 val) Explique quantitativamente, usando o sódio como exemplo, porque razão
os metais alcalinos aparecem frequentemente na forma da catião monopositivo
e nunca na forma de anião.
3. (2.0 val) Esboce o diagrama de energias das orbitais moleculares do ião NaO-.,
indicando as energias de ionização dos átomos constituintes e do ião e os tipos
de orbitais envolvidas. Calcule a ordem de ligação e diga que propriedades
magnéticas prevê para esta espécie.
4. (2.0 val) Descreva a estrutura da molécula isocianato de fenilo, C6H5NCO, à luz
da TEV, indicando hibridações dos átomos constituintes, ângulos e tipo de
ligação e pares de electrões não partilhados.
5. (1.5 val) O nylon 6,6 pode ser obtido por reacção de cloreto de adipoilo com
hexametileno diamina
a) Classifique este polímero quanto ao tipo de reacção de polimerização.
b) Explique detalhadamente que polímero deve apresentar maior temperatura
de transição vítrea , o nylon 6,6 ou o Kevlar:
6. (2.0 val) O diamante e o sílicio apresentam a mesma estrutura cristalina mas o
diamante é um isolador e o sílicio um semicondutor. Explique a diferença nas
propriedades eléctricas destes materiais com base na estrutura de bandas de
ambos.
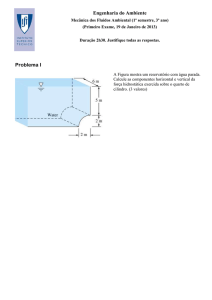
7. (3.0 val) Considere o cálcio (Ca)
a) Compare, justificando detalhadamente, a temperatura de fusão do cálcio e
do Vanádio (V).
b) Diga qual dos seguintes sais de cálcio deverá apresentar maior dureza: CaO
ou CaS.
c) Estime a densidade do óxido de cálcio sabendo que este sal apresenta uma
estrutura tipo NaCl: estrutura cúbica de corpo centrado de aniões em que
os catiões ocupam os interstícios octaédricos.
8. (3 val) Sabendo que a 25ºC Kp=4.71 x 10-31 para a reacção
N2 (g)+ O2 (g) 2NO (g)
e que Hf0 NO(g) = 90 kJ mol-1, calcule a composição de equílibrio num reactor de
1 L a 800 K em que foram introduzidas 0.1 mole de N2 e 0.4 mole de O2.
9. (3 val) Considere a seguinte pilha, a 25ºC :
C(s) H2 (g, 0.5 atm) KOH (10-3 M) O2(g, 0.8 atm) KOH (10-3 M) C (s)
a) Calcule a força electromotriz da pilha, indicando as reacções de eléctrodo e
a reacção global da pilha.
10. (1.0 val) Considere a seguinte reacção
4 HBr + O2 2 H2O + 2 Br2
a qual segue uma lei de velocidades v = k [HBr] [O2]
Diga se o seguinte mecanismo é compatível com esta lei de velocidades:
HBr + O2 HOOBr
equilíbrio rápido
HOOBr + HBr 2HOBr
lento
HOBr + HBr H2O + Br2
rápido
Dados:
h=6.62618x10-34 J s
NA= 6.0221367x1023
me=9.10953X10-31 kg
R=8.31441 J K-1 mol-1 = 0.0820575 atm L K-1 mol-1
EH0 O/H ,OH- = - 0.83V
2
2
F= 9.648x104 C mol-1
EO0 ,H O/OH- = 0.40V
2
2
c=2.99792458x108 ms-1