LISTA DE EXERCÍCIOS – RECUPERAÇÃO
Goiânia, ____ de ___________ de 2016
Aluno(a):___________________________________________________________________
Série: 3ª Turma: _______
Disciplina: Química Professor: Sylvão
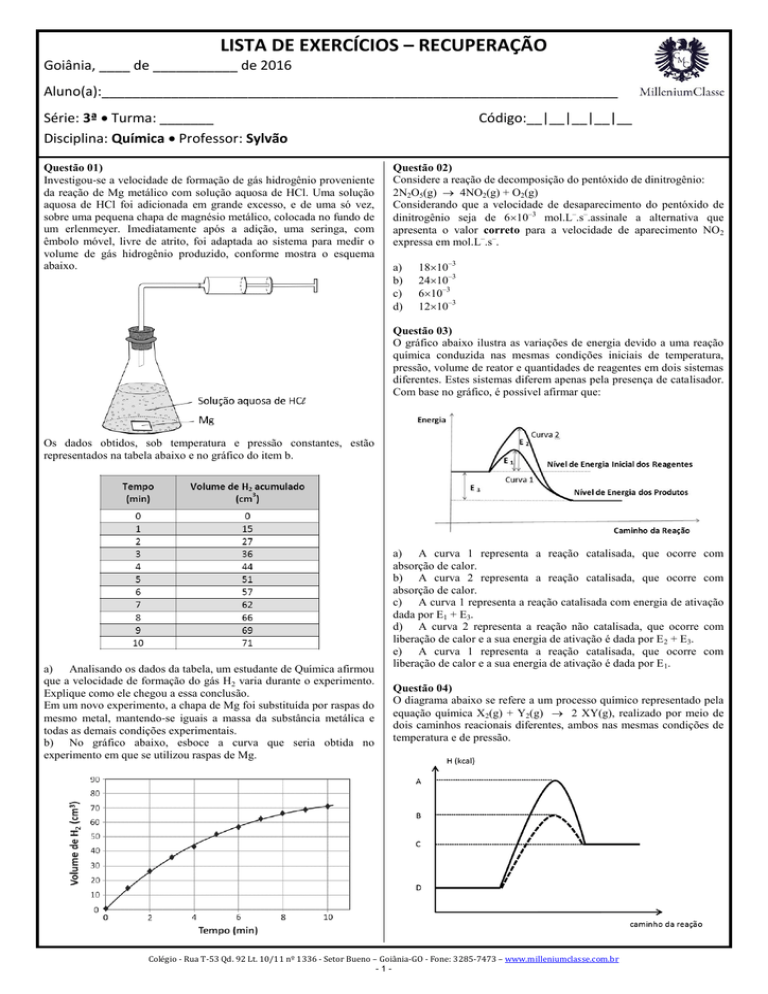
Questão 01)
Investigou‐se a velocidade de formação de gás hidrogênio proveniente
da reação de Mg metálico com solução aquosa de HCl. Uma solução
aquosa de HCl foi adicionada em grande excesso, e de uma só vez,
sobre uma pequena chapa de magnésio metálico, colocada no fundo de
um erlenmeyer. Imediatamente após a adição, uma seringa, com
êmbolo móvel, livre de atrito, foi adaptada ao sistema para medir o
volume de gás hidrogênio produzido, conforme mostra o esquema
abaixo.
Código:__|__|__|__|__
Questão 02)
Considere a reação de decomposição do pentóxido de dinitrogênio:
2N2O5(g) 4NO2(g) + O2(g)
Considerando que a velocidade de desaparecimento do pentóxido de
dinitrogênio seja de 610–3 mol.L–.s–.assinale a alternativa que
apresenta o valor correto para a velocidade de aparecimento NO2
expressa em mol.L–.s–.
a)
b)
c)
d)
1810–3
2410–3
610–3
1210–3
Questão 03)
O gráfico abaixo ilustra as variações de energia devido a uma reação
química conduzida nas mesmas condições iniciais de temperatura,
pressão, volume de reator e quantidades de reagentes em dois sistemas
diferentes. Estes sistemas diferem apenas pela presença de catalisador.
Com base no gráfico, é possível afirmar que:
Os dados obtidos, sob temperatura e pressão constantes, estão
representados na tabela abaixo e no gráfico do item b.
a) Analisando os dados da tabela, um estudante de Química afirmou
que a velocidade de formação do gás H2 varia durante o experimento.
Explique como ele chegou a essa conclusão.
Em um novo experimento, a chapa de Mg foi substituída por raspas do
mesmo metal, mantendo‐se iguais a massa da substância metálica e
todas as demais condições experimentais.
b) No gráfico abaixo, esboce a curva que seria obtida no
experimento em que se utilizou raspas de Mg.
a) A curva 1 representa a reação catalisada, que ocorre com
absorção de calor.
b) A curva 2 representa a reação catalisada, que ocorre com
absorção de calor.
c) A curva 1 representa a reação catalisada com energia de ativação
dada por E1 + E3.
d) A curva 2 representa a reação não catalisada, que ocorre com
liberação de calor e a sua energia de ativação é dada por E 2 + E3.
e) A curva 1 representa a reação catalisada, que ocorre com
liberação de calor e a sua energia de ativação é dada por E1.
Questão 04)
O diagrama abaixo se refere a um processo químico representado pela
equação química X2(g) + Y2(g) 2 XY(g), realizado por meio de
dois caminhos reacionais diferentes, ambos nas mesmas condições de
temperatura e de pressão.
Colégio - Rua T-53 Qd. 92 Lt. 10/11 nº 1336 - Setor Bueno – Goiânia-GO - Fone: 3285-7473 – www.milleniumclasse.com.br
-1-
A respeito desse diagrama, é INCORRETO afirmar que
a) a diferença entre os valores de energia, representados pelas letras
A e B, corresponde à diminuição da energia de ativação do processo,
provocada pelo uso de um catalisador.
b) o valor de energia representado pela letra C identifica a entalpia
do produto.
c) o valor de energia representado pela letra D se refere à entalpia
dos reagentes.
d) a diferença entre os valores de energia, representados pelas letras
A e D, corresponde à energia de ativação do processo catalisado.
e) a diferença entre os valores de energia, representados pelas letras
C e D, corresponde à variação da entalpia do processo.
Questão 05)
A reação química descreve a transformação do composto A em um
complexo ativado intermediário que, por sua vez, forma o composto B.
Complexo
Ativado
A
B + calor
O gráfico a seguir apresenta a relação entre a energia e o caminho da
reação.
Considerando o exposto,
a) calcule a energia de ativação e a variação de entalpia (H) da
reação.
b) esboce um gráfico entre a energia e o caminho da reação inversa.
Questão 06)
Considere a reação catalisada descrita pelo mecanismo a seguir.
Primeira etapa: A + BC AC + B
Segunda etapa: AC + D A + CD
O perfil energético dessa reação segue a representação do gráfico
abaixo.
a) os intermediários de reação são representados por (2) e (3) e
equivalem, respectivamente, aos compostos BC e AC.
b) os reagentes, representados por (1), são os compostos A e D.
c) o complexo ativado representado por (4) tem estrutura A-----C----D.
d) o produto, representado por (5), é único e equivale ao composto
CD.
e) a presença do catalisador A torna a reação exotérmica.
Questão 07)
Considere a reação de decomposição da amônia: NH3(g)
1
N2(g) +
2
3
H2(g) que possui uma energia de ativação de 150 kJ mol –1 e uma
2
variação de entalpia H = 46 kJ mol–1.
A energia de ativação da formação da amônia é:
a)
b)
c)
d)
46 kJ mol–1
104 kJ mol–1
150 kJ mol–1
196 kJ mol–1
Questão 08)
O esquema apresentado descreve os diagramas energéticos para uma
mesma reação química, realizada na ausência e na presença de um
agente catalisador.
Com base no esquema, responda qual a curva que representa a reação
na presença de catalisador. Explique sua resposta e faça uma previsão
sobre a variação da entalpia dessa reação na ausência e na presença do
catalisador.
Questão 09)
O processo de remoção de enxofre em refinarias de petróleo é uma
prática que vem sendo cada vez mais realizada com o intuito de
diminuir as emissões de dióxido de enxofre de veículos automotivos e
o grau de envenenamento de catalisadores utilizados. A
dessulfurização é um processo catalítico amplamente empregado para
a remoção de compostos de enxofre, o qual consiste basicamente na
inserção de hidrogênio.
A reação química do composto etanotiol é mostrada a seguir.
C2H5SH(g) + H2(g) C2H6(g) + H2S(g)
a) Suponha que a reação de dessulfurização seja realizada em
laboratório, na presença de concentrações diferentes de etanotiol e
hidrogênio, conforme quadro a seguir.
Experiências
Diante das informações apresentas, é correto afirmar que
[Etanotiol] [Hidrogênio] Velocidadeinicial
1
(mol/L)
2
(mol/L)
1
(mol/min)
4
2
3
2
2
8
3
6
4
8
6
6
16
Com base nos dados apresentados nessa tabela, determine a lei da
velocidade e a ordem da reação.
b) Considerando que a velocidade média da reação de
dessulfurização, em certo intervalo de tempo, é de 10 mol/s em relação
ao etanotiol, determine a velocidade da reação em relação ao gás
sulfídrico dada em g/s, no mesmo intervalo de tempo.
Questão 10)
Colégio - Rua T-53 Qd. 92 Lt. 10/11 nº 1336 - Setor Bueno – Goiânia-GO - Fone: 3285-7473 – www.milleniumclasse.com.br
-2-
Um fogão de cozinha consome 134,4 L de metano por hora, medidos
nas CNTP. Nas mesmas condições, a velocidade de formação do
dióxido de carbono, resultante da combustão completa do metano, é:
a)
b)
c)
d)
e)
6,0 moléculas/h
6,02x1023 moléculas/h
8,4 mol/h
22,4L/h
6,0 mol/h
GABARITO:
1) Gab:
a) Chegou a esta conclusão observando a tabela e verificando que a
variação de volume a cada intervalo de tempo não é a mesma.
Exemplo:
Intervalo de 0 min – 1 min: 15 cm3 – 0cm3 = 15 cm3
V
velocidade =
15 cm3/min
t
Intervalo de 1 min – 2 min: 36 cm3 – 27 cm3 = 9 cm3
velocidade = 9 cm3/min
b)
2) Gab: D
3) Gab: E
4) Gab: D
5) Gab:
a) HAtivação = +50 kJ/mol
HReação = +20 kJ/mol
b)
6) Gab: C
7) Gab: B
8) Gab:
A curva II representa a reação na presença de catalisador, pois houve
diminuição da energia de ativação. A variação de entalpia é a mesma
na presença e na ausência de um catalisador.
9) Gab:
a) A lei da velocidade é dada por v = k [Etanotiol] [H2] e a ordem
da reação é 2.
b) y = 340 g/s de H2S
10) Gab: E
Colégio - Rua T-53 Qd. 92 Lt. 10/11 nº 1336 - Setor Bueno – Goiânia-GO - Fone: 3285-7473 – www.milleniumclasse.com.br
-3-