UNIVERSIDADE ESTADUAL DE FEIRA DE SANTANA PROGRAMA DE PÓS­GRADUAÇÃO EM BIOTECNOLOGIA LÍVIA DE J ESUS VIEIRA CONSERVAÇÃO IN VITRO E CRIOPRESERVAÇÃO DE ESPÉCIES DE Manihot Feira de Santana, BA 2013
1 LÍVIA DE J ESUS VIEIRA CONSERVAÇÃO IN VITRO E CRIOPRESERVAÇÃO DE ESPÉCIES DE Manihot Tese apresentada ao Programa de Pós­graduação em Biotecnologia, da Universidade Estadual de Feira de Santana como requisito parcial para obtenção do título de Doutor em Biotecnologia. Orientador: Prof. Dr. José Raniere Ferreira de Santana Co­orientadores: Dra. Fernanda Vidigal Duarte Souza Dr. Alfredo Augusto Cunha Alves Feira de Santana, BA 2013
2 À minha mãe por ser a minha fonte de inteligência, perseverança e força, e a pesquisadora Fernanda Vidigal por sempre acreditar mim, pelo carinho, confiança, paciência, amizade e, sobretudo pela coragem de me orientar por tantos anos, eu DEDICO.
3 AGRADECIMENTOS Primeiramente a Deus por ter me abençoado e feito com que todas as coisas dessem certo em todos os momentos de dificuldade. Ao Programa de Pós­graduação em Biotecnologia da Universidade Estadual de Feira de Santana pela oportunidade de cursar meu doutorado nesta instituição. À Embrapa Mandioca e Fruticultura por disponibilizar a infraestrutura necessária para o desenvolvimento dos meus trabalhos. Ao National Center for Genetic Resources Preservation (NCGRP) por possibilitar a realização do meu estágio sanduiche. Ao meu orientador José Raniere Ferreira de Santana pela oportunidade, apoio, incentivo e conselhos cedidos. A minha coorientadora Fernanda Vidigal Duarte Souza pela minha formação científica e seus ensinamentos, conhecimentos, metodologia, conforto e abrigo ofertados. Ao meu coorientador Alfredo Augusto Cunha Alves por sua extrema bondade e gentileza prestados a mim em todos os momentos e por tudo que fez pelo meu intercâmbio. Ao meu coorientador David Ellis pela grande oportunidade de realizar meu doutorado sanduiche nos Estados Unidos. A pesquisadora Janay Santos­Serejo por sempre está disponível para tirar minhas dúvidas. A Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pela concessão da bolsa. A minha mãe Maria Neuza de Jesus Vieira e irmãos Letícia e André por sempre acreditarem e se emocionarem por minhas conquistas. Ao meu príncipe Leandro Ribeiro por todo amor, carinho, dedicação e todo apoio do mundo oferecido a mim durante todo trajeto desta caminhada. Ao sensei Arnaldo Neto por ser responsável pela minha integridade física e mental. Ao Helton, secretário do PPGBiotec, por sempre agilizar os meus pedidos. À bibliotecária da Embrapa Sônia Cordeiro por sempre está disponível para me atender com carinho e atenção. Aos técnicos do LCTV Hélder, Honorato, Karen e Tania pela disposição. As amigas de laboratório Ádila Melo e Cícera de Amaral pelo companheirismo. A grande amiga Vânia Santos pela amizade e direcionamento de vida na terra.
4 “Se farinha fosse americana,mandioca importada,banquete de bacanaera farinhada..” (Juraildes da Cruz ­ Xangai)
5 RESUMO Espécies silvestres de Manihot são fontes de genes úteis para o melhoramento genético da mandioca cultivada, evidenciando a necessidade e a importância de conservação desse germoplasma. O objetivo deste trabalho foi avaliar o efeito da sacarose, manitol e sorbitol na conservação in vitro de mandioca, e avaliar a tolerância ao crioarmazenamento de meristemas e grãos de pólen de espécies de Manihot. Nos trabalhos envolvendo a conservação in vitro, foram utilizadas microestacas de mandioca oriundas do BAG da Embrapa Mandioca e Fruticultura em três experimentos distintos. O primeiro constou na avaliação de cinco concentrações de sacarose (0, 14,61; 29,22; 43,84; 58,45 mM) nos BGMs 264, 265, 1037 e 1282; enquanto que no segundo e terceiro foi utilizado o acesso BGM 1282 e concentrações combinadas de sacarose (0 e 58 mM) com 0; 2,75; 6,86; 13,73 e 27,45 mM de manitol ou sorbitol. Nos testes de criopreservação de meristemas foi utilizado o método droplet­ vitrification nas espécies M. tristis e M. cartaginenses. Nas avaliações de viabilidade polínica foram utilizados os métodos in vivo, in vitro, colorimétrio e fluorométrico e, para criopreservação, foram utilizados grãos de pólen frescos e desidratados em câmara de fluxo laminar. O melhor resultado observado para a conservação in vitro foi na concentração de 58,45 mM de sacarose no experimento 1, e de 27,45 mM manitol ou sorbitol na ausência de sacarose (experimento 2 e 3). O método droplet vitrification foi eficiente na criopreservação dos meristemas, com taxas de regeneração acima de 60%.O método fluorométrico foi o mais eficaz na estimativa da viabilidade polínica. Grãos de pólen foram intolerantes ao crioarmazenamento. Palavras­chave: Viabilidade polínica. Pré­melhoramento. Recursos genéticos. Mandioca.
6 ABSTRACT Wild species of Manihot are sources of useful genes for genetic improvement of cassava, emphasizing the need for conservation of these germplasm. The aim of this study was to evaluate the effect of sucrose, mannitol and sorbitol in in vitro conservation of cassava, and evaluate the cryostorage tolerance meristems and pollen grains of species of Manihot. In studies involving in vitro conservation, micro­cuttings were used cassava originated from Embrapa Cassava and Fruits BAG in three separate experiments. The first consisted in the evaluation of five different concentrations of sucrose (0, 14.61, 29.22, 43.84, 58.45 mM) in BGMs 264, 265, 1037 and 1282, while the second and third the BGM 1282 was used in combined concentrations of sucrose (0 to 58 mM) with 0, 2.75, 6.86, 13.73 and 27.45 mM mannitol or sorbitol. In tests of cryopreservation of meristems was used the method droplet­ vitrification in the species M. tristis and M. Carthaginians. In the evaluations feasibility pollinic were used the methods in vivo, in vitro, colorimetric and fluorometric, and for cryopreservation were used pollen grains fresh and dehydrated in flow air. The best result observed for the conservation in vitro was in concentration of 58.45 mM of sucrose in experiment 1, and of 27.45 mM mannitol or sorbitol in the absence of sucrose in the experiment 2 and 3. The method droplet vitrification was efficient in meristems cryopreservation, with rates of regeneration above of 60%. The fluorometric method was the most effective in pollen viability estimative. Pollen grains were intolerant to cryostorage. Keywor ds: Pollen viability. Pre­breeding.Genetic resources. Cassava.
7 SUMÁRIO INTRODUÇÃO GERAL CAPÍTULO 1: EFEITO DA SACAROSE, MANITOL E SORBITOL NA CONSERVAÇÃO IN VITRO DE MANDIOCA 1.1 1.2 1.2.1 1.2.2 1.2.3 1.2.3.1 1.2.3.2 1.2.4 1.2.5 1.3 1.3.1 1.3.2 1.3.3 2.1 2.2. 2.2.1 2.2.2 2.2.2.1 2.2.2.2 2.3 2.3.1 2.3.2 3.1 3.2 3.2.1 3.2.1.1 3.2.1.2 3.2.1.3 3.2.1.4 Introdução Materiais e métodos Material vegetal Estabelecimento das plantas in vitro Conservação in vitro Experimento 1 Experimentos 2 e 3 Variáveis analisadas Análises estatísticas Resultados e discussão Experimento 1 Experimento 2 Experimento 3 CONCLUSÃO REFERÊNCIAS CAPÍTULO 2: CRIOPRESERVAÇÃO DE MERISTEMAS DE ESPÉCIES DE Manihot Introdução Materiais e métodos Material vegetal Criopreservação Criopreservação de meristemas apicais (~ 1 mm) Criopreservação de meristemas apicais (~ 0,4 mm) Resultados e discussão Uso de meristemas apicais Criopreservação de meristema apical com apenas o domo meristemático e dois primórdios foliares CONCLUSÃO REFERÊNCIAS CAPÍTULO 3: VIABILIDADE E CRIOPRESERVAÇÃO DE PÓLEN DE Manihot Introdução Materiais e métodos Testes de viabilidade polínica Testes colorimétricos Teste de reação fluorocromática Teste de germinação in vivo Teste de germinação in vitro 10 24 27 29 29 29 30 30 30 31 31 32 32 39 42 46 46 50 53 54 54 54 54 56 57 57 58 60 61 63 66 67 68 68 68 69 70
8 3.2.2 3.2.2.1 3.2.2.2 3.2.2.3 3.2.3 3.3 3.3.1 3.3.2 Criopreservação de pólen Tolerância à desidratação Métodos de criopreservação Microscopia eletrônica de varredura Análises estatísticas Resultados e discussão Testes de viabilidade polínica Criopreservação de pólen CONCLUSÃO REFERÊNCIAS CAPÍTULO 4: FLUORESCENCE MICROSCOPY METHOD FOR POLLEN VIABILITY STUDIES OF MANIHOT MILL. SPECIES 70 70 71 71 71 72 72 79 82 83 86 4.1 4.2 4.2.1 Introduction Methodology Plant material 89 91 91 4.2.2 Pollen viability tests 91 4.2.2.1 Colorimetric test 91 4.2.2.2 Fluorochromatic reaction test 92 4.2.3 Germination time and size of pollen tube 93 4.2.4 Polen longevity 93 4.3 Results and discussions 93 4.3.1 Colorimetric test 93 4.3.2 Fluorochromatic reaction test 95 4.3.3 Germination time and size of pollen tube 96 4.3.4 Polen longevity 97 CONCLUSION 99 REFERENCES 100 ANEXO 1 103
9 INTRODUÇÃO GERAL A cultura da mandioca A mandioca, Manihot esculenta Crantz, pertence à ordem Malpighiales, família Euphorbiaceae e gênero Manihot. A espécie é nativa do Brasil, com abrangência em todas as partes tropicais da América do Sul e Central, e nas Índias ocidentais (ROGERS, 1963). Domesticada de 3.000 a 7.000 anos atrás a partir de espécies silvestres, a subespécie M. esculenta spp. flabellifolia é considerada como principal ancestral (OLSEN; SCHALL, 1999, ROGERS, 1972). De acordo com Allem (1994), devido à ampla área de distribuição das subespécies M. esculenta spp. flabellifolia e M. esculenta spp. peruviana, torna­se difícil afirmar o local de domesticação inicial. Considerada uma das culturas alimentares mais importantes nas regiões tropicais e subtropicais do mundo, ocupa posição de destaque entre as principais fontes de energia alimentar em termos de consumo calórico global, classificada abaixo do trigo, arroz, milho e sorgo (ADEYEMO, 2009). É tolerante à seca e possui ampla adaptação às mais variadas condições de clima e solo. A parte mais importante da planta são as raízes tuberosas, ricas em amido, e utilizadas na alimentação humana e animal, ou como matéria­prima para diversas indústrias (FUKUDA et al., 2002, MORO, 2009). Com uma área de 1.798.000 hectares, o Brasil é o segundo maior produtor mundial de mandioca com uma safra de 24 milhões de toneladas de raízes frescas colhidas em 2012. O Nordeste brasileiro é a maior região produtora de mandioca do país, gerando 6.643.769 toneladas de raízes representando 33% da produção nacional, com destaque para os estados da Bahia (3.459 toneladas), Maranhão (1.853 toneladas) e Ceará (826 toneladas) (IBGE, 2012). A mandioca é uma espécie monoica, com flores estaminadas e pistiladas ocorrendo na mesma inflorescência (FUKUDA et al., 2002). Apesar de ser uma espécie preferencialmente alógama, a mandioca pode apresentar autofecundação. O estigma é receptivo durante todo o período de abertura das flores, perdendo sua vitalidade 24 horas após a antese. Comportamento semelhante acontece com o pólen, que perde sua viabilidade após 48 horas (CHAVARRIAGA; HALSEY, 2005), podendo manter­se viável por um período de seis dias, quando conservado em cloreto de cálcio. A mandioca apresenta protoginia, ou seja, as flores pistiladas abrem antes das flores estaminadas (DOMÍNGUEZ et al., 1984 apud Silva, 2001, VIEIRA 2012). Contudo, a abertura de flores pistiladas e estaminadas podem acontecer na mesma inflorescência, possibilitando a ocorrência de autocruzamentos (FUKUDA et al., 2002). Ocorridaa polinização,
10 a semente resultante se torna viável dois meses após a fecundação, e os frutos tornam­se maduros cerca de um mês depois disso, ou cerca de três meses após a fecundação (CEBALLOS et al., 2002). O fruto é deiscente, trilocular, e as sementes são ovóides, com cerca de 10 mm de comprimento e a endosperma pode variar entre 4 a 6 mm (ALVES, 2002). A mandioca é uma planta perene, bem adaptada às condições do clima tropical, com melhor desenvolvimento foliar e potencial fotossintético em ambientes com temperatura entre 23 e 25ºC, radiação solar elevada, e um modelo de fotossíntese típico de plantas C3. Suas folhas são adaptadas para condições de escassez hídrica, com a epiderme da superfície inferior do mesofilo apresentando células papiliformes, que aumentam em torno de 15% a espessura da folha, e a superfície superior lisa com alguns estômatos e tricomas dispersos. Toda planta com exceção das sementes apresentam o glucosídio cianogênico, sendo consideradas variedades ‘bravas’ ou ‘amargas’ as que apresentam quantidade maior que 100 mg Kg ­1 , enquanto as que apresentam teores abaixo a 100 mg Kg ­1 são consideradas ‘mansas’ ou ‘doces’. As raízes de mandioca ricas em carboidratos apresentam curto período pós­colheita (24 – 72 horas). A forma mais comum de propagação da mandioca é mediante o seccionamento das hastes e plantio das estacas ou por semente sexual (ALVES, 2002). Recur sos genéticos de mandioca A mandioca (Manihot esculenta Crantz) é a única espécie de valor comercial dentro do gênero Manihot. Os recursos genéticos de Manihot englobam genótipos da espécie cultivada e das espécies silvestres. Este gênero, originário do continente americano, abrange desde os Estados Unidos até a Argentina com 99 espécies que variam de plantas herbáceas a arbóreas (ROGER, APPAN, 1973. NASSAR et al., 2011). O Brasil possui 80% das espécies do gênero (ROGER, APPAN, 1973), sendo o maior centro de diversificação abrangendo o sul de Goiás e o oeste de Minas Gerais, do Nordeste do Brasil, do sudeste do Mato Grosso, seguido do sudeste do México e da Bolívia (NASSAR, 1978; NASSAR, 2000). No Brasil, a maior representatividade de espécies silvestres de Manihot ocorre no Cerrado (LEDO, 2010). Espécies silvestres de Manihot, embora pouco utilizadas, são importantes fontes de resistência a fatores bióticos e abióticos para a espécie comercializada, possibilitando, pela introgressão de genes de interesse, o desenvolvimento de variedades mais produtivas e menos susceptíveis a fatores variados, como pragas e mudanças climáticas (NASSAR, 2006).
11 Barreiras reprodutivas entre as espécies são fracas e hibridizações artificiais e naturais ocorrem no gênero. Dados citogenéticos mostraram que todas as espécies possuem o mesmo número cromossômico (2n=36), com comportamento meiótico de diplóides (CARVALHO; GUERRA, 2002). Nassar (1989) observou híbridos interespecíficos entre M. esculenta e espécies silvestres como M. neusana Nassar e M. pohlii Wawra que sobreviveram e demonstraramvigor. Devido à alta taxa de divisão meiótica normal e fertilidade razoável do pólen, é possível a introgressão e incorporação de alelos de genes de interesse das espécies silvestres na mandioca cultivada ainda que muito pouco tem sido feito nessa direção(NASSAR et al., 1986). Uma das limitações da utilização de genes de espécies silvestres de mandioca no melhoramento genético da espécie cultivada é a assincronia de florescimento que pode ocorrer entre as espécies de interesse. A conservação do pólen pode ser uma estratégia para a solução desse problema (VIEIRA, 2010). Alves (2006) listou características relevantes em espécies silvestres de Manihot, como adaptação a condição de seca emM. caerulescens,M. carthaginensis, M. dichotoma e M. pseudoglaziovii;adaptação a solos alcalinos em M. chlorostica, M. pentaphylla e M. pruinosa, adaptação a solos ácidos em M. irwinii e M. orbicularis; baixo teor de HCN em M. pringlei; alto teor de amido em M. anomala, M. oligantha, M. tripartita,M. tristis e M. zehntneri; tolerância ao frio em M. anisophylla, M. attenuata , M. grahamiie M. rubricaulis; produção de látex em M. caerulescens, M. dichotoma e M. glaziovii; e resistência a pragas de ocorrência comum em mandioca nas espécies M. dichotoma e M. glaziovii. Dessa forma, espécies silvestres do gênero Manihot e subespécies de M. esculenta se constituem em fontes de genes que podem ser usadas para a obtenção de novas variedades, tornando evidente a necessidade e a importância de conservação desses germoplasma, incluindo a conservação de pólen. Conser vação de ger moplasma A conservação ex situ de mandioca vêm sendo realizada por meio da manutenção de coleções em diferentes países, como a do CIAT, Centro Internacional de Agricultura Tropical, na Colômbia, com 6592 acessos (5.709 clones de M. esculenta e 883 genótipos de espécies silvestres) (CIAT, 2013), a do IITA (International Institute of Tropical Agriculture) na Nigéria, com 2700 acessos (IITA, 2007). No Brasil, em função da adaptação específica das
12 variedades de mandioca aosdiferentes ecossistemas do país, foram estabelecidos a partir de 1994, sob aliderança da Embrapa Mandioca e Fruticultura (CNPMF), seis bancos regionais de mandioca (CPATSA, Petrolina­PE; CPATU, Belém­PA; CPAA, Manaus­AM; CPAC, Brasília­DF; EPAGRI, Itajaí­SC) com os objetivos principais de prevenir a erosão genética daespécie Manihot esculenta dentro de cada ecossistema onde estão localizados edar suporte aos programas de melhoramento regionais com a cultura(FUKUDA et al, 1999).A Embrapa Mandioca e Fruticultura dispõem atualmente com 1800 clones de M. esculenta e aproximadamente 600 acessos de 30 espécies silvestres (ALVES et al., 2010; LEDO et al., 2010). No caso das coleções internacionais existem cópias de segurança in vitro, assim como no Brasil alguns acessos já são mantidos em laboratório, tanto no CNPMF, como no CENARGEN, ainda que um número muito aquém dos acessos existentes nas coleções de campo. Coleções mantidas em campo estão sujeitas a riscos bióticos e abióticos, que podem levar à perda de acessos e, portanto, de parte da variabilidade genética conservada. Em vista disso, tem se buscado estratégias de conservação para o estabelecimento de duplicatas de segurança em outras condições. A biotecnologia, com suas técnicas de cultura de tecidos, oferecem possibilidades que vão desde a conservação in vitro até a criogenia de células vegetais ou criopreservação do germoplasma.Os métodos de conservação das coleções de plantas devem ser adequados aos seus sistemas de propagação e dessa forma garantir a viabilidade do material após o tempo de armazenamento. Conser vação in vitro Conservação in vitro compreende a manutenção de amostras de germoplasma vegetal utilizando­se a técnica da cultura de tecidos in vitro , em condições controladas de temperatura, fotoperíodo e em meio de cultura que favoreça o crescimento lento dos propágulos.É um método eficiente de preservação de germoplasma em médio prazo, de baixo custo, fácil e que apresenta como principais vantagens, em comparação com a conservação no campo, o reduzido espaço de armazenamento, rápida multiplicação de material vegetal livre de pragas e patógenos presentes no campo e independência das condições climáticas (SANTOS et al.; 2011, REED et al., 2013). Como desvantagem, esse tipo de conservação demanda mão de obra especializada, infraestrutura adequada e uma estratégia de cultivo que permita a manutenção das plantas em crescimento lento. A redução do metabolismo das plantas diminui de forma significativa o
13 trabalho de manutenção da coleção, pela redução no número de repicagens, e é um dos fatores que pode contribuir para evitar a ocorrência de variações somaclonais. Assim, a padronização do comportamento das plantas in vitro é um facilitador para a gestão da coleção, uma vez que pode permitir maior planejamento para os procedimentos de repicagem (PEREIRA et al., 2007), além das outras vantagens. Alguns aspectos devem ser considerados na conservação in vitro, como a capacidade de resgate do que está conservado, ou seja, a capacidade da planta manter­se viável após o período de conservação. Muitas vezes a estratégia utilizada para a redução do metabolismo da planta in vitro pode causar danos irreversíveis, dificultando a recuperação das mesmas para a condição ex vitro (HASSAN; BEKHEET, 2008, GOPAL; CHAUHAN, 2010, OREGO et al., 2012). Vários são os fatores que podem ser trabalhados para a redução do metabolismo das plantas in vitro , destacando­se o uso de reguladores osmóticos e outros componentes do meio de cultura. Fatores relacionados à forma de incubação, como incidência de luz, fotoperíodo, temperatura, dentre outros, costumam ter forte influencia sobre o crescimento das plantas (REED et al., 2013). A sacarose é um dissacarídeo não redutor muito utilizado como fonte de energia e esqueleto de carbono para plantas mantidas in vitro. Este açúcar promove o aumento de biomassae sua concentração é um fator determinante no crescimento das mesmas em condições de laboratório. Dessa forma, alterações na concentração de sacarose podem alterar de forma significativa o metabolismo das plantas e tem sido um dos fatores mais trabalhados na busca do crescimento mínimo in vitro (ANKITA; ANIMESH, 2013). O manitol e o sorbitol são açúcares alcoólicos utilizados para alterar as condições osmóticas, proteger as membranas das baixas temperaturas e reduzir a hiperidricidade, estado fisiológico em que a planta apresenta acúmulo anormal de água provocado pela difusão passiva da água do meio de cultivo para o interior dos tecidos,ou um distúrbio no processo metabólico da planta (KADOTA et al., 2001; FARIA et al., 2006; VASCONCELOS et al., 2012). Esses compostos tuam gerando um estresse hídrico pelo aumento da concentração osmótica, influenciando, desta forma no crescimento das plantas in vitro. Esse efeito se deve possivelmente a redução da capacidade de absorção de água e de nutrientes do meio de cultura pelas plantas (LEMOS et al. 2002).
14 A técnica mais utilizada para a conservação in vitro de mandioca tem sido o cultivo de ápices caulinares, que consiste no meristema apical associado a primórdios foliares (IITA, 2007; SOUZA et al., 2009). Entretanto, apesar da existência de metodologias de conservação in vitro para mandioca, a dependência genotípica de vários acessos, demanda estudos na direção de protocolos que possam ser eficientes para um maior número de genótipos facilitando a gestão e favorecendo maior estabilidade genética do que está sendo conservado. Criopr eser vação O processo de conservação de material biológico em nitrogênio líquido (­196ºC) é chamado de criopreservação. Esta técnica apresenta como principal vantagem o longo tempo de armazenamento sem a necessidade de subcultivos, que demandam tempo, mão de obra, além de ocorrer o risco de contaminação (SIMIONE, 2013). Com a parada quase total do metabolismo, explantes podem ficar estocados por período indeterminado, mantendo, entretanto, a integridade celular, o que torna essa forma de conservação atrativa e relativamente de baixo custo (BENSON, 2008). As técnicas de criopreservação vêm sendo utilizadas para diferentes tipos de propágulos, como sementes, calos, meristemas apicais, grãos de pólen e embriões somáticos. Entretanto a utilização desta tecnologia na preservação de germoplasma vegetal ainda é limitada (PANIS; LAMBARDI, 2005; SILVA et al., 2011; SARTOR et al., 2012) e o uso sistemático desta estratégia de conservação ainda demanda pesquisas e ajustes de fatores, considerados limitantes. Um dos aspectos mais problemáticos é o elevado nível de especificidade no comportamento das espécies quando submetidas às condições de ultracongelamento, criando uma genótipo­dependência no desenvolvimento de protocolos (ENGELMANN; TARAGI, 2000), similar ao que ocorre com a conservação in vitro. O processo de congelamento de explantes envolve fenômenos complexos, não sendo totalmente compreendido mesmo após anos de pesquisa. A taxa de sobrevivência de explantes após o congelamento está associada principalmente a fisiologia, teor de água nas células e a utilização de crioprotetores (BENSON, 2008). A elevada quantidade de água na célula pode provocar a formação de cristais de gelo durante os processos de congelamento e descongelamento, afetando estruturas, integridade coligativa e osmótica das células o que resulta em rupturas físicas e injurias mecânicas, que são letais (BENSON, 2008;SIMIONE, 2013). Em vista disso o uso de crioprotetores se faz
15 necessário para a proteção de estruturas celulares, principalmente as membranas, a fim de se obter êxito ao final do processo de criogenia. Os crioprotetores mais utilizados são o dimetilsulfoxide (DMSO), o glicerol e a sacarose (SIMIONE, 2013). Este último, além da proteção, atua oferecendo energia e pressão osmótica (YILDIZ et al., 2000). Nas técnicas clássicas de criopreservação de tecidos vegetais o congelamento das estruturas era realizado forma lenta, envolvendo as seguintes etapas: pré­cultivo das amostras, crioproteção, congelamento lento (0,5 – 2.0ºC por minuto) até uma temperatura preestabelecida (­40ºC), rápida imersão das amostras em nitrogênio líquido, armazenamento, descongelamento e regeneração (ENGELMANN, 2004). Enquanto que as técnicas de criopreservação modernas são fundamentadasna desidratação celular e vitrificação. A vitrificação é a transição da fase líquida da água para uma fase amorfa ou vítrea, não ocorrendo formação de gelo neste estado (ENGELMANN; DUSSERT, 2013). Os métodos de criopreservação mais utilizados são o encapsulamento­desidratação, encapsulamento­vitrificação e a vitrificação em gotas, conhecida comodroplet­vitrification. O encapsulamento­desidratação é uma técnica desenvolvida para produção de sementes artificiais ou sintéticas, mas vem sendo testado também para tecidos vegetais. Os explantes são encapsulados em solução de alginato de sódio, com crescimento prévio em meio líquido enriquecido com sacarose num intervalo de um a sete dias, parcialmente desidratado em sílica gel ou câmara de fluxo laminar, e submerso em nitrogênio líquido rapidamente. Já na técnica de encapsulamento­vitrificação, após o encapsulamento dos explantes, as amostras são submetidas a uma série de tratamentos. Primeiramente são expostas a uma solução de osmoproteção (geralmente 2 M glicerol + 0,4 M sacarose), e em seguida são desidratados em soluções de vitrificação altamente concentradas. A mais comumente utilizada é a de PVS2, Plant Vitrification Solution. Após essa etapa, as amostras são colocadas em criotubos e submersas em nitrogênio líquido. No método conhecido como droplet­vitrification (vitrificação em gotas), os explantes são pré­cultivados por um a sete dias, com ou sem osmoproteção e expostos diretamente em gotas de solução PVS2 por tempos variáveis, em laminas de alumínio, seguido da imersão em nitrogênio líquido rapidamente (SAKAI et al., 2008, ENGELMANN, et al 2008). Bons resultados após o congelamento em nitrogênio líquido têm sido mostrados para mais de 70 espécies de plantas mediante o uso de diversos materiais, tais como células em suspensões, protoplastos, calos, meristemas e embriões (REED, 2008). Alguns tipos de
16 explantes como pólen e sementes ortodoxas podem ser criopreservados sem nenhum tratamento prévio. No entanto a maioria dos materiais biológicos, como suspensões celulares, calos, meristemas apicais e embriões contêm elevadas quantidades de água intracelular e necessitam, portanto, ser desidratados para evitar danos provocados pela formação de cristais de gelo intracelular. A tolerância à desidratação é, sem dúvida, a etapa mais limitante de todo o processo de criogenia (ENGELMANN, 2004). Criopr eser vação de pólen O uso do pólen de espécies silvestres em hibridizações interespecíficas é um método comumente utilizado na transferência de genes entre espécies (JUNQUEIRA et al., 2008, FALEIRO et al., 2007). Devido à assincronia de florescimento no campo, trabalhos com objetivo de conservar grãos de pólen são de fundamental importância em muitos programas de melhoramento genético e para mandioca não é diferente. A criopreservação é um método eficiente para conservação de pólen de várias espécies (GANESHAN et al., 2008), podendo este ficar armazenado por tempo indeterminado. O sucesso da preservação do pólen depende principalmente de fatores como o estádio fisiológico da flor, a temperatura e umidade relativa do ambiente de armazenamento, e do grau de umidade do grão de pólen (GIORDANO et al., 2003). O teor de umidade no grão de pólen é determinante para sua sobrevivência e para a manutenção de sua viabilidade após o congelamento, mas a formação de cristais pode se constituir em um problema, à semelhança do que acontece com tecidos vegetais. Dessa forma, estimar o teor de umidade ideal para possibilitar a criopreservação, mas manter a viabilidade polínica pós­congelamento, é um dos grandes desafios na conservação de pólen por essa estratégia. Fica evidente a necessidade de cuidados especiais na etapa de desidratação (FRANÇA, 2008). No caso de mandioca, não existem dados que evidenciem os teores ideais de umidade em grãos de pólen, principalmente em acessos silvestres. Existem diversos trabalhos envolvendo a criopreservação de pólen em diferentes espécies (GANESHAN, 1986; MARCHANT, 1993; GANESHAN, 2008), mas nenhum registro para mandioca. Uma das condições necessárias para os trabalhos relacionados à conservação de pólen é a necessidade de um método confiável para a avaliação da viabilidade polínica após a conservação. Os métodos mais aplicados para estimar a percentagem de pólen viável são os testes colorimétricos, a germinação in vitro e in vivo, e o método de reação fluorocromática
17 (Fluorochromatic Reaction ­ FCR) (MARCELLÁN; CAMADRO, 1996; GEETHA et al., 2004; CUCHIARA et al., 2012). De uma forma geral, os testes colorimétricos superestimam os resultados e nem sempre correspondem à realidade e por isso precisam ser avaliados de forma mais criteriosa. A germinação in vitro, por outro lado, vem sendo largamente utilizada, por sua facilidade, bons resultados e confiabilidade. Entretanto, a germinação in vitro de polén de mandioca tem apresentado resultados pífios e outros métodos precisam ser desenvolvidos (MBAHE et al., 1994; VIEIRA, 2010). Finalmente, apesar da importância da espécie, principalmente na alimentação das populações mais carentes e da rusticidade do cultivo, existe uma demanda real para a melhoria da mandioca cultivada, não somente na qualidade nutricional da raiz, mas no que concerne ao cultivo propriamente dito. Em vista do exposto esse trabalho teve como objetivo a realização de estudos que possam subsidiar e tornar mais eficiente à conservação in vitro e a criopreservação de meristemas e pólen de espécies do gênero Manihot, como estratégias auxiliares à conservação do germoplasma e ao melhoramento genético da cultura. REFERENCIAS BIBLIOGRÁFICAS ADEYEMO, S. Molecular genetic characterization of photoperiodic genes in cassava (Manihot esculenta Crantz) and attempts to manipulate their expression to promote floral induction.2009. 133f. Tese (Doutorado em Ciências Naturais) ­ Universität zu Köln,Köln. ALLEM, A.C. The origin of Manihot esculenta Crantz (Euphorbiaceae).Genetic Resources and Crop Evolution ,v. 41,n. 3,pp 133­150, 1994. ALVES, A.A.C. Potencial de utilização de espécies silvestres de mandioca como fonte de resistência a estresses bióticos e abióticos. 2006. Disponível em: http:<//www.cnpmf.embrapa.br/projetos/projeto_mandsilvestre.pdf>. Acesso em:02 julho 2013. ALVES, A.A.C.; LEDO, C.A.S.; COSTA, I.R.S.; MENDES, R.A.; CARVALHO, P.C.L.; SILVA, A.F. Situação atual e utilização do germoplasma de espécies silvestres de Manihot da Embrapa Mandioca e Fruticultura Tropical (CNPMF). In: CONGRESSO BRASILEIRO DE RECURSOS GENÉTICOS, 2010, Salvador, Anais... Brasília, DF: Embrapa Recursos Genéticos e Biotecnologia, 2010. 1 CD­ROM (Embrapa Recursos Genéticos e
18 Biotecnologia.Documentos, 304). ANKITA, P.; ANIMESH, S. Effects of mannitol, sorbitol and sucrose on growth inhibition and in vitro conservation of germplasm of Asparagus racemosus ­An important medicinal plant.Medicinal Plants ­ International Journal of Phytomedicines and Related Industries, v.5. p. 71­74. 2013. BENSON, E. Cryopreservation Theory. In: REED, B. M. (Org). Plant Cryopreservation: A Practical Guide. Corvallis: Springer, 2008. p.15­32. CARVALHO, R.; GUERRA, M. Cytogenetics of Manihot esculenta Crantz (cassava) and eight related species.Hereditas, n.136, p. 159­168. 2002. CEBALLOS, H. et al. Mejoramiento Genetico de la Yuca. In: CEBALLOS, H.(Org). La yuca en el tercer milenio: sistemas modernos de produccion, processamiento, utilization y commercializacion . Cali: CIAT, p. 295­325. 2002. CHAVARRIAGA­AGUIRRE, P.; MALSEY, M. Cassava (M. esculenta Crantz):Reproductive biology and practices for confinement of experimental field trials:Program for Biosafety Systems. International Food Policy Research Institute 2005. Crop Science,v. 48, p. 49­58, 2008. CHICHERCHIO, C. L. da S. CONAP – Companhia Nacional de Abastecimento. Mandioca – Raiz, farinha e fécula: período de 4 a 8/3/2013. Disponível em:<http://www.conab.gov.br/OlalaCMS/uploads/arquivos/13_03_13_14_03_50_mandioca0 4a080313.pdf>. Acesso em: 12 julho 2013. CUCHIARA, C.et al. Conservação de grãos de pólen de mamoneira a baixas temperaturas. Revista Ceres, v. 59, n.1, p. 82­87. 2012. DOMÍNGUEZ, E.C.; CEBALLOS, L.F.; FUENTES, C. Morfologia de la planta deyuca. In: DOMÍNGUEZ, C.E. (Org.) Yuca: investigation, production y utilization. Cali: CIAT, p.29­ 49.1984. ENGELMANN, F.; TAKAGI, H. Cryopreservation of tropical plant germplasm.Current research progress and application.Japan International Research Center for Agricultural Sciences, Tsukuba, Japan/International Plant Genetic Resources Institute, Rome, p. 496. 2000. ENGELMANN, F. Plant cryopreservation: progress and prospects. In Vitro Cell, v. 40, p. 427­433. 2004. ENGELMANN, F. et al.The development of encapsulation dehydration.In. REED, BM (Org.).Plant cryopreservation: A practical guide. Spriger: New York, p. 59­75.2008.
19 FARIA, G. A.et al. Efeito da sacarose e sorbitol na conservação in vitro de Passiflora giberti N. E. Brown. Revista Brasileira de Fruticultura , v. 28, n. 2, p. 267­270. 2006. ENGELMANN, F.; DUSSERT, S..Cryopreservation. In:.NORMAH, M. (Org).Conservation of tropical plant species.New York: Springer, 2013. p. 107­119. FALEIRO, F.G.et al. Cruzamentos inter­específicos e retrocruzamentos visando à resistência do maracujazeiro a doenças. Disponível em: <http://www.cpac.embrapa.br/publico/usuarios/uploads/arquivos_maracuja/artigos_completos /2_15.pdf>. Acesso em:05 março 2013. FRANÇA, L.V. Secagem e conservação de grãos de pólen de berinjela . 2008. 93f. Dissertação (Mestrado em Ciências Agrárias) ­ Universidade de Brasília. Faculdade de Ciências Agrárias. Brasília. FUKUDA, W.G. et al. Variabilidade genética e melhoramento da mandioca (Manihot esculenta Crantz). Recursos Genéticos e Melhoramento de Plantas para o Nordeste Brasileiro. 1999. Disponível em: <http://www.cpatsa.embrapa.br:8080/catalogo/livrorg/mandioca.pdf>. Acesso em:15 julho de 2013. FUKUDA, W.M.G.; SILVA, S.O. IGLESIAS, C. Breeding cassava. Crop Breeding and Applied Biotechnology, v. 2, n. 4, p. 617­638, 2002 GANESHAN, S. Cryogenic preservation of papaya pollen.Scientia Horticulturae,v. 28, n.1­2, p. 65–70.1986. GANESHAN, S. et al. W. Cryopreservation of pollen. In: REED B. M. (Org), PlantCryopreservation– A practical Guide. New York: Springer, p. 443­447. 2008. GEETHA, K.; VIJAYABASKARAN, S.; JAYARAMAN, N.In vitro studies on pollen germination and pollen tube growth in maize. Food, Agriculture, Environment, v. 2, p. 205­ 207. 2004. GIORDANO, L.B. ARAGÃO, F.A.S., BOITEUX, L.S. Melhoramento genético do tomateiro.Informe Agropecuário, v. 24, n.219, p. 43­57. 2003. GOPAL, J.; CHAUHAN, N.S., Slow growth in vitro conservation of potato germplasm at low temperature.Potato Research ,v. 53, n.3, p141–149.2010. HASSAN, N.A., BEKHEET, S.A. Mid­term storage and genetic stability of strawberry tissue cultures.Research Journal of Agriculture and Biological Sciences, v. 4, n. 5, p. 505–511.2008. INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA ­ IBGE. Estatística da Produção agrícola . 2012. Disponível em:
20 <http://www.ibge.gov.br/home/estatistica/indicadores/agropecuaria/lspa/lspa_201302comenta rios.pdf>. Acesso em: 07 março 2013. IITA. Cassava in vitro processing and gene banking. IITA Genebank series, p. 35. 2007. JUNQUEIRA, K.P.et al. Confirmação de híbridos interespecíficos artificiais no gênero passiflora por meio de marcadores RAPD. Revista Brasileira de Fruticultura , v. 30, n. 1, p. 191­196. 2008. KADOTA, M.; IMIZU, K.; HIRANO, T. Doublé­phase in vitro culture using sorbitol increase ahoot proliferation and hyperhydricity in Japanese pear. Scientia Horticulturae, v. 89, p.207­ 210. 2001. LEDO, C.A.S.; SILVEIRA, T.C.S.; CARVALHO, P.C.L.; MARTINS, M.L.L.; TAVARES FILHO, L.F.Q. Coleta e Conservação de Germoplasma de Espécies Silvestres de Manihot no Estado da Bahia para Ampliação da Coleção de Trabalho da Embrapa Mandioca e Fruticultura. Cruz das Almas: Embrapa Mandioca e Fruticultura, 2010. 5p. (Embrapa Mandioca e Fruticultura. Comunicado Técnico, 146). LEMOS, E.E.P.; FERREIRA, M.S.; ALENCAR, L.M.C.; NETO, C.E.R.; ALBUQUERQUE, M.M. Conser vação in vitro de ger moplasma de cana­de­açúcar . Pesquisa Agropecuária Brasileira , v. 37, n. 10, p. 1359­1364. 2002 MARCELLÁN, O.N.; CAMADRO, E.L. The viability of asparagus pollen after storage at low temperatures. Scientia Horticulturae, n.67, p.101­104, 1996. MARCHANT, R. et al. Cryopreservation of pollen from two rose cultivars. Euphytica , v. 66,n. 3, p 235­241. 1993. MBAHE, R. E., AKEN'OVA, M. E; HAHN, S. K. Germination of cassava (Manihot esculenta Crantz) pollen. Acta Horticulturae, p. 172­177. 1994. MORO, A.L. Obtenção de massa de mandioca com adição de maltodextrina de amido de milho waxy.2009. 65f.Dissertação (Mestrado em Ciências Agronômicas) Universidade Estadual Paulista “Júlio de Mesquita Filho”. Botucatu. NASSAR, N.M.A. Genetic resources of cassava: 4‑chromosome behavior in some wild Manihot species. Indian Journal of Genetics and Plant Breeding, v.38, p.135‑137. 1978. NASSAR, N.M.A.; SILVA, J.R.; VIEIRA, C. Hibridação interespecífica entre mandioca e espécies silvestres de Manihot. Ciência e Cultura , n. 38, p. 1058­1065. 1986. NASSAR, N.M.A. Broadening the genetic base of cassava, Manihot esculenta Crantz, by interespecific hybridization. Canadian Journal Plant Science, n. 61, p. 1071­1073. 1989.
21 NASSAR, N.M.A.; Selvagens da mandioca, Manihotspp.:Biologia e potencialidades para o melhoramento genético. Genetic and Molecular Biology, v. 23, n.1, p. 201­212, 2000. NASSAR, N.M.A. Mandioca: Uma opção contra a fome estudos e lições do Brasil e do mundo. Ciência Hoje, v. 39, n. 231, p. 31­34. 2006. NASSAR, N.M.A. et al. Manihot fortalezensis Nassar, Ribeiro, Bonfim et Gomes a new species of Manihot from Ceará, Brazil. Genetic Resources Crop Evolution, v. 58, p. 831­835. 2011. OLSEN, K.M.; SCHAAL, B.A. Evidence on the origin of cassava: Phylogeography of Manihot esculenta. Proc. Natl. Acad. Sci. USA. v. 96, p. 5586–5591. 1999. OREGO, K.O.; GITONGA, N.M. MWANGI, M. OMBORI, O. NGUGI, M. Cost­effective nutrient sources for tissue culture of cassava (Manihot esculenta Crantz). African Journal of Biotechnology, v. 11, n. 66, p. 12964­12973. 2012. PANIS, B.; M. LAMBARDI. Status of cryopreservation technologiesin plants (crops and forest trees).In The Role of Biotechnology for the Characterization and Conservation of Crop, Forest, Animal and Fishery Genetic Resources in Developing Countries.Eds. FAO. Turin, Italy, p 43–54. 2005. PEREIRA, D.M.et al. Micropropagação de acessos de mandioca integrantes da coleção da fundação estadual de pesquisa agropecuária (FEPAGRO­ RS). 2007. Disponível em:<http://www.cpact.embrapa.br/publicacoes/download/livro/Agroenergia_2007/Agroener/t rabalhos/Outras%20culturas_11_OK/Pereira_1.pdf>. Acesso em: 27 março 2013. REED, B. M. Plant Cryopreservation: A Practical Guide. New York, NY: Springer. 515 pp. 2008. REED, B.M.; GUPTA, S.; UCHENDU, E.E.In vitro genebanks for preserving tropical biodiversity.NORMAH, M.N.; CHIN, H.F.; REED, B.M. (Org.)Conservation of tropical plant species.Springer. New York. P. 77­106. 2013. ROGERS, D.; APPAN, C.Manihot and Manihotoides (Euphorbiaceae): a computed assisted study.Flora Neotropica. (Monograph nº 13) Hafner Press, New York, NY, USA. 1973. ROGER, D. Bulletin of the Torrey Botanical Club, v. 90, n.1, p 43­54. 1963. SAKAI, A; HIRAI, D.; NIINO, T. Development of PVS based vitrification and encapsulation­vitrification protocols. In: Reed B.M.(Org.) Plant Cryopreservation: a practical guide. pp. 33­57.2008. SANTOS, M.C.et al . Efeito da sacarose e do sorbitol na conservação in vitro de segmentos nodais de mangabeira.Revista Ciência Agronomia , v. 42, n. 3, p. 735­741. 2011.
22 SANTOS, T.C.; ARRIGONI­BLANK, M.F.; BLANK, A.F. Propagação e conservação in vitro de vetiver.Horticultura Brasileira , v. 30, n. 3, p. 507­513. 2012. SILVA, R.M. BANDEL, G. FARALDO, M.I.F.; MARTINS, P.S. Biologia reprodutiva de etnovariedades de mandioca.Scientia Agricola , v. 58, n.1, p. 101­107. 2001. SILVA, R.C.et al. Potencial germinativo e morfoanatomia foliar de plântulas de pinhão-manso originadas de germoplasma criopreservado. Pesquisa Agropecuária Brasileira , v.46, n.8, p.836­844. 2011. SIMIONE, F.P. Thermo Scientific Nalgene and Nunc Cryopreservation Guide.2013. Disponível em: <http://www.atcc.org/~/media/PDFs/Cryopreservation_Technical_Manual.ashx>. Acesso em: 01 julho 2013. SOUZA, A.S. et al. Estabelecimento in vitro do banco ativo de germoplasma de citros da Embrapa Mandioca e Fruticultura. Circular Técnica 103. 2009. Disponível em: <http://www.cnpmf.embrapa.br/publicacoes/circulares/circular_103.pdf>. Acesso em: 04 julho 2013. VASCONCELOS, A.G.V.; TOMAS, L.F.; CAMARA, T.R.; WILLADINO, L. Hiperidricidade: uma desordem metabólica. Ciência Rural, v.42, n. 5, p. 837­844. 2012. VIEIRA, L.J. Uso de recursos genéticos do gênero Manihot no pré­Melhoramento genético de mandioca. 2010. 65f. Dissertação (Mestrado em Recursos Genéticos Vegetais). – Universidade Federal do Recôncavo da Bahia. Cruz das Almas. VIEIRA, L. J.; SOARES, T. L.; ROSSI, M. L.; ALVES, A. A. C.; SANTOS, F. A. R., SOUZA, F. V. D. Viability, production and morphology of pollen grains for different species in the genus Manihot (Euphorbiaceae). Acta Botanica Brasilica . v. 26. n. 2. p. 340­ 356. 2012. YILDIZ, C.; A. KAYA, M. AKSOY; T. TEKELI. Influence of sugar supplementation of the extender on motility, viability and acrosomal integrity of dog spermatozoa duringfreezing. Theriogenol,v. 54, p. 579­585, 2000.
23 CAPÍTULO 1 Efeito da sacarose, manitol e sor bitol na conser vação in vitro de mandioca
24 RESUMO A conservação in vitro de mandioca possui papel relevante como estratégia auxiliar e duplicata de segurança para a conservação e melhoramento genético da espécie. O objetivo deste trabalho foi avaliar o efeito da sacarose como fonte de carbono e dos reguladores osmóticos manitol e sorbitol na redução do crescimento in vitro de plantas de mandioca visando maior eficiência na conservação in vitro do germoplasma desta espécie. Foram utilizados microestacas de mandioca oriundas de acessos de mandioca do BAG da Embrapa Mandioca e Fruticultura em três experimentos distintos. O primeiro constou na avaliação de cinco concentrações de sacarose (0, 14,61; 29,22; 43,84; 58,45 mM) nos BGMs 264, 265, 1037 e 1282; enquanto que no segundo e terceiro foi utilizado o acesso BGM 1282 e concentrações combinadas de sacarose (0 e 58 mM) com 0; 2,75; 6,86; 13,73 e 27,45 mM de manitol ou sorbitol. Foram avaliadas as seguintes variáveis: altura da planta (cm); número de folhas total; número de folhas senescentes; número de microestacas e número de raízes. Com base nas variáveis avaliadas no final dos experimentos, os melhores resultados para conservação in vitro no primeiro experimento foram observados na concentração de 58,45 mM de sacarose. Enquanto que no segundo e no terceiro experimentos a concentração de 27,45 mM de manitol ou sorbitol apresentaram os melhores resultados. Palavras­chave: Conservação de germoplasma. Cultura de tecidos. Manihot esculenta Crantz. Recursos genéticos.
25 ABSTRACT The in vitro conservation of cassava is an auxiliary strategy and duplicated security for the conservation and breeding of the species. The aim of this study was to evaluate the effect of sucrose, mannitol and sorbitol osmotic regulators in reducing the in vitro growth of cassava plants seeking greater efficiency in vitro conservation of this species. Micro­cuttings were used cassava originated from BAG Embrapa Cassava and Fruits in three separate experiments. The first consisted in the evaluation of five different concentrations of sucrose (0, 14.61, 29.22, 43.84, 58.45 mM) BGMs 264, 265, 1037 and 1282, while the second and third access was used 1282 BGM and combined concentrations of sucrose (0 to 58 mM) with 0, 2.75, 6.86, 13.73 and 27.45 mM mannitol or sorbitol. The following variables were evaluated: plant height (cm), number of total sheets, number of senescent leaves, number of micro­cutting and number of roots. Based on the variables evaluated at the end of the experiments, the best results for in vitro conservation in the first experiment were observed in the concentration of sucrose 58.45 mM. While the second and third experiments the concentration of 27.45 mM mannitol or sorbitol showed the best results. Keywor ds: Germplasm conservation. Tissue culture.Manihot esculenta Crantz.Genetic Resources.
26 1.1 INTRODUÇÃO A cultura da mandioca (Manihot esculenta Crantz) apresenta uma ampla diversidade genética concentrada principalmente na América Latina, Caribe e México. Hershey (1994) estimou cerca de 7000 variedades de mandioca cultivada distribuídas por todo o mundo. Essa variabilidade genética é decorrentedo processo de seleção e domesticação em diversos ambientes distintos, o que resultou numa ampla diversidade de clones, com adaptação específica a determinados ecossistemas (HERSHEY, 1988). A diversidade genética de mandioca existente no Brasil representa uma ampla base genética para programasde melhoramento com a cultura nos trópicos, por concentrar genes que conferem resistência às principais pragas e doenças que afetam o cultivo, além de adaptação a diferentes condições edafo­climáticas (ALBUQUERQUE et al., 2009, SIQUEIRA et al., 2010). Entretanto, a erosão genética em mandioca provocada principalmente por estresses bióticos e abióticos a que estão sujeitas as plantas em seu habitat natural, à expansão de novas fronteiras agrícolas, e pela substituição das variedades tradicionais por novas variedades melhoradasé uma realidade que não deve ser ignorada e coloca em riscoas ações presentes e futuras para o melhoramento genético da cultura(FUKUDA et al., 2005, RIVAL; MCKEY, 2008).A demanda, portanto, por ações voltadas para a conservação desse germoplasma, seja da espécie cultivada, como das espécies silvestres, cresce a cada dia. Entretanto, a conservação de mandioca em campo apresenta como principais desvantagens a lentidão do processo de multiplicação, dissiminação de doenças transmitidas por meio de gerações sucessivas, demanda por áreas extensas, mão de obra elevada e um grande índice de perdas em campo provocadas por estresses causados por fatores abióticos e/ou bióticos. (SCOBAR et al., 1997; OLIVEIRA et al., 2000). Diante disso, a conservação de germoplasma de mandioca no campo deve ser complementada com uma duplicata de segurança, dessa forma garantindo a manutenção da diversidade genética das espécies cultivadas e silvestres. A conservação in vitro consiste na manutenção de plantas micropropagadas em condições de crescimento mínimo por meio da intervenção de diferentes fatores do cultivo, como temperatura, radiação fotossintética ativa, fotoperíodo, e adição de retardantes osmóticos e hormonais ao meio de cultura (CANTO et al., 2004), prolongando, dessa forma, o intervalo entre os subcultivos e reduzindo assim a necessidade de mão de obra e de
27 reagentes e, consequentemente, diminuindo os riscos de eventuais contaminações fúngicas e/ou bacterianas (LEMOS et al. 2002), assim como o surgimento de variação somaclonal,decorrentes da excessiva manipulação do tecido vegetal (SANTOS, 2008; SOUZA et al. 2009). Dessa forma a redução do metabolismo e o estabelecimento de condições de crescimento mínimo, mantendo a planta saudável e com capacidade de sobreviver, são os principais objetivos em trabalhos de conservação in vitro. Plantas mantidas in vitro não realizam fotossíntese o suficiente para suprir sua necessidade energética. Assim, uma fonte de carbono deve ser adicionada no meio de cultivo para garantir o desenvolvimento dos explantes. A sacarose é o açúcar mais utilizado em meio nutritivos por ser facilmente metabolizado por diversas espécies (DE CONTI et al., 2011), e a redução da quantidade deste carboidrato no meio de cultivo resulta no menor crescimento do explante. O manitol e o sorbitol são açúcares alcoólicos utilizados para alterar as condições osmóticas, proteger as membranas das baixas temperaturas e reduzir a hiperidricidade evitando a vitrificação (KADOTA, 2001; FARIA et al, 2006). Estes agentes atuam gerando um estresse hídrico pelo aumento da concentração osmótica do meio, influenciando, desta forma no crescimento das plantas in vitro. Esse efeito se deve possivelmente, a redução da capacidade de absorção de água e de nutrientes do meio de cultivo pelas plantas (LEMOS et al., 2002; PEREIRA NETO; OTONI, 2003). Por outro lado, nos estudos de conservação in vitro, geralmente são utilizados métodosestatísticos univariados para avaliar a eficiência dos tratamentos testados. No entanto, o estudo das variáveis isoladamente poderá não ser suficiente para modelar o fenômeno biológico em questão, uma vez que se perdem importantes informações ao se desconsiderarem as correlações existentes entre as variáveis. Dessa forma, a análise multivariada que corresponde a um grande número de métodos e técnicas que utilizam, simultaneamente, todas as variáveis na interpretação teórica do conjunto de dados obtidos (NETO, 2004), torna­se muito importante, porque avalia simultaneamente um conjunto de características, levando em consideração as correlações existentes entre elas, o que permite que inferências sobre o conjunto de características sejam feitas em um nível de significância conhecido (JOHNSON; WICHERN, 1992). Segundo Hair et al. (2005) a análise multivariada de variância (MANOVA) é uma técnica estatística que pode ser usada para explorar simultaneamente as relações entre
28 diversas variáveis independentes categóricas (geralmente chamadas de tratamentos) e duas ou mais variáveis dependentes métricas, representando uma extensão da análise de variância univariada (ANOVA). Entretanto, a utilização de técnicas de análise multivariada tem sido pouco aproveitada em estudos envolvendo a conservação in vitro, principalmente devido à complexidade de seus cálculos. Diante do exposto, o objetivo deste trabalho foi avaliar o efeito da sacarose como fonte de carbono e dos reguladores osmóticos manitol e sorbitol na redução do crescimento in vitro de plantas de mandioca, assim como ajustar procedimentos uni e multivariados visando maior eficiência nos estudos sobre a conservação in vitro do germoplasma de mandioca. 1.2 MATERIAL E MÉTODOS 1.2.1Mater ial vegetal Para o desenvolvimento deste trabalho foram selecionadas quatro cultivares de mandioca oriundas de diferentes regiões do Brasil e conservadas em condições de campo no Banco Ativo de Germoplasma da Embrapa Mandioca e Fruticultura, Cruz das Almas, BA. Os acessos e respectivos códigos do Banco de Germoplasma de Mandioca (BGM), nome vulgar, procedência e local de coleta são descritos na Tabela 1. Tabela 1. Relação de acessos de mandioca, nome comum, precedência e local de coleta. Acessos Nome vulgar Pr ocedência L ocal de coleta BGM 264 Cigana EAUFBA Amargosa­BA, Brasil BGM 265 Panguá IPEAL Santa Teresinha­BA, Brasil BGM 1037 Casco de Burro CENARGEN Aurora do Norte­TO, Brasil BGM 1282 Cacaxeira­Cara CENARGEN/CNPMF Ouricuri­PE, Brasil Fonte: www.cnpmf.embrapa.br/planilhas/bag_man.xls 1.2.2Estabelecimento das plantas in vitro Como explante inicial para os experimentos de conservação foram utilizadas plantas dos acessos da Tabela 1 após sua introdução in vitro. Meristemas excisados de plantas mantidas em casa de vegetação foram desinfestados e inoculados em meio 4S contendo os sais do MS (MURASHIGE; SKOOG, 1962), suplementado com 1 mg L ­1 de tiamina, 100 mg L ­1 de inositol, 0,02 mg L ­1 de ANA (ácido naftalenoacético), 0,04 mg L ­1 de BAP (benzilaminopurina), 0,05 mg L ­1 de GA3 (ácido giberélico), 20 g L ­1 de sacarose, solidificado com 2,4 g L ­1 de Phytagel ® e pH ajustado em 5,8, sob condições de temperatura de 27 ± 1ºC, fotoperíodo de 16 horas e densidade de fluxo de fótons 30 µmol m ­2 s ­1 por 30 dias (fase de
29 estabelecimento).A fase de multiplicação foi realizada em três subcultivos com intervalos de 45 dias utilizando­se como explantes, microestacas de 1,0 cm inoculadas em, meio 17N (CIAT, 1984) composto por 1/3 dos macro e micronutrientes do MS, suplementado com 0,35 mg L ­1 de tiamina, 35 mg L ­1 de inositol, 0,01 mg L ­1 de ANA, 0,01 mg L ­1 de BAP, 0,01 mg L ­1 de GA3, 20 g L ­1 de sacarose e 2,4 g L ­1 de Phytagel ® , de pH 5,8. As condições de incubação foram em sala de crescimento com fotoperíodo de 16 horas, temperatura de 26± 1°C e densidade de fluxo de fótons de 30 μmol.m ­2 s ­1 . 1.2.3Conser vação in vitro Microestacas de 1,0 cm oriundas das plantas obtidas na etapa anterior foram inoculadas em meio de cultura básico “8S”, desenvolvido no Centro Internacional de Agricultura Tropical – CIAT, Cali, Colômbia (CIAT, 1984) e que se constituiu dos sais minerais e vitaminas do “MS”, suplementado com ácido naftalenoacético – ANA (0,01 mgL ­ 1 ), 6­benzilaminopurina – BAP (0,02 mg L ­1 ), ácido giberélico – AG3(0,1 mg L ­1 ) e pH ajustado entre 5,7 ­ 5,8, solidificado com 2 gL ­1 de Phytagel ® . As plantas foram armazenadas em sala de crescimento lento com temperatura de aproximadamente 22°C, fotoperíodo de 12 horas e densidade de fluxo de fótons de 30 µmol m ­2 s ­1 . As concentrações utilizadas de sacarose, manitol e sorbitol foram com base nos resultados obtidos por Macia (2011), tendo­ se realizado três experimentos separadamente descritos a seguir: 1.2.3.1 Experimento 1. Efeito de diferentes concentrações de sacarose na redução do metabolismo de plantas de mandiocain vitro . Para avaliar o efeito da sacarose foram utilizadas quatro concentrações diferentes deste açúcar e um tratamento controle que se constituiu na ausência de sacarose no meio de cultivo. As concentrações avaliadas foram as seguintes: 14,61 mM; 29,22 mM; 43,84 mM; 58,45 mM. Foram realizadas avaliações 30, 60, 120 e 330 dias após incubação. Após os 330 dias no meio de conservação, as plantas sobreviventes foram repicadas e cultivadas em meio de crescimento 17N. A viabilidade das plantas foi calculada mediante a taxa de regeneração (%) por acesso e tratamento. 1.2.3.2 Experimentos 2 e 3 . Efeito do manitol e sacarose (Exp.2) e do sorbitol e sacarose (Exp.3) na redução do metabolismo de plantas do acesso de mandioca BGM 1282 in vitro .
30 Para avaliação do efeito do manitol na conservação in vitro de mandioca, foram avaliadas duas condições de sacarose: ausência e 58,45 mM combinados ou com a ausência de manitol ou com quatro concentrações do açúcar: 2,75 mM; 6,86 mM; 13,73 mM e 27,45 mM. As avaliações foram realizadas aos 30, 180 e 270 dias após incubação. O experimento realizado com o agente sorbitol teve o mesmo delineamento descrito para o manitol e os períodos de avaliações foram 30, 60, 180 e 300 dias após incubação. 1.2.4Var iáveis analisadas Em todos os experimentos foram avaliadas as seguintes variáveis: altura das plantas (ALT) em cm, número de folhas total (NF), número de folhas senescentes (NFS), número de microestacas (NME), número de raízes (NR), comprimento de raiz (CR) em cm, tamanho do calo (TC) utilizando a escala 0 – ausente, 1 – pequeno, 2 – médio e 3 – grande e vigor (V), utilizando a escala 3 – plantas totalmente verde, 2 – planta pouco amarelada, 1 – planta muito amarelada e 0 – planta morta (Anexo 1). 1.2.5 Análise estatística Para o experimento 1 foi realizado análise de variância considerando o delineamento inteiramente casualizado em esquema de parcelas subdivididas no tempo. Nas parcelas foram considerados 4 acessos e 5 concentrações de sacarose e nas subparcelas foram consideradas os tempos de avaliação (30, 60, 120 e 330 dias após incubação) e suas respectivas interações com os fatores das parcelas. No experimento 2 considerou­se o delineamento inteiramente casualizado em esquema de parcelas subdivididas no tempo. Nas parcelas foram consideradas 2 concentrações de sacarose e 5 concentrações de manitol; e nas subparcelas os tempos de avaliação (30, 180 e 270 dias após incubação) e suas respectivas interações com os fatores das parcelas. Para o experimento 3 considerou­se o delineamento inteiramente casualizado em esquema de parcelas subdivididas no tempo. Nas parcelas foram consideradas as 2 concentrações de sacarose e as 5 concentrações de sorbitol; e nas subparcelas os tempos de avaliação (30, 60, 180 e 300 dias após incubação) e suas respectivas interações com os fatores das parcelas. Nos três experimentos foram utilizadas cinco repetições por tratamento, sendo cada uma composta por três plantas; a parcela experimental foi constituída por um tubo de ensaio contendo uma microestaca. Os dados das variáveis número de folha (NF), número de folhas senescentes (NFS), número de microestacas (NME) e número de raízes (NR) foram
31 transformados para (x+0,5) 1/2 visando atendimento das pressuposições da análise de variância. As análises de variância foram obtidas com o auxílio do programa computacional SAS ­ Statistical Analysis System (SAS Institute Inc., 2000). Foi também realizada análise de variância multivariada (MANOVA), para verificar o efeito dos tratamentos em relação às variáveis simultaneamente. A significância dos tratamentos foi testada pelo critério de Wilks, segundo Johnson e Wichern (1992). Com base na matriz de somas de quadrados e produtos obtidos na MANOVA, foram calculados os coeficientes de correlação parcial e realizado o diagnóstico de multicolinearidade segundo o critério de Montgomery e Peck (1981). Para o cálculo da contribuição relativa de cada variável na análise multivariada utilizou­se o critério de Singh (1981). Foi calculada a taxa de plantas regeneradas após cada período de avaliação. A equação de regressão dos resultados foi determinada com sistema operacional Microsoft Excel 2010. 1.3 RESULTADOS E DISCUSSÃO 1.3.1 Experimento1.Efeito de diferentes concentrações de sacarose na redução do metabolismo de plantas de mandiocain vitro . A análise de variância mostrou que houve os efeitos dos tratamentos de sacarose, acessos e tempo de avaliação sobre as variáveis avaliadas(Tabela 2), com resultados que mostram diferentes comportamentos a depender do tratamento e da variável considerada. Tabela 2.Resumo da análise de variância para altura (ALT),número de folhas (NF),número de folhas senescentes (NFS), tamanho de calo (TC); número de estacas (NME); número de raiz (NR); comprimento de raiz (CR) e vigor (V) nos acessos de mandioca BGM 264, BGM 265, BGM 1037 e BGM 1282. FV QM GL ALT NF NFS TC NME NR ACESSO 3 223,74** 23,41** 17,20** 4,29** 5,77** 9,87** SACAROSE 4 641,62** 43,26** 31,73** 3,40** 24,86** 28,76** CR ns 73,14 318,74** ns V 1,28 ns 0,18 ns 0,41 ns ACESSO*SAC 12 ERRO A 76 14,91 1,93 1,07 0,30 0,52 0,64 22,30 0,19 AVAL 4 468,71** 62,03** 116,36** 3,04** 20,90** 38,35** 224,34** 25,36** ERRO B 16 2,31 0,25 0,23 0,06 0,12 0,16 3,86 0,07 ACESSO*TEMPO 12 28,94** 1,41 ns 2,50** 0,08 ns 0,57** 1,03** 24,78** 0,27 ns SAC*TEMP 16 35,52** 2,25** 2,60** 0,06 ns 1,30** 3,13** 30,76** 0,13 ns ACESSO*SAC*TEM 127,84** 7,90** 5,62** 2,37** 4,44** 4,04** 57,47 ns 48 9,78** 0,94** 1,02** 0,12** 0,34** 0,51** 1054 4,00 0,44 0,32 0,05 0,14 0,25 5,91 0,08 CV (% ) 41,97 30,52 32,60 14,99 19,93 36,04 22,07 19,24 Média Geral 4,76 5,51 3,72 2,08 3,62 2,11 11,01 1,99 ERRO C 10,79 0,19** ns ** significativo a 1% de significância pelo teste F. não significativo a 5% de significância.
32 Na Tabela 3, o critério de Singh (1981) mostra que as variáveis que mais contribuíram para explicar o comportamento das plantas de mandioca nas condições estabelecidas foram o numero de folhas (NF) e número de folhas senescentes (NFS) com 36,52 e 33,62% respectivamente, enquanto variáveis como tamanho de calo (TC) e o vigor das plantas (V) tiveram baixa contribuição para explicar a variação observada, 0,66 e 0,22%, respectivamente. Esse tipo de análise permite a seleção das variáveis que efetivamente são importantes para os estudos de conservação in vitro,facilitando o manejo dos dados e análises subsequentes. Tabela 3. Contribuição relativa das variáveis para a diversidade segundo o critério de Singh (1981) para altura da planta (ALT), número de folhas (NF), número de folhas senescentes (NFS), tamanho de calo (TC), número de estacas (NME), número de raiz (NR) e vigor (V) nos acessos de mandioca BGM264, BGM265, BGM 1037 e BGM 1282 em função de diferentes concentrações de sacarose. Variável ALT Sij 6846,15 Sij (%) 7,12 NF NFS 35132,47 32344,24 36,52 33,62 TC NME 631,84 0,66 12385,41 12,87 NR V 8657,44 207,87 9,00 0,22 Por outro lado o coeficiente de correlação parcial, obtido por meio da análise multivariada (Tabela 4) e realizado com as variáveis consideradas mais importantes para o estudo (ALT, NF, NFS e NME) de acordo com o critério de Singh (1981) permitiu uma análise ainda mais detalhada. Tabela 4. Coeficiente de correlação parcial para altura (ALT), número de folhas (NF), número de folhas senescentes (NFS), número de estacas (NME) e número de raiz (NR) nos acesso de mandioca BGM264, BGM265, BGM 1037 e BGM 1282 em função de diferentes concentrações de sacarose. Variáveis NF NFS NME NR ALT 0,65** 0,62** 0,78** 0,52** 0,80** 0,79** 0,71** 0,59** 0,53** NF NFS NME ** significativo a 1% de significância pelo teste t.
0,57** 33 As correlações mais elevadas foram obtidas entre NF e NFS (0,80**), NF e NME (0,79**) e ALT e NME (0,78**), que envolvem variáveis de impacto para a conservação e que expressam o desenvolvimento das plantas nas condições estabelecidas. O coeficiente de correlação parcial mostra o quanto o comportamento de uma variável está relacionado com outra e em alguns casos permite a eliminação de uma delas, já que seu comportamento pode ser previsto pela outra. Em casos onde a aferição de determinada variável é trabalhosa ou pode ser destrutiva, a alta correlação com outra variável pode dispensar essas medições. O número de condição (NC) do diagnóstico de multicolinearidade foi de 51,54, considerada uma multicolinearidade fraca na matriz de correlação, segundo a classificação de Montgomery e Peck (1981), indicando a possibilidade de obtenção de uma estimativa confiável em termos biológicos. Nesse trabalho, NF, NFS e ALT apresentaram alta correlação com o número de microestacas (NME), o que facilita a avaliação dos resultados obtidos, uma vez que podem ser consideradas em conjunto para avaliar a eficiência dos tratamentos sobre a redução do metabolismo das plantas e sua posterior viabilidade. Essas variáveis são consideradas de alta relevância para os estudos de conservação de mandiocain vitro e as ferramentas estatísticas usadas nesse trabalho confirmaram essa importância. Uma vantagem da extensão multivariada, quando comparada com a metodologia univariada tradicional, é a possibilidade de se estimar a matriz de correlação parcial obtida a partir da matriz de soma de quadrado e produto do resíduo. A correlação parcial estabelece o grau de associação entre duas variáveis eliminando o efeito dos tratamentos. Ito e Schull (1964) e Korin (1972) observaram que os testes aplicados na análise de variância multivariada não são grandemente influenciados pela heterogeneidade das matrizes de variância e covariâncias quando o número de repetições é grande. Mardia (1971) concluiu que a análise de variância multivariada é robusta e a não normalidade a torna uma ferramenta mais indicada para os trabalhos de cultura de tecidos. Nesse estudo a eliminação de duas variáveis (TC e V) implica em uma redução significativa de trabalho a ser realizado, na busca por uma condição adequada que possa abrigar o maior número possível de acessos de mandioca in vitro, com um comportamento o mais padronizado possível. A relevância de uma variável para um determinado estudo vai depender da espécie em questão e do objetivo. Para a conservação de citros, por exemplo, o número de microestacas não é determinante, como comprovado pelos estudos feitos por Carvalho (2013). Já em mandioca essa variável é fundamental, pois na mesma planta várias microestacas são obtidas
34 e o incremento no número de microestacas vai depender do tratamento. A quebra da dominância apical in vitro em mandioca é bastante complicada e a multiplicação é dependente do número de microestacas. No cultivo in vitro de mandioca, Vidal (2009) encontrou uma correlação fortemente positiva (0,71**) e semelhante a obtida nesse trabalho (0,78**) entre altura das plantas e número de microestacas. Macia (2011) também sugere que essas duas variáveis podem apresentar uma boa correlação na conservação in vitro de mandioca. A interação entre os acessos e as diferentes concentrações de sacarose utilizadas foram altamente significativa para as variáveis ALT, NF, NFS, NME e NR. As regressões em razão das diferentes concentrações de sacarose se encontram na Figura 1. Figur a 1. Altura média das plantas (cm), número de folhas, número de folhas senescentes e número de estacas dos acessos de mandioca BGM 264, BGM 265, BGM 1037 e BGM 1282 em razão de diferentes concentrações de sacarose no meio ‘8S’ (CIAT, 1984).
35 A concentração da sacarose influenciou significativamente no desenvolvimento das plantas. Considerando as variáveis como um conjunto, de acordo com o indicado pela análise multivariada, observou­se que o comportamento dos acessos seguiu uma tendência exponencial até a concentração de 43,84 mM de sacarose a partir da qual se observa uma queda drástica para o BGM 265 em todas as variáveis analisadas. Isso pode ser devido a uma sensibilidade maior dessas plantas a maiores concentrações de sacarose, afetando a capacidade das mesmas de retirar água do meio de cultura. Os outros acessos apresentaram comportamento similar a partir dessa concentração com um leve decréscimo para a maioria das variáveis. A diferença de comportamento entre os quatro acessos aparece em todas as variáveis, com o BGM 1282 mostrando os menores valores para todas as variáveis apresentadas. Uma observação interessante é o comportamento similar de três acessos (BGM 264, BGM 265 e BGM 1282) nas variáveis ALT, NF, NFS e NME na concentração de 43,84 mM (15g L ­1 ). Esse é um resultado que poderia ser considerado interessante para a gestão de bancos de germoplasma in vitro, visto que uma das grandes dificuldades encontradas está exatamente nos diferentes comportamentos observados entre os genótipos conservados. Na Figura 2 se encontram as taxas de sobrevivência dos diferentes acessos nos tempos determinados de avaliação ao longo do cultivo, considerando todos os tratamentos de sacarose.
36 Figur a 2. Taxa de sobrevivência de acessos de mandioca (BGM 264, 265, 1037 e 1282) em diferentes concentrações de sacarose (0,00; 14,61; 29,22; 43,84 e 58,45 mM) após diferentes períodos de tempo. O BGM 264 inicia a perda de plantas a partir dos 120 dias de cultivo, independente da concentração de sacarose utilizada, comportamento similar ao observado no BGM 265. Já os BGMs 1037 e 1282 tiveram as primeiras plantas mortas logo aos 30 dias de conservação. Esse comportamento confirma o que se considera um dos problemas na conservação in vitro de mandioca, a resposta específica de cada acesso às condições estabelecidas. Um dos aspectos mais importantes na conservação in vitro é a manutenção da viabilidade das plantas após o período de incubação. A redução do metabolismo precisa vir acompanhada da manutenção da viabilidade das plantas para garantir seu posterior resgate e cumprir dessa forma o objetivo a que se destina. Na Tabela 5 os índices de sobrevivência são conclusivos quanto ao melhor tratamento para a conservação destes quatro acessos. Apesar dos resultados animadores com a concentração de 43,84 mM, como comentado anteriormente, apenas um acesso (BGM 265) apresentou plantas viáveis ao final de 330 dias de cultivo e ainda assim com 39% de plantas viáveis. Para os acessos BGM 264 e BGM 1037 foram obtidas plantas viáveis após o mesmo período de conservação com a concentração mais elevada de sacarose, 90% e 100%
37 respectivamente, de plantas viáveis, ainda que do BGM 1037, os 100% significam apenas 4 plantas. Esses resultados, no entanto podem ser considerados promissores, já que em mandioca o tempo máximo de conservação é de 270 dias (IITA, 2002). Tabela 5. Número de plantas sobreviventes após 330 dias (NPSO), número de microestacas cultivadas (NME), número de plantas viáveis (NPV) e viabilidade das plantas (%) (VP%) de diferentes acessos de mandioca após conservação em diferentes concentrações de sacarose. Sacarose (mM) 0,0 14,61 29,22 43,84 58,45 Acessos BGM 264 BGM 265 BGM 1037 BGM 1282 NPSO 10 8 2 7 5 NPSO 4 17 2 6 NME 10 8 2 19 25 NME 26 24 6 8 NPV 0 0 0 5 22 NPV 5 18 4 0 VP% 0 0 0 26 88 VP% 19 75 67 0 Considerando, portanto, o que se observa na Figura 2, é possível sugerir que se as plantas tivessem sido resgatadas aos 120 dias de conservação, as taxas de sobrevivência teriam sido mais expressivas. As diferenças entre as plantas do BGM 265 em três períodos de avaliação podem ser vistas na Figura 3, onde se confirma o bom estádio fisiológico das mesmas aos 120 dias de cultivo. Os resultados obtidos nesse trabalho coadunam com outros realizados por Londe et al. (2012), que avaliando o efeito da sacarose na taxa de crescimento de mandioca, observaram que a concentração de 58 mM apresentou maior brotamento e altura das plantas. Macia (2011) testou diferentes concentrações de sacarose na conservação in vitro de mandioca (29, 58, 116 e 232 mM) com os melhores resultados observados na mesma concentração do presente trabalho, com obtenção de plantas que mostraram redução do metabolismo celular, sem comprometer, no entanto, a viabilidade das mesmas após o período de conservação. A drástica redução de metabolismo observada no acesso BGM 1282 (Figura 2 e Tabela 5) foi determinante para sua inviabilidade após a incubação, deixando clara a necessidade de ajustes para a conservação deste material com maiores concentrações de açúcar. Esses resultados enfatizam mais uma vez a forte genótipo­dependência observada no comportamento in vitro de variedades de mandioca e o quanto pode ser limitante e determinante a fonte de carboidrato.
38 Figur a 3. Plantas do acesso de mandioca BGM 264 em meio de cultivo com diferentes concentrações de sacarose: T1 ­ 0 mM; T2­ 14,61 mM; T3 – 29,22 mM; T4 – 43,84 mM; e T5­ 58,45 mM após 30 (A), 120 (B) e 330 (C) dias de cultivo. 1.3.2Experimento 2. Efeito do manitol e da sacarose na redução do metabolismo de plantas in vitro de mandioca. A sacarose influenciou de forma significativa todas as variáveis estudadas, mas o manitol, assim como a interação entre os dois açúcares só foram significativos para a altura das plantas (Tabela 6). Tabela 6. Resumo da análise de variância para altura (ALT), número de folhas (NF), número de folhas senescentes (NFS), tamanho de calo (TC), número de estacas (NE), número de raiz (NR), tamanho de raiz (TR) e vigor (V) no acesso de mandioca BGM 1282 em função de diferentes concentrações de manitol. FV QM GL 1234 ALT SAC 1 60,1** NF NFS 32,70** 21,16** TC ns 0,35 NE 2,31** NR TR V ns 3,19 ns ns 0,30 ns 17,21** 16,35 MANITOL SAC*MAN 4 4 ERRO A TEMPO 36 2 0,80 0,83 0,44 0,22 0,00 0,39 16,81** 3,17** 6,78** 0,18 ns 0,48** 0,77** ERRO B SAC*TEMPO 8 2 0,21 0,03 0,03 0,04 0,00 0,01 0,46 0,04 14,72** 1,08 ns 4,46** 0,09 ns 0,27 ns 0,72 ns . 1,21 ns MAN*TEMPO SAC*MAN*TEMPO 8 8 6,34** 0,14 ns 0,49 ns 0,06 ns 0,05 ns 0,04 ns 4,64 ns. 0,10 ns 6,05** ns 0,08 ns ns ns ns 0,04 . 1,60 ns 372 0,33 0,19 0,16 0,06 0,03 0,09 5,89 1,12 41 41,86 28,82 13,83 33,97 54 26,61 ERRO C CV (% ) ns ns ns ns ns 18,83** 2,25 2,02 0,38 0,57 1,22 17,64** 1,31 ns 0,77 ns 0,25 ns 0,39 ns 1,22 ns 30,48 0,23 0,02 0,02 16,33 . 0,80 ns 12,83 0,23 62,60** 9,13** Média Ger al 1,88 1,00 0,74 0,34 1,27 0,48 4,49 1,54 ** significativo a 1% de probabilidade pelo teste de F. ns não significativo a 5% de significância. 1GL Erro c=306 para variável ALT. 2 GL Erro c=370 para variáveis NF e NFS. 3 GL SAC*MAN =0; GL Erro a=11; GL SAC*TEMPO=0; GL S AC*MAN*TEMPO=0; GL Erro c =52 para a variável TR. 4 GL Erro c=304 para variável V.
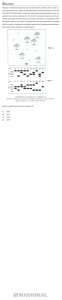
39 As variáveis que mais contribuíram para explicar o comportamento observado foram ALT, NF e NFS, com 43,23%, 22,70% e 15,68%, respectivamente, de acordo com o critério de Singh (1981) (Tabela 7). Tabela 7. Contribuição relativa das variáveis para a diversidade segundo o critério de Singh (1981) para altura da planta, em cm (ALT), número de folhas (NF), número de folhas senescentes (NFS), número de estacas (NE) e número de raiz (NR) no acesso de mandioca BGM 1282 em função de diferentes concentrações de manitol e sacarose. Variáveis ALT NF NFS NE NR Sij Sij (%) 182,88 43,23 96,02 66,32 22,70 15,68 18,49 4,37 39,62 9,37 A semelhança do que ocorreu no experimento com sacarose foi observada uma alta correlação parcial dessas variáveis com o NE, ainda que a correlação da altura das plantas (ALT) com NF e NFS, apesar de significativa a 1% pelo teste t apresentou valores bem mais baixos que os obtidos com a sacarose (Tabela 8). Tabela 8. Coeficiente de correlação parcial para altura, em cm (ALT), número de folhas (NF), número de folhas senescentes (NFS), número de estacas (NE) e número de raiz (NR) no acesso de mandioca BGM 1282 em função de diferentes concentrações de sacarose e manitol. Variáveis A NF NFS NE NF 0,43** NFS 0,35** 0,79** NE 0,76** 0,68** 0,65** NR 0,41** 0,59** 0,61** 0,60** ** significativo a 1% de significância pelo teste t. A tabela 9 mostra os valores médios observados para o acesso BGM 1282 quando utilizado nas combinações de sacarose e manitol. Os resultados foram similares aos obtidos no experimento anterior para esse acesso, com apenas um valor superior para a altura de plantas, quando se usou o tratamento de 58,45 mM de sacarose em combinação com 6,86 mM de manitol (Figura 4). Ainda assim a alta dependência deste acesso em relação à sacarose se confirmou também nesse experimento. Vale destacar que os experimentos com manitol e sorbitol foram realizados com apenas esse material, já que era o que possuía maior numero de plantas após o período de multiplicação, confirmando sua boa capacidade proliferativa in
40 vitroe superior aos outros acessos avaliados. Entretanto o meio de multiplicação utilizado rotineiramente para mandioca é o 17N, no qual a concentração de sacarose é de 87,68 mM e que parece ser determinante para o crescimento in vitro do BGM 1282. Tabela 9. Valores médios da altura da planta, em cm (ALT), número de folhas (NF), número de folhas senescentes (NFS), número de microestacas (NE) e número de raízes (NR) do acesso de mandioca BGM 1282 cultivados em diferentes concentrações de sacarose e manitol. Sacarose (mM) 0,0 58,45 Manitol (mM) 0,0 2,75 6,86 13,73 27,45 0,0 2,75 6,86 13,73 27,45 ALT 1,71 1,64 1,73 1,64 1,61 1,75 2,05 3,27 1,94 1,95 NF 0,71 0,82 0,91 0,84 0,75 1,05 1,25 1,85 1,28 1,28 NFS 0,71 0,75 0,86 0,75 0,71 1,00 1,11 1,61 1,16 1,06 NE 1,22 1,24 1,27 1,23 1,23 1,31 1,35 1,66 1,30 1,30 NR 0,71 0,72 0,71 0,71 0,71 0,94 1,10 1,50 0,96 0,99 Figur a 4. Plantas de mandioca após 30 dias de cultivo em meio 8S adicionado de 0 mM (1); 2,75 mM (2); 6,86 mM (3); 13,73 mM (4) e 27,45 mM (5) de manitol. De 6 a 10 meio 58,45 mM de sacarose combinada com:0 mM (6); 2,75 mM (7); 6,86 mM (8); 13,73 mM (9) e 27,45 mM (10) de manitol. Apesar da ocorrência de plantas vivas aos 270 dias de armazenamento (Figura 5), não houve registro de plantas viáveis em meio de crescimento após o período de conservação em nenhum dos tratamentos propostos, a semelhança do que ocorreu no experimento anterior.
41 Figur a 5.Taxa de sobrevivência de plantas do acesso de mandioca BGM 1282 após diferentes períodos de incubação. Tratamentos de 1 a 5 ­ 0 mM sacarose + 0 mM (1); 3 mM (2); 7 mM (3); 14mM (4) e 28 mM (5) de manitol. De 6 a 10 meio com 58 mM de sacarose + 0 mM (6); 3mM (7); 7Mm (8); 14mM (9) e 28 mM (10) de manitol. 1.3.3 Experimento 3. Efeito do sorbitol e da sacarose na redução do metabolismo de plantas in vitro de mandioca. O resumo da análise de variância para esse experimento se encontra na Tabela 10. A adição de sorbitol ao meio de cultura não influenciou nenhuma das variáveis avaliadas, nem de forma isolada ou em interação com as concentrações de sacarose utilizadas e apenas a interação com o tempo foi significativa para a maioria das variáveis analisadas (Figura 6 e 7).
42 Tabela 10. Resumo da análise de variância para altura (ALT), número de folhas (NF), número de folhas senescentes (NFS), tamanho de calo (TC), número de estacas (NE), número de raiz (NR), tamanho de raiz (TR) e vigor (V) no acesso de mandioca BGM 1282 em função de diferentes concentrações de sorbitol. QM FV 1 GL ALT NF NFS TC NE NR TR V 25,84** 60,15** 445,15** 6,30** 0,54 ns 1,29 ns 9,04 ns 0,21 ns 0,11 ns 0,31 ns 0,28 ns 3,37 ns 0,14 ns 0,26 0,28 0,90 18,50 0,32 ns SAC 1 384,56** SORB 4 5,53 ns 1,91 ns 1,38 ns 0,38 ns SAC*SORB 4 5,00 ns 0,92 ns 1,08 ns ERRO A 36 3,79 1,53 0,83 TEMPO 3 118,30** ERRO B 12 1,32 63,41** 58,88** 17,46** 28,08** 0,11 0,13 2,06 ns 0,09 0,05 ns 8,11** 10,14** 0,07 0,09 ns 66,10 5,49 ns 9,31** 0,13 SAC*TEMPO 3 91,26** 7,17** 9,41** 0,01 5,05** 4,36** 45,23 1,33** SORB*TEMPO 12 4,62** 0,83 ns 0,90 ns 0,06 ns 0,33 ns 0,46 ns 8,56 ns 0,03 ns SAC*SORB*TE M ERRO C 12 5,19** 0,82 ns 0,76 ns 0,06 ns 0,34 ns 0,36 ns 9,81 ns 0,08 ns 415 1,72 0,43 0,33 0,12 0,11 0,25 11,86 0,11 56,95 47,26 47,60 36,44 23,04 42,35 78,30 24,08 CV (% ) Média Ger al 2,30 2,14 1,56 0,53 1,80 1,37 4,40 1,66 ** significativo a 1% de probabilidade pelo teste de F. ns não significativo a 5% de significância. 1 GL Erro A=29, GL Erro c=131 para a variável TR. Figur a 6. Altura da planta (cm) dos acessos de mandioca BGM 1282 em razão de diferentes concentrações de sorbitol no meio 8S (CIAT, 1984). As variáveis que mais contribuíram para explicar o comportamento observado foram o número de folhas (NF) e o número de folhas senescentes (NFS), com 34,61% e 22,14% respectivamente, de acordo com o critério de Singh (1981). O pouco crescimento das plantas
43 durante todo o período de avaliação foi o responsável pela variável NE não estar em as que mais contribuíram para explicar a variação observada (Tabela 11). Tabela 11. Contribuição relativa das variáveis para a diversidade segundo o critério de Singh (1981) para altura da planta, em cm (ALT), número de folhas (NF), número de folhas senescentes (NFS), tamanho de calo (TC), número de estacas (NE) e número de raiz (NR) no acesso de mandioca BGM 1282 em função de diferentes concentrações de sorbitol e sacarose. Variável Sij Sij (%) ALT NF 40368,52 184969,57 7,55 34,61 NFS 118317,12 22,14 TC 12988,90 2,43 NE NR 56578,95 109156,85 10,59 20,42 V 12112,46 2,27 Figur a 7. Plantas do acesso de mandioca BGM 1282 após 300 dias de cultivo em meio ‘8S’ adicionado de 0 mM (1); 2,75 mM (2); 6,86 mM (3); 13,73 mM (4) e 27,45 mM (5) de sorbitol. De 6 a 10 meio 58,45 mM de sacarose combinada com:0 mM (6); 2,75 mM (7); 6,86 mM (8); 13,73 mM (9) e 27,45 mM (10) de sorbitol. Assim como ocorrido no experimento com manitol, não houve resgate de plantas viáveis após a conservação, ainda que foram registradas plantas vivas na ausência de sacarose e sorbitol (Figura 9). Entretanto, as plantas sobreviventes dos cinco tratamentos sem sacarose, após a multiplicação e cultivo em meio de crescimento 17N, não formaram plantas com desenvolvimento normal após a conservação, mostrando a necessidade da sacarose na manutenção da viabilidade das plantas. Segundo Gopal e Chauhan (2010) o manitol e o
44 sorbitol não são consideráveis para conservação in vitro de batata, e sim a combinação específica de sacarose­manitol ou sorbitol. Figur a 9.Taxa de sobrevivência de plantas do acesso de mandioca BGM 1282 após diferentes períodos de incubação. Tratamentos de 1 a 5 ­ 0 mM sacarose + 0 mM (1); 3 mM (2); 7 mM (3); 14mM (4) e 28 mM (5) de sorbitol. De 6 a 10 meio com 58 mM de sacarose + 0 mM (6); 3 mM (7); 7 mM (8); 14mM (9) e 28 mM (10) de sorbitol. As concentrações utilizadas neste trabalho para o uso do manitol e do sorbitol foram baseadas nos resultados obtidos por Macia (2011) que trabalharam com as concentrações de 27,46 mM e 54,92 mM, concluindo que eram extremamente elevadas para a conservação de mandioca. Dessa forma, esse trabalho buscou usar concentrações abaixo da menor concentração usada por Macia (2011). Os resultados obtidos, nas condições aqui estabelecidas, mostraram que esses açúcares não são eficientes para a conservação in vitro de mandioca. Entretanto, é preciso levar em consideração o que foi observado em relação ao BGM 1282, ou seja, sua dependência de uma concentração de sacarose acima das 58,45 mM, o que certamente comprometeu os resultados esperados. Por outro lado, em experimentos posteriores, é preciso medir a viabilidade das plantas resgatadas nos diferentes períodos de avaliação para poder determinar efetivamente qual o tempo máximo de cultivo que os acessos podem suportar e em que condições.
45 O uso dos métodos estatísticos multivariados mostrou­se promissor neste tipo de estudo, conferindo a possibilidade de manejar os dados e as avaliações de forma mais eficiente. Para mandioca, em estudos futuros com os outros acessos que deverão estar no banco in vitroda Embrapa Mandioca e Fruticultura nos próximos anos, deverão ser consideradas as variáveis que se mostraram mais determinantes para explicar as variações observadas. Esse tipo de abordagem estatística vem sendo aplicada a outras espécies, como citros (CARVALHO, 2013) e abacaxi (LIMA, comunicação pessoal), com resultados interessantes. CONCLUSÃO A utilização da técnica de análise multivariada pode ser considerada uma ferramenta eficiente para estudos de conservação in vitro de mandioca; As concentrações 14,61 mM e 29,22 mM de sacarose reduzem o metabolismo de plantas de mandioca in vitro , porém inviabilizam o resgate e a viabilidade das mesmas; Os açúcares alcoólicos manitol e sorbitol não foram eficientes na redução do crescimento e manutenção da viabilidade do BGM 1282. REFERÊNCIAS ALBUQUERQUE, J.A.A. et al. Caracterização morfológica e agronômica de clones de mandioca cultivados no Estado de Roraima. Revista Brasileira de Ciências Agrárias, v. 4, n.4, p. 388­394. 2009. CANTO, A.M. et al. Conservação in vitro de germoplasma de abacaxi tratado com paclobutrazol.Pesquisa Agropecuária Brasileira , v. 39, n. 7. 2004. CARVALHO, Mariane de Jesus da Silva. Adequação da condição de crescimento mínimo para a conservação in vitro de germoplasma de citrus. 2013. 84f. Dissertação (Mestrado Recursos Genéticos Vegetais) ­ Universidade Federal do Recôncavo da Bahia. Cruz das Almas. CIAT. El cultivo de meristemas para la conservación de germoplasma de yucain vitro;Guía de estúdio. Centro Internacional de Agricultura Tropical, Cali, p. 44. 1984. DE CONTI, D. et al. Fontes de carbono influenciam a multiplicação in vitro de ameixeira japonesa ‘America’ (Prunus salicina Lindl.). Disponível em: <http://ufpel.edu.br/enpos/2011/anais/pdf/CA/CA_00207.pdf>. Acesso em: 30 setembro 2013.
46 FARIA, G.A. et al. Efeito da sacarose e sorbitol na conservação in vitro de Passiflora giberti N. E. Brown. Revista Brasileira de Fruticultura , v. 28, n. 2, p. 267­270. 2006. FUKUDA, W.G. et al. Variabilidade genética e melhoramento da mandioca (Manihot esculenta Crantz). Recursos Genéticos e Melhoramento de Plantas para o Nordeste Brasileiro. 1999. Disponível em: http://www.cpatsa.embrapa.br:8080/catalogo/livrorg/mandioca.pdf. Acesso em jul de 2013. FUKUDA, W.M.G. et al. Germoplasma de mandioca (Manihot esculenta Crantz) no Brasil.Revista Brasileira de Mandioca ,v.18, p.7­12. 2005. GOPAL, J.; CHAUHAN, N.S. Slow growth in vitro conservation of potato germplasm at low temperature. Potato Research, v. 53, n. 3, p. 141–149. 2010. HAIR, J.F et al., Análise multivariada de dados. 5ed. Porto Alegre: Bookman, p. 593, 2005. HERSHEY, C. H. Cassava breeding. CIAT Headgunters. In: HOWELER, R. H.;KAWANO, K. (Org.) Cassava breeding and agronomy research in Äsia .Proceedings of a workshop held in Tailand, 1987. Cali, Colombia: CIAT, p. 99 – 116. 1988. HERSHEY, C.H.Research for development: The CIAT cassava program. Cali (Colombia), Centro Internacional de Agricultura Tropical. 99 p. 1994. IITA.Genetic Resources and Conservation.2002. Disponível em: http://books.google.com.br/books?hl=ptBR&lr=&id=qBOY6TrE3AwC&oi=fnd&pg=PA167 &dq=ciat+conservation+cassava+nine+months&ots=XIDsvnpF7u&sig=2IUw1_UKBITxkB8 wjZUoaQt4mE#v=onepage&q=ciat%20conservation%20cassava%20nine%20months&f=fals e. Acesso em julho de 2013. ITO, K.; SCHULL, W.J.On the robustness of the T 2 test in multivariate analysis of variance when variance­covariance matrices are not equal.Biometrika , v. 51, n. ½, p. 71­82. 1964. JOHNSON, R.A.; WICHERN, D.W. Applied multivariate statistical analysis. 3ed. New Jersey: Prentice­Hall, p. 390. 1992. KADOTA, M.; IMIZU, K.; HIRANO, T. Doublé­phase in vitro culture using sorbitol increase ahoot proliferation and hyperhydricity in Japanese pear. Scientia Horticulturae, v.89, p.207­ 210. 2001. KORIN, B.P. Some comments on the homocedasticity criterion M and the multivariate analysis of variance tests T 2 , W and R. Biometrika . London, v. 59, n. 1, p. 215­216. 1972. LEMOS,E.E.P. et al. Conservação in vitro de germoplasma de cana­de­açúcarPesquisa Agropecuária Brasileira , v. 37, n. 10, p. 1359­1364. 2002.
47 LONDE, L.N.; ALVES, K.A.; RIBEIRO, E.B. Efeito de concentrações de sacarose e de meio de cultura sobre a taxa de crescimento de Mandioca variedade BGM 0116 conservadas in vitro.Revista Trópica – Ciências Agrárias e Biológicas, v. 6, n.2, p. 67. 2012. MACIA, Ricardo Josué. Conservação in vitro de cultivares de mandioca (Manihot esculenta Crantz). 2011. 67f.Dissertação (Mestrado em Recursos Genéticos Vegetais) – Universidade Federal do Recôncavo da Bahia. Cruz das Almas. MARDIA, K.V. The effect of nonnormality on some multivariate tests and robustness to nonnormatility in the linear model.Biometrika , London, v. 58, n. 1, p. 105­121. 1971. MONTGOMERY, D.C.; PECK, E.A. Introduction to linear regression analysis.New York: J. Wiley, 504 p. 1981. MURASHIGE, T.; SKOOG, F.A revised médium for rapid growth and bioassays with tobacco tissue culture.Physiologia Plantarum, v. 15, n. 3, p. 473­497. 1962. NETO, M.M.J. Estatística multivariada. Revista de Filosofia e Ensino. 2004. Disponível em: http://criticanarede.com/cien_estatistica.html. Acesso em julho de 2013. OLIVEIRA, R.P.; GOMES, T.S.; VILARINHOS, A.D. Avaliação de um sistema de micropropagação massal de variedades de mandioca. Pesquisa Agropecuária Brasileira.Brasília, v.35, n.12, p. 2329­2334, 2000. PEREIRA NETO, V.B.P.; OTONI, W.C. Carbon sources and their osmotic potential in plant tissue culture: does it matter? Science Horticulture, v.97, p.193­198, 2003. RIVAL, L.; MCKEY, D. Domestication and diversity in manioc (Manihot esculenta Crantz ssp. esculenta, Euphorbiaceae).Current Anthropology, v.49, n. 6, p. 1119­1128, 2008. SANTOS, M.T. Micropropagação e viabilidade de regeneração de variedades silvestres de abacaxi conservadas in vitro. 2008. 57 f. Dissertação (Mestrado em Ciências Agrárias) ­ Universidade Federal do Recôncavo da Bahia, Cruz das Almas. SAS INSTITUTE INC. SAS/STAT User´s Guide. v. 8.0. Cary, NC, v.1, 2000. SCOBAR, R.H., MAFLA, G., ROCA, W.M. A methodology for recovering cassava plants from shoot tips maintained in liquid nitrogen. Plant Cell Reports, n. 16, p. 474­478. 1997. SOUZA, A.S. et al. Preservação de Germoplasma Vegetal, com Ênfase na Conservação in Vitro de Variedades de Mandioca. Circular Técnica, n.90,1ed, p. 1­24. 2009. SINGH, D.The relative importance of characters affecting genetic divergence.Indian Journal of Genetic and Plant Breeding, New Delhi, v. 41, n. 2, p. 237­245. 1981.
48 SIQUEIRA, M.V.B.M.; PINHEIRO, T.T.; BORGES, A.; VALLE, T.L.; ZATARIM, M.; VEASEY, E.A. Microsatellite Polymorphisms in Cassava Landraces from the Cerrado Biome, Mato Grosso do Sul, Brazil. Biochemical Genetics, v. 48, n. 9­10,p 879­895. 2010. VIDAL, A.M. Micropropagação e embriogênese somática em variedades cultivadas de mandioca. 2009. 59p. Dissertação (Mestrado em Ciências Agrárias) – Universidade do Recôncavo da Bahia. Cruz das Almas. 2009.
49 CAPÍTULO 2 Cr iopreservação de meristemas de espécies de Manihot
50 RESUMO A adoção de novas estratégias para conservação de germoplasma de Manihot é de extrema importância para o melhoramento genético de mandioca cultivada. O objetivo deste trabalho foi avaliar o uso do método de vitrificação em gotas (droplet vitrification) para a criopreservação de meristemas de espécies de Manihot. O trabalho foi desenvolvido no Laboratório de Cultura de Tecidos do National Center for Genetic Resources and Preservation – NCGRP/ARS/USDA. Como material vegetal foram utilizados meristemas apicais (~1,0 mm) de Manihot tristis e domos apicais (~0,4mm) de Manihot carthaginenses. Foi calculada a taxa de regeneração em todas as etapas dos procedimentos. Foram obtidas altas percentagens de regeneração após o congelamento em nitrogênio líquido, com maiores valores encontrados em meristemas tratados por 75 minutos em solução dePlant Vitrification Solution (PVS2) em Manihot tristis (86%), e em domos tratados por apenas 10 minutos em PVS2 na Manihot carthaginenses, com 60% de plantas regeneradas. O método droplet vitrification foi eficiente para criopreservar meristemas das espécies avaliadas. Palavras­chave: Conservação de germoplasma. Mandioca.Recursos genéticos. Vitrificação
51 ABSTRACT The adoption of new strategies for germplasm conservation of Manihot is important for the genetic breeding program of cassava. The aim of this study was to evaluate the droplet vitrification method for different species of Manihot. The work was carried out in the Tissue Culture Laboratory at National Center for Genetic Resources Preservation – NCGRP/ARS/USDA. The plant material used to perform experiments were apical meristems (~ 1,0mm) of Manihot tristis and apical domes (~ 0,4 mm) of Manihot carthaginenses. Regeneration rates were calculated for all stages of the procedures. The high regeneration rates after freezing in liquid nitrogen were obtained with 75 minutes of exposure time in Plant Vitrification Solution (PVS2) to Manihot tristis (86%), and with 10 minutes of time exposure in PVS2 to in Manihot carthaginenses (60%). The droplet vitrification method was effective for cryopreservation of cassava meristems. Keywor ds: Germplasm conservation. Cassava.Genetic resources.Vitrification.
52 2.1 INTRODUÇÃO A criopreservação é uma forma de conservação ex situ de células, tecidos e órgãos vegetais em temperaturas ultra baixas, geralmente em nitrogênio líquido (NL) (­196ºC) ou em vapor (­140ºC). O processo de congelamento envolve fenômenos complexos, não sendo totalmente compreendido mesmo após décadas de pesquisas, porém boas taxas de regeneração de plantas após o armazenamento em nitrogênio líquido vêm sendo obtidas para várias espécies (REINHOUD et al., 2000; SIMIONE, 2013). Dentre as etapas cruciais do processo estão os procedimentos de desidratação e crioproteção dos tecidos que consistem na preparação das células para suportarem as temperaturas ultra baixas evitando a formação de cristais e danos às estruturas celulares, principalmente à membrana. A formação de cristais afeta a integridade coligativa e osmótica das células resultando em rupturas físicas e injurias mecânica, que são letais para as células (BENSON, 2008; SIMIONE, 2013). A crioproteção é utilizada para evitar a formação de cristais de gelo durante o congelamento, sendo o glicerol e o DMSO (Dimetilsulfoxido) os agentes crioproterores mais comumente empregados (REINHOUD et al., 2000). Atualmente os principais métodos de criopreservação utilizados são: encapsulamento­desidratação (ENGELMANN et al., 2008),encapsulamento­vitrificação (SAKAI et al., 2008), e a vitrificação em gotas, conhecido como droplet­vitrification (REED, 2008). Diferentes fontes de explantes podem ser utilizadas para este tipo de conservação, como células em suspensão, calos, embriões zigóticos, embriões somáticos, meristemas apicais, gemas axilares, sementes, pólen, entre outras estruturas (ENGELMANN; DUSSERT, 2013). Entretanto, o uso de meristemas é fortemente indicado, não apenas pela estabilidade genética que pode ser obtida ao se trabalhar com esse tipo de explante, mas também por sua adequação a diferentes métodos de criopreservação (SAENZ et al., 2012). O tamanho dos explantes de partida é uma das limitações na criopreservação de tecidos vegetais. Explantes com tamanho superior a 1mm costumam apresentar maiores dificuldades nos procedimentos de crioproteção e, portanto, resultados menos eficientes na regeneração após o congelamento.
53 Por outro lado, o uso de meristemas compostos apenas do domo meristemático acompanhado de poucos primórdios foliares é atrativo por possibilitar, além da preservação, alimpeza fitossanitária pelo cultivo dessas estruturas in vitro (RAMGAREEB et al., 2010). Contudo, o tamanho extremamente reduzido desse tipo de explante, é um dos fatores que dificultam o estabelecimento dos procedimentos de crioproteção e desidratação necessária para proteção dos tecidos no ultracongelamento e se constituem em um desafio. Diversas espécies tropicais como a M. esculenta Crantz vêm sendo criopreservadas com sucesso (KAVIANI, 2011,ZHOU et al., 2012).No entanto, poucos protocolos com taxas de regeneração elevada, acima de 70%, foram obtidos (MARIN et al., 1990, DANSO; FORD­ LLOYD, 2002, DANSO; FORD­LLOYD, 2011). Em vista do exposto, o objetivo deste trabalho foi avaliar o uso da metodologia de droplet vitrification para a criopreservação de espécies de Manihot. 2.2 MATERIAIS E MÉTODOS 2.2.1 Mater ial vegetal Como material vegetalforam utilizados meristemas apicais do acesso TST­XXX­1 da espécie Manihot tristis e domos meristemáticos de Manihot cartaginense,provenientes do Centro Internacional para Agricultura Tropical (CIAT). Asplantas com 2­3 meses de idade estavam mantidas in vitro em meio de crescimento 12A3(CIAT, 1984). 2.2.2 Cr iopreser vação Todo o procedimento adotado para criopreservação dos segmentos foram desenvolvidos no Laboratório de Cultura de Tecidos do National Center for Genetic Resources Preservation (NCGRP), do ARS/USDA (Agricultural Research Service/United States Department of Agriculture), em Fort Collins, Colorado, EUA, durante o período de maio de 2011 a dezembro de 2012. O método droplet vitrification tem sido adotado para criopreservação de explantes de diversas espécies como Ananas comosus L. Merril, Saccharum officinarum, e Citrus sinensis L. nos Estados Unidos e entre elas, espécies de Manihot. 2.2.2.1Criopreservação de meristemas apicais (~ 1mm)
54 Para este experimento, inicialmente, foram utilizados segmentos nodais da espécie M. tristiscom aproximadamente1cm cultivados previamente em meio12A3 (CIAT, 1984), em placas de Petri(90 x25 mm). Após 15­20 dias decultivo,segmentos com meristemasapicais(~1,0 mm)foram excisadose inoculados emmeio sólido depré­cultivo (MS suplementado com0,3 Mde sacarose) em pequenas placas de Petri(55x15 mm)por1 e 2dias emcâmara de crescimentosob luz indireta. Após este período, os meristemas apicaisforam removidos e colocados emuma pequena gota(5uL)de Plant VitrificationSolution (PVS2) em pequenas tiras de papel alumínio(~5 x15 mm)com5 gotasportira. Os meristemas foram tratados emPVS2durante diferentes tempos de exposição: 15, 30, 45, 60 e 75 minutos (Figura 1). Após esta etapa, as tiras de papel alumínio com os explantes foram colocadas dentro de criotubos de 2ml que foram submergidos rapidamente no nitrogênio líquido. Figur a 1. Criopreservação de meristema de M. tristis. Etapas pré­congelamento. A – planta micropropagada em meio de cultivo 12A3 (CIAT, 1984). B – segmentos uninodais. C – segmentos uninodais após 15­20 dias de cultivo. D – microestaca contendo meristema apical. E – meristemas em meio de pré­cultivo (MS suplementado com0,3 Mde sacarose). F ­ gotas (5uL)dasolução de vitrificação(PVS2) em pequenas tiras de alumínio para tratamento dos explantes. Foto: ALVES, A. A. C.
55 No descongelamento, os meristemas foram removidosdo nitrogênio líquidorapidamente após 24 horas e mergulhados em solução de lavagem(MS+solução de sacarose1,0 M)durante 15 minutos, e em seguida cultivados em meio deregeneração, onde forammantidas na ausência de luz e temperatura de 26 ± 1ºC, juntamente com as placas/controle dos tempos dePVS2. As avaliaçõesdas taxas de sobrevivência e regeneraçãoforam realizadas semanalmente.Considerou­se três repetiçoes por tratamento, sendo quea unidadeexperimentalse constituiu de 12­15meristemas/placa de petri e cultivados em placas de petricontendo meio deregeneração 12A3 (VELÁSQUEZ; MAFLA, 1999).A equação de regressão dos resultados foi determinada com sistema operacional Microsoft Excel 2010. 2.2.2.2Criopreservação de meristema apical (~ 0,4 mm) O procedimento decultivo dossegmentosnodaisfoi da mesma forma descrita anteriormente. Após 15 dias de cultivo, os meristemas apicais foram excisados até o tamanho de aproximadamente 0,4mm, onde se podia ver o domo meristematico acompanhado de dois primórdios foliares. Foi realizado o pré­cultivo emmeio MS sólidosuplementado com0,3 Mde sacarosepor24 horas no escuro em câmara de crescimento. Após este período, foi realizada a osmoproteção dos meristemas em solução de sacarose 0,75M + glicerol 1,0 M durante 20 minutos. Após a osmoproteção, os meristemas foram colocados em gotas de 3µLdasolução de PVS2 emtrêsdiferentes tempos de exposição: 5, 10, e 20minutos. Em seguida a cada tempo de exposição, as laminas com os meristemas foram depositadas em criotubos e submergidas rapidamente em nitrogênio líquido por 48 horas. Depois deste período de congelamento, os criotubos foram removidos e os meristemas retirados e imersos em solução de lavagem (MS+solução de sacarose1,0 M)durante 20 minutos. Em seguida eram cultivados em meio deregeneraçãoe mantidosna câmara de crescimento, juntamente com as placasde controle de todas as etapas. Avaliaçãodas taxas de sobrevivência e regeneraçãoforam realizadas semanalmente. A unidadeexperimentalpara cada tratamentoconsistiu de 10 meristemas/placa. Três semanas após o descongelamento foi calculado a porcentagem de explantes que apresentaram regeneração após as diferentes etapas da criopreservação.O delineamento experimental foi inteiramente casualizado com três repetições, sendo cada repetição formada por 500 grãos de pólen. Os dados expressos em percentagem foram transformados em arcsen √x/100, para atendimento das pressuposições da ANOVA. As médias foram comparadas pelo
56 teste de Tukey, ao nível de 5% de probabilidade, com o uso do programa SAS 9.2 (2008). 2.3 RESULTADOS E DISCUSSÃO 2.3.1Uso de meristemas apicais (~1 mm) Não houve diferença na taxa de regeneração de plantas após zero, um e dois dias em meio de pré­cultivo de sacarose 0,3M. A Figura 2 mostra que todos os meristemas apicais geraram plantas (Figura 2). Apesar de todos os meristemas sobreviverem, observou­se uma variação no vigor das plantas regeneradas, sendo que no tratamento onde os meristemas sem pré­cultivo as plantas apresentaram maior desenvolvimento (Figura 2). Figur a 2. Regeneração de plantas de M. tristis. A­ sem pré­cultivo. B ­Após um dia de pre­cultivo em meio 0,3M de sacarose e C – após dois dias de pré­cultivo em meio 0,3M de sacarose. A taxa de regeneração de meristemas após um ou dois dias de pré­cultivo e em função dos tempos de exposição ao PVS2 apresentou grandes variações (Figura 3). O efeito tóxico da solução crioprotetora fica bem evidente quando se submete os explante a apenas um dia de pré­cultivo, destacando também a importância da sacarose no processo de vitrificação.
57 Figur a 3. Regeneração de meristemas apicais de M. tristis após um e dois dias de pré­cultivo em meio 0,3M de sacarose, tratados por diferentes tempos em PVS2 e criopreservados em nitrogênio líquido por 24 horas. Açúcares utilizados no pré­cultivo e na solução de PVS2 mostram alta eficiência na estabilização das membranas celulares durante o congelamento, em comparação com os crioprotetores tradicionais. Seu efeito protetor está supostamente associado à vitrificação das membranas celulares no citoplasma (SIMIONE, 2013). Quando as células são desidratadas em excesso elas podem ser danificadas pela exposição aos efeitos nocivos da concentração elevada dos eletrólitos celulares (efeitos de solução). A sacarose é um excelente agente vitrificador e, além disto, não apresenta toxicidade para as células vegetais mesmo quando se acumula em grande quantidade no citoplasma(SANTOS, 2000). Ainda que os resultados obtidos com um dia de pré­cultivo podem ser considerados satisfatórios, 46,7% de sobrevivência, com 30 e 75minutos, os resultados mais proeminentes foram obtidos a partir de dois dias de pré­cultivo (Figura 3). A medida que se aumentou o tempo de exposição ao PVS2 houve um incremento significativo na porcentagem de plantas regeneradas, atingindo 87%, valor esse ainda não registrado para criopreservação de mandioca. A Figura 4 mostra o aspecto das plantas regeneradas após dois dias de pré­cultivo, tratadas por 75 minutos em PVS2 e criopreservada por 24 horas.
58 Figur a 4. Crescimento de plantas de M. tristis após 2 dias de pré­cultivo, tratadas em PVS2 por 75 minutos e congeladas em nitrogênio líquido por 24 horas. A explicação para o alcance de excelentes resultados pode estar na eficiência com que o processo de vitrificação foi obtido pela combinação de dois dias de pré­cultivo em sacarose 0,3 M e um elevado tempo de exposição ao PVS2 com um material já parcialmente protegido. É preciso destacar que a vitrificação do citoplasma é obtida por meio da desidratação dos tecidos até que não exista água livre que possibilite a formação de cristais e, portanto a formação de injúrias no momento do congelamento (SANTOS, 2000). Os resultados obtidos neste trabalho são semelhantes aos observados por Rodrigues (2013) ao avaliar diferentes métodos de criopreservação em mandioca. Outros autores também não obtiveram resultados satisfatórios com outros métodos de criopreservação e apenas a partir da vitrificação das células puderam obter uma taxa de regeneração superior a 50% após imersão em nitrogênio líquido (NISHIZAWAet al., 1993; MATSUMOTO et al., 1994; SEKIZAWA et al., 2011;ZHOU et al., 2012) 2.3.2Criopreservação de meristema apical (~0,4 mm) Foi realizado um ensaio preliminar onde meristemas com essa condição (apenas o domo e os dois primórdios foliares) passaram por um pré­cultivo em meio MS suplementado com 0,3M de sacarose por 48 horas antes da imersão nos três tempos de PVS2 (30, 45 e 60 minutos). Vale destacar que neste ensaio não foi realizada a osmoproteção e o resultado foi a não sobrevivência de nenhum dos explantes, incluindo todos os controles, deixando evidente que eram tempos de exposição altamente tóxicos para os explantes em questão, independente da imersão em nitrogênio líquido.
59 Em vista disso, decidiu­se por delinear tratamentos com tempos de exposição abaixo dos 30 minutos, assim como realizar o procedimento de osmoproteção em meio MS0,75M de sacarose + glicerol 1,0 M durante 20 minutos antes do tratamento em PVS2. Os resultados obtidosforam bastante satisfatórios sendo observados 100% de regeneração nas etapas de 48 horas em pré­cultivo e osmoproteção. Taxade até 60% de sobrevivência de plantas foram encontradas no tratamento de 10 minutos de exposição ao PVS2 (Tabela 1). Tabela 1. Taxa de regeneração de plantas do acesso de M. cartaginense CTH­XXX­96 após diferentes tempos de tratamento de meristemas com tamanho de ~0,4 mm em PVS2 e armazenamento em nitrogênio líquido por 24 horas. Tratamento Taxa de regeneração (%) Pré­cultivo 100 a Osmoproteção 100 a Meristema 80 ab PVS2 10 minutos 90 a PVS2 15 minutos 80 ab PVS2 20 minutos 80 ab PVS2 10 minutos + NL2 60bc PVS2 15 minutos + NL2 50 cd PVS2 20 minutos + NL2 30 d * Médias seguidas pela mesma letra não diferem estatisticamente entre si pelo teste de Tukey a 5% de probabilidade. Segmentos mantidos como controle mostraram 80% de regeneração o que comprova a viabilidade desse tipo de explante antes de qualquer tipo de tratamento. O resultado de 50% de regeneração com 15 minutos de exposição ao PVS2, também pode ser considerado muito positivo, já que em criopreservação, resultados acima de 40% são considerados satisfatórios. Os resultados obtidos com esse tipo de explante são promissores já que por suas características são indicados para trabalhos de limpeza de vírus, cuja associação com as técnicas de criogenia originaram a crioterapia, que vem sendo utilizada para várias espécies com êxito (DING et al., 2008; WANG; VALKONEN, 2009). CONCLUSÃO A droplet vitrification é uma técnica fácil e promissora para conservação ex situ de mandioca por criogenia. Os meristemas com tamanho de ~0,4mm são intolerantes a tempos
60 acima de 20 minutos em PVS2 mas podem ser criopreservados se previamente tratados com 10 minutos de exposição ao PVS2. REFERENCIAS BENSON, E.E. Cryopreservation of phytodiversity: a critical appraisal of theory practice. Critical reviews in plant sciences, v. 27, n.3, p. 141­219. 2008. CIAT. El cultivo de meristemas para la conservación de germoplasma de yuca in vitro;Guía de estúdio. Centro Internacional de Agricultura Tropical, Cali, p. 44, 1984. VELÁSQUEZ, E.; MAFLA, G. Conservation in vitro: Una alternativa segura para preservar especies silvestres de Manihot spp (Euphorbiaceae). In: Congresso Nacional de Conservación de la Biodiversidad (2, 1999, Bogotá, Colombia). DANSO, K.E.; FORD­LLOYD, B.V. Induction of high­frequency somatic embryos in cassava for cryopreservation. Plant Cell Reports,n. 21, p. 226­232. 2002. DANSO, K.E.; FORD­LLOYD, B.V. Cryopreservation of Cassava Micropropagules using Simple Slow Freezing and Vitrification Techniques.Biotechnology, v. 10, n. 5, p. 415­420, 2011. DING, F. et al. Vitrification­cryopreservation, an efficient method for eliminating Candidatus Liberobacter asiatucus, the citrus Huanglongbing pathogen, from in vitro adult shoot tips. Plant Cell Rep, n. 27, p. 241­250. 2008. ENGELMANN, F. et al.The development of encapsulation dehydration.In. REED, BM (Org.).Plant cryopreservation: A practical guide. Spriger: New York, p. 59­75. 2008. ENGELMANN, F.; DUSSERT, S..Cryopreservation. In:. Normah, Mohd (Org). Conservation of tropical plant species.New York: Springer, 2013. p. 107­119. REINHOUD, P.; IREN, F.V.; KIJNE, J.W. Cryopresevation technique.In ENGELMANN, F.; TAKAGI, H. (Org.) Cryopreservation of Tropical Plant Germoplasm. p. 91­109. 2000. KAVIANI, B. Conservation of plant genetic resources by cryopreservation.Australian Journal of Crop Science, v.5, n.6, p. 778­800. 2011. MARÍN M, et al. Cryopreservation of cassava zygotic embryos and whole seeds in liquid nitrogen. Cryo­letters, v. 11, n. 4, p. 257­264. 1990. MATSUMOTO, T.; SAKAI, A.; YAMADA, K. Cryopreservation of in vitro­grown apical meristems of wasabi (Wasabia japonica ) by vitrification and subsequent high plant regeneration.Plant Cell Reports, v. 13, p. 442­446. 1994.
61 NISHIZAWA, S. et al. Cryopreservation of asparagus (Asparagus officinalis L.) embryogenic suspension cells and subsequent plant regeneration by vitrification.Plant Science, v. 91, n.1, p. 67­73. 1993. RAMGAREEB S, SNYMAN SJ, VAN ANTWERPEN T. Elimination of virus and rapid propagation of disease­free sugarcane (Saccharum spp. cultivar NCo376) using apical meristem culture. Plant Cell Tissue Organs, v. 100, p. 175­181. 2010. REED, B. M. Plant Cryopreservation: a practical guide. New York, NY: Springer. 515 pp. 2008. RODRIGUES, L. A. Z. Cryopreservation of cassava genotypes. Tese de doutorado. Universidade Federal de Lavras. 2013. Disponível em:<http://repositorio.ufla.br/jspui/handle/1/311>. Acesso em: 15 abril 2013. SAKAI, A; HIRAI, D.; NIINO, T. Development of PVS based vitrification and encapsulation­vitrification protocols. In: Reed B.M. (Org.) Plant Cryopreservation: a practical guide. pp. 33­57. 2008. SAENZ J. et al.Effects of slow freezing procedure on late blastocyst gene expression and survival rate in rabbit.Biology Reproductive.v. 18, n. 4, p. 91. 2012. SANTOS, I. R. I. Criopreservação: potencial e perspectivas para a conservação degermoplasma vegetal. Revista Brasileira de Fisiologia Vegetal, v. 12 (Edição Especial): 70­ 84, 2000. SEKIZAWA, K. et al. Cryopreservation of in vitro­grown shoot tips of carnation (Dianthus caryphyllus L.) by vitrification method using aluminium cryo­plates. Plant Biotechnology, v. 28, n. 4. p. 401­405. 2011. SIMIONE, F.P. Thermo scientific nalgene and nunc cryopreservation guide. 2013. Disponível em: <http://www.atcc.org/~/media/PDFs/Cryopreservation_Technical_Manual.ashx>. Acesso em: 01 julho 2013. ZHOU, Q. et al. Cryopreservation and plant regeneration of anther callus in Hevea by vitrification. African Journal of Biotechnology. v. 11, n. 28, p. 7208­7217. 2012. WANG, Q.; VALKONEN, J.P.T. Cryoterapy of shoot tips: novel pathogen eradication method.Trends in Plant Science, v. 14. n. 3, p. 119­122. 2009.
62 CAPÍTULO 3 Viabilidade e criopr eser vação de pólen de Manihot
63 RESUMO Estudos relacionados à viabilidade e conservação de grãos de pólen de espécies de Manihot são fundamentais para o desenvolvimento de hibridizações entre essas espécies, devido, principalmente à assincronia de florescimento. O objetivo deste trabalho foi estimar a viabilidade polínica de grãos de pólen de diferentes espécies de Manihot utilizando diferentes metodologias, e avaliar a tolerância do pólen ao armazenamento em nitrogênio líquido.Foram utilizados quatro acessos da espécie cultivada M. esculenta spp. esculenta, e seis acesssos oriundos de cinco espécies silvestres (M. esculenta ssp. flabellifolia Pohl Cif, M.esculenta ssp peruviana Mueller Argoviensis, M. dichotoma Ule, M. anomala Pohl e M. irwinii D. J. Roger & Appan). Para avaliação da viabilidade polínica foram utilizados os métodos colorimétricos, fluorocromático, germinação in vivo e in vitro. Para o experimento de criopreservação foram utilizados grãos de pólen fresco e desidratado. Os grãos de pólen das espécies de Manihot mostraram alta viabilidade em todos os métodos avaliados com exceção do método in vitro. Os valores mais elevados foram registrados com o teste colorimétrico sugerindo uma superestimação quando comparado com os outros métodos.Já os tratamentos utilizados usando a tolerância dos grãos de pólen ao congelamento em nitrogênio líquido não foram eficientes, deixando evidente a necessidade de novas estratégias de crioproteção. Palavras­chave: Mandioca. Palinologia. Pré­melhoramento. Recursos genéticos.
64 ABSTRACT Studies related to the viability and preservation of pollen grains of Manihot species are fundamental to the development of hybridization between these species, mainly due to the asynchrony of flowering. The aim of this study was to estimate the pollen viability grains of different species of Manihot using different methodologies, and to evaluate the pollen tolerance to storage in liquid nitrogen. We used four accessions of cultivated species M. esculenta spp. esculenta and six accessions from five wild species (M. esculenta ssp. flabellifolia Pohl Cif, M. esculenta ssp peruviana Mueller Argoviensis, M. dichotoma Ule, M.anomala Pohl and M. irwinii D.J. Roger & Appan). For evaluation of pollen viability were used methods colorimetric, fluorescence,in vivo and in vitro germination. For the experiment were used for cryopreservation of fresh pollen grains and dehydrated. The pollen grains of Manihot species showed high viability in all methods except the method evaluated in vitro. The highest values were recorded with the colorimetric test suggesting a overestimation when compared with other methods. Treatments used for freezing tolerance of pollen were not efficient for storage in liquid nitrogen, making evident the need for new strategies for cryoprotection. Keywor ds: Cassava. Palynology.Pre­breeding.Genetic resources.
65 3.1 INTRODUÇÃO A mandioca (Manihot esculenta Crantz) é a única das 98 espécies de Manihot que possui importância econômica, e possui três subespécies conhecidas, M. esculenta Crantz ssp. esculenta , M. esculenta ssp. flabellifolia (Pohl)Cif. eM. esculenta ssp . peruviana (Mull. Arg.s) Allem(ALLEM, 2001). Desde a sua introdução nos países tropicais da África e Ásia, a partir da América do Sul, a mandioca é cultivada em mais de 90 países, considerada uma cultura estratégica no combate a fome em áreas de baixa pluviosidade (MONTAGNAC et al., 2009). As espécies silvestres do gênero Manihot e subespécies de M. esculenta se constituem em uma fonte de genes que pode ser usada para a obtenção de novas variedades, ainda que poucos esforços tenham sido realizados nessa direção. Estudos mostraram combinações interessantes de proteínas nas espécies M. esculenta ssp. flabellifolia , M. esculenta ssp. peruviana e M. tristis Mull. Arg. (CIAT, 2003). Akinbo et al. (2012) ao avaliarem progênie F1 oriundas do cruzamento entre a espécie cultivada e M. esculenta ssp. flabellifolia identificaram progênies com teores de proteína acima de 11,5%, percentagem superior a observada normalmente em mandioca, que varia de 0,7 – 1,4% (NASSAR; DOREA, 1982). Dentre as limitações encontradas para o uso destas espécies no melhoramento da mandioca, destaca­se o pouco conhecimento sobre aspectos de morfologia e longevidade do pólen destes materiais, assim como, a assincronia de florescimento que é um aspecto crucial no impedimento de hibridações que poderiam gerar variedades de interesse relevante. Neste aspecto, estratégias apropriadas de conservação de pólen tornam­se fundamentais para permitir essas hibridações e gerar inovações nos programas de melhoramento pela introgressão de novos genes. Além disso, a conservação de pólen também é importante para pesquisas básicas, estudos de cruzabilidade, assim como para o intercâmbio e preservação de germoplasma (HANNA, 1994; RAJASEKHARAN et al., 2013). O pólen conservado, no entanto, deve preservar sua viabilidade e por isso a necessidade de monitorar essa capacidade antes, durante e depois do período de armazenamento. Dessa forma, deve­se estabelecer o período máximo em que os grãos de pólen podem permanecer conservados sem perder a capacidade de germinar, assim como estabelecer um banco de pólen conservado a ser disponibilizado para o melhorista, permitindo, além das hibridações desejadas, o intercâmbio entre instituições.
66 A viabilidade do pólen pode ser determinada por diferentes métodos, sendo os mais utilizados os testes colorimétricos; germinação in vitro; germinação in vivo, polinização in vivo, reação fluocromática e a porcentagem de frutificação efetiva (GALETTA, 1983). A criopreservação é um método eficiente para conservação de pólen, já que este pode ficar armazenado por tempo indeterminado. Para o sucesso desta técnica, fatores relacionados ao estágio fisiológico da flor, a temperatura, umidade relativa do ambiente de armazenamento, e do grau de umidade do grão de pólen devem ser previamente estabelecidos (AKIHAMA et al., 1979; GIORDANO et al., 2003). Entretanto, não existem estudos publicados sobre a viabilidade e conservação de pólen de plantas de Manihot e, consequentemente, poucos são os estudos existentes sobre compatibilidade e cruzabilidade entre as espécies silvestres do gênero. Neste sentido o objetivo deste trabalho foi estimar a viabilidade polínica de grãos de pólen de diferentes espécies de Manihot utilizando quatro métodos distintos: colorimétrico, fluorescência in vivo e in vitro, e avaliar a tolerância do pólen ao armazenamento em nitrogênio líquido. 3.2 MATERIAIS E MÉTODOS Neste trabalho foram utilizados grãos de pólen de quatro acessos da espécie cultivada M. esculenta spp. esculenta e seis acessos envolvendo cinco espécies silvestres (Tabela 1), mantidos na coleção da Embrapa Mandioca e Fruticultura. Tabela 1 – Acessos e espécies de Manihot utilizados. Código do acesso BGM 116 BGM 728 BGM 940 TN 001 PER 002V FLA 029V­01 DIC 001 ANO 049V­05 IRW 027­01 IRW 027­07 Nome comum 'Cigana Preta' ‘Clone­370’ ‘Muxuanga’ 'Mandiocaba' 'Mandioca silvestre' 'Mandioca silvestre' 'Mandioca silvestre' 'Mandioca silvestre' 'Mandioca silvestre' 'Mandioca silvestre' Espécie M. esculenta Crantz ssp.esculenta M. esculenta Crantz ssp.esculenta M. esculenta Crantz ssp.esculenta M. esculenta Crantz ssp.esculenta M. esculenta sspperuviana (Mull. Arg.s) Allem M. esculenta ssp.flabellifolia (Pohl) Cif. M. dichotoma Ule M. anomala Pohl M. irwinii D. J. Roger & Appan M. irwinii D. J. Roger & Appan
67 3.2.1 Testes de viabilidade polínica 3.2.1.1 Teste colorimétrico Para análise de viabilidade por meio de corantes, foram utilizados grãos de pólen dos acessos BGM 116, TN 001, PER 002V, FLA 009V­01, DIC 001, ANO 049V­05, IRW 027­01 e IRW 027­07. Grãos de pólen de cada acesso foram aspergido sobre lâmina de vidro e corado com os corantes: lugol 1%, carmim acético 2%, orceína acética 1% e solução de Alexander. Os grãos de pólen foram observados 10 minutos após a adição dos corantes. A fim de se obter uma amostragem ao acaso dos grãos de pólen corados, foi utilizado o método de varredura, sendo contabilizados 100 grãos de pólen/lâmina/genótipo com três repetições cada, perfazendo um total de 300 grãos de pólen para cada corante investigado, com auxílio de um microscópio óptico Leica usando­se uma lente objetiva de 20x. Foram considerados grãos de pólen viáveis, aqueles que apresentassem as seguintes características: corados, formato circular de tamanho grande ou médio e uniformes. As fotomicrografias dos grãos de pólen foram realizadas com auxílio de um microscópio óptico de fluorescência OLYMPUS U­RFL­T, utilizando a ocular 20x. O delineamento experimental foi inteiramente casualizado em esquema fatorial 5 x 3 (acessos x corantes) com três repetições, sendo cada repetição formada por 100 grãos de pólen. 3.2.1.2 Teste de reação fluorocromática Como material vegetal foram utilizados grãos de pólen dos acessos BGM 116, TN 001, PER 002V, FLA 009V­01, DIC 001, ANO 049V­05, IRW 027­01 e IRW 027­07. Inicialmente flores pistiladas e estaminadas foram protegidas com sacos de tecido com a finalidade de evitar a contaminação por pólen exógeno. No dia seguinte, cruzamentos e autofecundações manuais foram realizados entre diferentes acessos (Tabela 4) por volta das 09:00 horas da manhã, logo após a antese, momento em que o estigma encontra­se com maior receptividade. Após 24 horas da polinização, as flores pistiladas foram coletadas e levadas para o Laboratório de Cultura de Tecidos Vegetais da Embrapa Mandioca e Fruticultura, Cruz das Almas, BA. A fixação dos estigmas consistiu na imersão dos mesmos em solução de etanol­ácido acético 3:1 (FAA) por 24 horas. As amostras foram então lavadas com etanol 70% e submetidas ao processo de autoclavagem por 25 minutos sob pressão de 1kg/cm 2 em solução
68 de sulfito de sódio (Na2SO3) com objetivo de molificação e clareamento dos tecidos. Após esse procedimento, os estigmas foram lavados com água destilada e submersos na solução corante de anilina azul 0,01% por 24 horas.Para visualização dos tubos polínicos, foi depositado um estigma em cada lâmina de vidro, com três gotas do corante anilina azul e cobertos com lamínulas de vidro. Para cada cruzamento foram avaliadas três lâminas. Após o preparo do material, as lâminas foram levadas ao microscópio óptico de fluorescência OLYMPUS U­RFL­T, onde foram visualizadas e fotografadas na ocular 10x. Contou­se o número de grãos de pólen aderidos ao estigma (pólen total) e o número de grãos de pólen germinados. A taxa de viabilidade do pólen foi estimada pela porcentagem de pólen germinado, com tubos polínicos bem desenvolvidos, em relação ao pólen total contabilizado por estigma. 3.2.1.3 Teste de germinação in vivo Foram realizados cruzamentos segundo a metodologia utilizada por Fukuda (2002) para os testes de viabilidade do pólen in vivo, envolvendo duas variedades de mandioca Manihot esculenta Crantz ssp. esculenta (BGM 940 e BGM 728), o acesso FLA 029V­01 da subespécie Manihot esculenta Crantz ssp. Flabellifolia, e o acesso PER 002V da subespécie M. esculenta ssp peruviana mantidas na coleção de trabalho da Embrapa Mandioca e Fruticultura, Cruz das Almas, BA. A escolha dos acessos foi realizada de acordo com a capacidade de produção de flores. Para a realização dos cruzamentos, flores pistiladas e estaminadas foram cobertas com sacos de pano de 20 x 15 cm de comprimento, a fim de protegê­las da contaminação por pólen exógeno no momento da abertura floral. Foram eliminados frutos, flores estaminadas e flores pistiladas já fecundadas presentes na mesma inflorescência com o auxílio de uma tesoura. O pólen foi colhido entre 09:00 e 14:00 horas, horário já designado como ideal para a realização de cruzamentos (VIEIRA, 2010). A polinização foi alcançada a partir do contato das anteras sobre o estigma da flor pistilada. A flor foi coberta após a polinização e logo em seguida foi realizada a identificação dos tratamentos com o uso de etiquetas contendo informações sobre o nome dos parentais, o número de flores polinizadas e a data da polinização. A viabilidade do pólen foi estimada após a contagem do número de frutos que originaram sementes e a média de sementes por fruto.
69 3.2.1.4 Teste de germinação in vitro Neste método foram utilizados grãos de pólen de três subespécies de mandioca (M. esculenta spp esculenta,M. esculenta spp flabellifolia e M.esculenta spp peruviana). Grãos de pólen foram coletados no campo por volta das 09:00 horas da manhã e levados para o laboratório de Cultura de Tecidos da Embrapa Mandioca e Fruticultura, Cruz das Almas, BA. Em seguida eram depositados diretamente sobre a superfície do meio de germinação in vitro utilizado por Mbahe et al. (1990). Foi realizada a contagem de grãos de pólen aderidos no meio de germinação e os grãos pólen germinado com o auxílio de uma lupa bi ocular. Foi considerado grão de pólen germinado aqueles que apresentaram desenvolvimento de tubo polínico igual ou maior que o diâmetro do grão. 3.2.2Criopr eser vação de pólen 3.2.2.1 Tolerância à desidratação Foram utilizadas anteras do acesso de Manihot esculenta spp flabelifollia, ‘FLA 029V­ 01’, mantido no Banco de Germoplasma de Mandioca da Embrapa Mandioca e Fruticultura, Cruz das Almas, BA. As flores coletadas foram levadas ao Laboratório de Cultura de Tecidos. Para a avaliação da tolerância à desidratação do pólen de Manihot esculenta , foram utilizados dois procedimentos diferentes: desidratação em câmara de fluxo laminar e desidratação em sílica gel. Em ambos os procedimentos as anteras foram depositadas em envelopes abertos de papel alumínio e foram submetidas diretamente à exposição por diferentes períodos (15, 20, 25 e 30 minutos). Foram utilizadas 50 anteras para cada tratamento. Anteras não desidratadas foram usadas como tratamento controle. Determinou­se a umidade do grão de pólen para todos os tratamentos, adotando a mesma metodologia utilizada para determinação do grau de umidade de sementes (BRASIL, 2009). Para avaliação da viabilidade polínica após a desidratação foi utilizado o método de reação fluocromático. Para visualização dos tubos polínicos os estigmas foram depositados em lâminas de vidro, com três gotas do corante anilina azul e cobertas com lamínulas de vidro. As lâminas foram levadas ao microscópio óptico de fluorescência OLYMPUS U­RFL­ T e visualizadas na lente de 10x.
70 3.2.2.2 Métodos de criopreservação Como material vegetal foram utilizados grãos de pólen de acessos dassub­espécies de mandioca (M. esculenta,M. flabellifolia e M. peruviana). Foram comparadas duas formas de armazenamento de pólen: 1. Pólen fresco : 30 flores estaminadas dos acessos BGM 116, FLA 029V­01 e PER 001foram coletadas por volta das 8:00 horas da manhã no BAG de mandioca da Embrapa Mandioca e Fruticultura, Cruz das Almas, BA. Em condições de laboratório os grãos de pólen foram pincelados em papel alumínio e sem nenhum tratamento prévio foram submersos em nitrogênio líquido por 24 horas. O descongelamento ocorreu em estufa a 45°C por 3 minutos. Após o crioarmazenamento foram realizados testes de viabilidade polínica pelo método colorimétrico, fluocromático, germinação in vitro e por polinização in vivo. 2. Pólen desidratado: Neste método os grãos de pólen foram desidratados utilizando­se três métodos: em câmara de fluxo laminar por 20 minutos, em sílica gel por 1, 2, 3 e 6 horas; e por fim, em estufa a 60°C por 20, 25 e 30 minutos. Após a desidratação os grãos de pólen foram armazenados em nitrogênio líquido por 24 horas, descongelados em estufa a 45°C por 3 minutos e após esse procedimento foi realizado o teste de viabilidade polínica pelo método fluorocromático. Para cada tratamento foram avaliadas cinco repetições, com 200 grãos de pólen cada. 3.2.2.3 Microscopia eletrônica de varredura Foi realizado no laboratório do NAP/MEPA – ESALQ/USPa microscopia eletrônica de varredurapara avaliação das estruturas dos grãos de pólen fresco, após a desidratação em câmara de fluxo laminar por 15, 20, 25 e 30 minutos e após o armazenamento por oito dias em nitrogênio líquido. As anteras foram colocadas em tubos eppendorf contendo solução fixadora de Karnovsky. As amostras foram desidratadas em série etílica crescente (35, 50, 60, 75, 85, 95 e 100%). A secagem das amostras foi realizada ao ponto crítico utilizando CO2 líquido. Em seguida, foram depositadas diretamente sobre suportes metálicos (STUBS), metalizadas com ouro e observadas ao microscópio eletrônico de varredura Zeiss LEO 435 VP e as imagens digitalizadas. 3.2.3 Análises estatísticas O delineamento experimental foi inteiramente casualizado com três repetições, sendo cada repetição formada por 500 grãos de pólen. Os dados expressos em percentagem foram
71 transformados em arcsen √x/100, para atendimento das pressuposições da ANOVA. As médias foram comparadas pelo teste de Tukey, ao nível de 5% de probabilidade, com o uso do programa SAS 9.2 (2008). 3.3 RESULTADOS E DISCUSSÃO 3.3.1 Teste de viabilidade polínica Teste colorimétrico Ainda que os quatro corantes mostraram resultados com elevadas taxas de viabilidade, os corantes lugol 1% e a orceína acética 1% foram os que estimaram as maiores porcentagens de grãos de pólen viáveis (96 e 94%), respectivamente, independente do acesso avaliado ( Tabela 2, Figura 1). Tabela 2. Porcentagem de grãos de pólen viáveis de Manihot estimada em quatro corantes distintos: lugol, carmim acético, orceína acética e solução de Alexander. Cor antes Média (% ) Lugol 1% 96 a Carmin acético 2% 88 b Orceina acética 1% 94 a Solução de Alexander 84 c CV 1,54 *Médias seguidas pela mesma letra na coluna não diferem entre si pelo teste de Tukey 5% de probabilidade. Apesar dos testes colorimétricos apresentarem, normalmente, resultados superestimados, o uso desses corantes permite inferências importantes sobre constituintes celulares e sobre a integridade dos grãos de pólen avaliados (MUNHOZ et al., 2008). A solução de Alexander é considerada por muitos autores, como um dos corantes mais confiáveis por diferenciar através das cores o protoplasma e a parede celular (BATTISTIN; MATTOS, 2002, AULER et al., 2006). Este corante utiliza uma solução tripla, composta por orangeG, fucsina básica e verde malaquita. A fucsina básica é um corante específico para DNA, corando o citoplasma de vermelho; o verde malaquita colore de verde a parede do grão de pólen e o orangeG é um
72 intensificador. Através desse teste, o núcleo do grão de pólen viável reage com a fucsina e se cora de rosa, enquanto os grãos inviáveis coram­se de verde.A coloração com lugol baseia­se em uma reação química que acontece entre o iodo e a molécula de amido, dando aos grãos de pólen viáveis uma coloração marrom e aos inviáveis, devido à ausência de amido, uma coloração amarela­clara, apresentando­se transparentes. Já no teste do carmim acético, os grãos de pólen viáveis apresentam uma coloração rosa/vermelha forte, enquanto os grãos inviáveis mostram­se transparentes e não corados, devido à reação com o material genético existente no citoplasma, como o DNA (PAGLIARINI; POZZOBON, 2004). Conforme a Figura 1 (A­D) os métodos colorimétricos empregados revelaramgrãos de pólen com boa integridade celular.Apesar dos testes de coloração ser rápido, fácil e de baixo custo, esse método não fornecem informações sobre a capacidade germinativa do pólen, sendo mais indicado para essa finalidade o uso de testes de germinação in vitro , in vivoou via reação fluorocromática, também conhecido como teste do FCR (MARTINS, 2010). Figur a 1. Teste colorimétrico em acessos de Manihot. A ­ lugol 1%; B – carmim acético 2%;C ­ orceína acética; D ­ solução de Alexander. Comparando a viabilidade dos grãos de pólen entre os acessos de mandioca (Tabela 3) a maior porcentagem de grãos de pólen viáveis foi observada em M. esculenta spp.
73 peruviana (PER 002 V), M. spp . flabelifollia (FLA 029V­01), M. anomala (ANO 049V­01), e M.esculenta spp.esculenta (TN 001), com 95%, 94%, 91 e 90%, respectivamente. A menor detecção de grãos de pólen viáveis foi observada emM.esculenta spp. esculenta (BGM 116), com 78%. Estes resultados corroboram com os obtidos por Vieira et al. (2012) onde os maiores percentuais de pólen viável foram registrados nas subespécies silvestres em comparação com a cultivada. A domesticação da mandioca foi realizada a partir de seleções voltadas prioritariamente para uma maior tuberização e facilidade para reprodução por manivas em detrimento de sua reprodução sexual, o que pode ter levado a redução da funcionalidade do pólen e explicar em parte os resultados obtidos nestes trabalhos (CREPALDI, 1992). Tabela 3. Porcentagem de grãos de pólen viáveis de diferentes acessos de Manihota partir da média obtida dos testes colorimétricos. Nome da espécie (Acesso) Média (% ) M.esculenta spp. esculenta (TN 001) 90 ab M.esculenta spp. esculenta (BGM 116) 78 c M. esculenta spp. flabelifollia (FLA 029V­01) 94 a M. esculenta spp. peruviana (PER 002V) 95 a M. dichotoma (DIC 001) 86 b M.anomala (ANO 049V­05) 91 ab M. irwinii (IRW 027­07) 87 b CV(%) 5,03 *Médias seguidas pela mesma letra na coluna não diferem entre si pelo teste de Tukey 5% de probabilidade. De acordo com Souza (2002), valores acima de 70% são considerados como alta viabilidade polínica, de 31 a 69% como média e até 30%, baixa. Os resultados apresentados neste trabalho corroboram os discutidos na literatura sobre mandioca, segundo os quais a taxa de viabilidade de pólen utilizando o método colorimétrico é superior a 60% (SILVA et al., 2001; VIEIRA et al., 2012). Não houve efeito significativo na interação acesso x corantes utilizados. Teste de reação fluorocromática O uso da fluorescência permitiu a visualização do pólen germinado e os resultados obtidos mostraram diferenças significativas entre os cruzamentos (Tabela 4). As maiores taxas de grão de pólen germinados foram observadas nos cruzamentos entre PER 005 V x PER 002 V (85%), PER 002 V x FLA 029V­01 (84%), FLA 029V­01 autofecundada com 81% e FLA
74 029V­01 x TN 001 (77%). A menor porcentagem de tubos polínicos desenvolvidos foi observada no cruzamento FLA 029V­01 x DIC 001, com apenas 5% de grãos germinados. Baixas taxas de germinação também foram obtidas com os cruzamentos entre IRW 027­01 e IRW 027­07 e FLA 029V­01 e ANO 049V­05 (Figura 2). Tabela 4. Taxa de tubos polínicos desenvolvidos (%) em cruzamentos entre acessos do gênero Manihot pelo método de fluorescência. Estigma Nº de pólen ger minado (% ) Pólen Nº de pólen ader ido FLA 029V­01 TN 001 235 cd 77 a BGM 116 BGM 116 216 d 56 b PER 002 V FLA 029V­01 500 b 84 a FLA 029V­01 FLA 029V­01 509 b 81 a PER 005 V PER 002 V 300 cd 85 a FLA 029V­01 DIC 001 237 cd 5 d IRW 027­01 IRW 027­07 933 a 32 c FLA 029V­01 ANO 049V­05 305 cd 27 c CV 1,66 *Médias seguidas pela mesma letra na coluna não diferem entre si pelo teste de Tukey a 5% de probabilidade. Figur a 2. Desenvolvimento de tubo polínico nos cruzamentos: A – FLA 029V­01 x TN 001; B – BGM 116 x TN 001; C – IRW 027­01 x IRW 027­07; D – FLA 029V­01 x ANO 049V­051; E ­ BGM 116 autofecundada e F – FLA 029V­01 autofecundada. Ocular 10x. Os resultados apresentados na Tabela 4 mostram que maiores taxas de germinação relativa ocorreram quando foram utilizados progenitores da mesma subespécie. Esse fato pode
75 estar relacionado com a pequena distância evolutiva desses acessos, já que a subespécies M.esculenta ssp. flabellifolia e M. esculenta ssp. peruviana são consideradas como ancestrais silvestres que deram origem a mandioca cultivada (M. esculenta ssp. esculenta ) (ALLEM, 2000). Na autofecundação de M. esculenta ssp. flabellifolia (FLA 029V–01) foi observado alta percentagem de tubos polínicos desenvolvidos, deixando evidente a ausência de mecanismos de autoincompatibilidade na subespécie. Nassar (1985) observou que flores pistiladas e estaminadas abriam frequentemente ao mesmo tempo em clones de mandioca sem haver autoincompatibilidade entre eles. Kawano et al. (1978) também não encontraram barreiras para prevenção de autofertilização em M. esculenta Crantz. Um dos facilitadores para esse fenômeno é a forma dos estigmas, que é carnoso, com ondulações e pegajosos, o que propicia a fertilização pelos insetos polinizadores. Apesar de a mandioca possuir alta variabilidade genética, a ocorrência de autopolinização pode provocar a endogamia na espécie (FUKUDA et al., 2002). Já os cruzamentos realizados entre FLA–029V­01 e os acessos silvestres DIC 001 e ANO 049V­05 apresentaram baixa germinação de pólen, sugerindo uma provável incompatibilidade entre as espécies. Esse resultado, no entanto, não pode ser considerado conclusivo no que se refere à viabilidade polínica desses acessos, uma vez que esses materiais podem apresentar boa germinação se hibridizados com outros acessos, considerados compatíveis. O teste de correlação realizado entre as variáveis número de grãos de pólen aderidos e pólen germinado mostrou uma correlação ligeiramente positiva (r = 0.56), o que evidencia que estas variáveis devem ser usadas com restrição como indicativo de compatibilidade entre acessos ou espécies. Já o cruzamento IRW 027­01 x IRW 027­07 apresentou boa aderência do pólen ao estigma, porém obtiveram baixas taxas de germinação. Já no cruzamento entre FLA 029V­01 x TN 001 foi observado baixo número de grãos de pólen aderidos ao estigma e alta porcentagem de pólen germinado (77%). Germinação in vivo O maior número de frutos com sementes foi observado no cruzamento envolvendo acessos da mesma subespécie como progenitor feminino e masculino, os BGMs 940 e 728 respectivamente (Tabela 5). A média de sementes formadas por fruto nos três cruzamentos foi
76 de duas sementes por fruto. O mesmo valor em média foi obtido por Silva et al. (2001) ao avaliar o número de sementes produzidas por fruto de nove acessos de mandioca cultivada. De acordo com os resultados desses autores, o fruto de mandioca quando é formado, apresenta maior probabilidade de conter duas ou três sementes; entretanto, sementes originadas de fruto com apenas uma semente, apresentam maior probabilidade de germinar. Tabela 5. Viabilidade in vivo de pólen fresco observada entre variedades da subespécie M. esculenta e entre as subespécies M. esculenta ssp. esculenta , M.esculenta ssp. flabellifolia e M.esculenta ssp. peruviana Pr ogenitor feminino Pr ogenitor masculino Fr utos com sementes (% ) M. esculenta ssp. esculenta (BGM M. esculenta ssp. esculenta (BGM 80 a M. esculenta ssp. esculenta (BGM M. esculenta ssp. flabellifolia (FLA 60 b M. esculenta ssp. esculenta (BGM M. esculenta ssp. peruviana (PER 002 50 b CV 12,01 *Médias seguidas pela mesma letra na coluna não diferem entre si pelo teste de Tukey a 5% de probabilidade. No cruzamento entre as duas subespécies distintas, a porcentagem de frutos formados foi inferior, demonstrando que apesar da fraca barreira reprodutiva existente entre espécies de Manihot, a interação entre genótipos progenitores influenciaram na produção de frutos e sementes. Não houve a ocorrência de frutos sem sementes (partenocarpia) em nenhum dos acessos avaliados (Figura 3). Figur a 3. Hidridização manual ente M.esculenta ssp. esculenta e M. esculenta ssp. flabellifolia. A – Flores pistiladas protegidas com saco de tecido. B – Formação de frutos após hidridizações. C – Semente de mandioca formada a partir de cruzamentos manuais.
77 Germinação in vitro Houve baixa taxa de grãos de pólen germinados in vitro nas duas subespécies avaliadas, sendo que o acesso de M. flabellifolia apresentou maior porcentagem de grãos de pólen germinados (Tabela 6, Figura 4). Esses resultados não diferem dos obtidos por Mbahe et al. (1990) e Vieira (2010), indicando a alta dependência do conteúdo estigmático na germinação do pólen de Manihot esculenta. Tabela 6. Viabilidade in vitrode grãos de pólen fresco das sub­espéciesM.esculenta spp. esculenta, M. esculenta spp. flabellifolia e M. esculenta spp. peruviana no meio de cultura utilizado por Mbahe (1990). Média de pólen ger minado (% ) Sub­espécie Nº de gr ãos avaliados M esculenta spp. esculenta 500 0,8 M. esculenta spp. flabellifolia 900 1,1 M esculenta spp. peruviana 400 0 Figur a 4. Grão de pólen germinado do acesso FLA 029V­01 em meio utilizado por Mbahe (1990) em M. esculenta spp. esculenta . Comparando­se os resultados obtidos entre os métodos avaliados não é possível, com exceção da germinação in vitro, concluir pela superioridade ou maior eficiência de algum de forma isolada, ainda que, o método de fluorescência, no caso da mandioca seja o mais indicado. Os métodos colorimétricos avaliam, em separado, características que mostram a
78 integridade polínica e podem ser, portanto, indicadores de boas condições de germinabilidade mas não são conclusivos. Por outro lado, a fluorescência, assim como a fertilização in vivo mostram de forma contundente a germinação do pólen e a formação de sementes, ainda que, em condições especificas, ou seja, em determinados cruzamentos, atestando mais sobre a compatibilidade entre os acessos, do que sobre a viabilidade polínica propriamente dita. Dessa forma os testes colorimétricos e os métodos de fluorescência ou de fertilização in vivo podem e devem ser considerados como complementares. Por outro lado, os resultados obtidos com a germinação in vitro , apontaram de forma clara a necessidade de novos experimentos que possam quebrar a resistência observada pelo pólen de mandioca às condições de cultivo estabelecidas. Essa dificuldade na germinação in vitro de pólen de mandioca já foi registrada anteriormente por Mbaheet al. (1990) e Vieira (2010) sugerindo uma forte dependência de componentes estigmáticos ou algum tipo de dormência, que sejam responsáveis por essa falta de germinação. 3.3.2 Cr iopreser vação de pólen Tolerância à desidratação A de umidade após diferentes períodos de exposição ao fluxo laminar variou de 88 (após 15 minutos) a 77% (após 30 minutos), enquanto que na desidratação em sílica gel variou de 76 (após 15 minutos) a 69% (após 30 minutos). Em ambos os tratamentos houve redução gradativa da umidade à medida que se aumenta o tempo de exposição, ainda que a sílica pareça ter uma propriedade de retirar água das células mais rapidamente (Tabela 7). Tabela 7. Conteúdo de água ­ CA (%) e porcentagem de pólen viável (PV) de grãos de pólen de M.esculenta ssp. flabellifolia após diferentes métodos de desidratação: exposição em câmara de fluxo laminar e em sílica gel. Sílica gel Fluxo laminar Tempo de Exposição (min) CA (%) PV(%) CA (%) PV(%) 0 100 81 a 100 81 a 15 88 72 b 76 5,57 b 20 83 28 c 74 3,51 c 25 78 27 c 70 0 d 77 3 d 69 0 d 30 *Médias seguidas pela mesma letra na coluna não diferem entre si pelo teste de Tukey a 5% de probabilidade.
79 No que se refere à viabilidade do pólen, os resultados diferem de forma marcante entre os dois tratamentos, como pode ser visto pela reação fluocromática (Tabela 7). No fluxo laminar redução significativa foi observada após 20 minutos de exposição, sendo registrada uma redução de 72 para 28% de pólen viável, Em sílica, o primeiro tempo de exposição (15 minutos) já compromete totalmente a germinação do pólen, tendo­se registrado uma queda de, praticamente, 75% na viabilidade polínica. O limite de desidratação dos grãos de pólen parece estar próximo dos 88% já que com 83% de umidade houve uma redução de aproximadamente 60% na viabilidade do pólen. Em geral polens tricelulares coletados na antese apresentam elevada umidade e sobrevivência limitada ao grau de desidratação como visto nos resultados apresentados neste trabalho (TOWILL; WALTERS, 2000). Para os sistemas de criopreservação, a tolerância à retirada de água é um fator crucial, e a baixa tolerância pode ser limitante para o uso dessa técnica. Métodos de criopreservação O porcentual de grãos de pólen viáveis após a criopreservação foi extremamente baixo (abaixo de 1%) nos grãos de pólen fresco e desidratado por 20 minutos em câmara de fluxo laminar em todos os acessos e métodos avaliados para confirmar a viabilidade polínica, com exceção do método colorimétrico, que apresentou porcentagem de grãos de pólen viáveis acima de 50% (Tabela 8), reafirmando a confiabilidade dos métodos.Em todos demais métodos de desidratação e períodos de exposição não houve a ocorrência de pólen viável após o congelamento em nitrogênio líquido. Tabela 8. Porcentagem de pólen fresco e desidratados viáveis das subespécies M. esculenta ssp. esculenta e M. esculenta ssp. flabellifolia após crioarmazenamento por diferentes métodos. PF – pólen fresco. PD – pólen desidratado por 20 minutos em câmara de fluxo lâminar. Pólen viável (% ) M. ssp esculenta M. ssp flabellifolia M. ssp peruviana Metódo PF PD PF PD PF PD Carmim acético 63 67 65 70 71 80 Fluorocromático 0 0 0 0 0 0 In vivo 0 0 0 2 0 0 In vitro 0 1,5 0 0 0 0
80 Na Figura 5 pode se observar a presença de grãos de pólen germinados após o armazenamento em nitrogênio líquido em diferentes métodos para estimativa de viabilidade polínica. Figur a 5. Grãos de pólen de M. esculenta após imersão em nitrogênio líquido. A – Germinação in vitrodo pólen de M. esculenta ssp. esculenta. B – Germinação in vivode grãos de pólen de M. esculenta ssp. flabellifolia e C – Ausência de germinação utilizando o método fluorocromático. O tempo de exposição de 15minutos em câmara de fluxo laminar, que promoveu previamente os melhores resultados em manter a viabilidade do pólen, foi insuficiente para proteger os tecidos do ultraconglamente, muito provavelmente porque a queda da umidade foi de apenas 12%. Possivelmente, ocorreram injurias mecânicas e/ou fisiológicas causadas pelo excesso de água dentro das células. Os resultados deste trabalho mostram que a criopreservação de pólen das espécies avaliadas é um processo árduo devido à sua intolerância à desidratação acima de 30%. De acordo com Towill e Walters (2000), a tolerância à desidratação intracelular depende da composição química do pólen a ser desidratado, e para fins de criopreservação, bons resultados vêm sendo observados em grãos de pólen com 15­25% de umidade. Vargas et al. (2009) ao avaliar grãos de pólen de mamona, outra espécie da família Euphorbiaceae, também observaram baixa taxa germinação após o armazenamento em nitrogênio líquido, obtendo apenas 0,08 % de grãos de pólen germinado. Microscopia eletrônica de varredura Foi possível observar alterações na estrutura da exina dos grãos de pólen com a utilização da microscopia eletrônica de varredura (Figura 6). Os resultados obtidos com o pólen criopreservado correspondem ao que foi observado com os dois métodos de desidratação. A intolerância do pólen de mandioca ao ultracongelamento pode estar relacionada à alterações fisiológicas, e/ou mecânicas, como a deformação das estruturas membranosas como pode ser observado na Figura 6­D.
81 Figur a 6. Microscopia eletrônica de varredura de grãos de pólen de mandioca. A – pólen fresco. B – pólen desidratado em câmara de fluxo laminar por 20 minutos. C – pólen sem desidratar e congelado em nitrogênio líquido por oito dias. D ­ pólen desidratado em câmara de fluxo laminar por 20 minutos e congelado em nitrogênio líquido por oito dias. (A, B e D ocular de 20x, C 0cular de 10x). As imagens geradas pela microscopia de varredura mostraram que as alterações que causam a inviabilidade do pólen após a desidratação e o congelamento não são necessariamente de natureza mecânica já que alguns grãos parecem estar íntegros (Figura 6 C e D). Dessa forma, o desafio será estabelecer uma condição que promova a tolerância do pólen à desidratação para então buscar a melhor estratégia de congelamento. CONCLUSÃO Em comparação com as outras metodologias empregadas, o teste colorimétrico superestimou o número de pólen viável. A reação fluocromática é a mais indicada para estimar a viabilidade do pólen no caso de mandioca.Os tratamentos utilizados para desidratação do pólen não são eficientes para garantir a viabilidade do pólen após o processo de congelamento em nitrogênio líquido, indicando a necessidade de novos estudos. REFERENCIAS
82 AKIHAMA, T.; OMURA, M.; KOSAKI, I. Long­term of fruit tree pollen and its application in breeding.Tropical Agriculture Research,v. 4, p. 238­241. 1979. AKINBO O, LABUSCHAGNE M, FREGENE M. Increased storage protein from interspecific F1 hybrids between cassava (Manihot esculenta Crantz) and its wild progenitor (M. esculenta ssp. flabellifolia ). Euphytica , v.185, n. 2, p. 303­311.2012. ALLEM, A.C. Ethnobotanical testimony on the ancestors of cassava (M. esculenta Crantz ssp. esculenta).Plant Genetic Resource Newletter , v. 123, p. 19­22. 2000. ALLEM, A.C. The primary gene pool of cassava (Manihot esculenta Crantz subspecies esculenta, Euphorbiaceae).Euphytica , v.120, p.127–132.2001. AULER, N.M.F; BATTISTIN, A.; REIS, M.S. Número de cromossomos, microsporogênese e viabilidade do pólen em populações de carqueja [Baccharis trimera (Less.) DC.] do Rio Grande do Sul e Santa Catarina. Revista Brasileira de Plantas Medicinais, v.8, n.2, p. 55­63. 2006. BATTISTIN, A.; MATTOS, A.C.F. Número de cromossomos, comportamento meiótico e viabilidade do pólen em três espécies de Stylosanthes Sw. (Leguminosae­Papilionoideae) nativas do Sul do Brasil. Bioikos, v.16, n.1­2, p.13­7, 2002. BRASIL, Ministério da Agricultura e Reforma Agrária. Regras para análise de sementes. Brasília, DF, Secretaria Nacional de Defesa Agropecuária. Departamento Nacional de Defesa Vegetal. Coordenação de Laboratório Vegetal. 2009. CIAT (Centro Internacional de Agricultura Tropical). Improved Cassava for the Developing World.Annual Report Project IP3. Cali, Colombia: CIAT, p. 8­65 to 8­68. 2003. CREPALDI, I. Origem, Evolução e Geografia da mandioca: Uma Revisão. Sitientibus, n.10, p. 89­94, 1992. FUKUDA, W.M.G.;SILVA, S.O. Melhoramento de Mandioca no Brasil. In: Agricultura: Tuberosas Amiláceas Latino Americano, v. 2, p. 242­57. 2002. GALETTA, G.J. Pollen and Seed Management. In: MOORE, J. N.; JANIK, J. (Ed.). Methods in fruit Breeding . Indiana: Purdne Universitz Press. p. 23­47, 1983. GIORDANO, L.B. ARAGÃO, F.A.S., BOITEUX, L.S. Melhoramento genético do tomateiro.Informe Agropecuário, Belo Horizonte, v. 24, n. 219, p. 43­57, 2003. HANNA, W.N. Pollen storage in frostless and conventional frostforming freezers.Crop Science, v.34, p.1681­1682, 1994. KAWANO, K.; AMAYA; A.; RIO, M. Factors affecting efficiency of hybridization and selection in cassava. Crop Science, v. 18, p. 373­376. 1978.
83 MARTINS, K. C. Palinologia de Capsicum spp.: caracterização, divergência genética e viabilidade polínica. 2010. 112f. Dissertação (Mestrado em Genética e Melhoramento de Plantas). – Universidade Estadual do Norte Fluminense. Rio de Janeiro. MBAHE, R.E., AKEN'OVA, M.E; HAHN, S.K. Germination of cassava (Manihot esculenta Crantz) pollen.Acta Horticulturae,v. 380.p. 172­177. 1994. MONTAGNAC, J.A.; DAVIS, C.R.; TANUMIHARDJO, S.A. Processing Techniques to Reduce Toxicity and Antinutrients of Cassava for Use as a Staple Food.Comprehensive Reviews in Food Science and Food Safety, n. 8, p. 17–27. 2009. MUNHOZ, M.L. et al. Viabilidade polínica de Carica papaya L.: uma comparação metodológica. Revista Brasileira de Botânica , v.31, n.2, p. 209­214. 2008 NASSAR, N.M.A.; DOREA, J.G. Protein content of cassava cultivars and its hybrid with wild Manihot species. Reprint from Turrialba , v. 32, p. 429­432. 1982. PAGLIARINI, M.; POZZOBON, M.T. II Curso de citogenética aplicada a recursos genéticos vegetais. Embrapa, CENARGEM­DF. 2004 RAJASEKHARAN, et al. Pollen Cryobanking for Tropical Plant Species In: NORMAH, M.N.; CHIN;H.F.; REED, M. (Org.) Conservation of Tropical Plant Species. 2013,p 65­75. 2013. SAS Institute Inc., SAS® 9.2 Qualification Tools User’s Guide, Cary, NC: SAS Institute Inc., 2008. SILVA, R. et al. Biologia reprodutiva de etnovariedades de mandioca.Scientia Agricola , v. 58, n.1, p. 101­107. 2001. SOUZA, M.M.; PEREIRA, T.N.S.; MARTINS, E.R. Microsporogênese e microgametogênese associadas ao tamanho do botão floral e da antera e viabilidade polínica em maracujazeiro­ amarelo (Passiflora edulis Sims f. flavicarpa degener ). Ciência e Agrotecnologia, Lavras. v. 26, n. 6, p.1209­ 1217. 2002. TOWILL, L.E.; WALTERS, C. Cryopreservation of pollen. In: Engelmann, F., Takagi, H. (Org.) Cryopreservation of tropical germplasm. Current research progress and application, p. 115–129, JIRCAS/IPGRI.2000.
84 VARGAS, D.P. et al. Análises de grãos de pólen de diferentes cultivares de mamona (Ricinus communis L., Euphorbiaceae): Conservação e viabilidade. Arquivos do Instituto Biológico, v.76, n.1, p.115­120, jan./mar., 2009. VIEIRA, L.J. Uso de recursos genéticos do gênero Manihot no pré­Melhoramento genético de mandioca. 2010. 65f. Dissertação (Mestrado em Recursos Genéticos Vegetais). – Universidade Federal do Recôncavo da Bahia. Cruz das Almas. VIEIRA, L.J.; SOARES, T.L.; ROSSI, M.L.; ALVES, A.A.C.; SANTOS, F.A.R., SOUZA, F.V.D. Viability, production and morphology of pollen grains for different species in the genus Manihot (Euphorbiaceae). Acta Botanica Brasilica . v. 26. n. 2. p. 340­356. 2012.
85 CAPÍTULO 4 Fluor escence microscopy method for pollen viability studies of Manihot Mill. species
86 ABSTRACT The lack of a reliable test to evaluate pollen viability in species of the genus Manihot is one of the primary limitations for performing studies aimed at the genetic improvement of the cassava. Thus, the objective of the present study was to evaluate the efficiency of using fluorescence microscopy for studies related to the pollen viability of species of Manihot. The present study used pollen grains from 2 accessions of the cultivated species M. esculenta spp. esculenta and 4 accessions of 3 wild species (M. esculenta ssp. flabellifolia (Pohl) Cif; M. anomala Pohl.; and M. irwinii D. J. Roger & Appan). The methodology was used to evaluate the pollen viability, germination time after pollination, size of the pollen tube, and pollen longevity of different accessions of Manihot. Pollen tubes developed after 45 minutes of contact between the pollen and the stigma, demonstrating that the germination of pollen grains in Manihot occurs rapidly. The size of the pollen tubes was 2.9 mm, on average,24 hours after the moment of pollination. The studies examining the longevity of pollen showed that pollen viability varied from 81% in the anthesis stage to 50% in the pre­anthesis stage; germination did not occur when the pollen grains were evaluated 24 hours after anthesis. Thus, the use of fluorescence microscopy can be considered an effective method for studying pollen morphology, longevity, viability and Manihot crossability. Keywor ds: Cassava. Resources genetics.Palynology.Pre­breeding.
87 RESUMO A falta de um teste confiável para avaliar a viabilidade do pólen em espécies do gênero Manihot é uma das principais limitações para a realização de estudos que visam o melhoramento genético da mandioca. Assim, o objetivo do presente estudo foi avaliar a eficiência do uso de microscopia de fluorescência para estudos relacionados à viabilidade do pólen de espécies de Manihot. O presente estudo utilizou grãos de pólen de dois acessos de espécies cultivadas M. esculenta spp. esculenta e quatro acessos de três espécies selvagens (M. esculenta ssp flabellifolia (Pohl) Cif;. M. anomala Pohl;. e M. irwinii DJ Roger & Appan). A metodologia utilizada propiciou avaliar a viabilidade do pólen, o tempo de germinação após a polinização, a dimensão do tubo de pólen e longevidade de pólen de diferentes acessos de Manihot. Tubos polínicos se desenvolveram após 45 minutos de contato entre o pólen eo estigma, demonstrando que a germinação de grãos de pólen em Manihot ocorre rapidamente. O tamanho dos tubos de pólen foi de 2,9 mm, em média, 24 horas após o momento da polinização. Os estudos que examinaram a longevidade do pólen mostrou que a viabilidade do pólen variou de 81% na fase de antese até 50% na fase de pré­antese; não ocorreu germinação nos grãos de pólen com 24 horas após a antese. Assim, a utilização de microscopia de fluorescência pode ser considerado como um método eficaz para estudar a morfologia do pólen, longevidade, viabilidade e cruzabilidade em Manihot. Palavras­chave: Mandioca. Recursos genética. Palinologia.Pré­melhoramento.
88 4.1 INTRODUCTION Cassava, the only cultivated species of the genus Manihot, is one of the most important food plants in the tropical and subtropical regions of the world, occupying an important position among the primary sources of food energy in terms of global caloric consumption and classified below flour, rice, corn and sorghum(Adeyemo, 2009). Cassava is tolerant to drought and has a wide adaptation to the most varied climate and soil conditions. The most important parts of the plant are its tuberous roots, which are rich in starch and used as human and animal food or as the raw material for various industries (Ike and Thurtell, 1981; Montagnac et al., 2009). However, despite the importance of cassava and its large contribution as a food source for the poorest populations, there is a real demand for improvement, not only in the nutritional quality of the root but also in obtaining plant varieties that are more resistant to biotic and abiotic factors. Wild species of the genus Manihot and the M. esculenta Crantz sub­species constitute sources of genes that can be utilized to obtain new varieties, although little effort has been made in this direction. Previous studies have shown interesting combinations of proteins in the species M. esculenta ssp. flabellifolia , M. esculenta ssp. peruviana , and M. tristis Mull. Arg. (Ciat, 2003). When evaluating the F1 progeny from crossing a cultivated species with M. esculenta ssp. flabellifolia , Akinbo et al. (2012) identified progeny with protein concentrations above 11.5%. However, the limitations for the use of these species in improving cassava include a lack of knowledge regarding aspects of the morphology and pollen longevity of these materials and the asynchrony of flowering between cultivated and wild species, which is a crucial aspect that could impede the development of hybrids of interest. Appropriate pollen conservation strategies are essential to the generation of innovations in breeding programs by the introgression of new genes. Pollen conservation is also important for basic research, crossability studies, and the interchange and preservation of the germplasm (Hanna, 1994; Rajasekharan et al., 2013). Pollen conservation must preserve pollen viability; therefore, there is a need for the monitoring of viability before, during and after storage. Thus, the maximum period for which the pollen grains can be conserved without losing their capacity to germinate must be established. The establishment of a conserved pollen bank made available to breeders would allow for testing desired hybridizations and facilitate the interchange of pollen between
89 institutions (Rajasekharan et al., 2013). However, there are no published studies regarding pollen conservation from Manihot plants; consequently, there are few existing studies regarding the compatibility and crossability of different species of the genus, including wild species. For the evaluation of longevity and the monitoring of the viability of conserved pollen, various tests can be used, which generally consist of 4 main types: a. the use of stains; b. in vitro germination; c. in vivo germination; and d. in vivo pollination and the percentage of effective fruition (Galetta, 1983). The viability of the pollen grains can be estimated by various colorimetric methods, such as Lugol’s solution, a fluorochromatic reaction (FCR), Alexander’s triple solution, and vital stains such as acetocarmine, carmine­propionic acid, sudan IV, and 2,3,5­triphenyltetrazolium chloride (TTC). Among the methods used, in vitro germination has been considered to be the most practical and appropriate method and has been broadly used in studies to estimate the pollen viability in various species (Marcellán and Camadro, 1996; Geetha et al., 2004; Souza et al., 2010). However, the results from the in vitro germination of cassava are not encouraging, and the need to evaluate more than 40 different culture media demands new efforts in this direction (Orrego and Hersley, 1984; Mbahe and Hahn, 1994). In Manihot, the most commonly employed method for establishing pollen viability is a colorimetric assay using different types of stains (Silva et al., 2001; Vieira et al., 2012). However, no correspondence was observed between the colorimetric tests and the in vivo viability tests, reinforcing theories suggested by some authors regarding the inefficiency of these stains as proof of pollen viability (Ge et al., 2011; Vieira et al., 2012; Melloni et al., 2013). Aniline blue is a stain specific for callose that fluoresces under ultraviolet light. The use of aniline blue in fluorescence microscopy allows for the visualization of pollen tubes in the stigma and along the stylet, providing information related to the compatibility of accessions and pollen viability (Kalinganire, 2000; Fonseca et al., 2002; Fang et al., 2010). This is an advanced technique with broad objectives that, when combined with studies of longevity, viability, and pollen conservation, allows for the observation of alterations in the structure of pollen grains after storage. Thus, the objective of the present study was to evaluate the efficiency of fluorescence microscopy in different studies related to pollen
90 viability in different species of Manihot. 4.2 METHODOLOGY 4.2.1 Plant mater ial Pollen grains from 2 accessions of the cultivated species M. esculenta spp. esculenta and 4 accessions involving 3 wild species (Table 1) that were maintained in the collection Embrapa Cassava and Fruticulture were used as plant material. Table 1. Accessions and species of Manihot used. Accession Accession Manihot Code Name Species BGM 116 'Cigana Preta' M. esculenta Crantz ssp.esculenta TN 001 'Mandiocaba' M. esculenta Crantz ssp.esculenta FLA 029V­01 'Mandioca silvestre' M. esculenta ssp. flabellifolia (Pohl) Cif. ANO 049V­05 'Mandioca silvestre' M. anomala Pohl IRW 027­01 'Mandioca silvestre' M. irwinii D. J. Roger & Appan IRW 027­07 'Mandioca silvestre' M. irwinii D. J. Roger & Appan 4.2.2Pollen viability tests 4.2.2.1 Colorimetric test For the analysis of viability using stains, pollen from each studied accession was sprinkled over a glass slide and stained with 3 types of stains: acetocarmine, acetic­orcein, and Alexander solution. The pollen grains were observed 10 minutes after the addition of the stains. To obtain a random sampling of the stained pollen grains, the scanning method was used. One hundred pollen grains/slide/genotype were counted using a Leica optical microscope fitted with a 20x objective lens; counts were repeated 3 times each, for a total of 300 pollen grains counted for each stain investigated. Viable pollen grains were considered to be those that showed the following characteristics: stained, a circular format with large or medium size, and a uniform shape. Photomicrographs of the pollen grains were taken with the aid of an OLYMPUS U­RFL­T optical fluorescence microscope using the 20x ocular lens. The experimental design was entirely random with 3 repetitions, each repetition consisting of 100 pollen grains. Prior to the analysis of variance, the data, expressed as percentages were transformed using the arcsin function to meet the assumptions of the ANOVA. The averages were compared by the Tukey test at a 5% probability level using the
91 SAS 9.2 program (Cary, NC: SAS Institute Inc., 2008). 4.2.2.2 Fluorochromatic Reaction test Pollination
Initially, pistillate and staminate flowers were protected with fabric sacks to avoid contamination by exogenous pollen. The next day, manual crossings and self­pollinations were performed between the different accessions (Table 3) at approximately 9:00 AM, soon after anthesis, which is the moment at which the stigma has the greatest receptivity. Twenty­ four hours after pollination, the pistillate flowers were collected and taken to the Laboratory of Biotechnology and Culture of Plant Tissues of Embrapa Cassava and Fruticulture. Staining and fixation of the stigmas The stigmas were fixated by immersion in a 3:1 ethanol­acetic acid solution (FAA) for 24 hours. The samples were then washed with 70% ethanol and subjected to autoclaving for 25 minutes at a pressure of 1 kg cm ­2 in a solution of sodium sulfite (Na2SO3) to mollify and clear the tissues. After this procedure, the stigmas were washed with distilled water and submerged in a solution of 0.01% aniline blue for 24 hours. Visualization of the pollen tubes To visualize the pollen tubes, each stigma was deposited on a glass slide with 3 drops of aniline blue stain and covered with a glass cover slip. Three slides were evaluated for each hybrid. After preparation, the slides were taken to the OLYMPUS U­RFL­T optical fluorescence microscope, where they were visualized and photographed using the 10x ocular lens. Pollen viability and statistical analysis The number of pollen grains adhering to the stigma (total pollen) and the number of germinated pollen grains were counted. The pollen viability rate was estimated by the percentage of germinated pollen, with well­developed pollen tubes in relation to the total number of pollen grains counted per stigma. The statistical analyses followed an entirely random design with 3 repetitions, with each repetition consisting of 1 pollinated stigma. The data were subjected to analyses of variance, and the averages were compared by the Tukey test at a 5% probability. For the statistical analyses, the SAS 9.2 program (Cary, NC: SAS Institute Inc., 2008) was used.
92 4.2.3 Ger mination time and size of the pollen tube For the determination of the germination time of the pollen grains and the size of the pollen tube, the FLA 029V­01 accession of M. esculenta spp. flabellifolia was used. Pollinated stigmas were fixed in a 3:1 FAA solution after different time intervals: 0:45, 1:00, 3:00, 6:00, 12:00, and 24:00 hours after pollination. To evaluate the size of the pollen tubes, 3 repetitions composed of 25 pollen grains were considered. The sizes of the developed pollen tubes were determined 24 hours after the pollination of the stigmas according to the scale in the photographs. 4.2.4. Pollen longevity For the evaluation of pollen longevity, Manihot esculenta spp. flabellifolia (FLA 029V­01) was used. Staminate and pistillate flowers were used in 4 distinct stages: 1 – pre­ anthesis; 2 – anthesis; 3 – 24 hours after anthesis and 4 – 48 hours after anthesis. The colorimetric and fluorescence tests were used to measure pollen viability in each of these stages. 4.3 RESULTS AND DISCUSSION 4.3.1 Color imetr ic tests The germination rates from the evaluated colorimetric tests can be found in Table 2. Table 2. The percentage of viable pollen grains from different accessions of Manihot, using acetocarmine, acetic­ orcein and Alexander solution stains. Stain Averages Acetocarmine Acetic­orcein Alexander solution 88 b 1 94 a 84 c Accessions Averages TN 001 IRW 027­07 ANO 049V­05 FLA 029V­01 BGM 116 90 ab 1 87 b 91 ab 94 a 78 c CV(%) 5,03 *Averages followed by the same letter in a column do not differ from each other based on the results of the
93 Tukey test at a probability of 5%. The results showed significant differences, both between accessions and methods.There was not a significant difference found in the accession x stain used interaction. The acetic­ orcein stain showed the largest percentage of viable pollen grains (94%), while the lowest percentage of viable pollen grains (84%) was observed when the Alexander solution was used (Table 2). Among the accessions evaluated by the colorimetric method, the largest percentage of viable pollen grains were observed in the species M. esculenta spp. esculenta (TN 001), M. anomala (ANO 049V­05), and M. esculenta spp . flabellifolia (FLA 029V­01). The presence of pollenkitt was observed in the colorimetric tests of pollen grains at different levels among the accessions (Figure 1) and was observed most frequently in the accessions ANO 049V­01, FLA 029V­01 and IRW 027­07. The term pollenkitt refers to a substance on the surface of the pollen grains that contains volatile components that are attractive to pollinators, thus guaranteeing the dispersion of the pollen grains and increasing the adherence of the pollen to the stigma (Pacini and Hesse, 2005). This substance is highly hydrophobic, homogeneous, contains lipids, carotenoids, flavonoids and fatty acids, which are all secreted by the tapetum cells, and remains adhered to the exine of mature pollen (Stanley and Linskens, 1974). According to Lush (1999), the presence of lipids reduces water loss from the stigma and pollen grains due to their hydrophobic nature. Figure 1. Colorimetric tests in pollen grains from different accessions of Manihot. A­ pollen from ANO 049V­05 in acetocarmine. B – pollen from FLA 029V­01 in acetic­orcein. C – pollen from TN 001 in Alexander solution. D – pollen from the accession BGM 116 in Alexander solution. The arrow points to non­viable pollen.
94 4.3.2Fluorochr omatic Reaction Test The use of fluorescence permitted the visualization of germinated pollen. The results obtained show significant differences between crossings (Table 3). The highest rates of viable pollen grains were observed in crossings between BGM 116 x TN 001 (84%), FLA 029V­01 x TN 001 (76%), and self­pollinated FLA 029V­01, with 81% of the pollen tubes being germinated. The lowest percentage of developed pollen tubes was observed in the crossing between FLA 029V­01 x ANO 049V­05, with 27% of the grains being germinated (Table 3). A comparison between data involving the same parent (FLA 029V­01) allows for some inferences to be made regarding the potential compatibility of the parent with the accession TN 001 and the reduced compatibility of the parent with the accession ANO 049V­05, although the consolidation of evidence can only be obtained with the formation of seeds from the crossings performed. The correlation test showed a slightly positive correlation (r = 0.56) between the number of pollen grains that were adhered to the stigma and the number of germinated pollen grains, which shows that this parameter must be used with restriction as an indication of compatibility between accessions or species. The crossing IRW 027­01 x IRW 027­07 showed a good adherence of pollen to the stigma; however, low rates of germination were obtained. In the crossing FLA 029V­01 x TN 001, a low number of pollen grains adhered to the stigma were observed, with a high percentage of germinated pollen (Table 3). Table 3. Number of adhered pollen, number of germinated pollen and percentage of developed pollen tubes (%) in crossings between accessions of the genus Manihot using the fluorescence method (FLM) and pollen viability with colorimetric method (CM) applied. Crossing No. of adhered No. of (%) pollen (%) pollen pollen germinated germinated by viable by (FLM) pollen (FLM) FLM CM FLA 029V­01 x TN 001 235 CD 181 C 77 A 90 A BGM 116 x TN 001 400 BC 337 AB 84 A 90 A IRW 027­01 x IRW 027­07 933 A 298 B 32 C 87 B FLA 029V­01 x ANO 049V­05 305 CD 84 C 27 C 91 AB BGM 116 self­pollinated 216 D 120 C 56 B 78 C FLA 029V­01self­pollinated 509 B 413 A 81 A 94 A CV 3,78 1,12 *Average followed by the same letter in a column do not differ from each other based on the results of the Tukey test at a probability of 5%.
95 When comparing the results obtained from the 2 methods, colorimetry overestimated the pollen viability for all of the parents used, even though it showed a correspondence with the results from 3 crossings. However, for the other 3 crossings, the results obtained by this method could not be considered, thereby demonstrating the fragility of colorimetric tests for the estimation of pollen viability in the genus Manihot. The images generated using fluorescence in the crossings can be found in Figure 2. Figur e 2. The development of the pollen tube in the crossings: A – FLA 029V­01 x TN 001; B – BGM 116 x TN 001; C – IRW 027­01 x IRW 027­07; D – FLA 029V­01 x ANO 049V­051; E ­ BGM 116, self­pollinated; and F – FLA 029V­01, self­pollinated.
96 4.3.3Ger mination time and size of the pollen tube With regards to the germination time and the size of the pollen tubes, the use of fluorescence made the visualization and evaluation of the developed tubes possible. The results from the fixation of pollen grains at different time intervals after pollination showed the presence of developed pollen tubes after 45 minutes of contact with the stigma, demonstrating that the germination of pollen grains in Manihot occurs rapidly. The size of the pollen tubes that developed 24 hours after pollination were approximately 2.9 mm, on average, varying from 1.3 to 4.2 mm (Figure 3). Figur e 3.Animage of the developed pollen tubes from M. esculenta ssp. flabellifolia that were used in the determination of the size (mm) of developed tubes 24 hours after pollination. 4.3.4Pollen longevity Studies of pollen longevity showed that the viability estimated using the colorimetric tests was higher for all of the physiological stages when compared with the FCR method, varying from 90% of the pollen in anthesis to 75% in the grains examined at a period greater than 24 hours after anthesis. In the fluorochromatic reaction test, the percentage of viable pollen was 81% for pollen at anthesis and 50% for pollen at pre­anthesis; germination did not occur when the pollen grains were evaluated 24 hours after anthesis (Table 4 and Figure 4). These results confirmed the inability of the evaluated stains to indicate cassava pollen viability, thus demonstrating the need for more efficient techniques, such as the FCR method, to determine Manihot pollen grain viability (Table 4).
97 Table 4. The pollen viability (%) of the accession FLA 029V­01 of M. esculenta spp. flabellifolia in different physiological stages using the colorimetric method and the fluorochromatic reaction method (FCR) Method Colorimetric FCR Pre­anthesis 82 50 Anthesis 90 81 24 hours after anthesis 84 0 48 hours after anthesis 75 0 Figur e 4.Evaluations of pollen viability from M. esculenta spp. flabellifolia using acetocarmine stain: A – pollen in pre­anthesis; B – pollen in anthesis; C – pollen 24 hours after anthesis; and D – pollen 48 hours after anthesis. The fluorochromatic reaction method: E – pollen in pre­anthesis; F – pollen in anthesis; G – pollen 24 hours after anthesis; and H – pollen 48 hours after anthesis.The arrows point to non­viable grains. These results did not differ from those reported by Vieira et al. (2011), who evaluated the pollen longevity of accessions of M. esculenta. They observed that the largest percentage
98 of viable pollen was recorded in crossings in which the pollen grains were used in anthesis, and, as the storage time increased, the viability and, consequently, the crossings performed were compromised; after 1 hour of storing fresh pollen at room temperature, a 20% decrease in viability was observed, and, after 24 hours, a total loss of pollen viability was recorded. As demonstrated in this study, the application of the fluorescence method to different accessions of the Manihot genus can provide useful information that can be applied in a practical manner to various studies that support the genetic improvement of the culture of cassava, especially those that generate information regarding the germination, morphology, and pollen viability, as well as in vivo compatibility reactions with the stigma. The importance of developing precise techniques for to the study of pollen has generated a series of recent studies, such as those performed with sunflower (Atlagiê et al., 2012), where a comparison between methods has demonstrated positive results when using fluorescence. Studies evaluating pollen morphology with precise results were conducted with Croton hirtus (Euphorbiaceae), Mabea occidentalis (Euphorbiaceae), and Agropyron repens (Poaceae), demonstrating the importance of investing in pollen studies (Sivaguru et al., 2012) using more precise and reliable strategies. However, no record of this type of study exists for cassava, prior to this study. Studies related to the conservation of pollen from the genus are underway, with the objective of forming a pollen bank to subsidize the improvement of cassava, making possible the generation of new hybrids (data not shown). This study was not feasible until now, due to the absence of a reliable method for the evaluation of pollen viability, which is essential for this type of study. CONCLUSION The colorimetry method may be considered like indicators of pollen viability but is not efficient to analyse the growth of them. The use of fluorescence microscopy method is the most suitable in the case of cassava, for the testing of pollen viability for any proposed objective.
99 REFERENCES Adeyemo S.2009.Molecular genetic characterization of photoperiodic genes in cassava (Manihot esculenta Crantz) and attempts to manipulate their expression to promote floral induction.PhD thesis, Universität zu Köln.Mathematisch­Naturwissenschaftliche Fakultät. Akinbo O., Labuschagne M., Fregene M. 2012. Increased storage protein from interspecific F1 hybrids between cassava (Manihot esculenta Crantz) and its wild progenitor (M. esculenta ssp. flabellifolia).Euphyt. 185: 303–311. Atlagić J., Terzić S,. Marjanović­Jeromela A. 2012. Staining and fluorescent microscopy methods for pollen viability determination in sunflower and other plant species.Ind. Crops and Prod. 35: 88–91. CIAT. 2003. Improved cassava for the developing world. Annual Report 2003. Cali, Columbia: CIAT. Fang X, Turner N.C., Yan G, Li F, Siddique K.H.M. 2010. Flower numbers, pod production, pollen viability, and pistil function are reduced and flower and pod abortion increased in chickpea (Cicer arietinum L.) under terminal drought. J. Exp Bot. 61: 335–345. Fonseca A.E., Westgate M.E., Doyle R.T. 2002.Application of fluorescence microscopy and image analysis for quantifying dynamics of maize pollen shed. Crop Sci. 42: 2201–2206. Galetta G.J. 1983. Pollen and Seed Management. In: Moore JN, Janik J, eds. Methods in fruit breeding. Indiana: Purdue University Press: 23–47. Ge Y., Fu C., Bhandari H., Bouton J., Brummer E.C., Wang Z.Y. 2011.Pollen Viability and Longevity of Switchgrass (Panicum virgatum L.).Crop Sci. 51: 2698–2705. Geetha K., Vijayabaskaran S., Jayaraman N. 2004. In vitro studies on pollen germination and pollen tube growth in maize. Food Agri. Env. 2: 205–207. Hanna W.N. 1994. Pollen storage in frostless and conventional frost forming freezers. Crop Sci. 34: 1681–1682. Ike I.F, Thurtell G.W. 1981. Response of indoor­grown cassava to water deficits and recovery of leaf water potential and stomatal activity after water stress.J. Exp Bot. 32: 1029 –1034. Atlagiê J., Terzic S., Marjanovic­Jeromela A. 2012. Staining and fluorescent microscopy
100 methods for pollen viability determination in sunflower and other plant species. Ind. Crops and Prod. 35: 88 –91. Kalinganire A.C.E., Harwood CE, Slee M.U., SIMONS A.J. 2000. Floral structure, stigma receptivity and pollen viability in relation to protandry and self­incompatibility in silky oak (Grevillea robusta A. Cunn.). A. Bot. 86: 133–148. Lush W.M. 1999. Winter chemotropism and pollen tube guidance. T. Plant Sci. 4: 413–418. Marcellán O.N., Camadro E.L. 1996. The viability of asparagus pollen after storage ham clow temperatures. Sci. Hort. 67: 101–104. Mbahe R.E., Aken'ova M.E., Hahn S.K. 1994. Germination of cassava (Manihot esculenta Crantz) pollen. A. Hort. 380: 172–177. Melloni M.L.G., Scarpari M.S., Mendonça J.R., Perecin D., Landell, M.G.A., Pinto L.R. 2013. Comparison of two staining methods for pollen viability studies in sugarcane. S. Tech. 15: 103–107. Montagnac J.A.,Davis C.R., Tanumihardjo A.S.2009.Nutritional value of cassava for use as a staple food and recent advances for improvement.C. Reviews in Food Sci. and Food Saf. 8: 181–194. Orrego J.I., Hershey C.H. 1984. Almacenamiento del polen de yuca (Manihot esculenta Crantz) por medio de liofilizacion y varios regimenes de humedad y temperatura. A. Agro. 34: 21–24. Pacini E., Hesse M. 2005. Pollenkit – its composition, forms and functions. Flora 200, 399– 415. Rajasekharan P.E., Ravish B.S., Kumar T.V., Ganeshan S. 2013. Pollen cryobanking for tropical plant species. In: Normah MN, Chin, HF, Reed BM, eds. Conservation of tropical plant species. Springer Science, 65–75. Sivaguru M., Mander L., Fried G., Punyasena S.W. 2012. Capturing the Surface Texture and Shape of Pollen: A Comparison of Microscopy Techniques. PLoS ONE 7, e39129. doi:10.1371/journal.pone.0039129. Silva R.M., Bandel G., Faraldo M.I.F., Martins P.S. 2001. Reproductive biology of cassava landraces. Sci. Agri. 58: 101–107. Souza V.A., Schemberg E.A., Aguiar A.V. 2010. In vitro pollen germination of jerivá
101 (Syagrus romanzoffiana (S.)Cham).Sci. Forest. 38:147–151. Stanley R.G., Linskens H.F. 1974. Pollen: biology, biochemistry, management. Berlin: Heidelberg. Vieira L.J., Santana J.R.F., Silveira T.C., Alves A.A.C., Souza, F.V.D. 2011. Conservação e longevidade de pólen de acessos de Manihot esculenta. http://www.alice.cnptia.embrapa.br/bitstream/doc/915331/1/CONSERVACAOELONGEVID ADEResumon.266Liviaposter.pdf. (Accessed 28 September 2012). Vieira L.J., Soares T.L., Rossi M.L., Alves A.A.C., Santos F.A.R., Souza, F.V.D. 2012. Viability, production and morphology of pollen grains for different species in the the genus Manihot (Euphorbiaceae). A. Bot Bra. 26: 340­356.
102 ANEXO 1 Escala do vigor (V) da planta: 0 – planta morta, 1 – planta muito amarelada, 2 – planta pouco amareladae 3 – plantas totalmente verde.
103