Lista de revisão ---------- Nosso diferencial!!!!!!!! ------------------- Prof. Samir
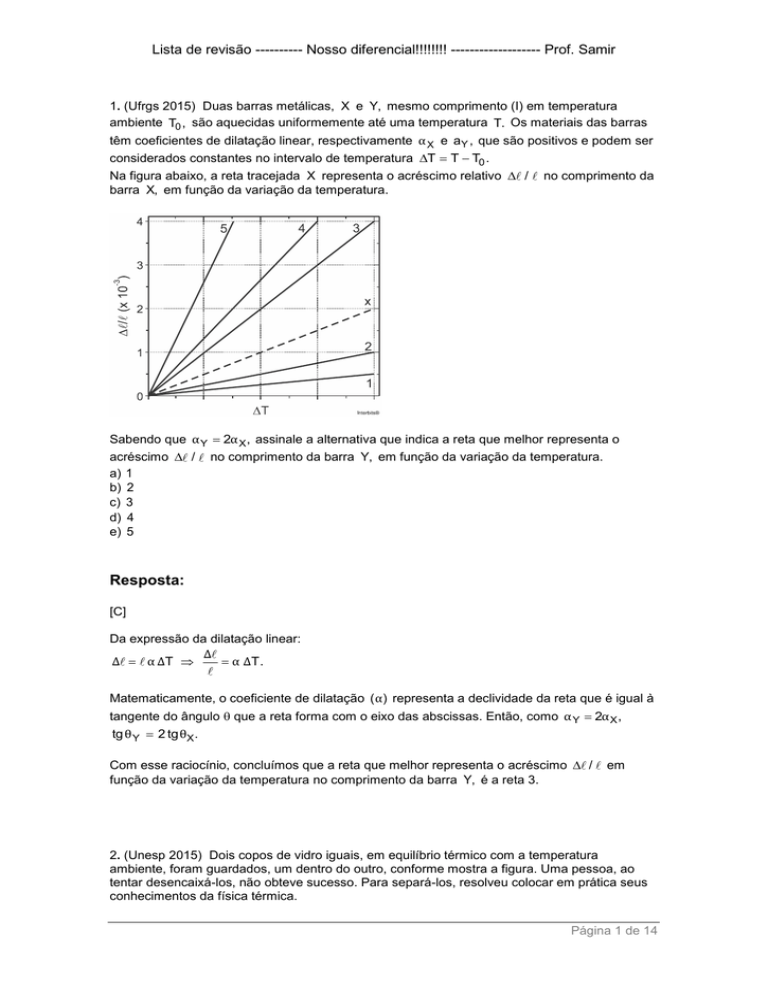
1. (Ufrgs 2015) Duas barras metálicas, X e Y, mesmo comprimento (I) em temperatura
ambiente T0 , são aquecidas uniformemente até uma temperatura T. Os materiais das barras
têm coeficientes de dilatação linear, respectivamente α X e a Y , que são positivos e podem ser
considerados constantes no intervalo de temperatura T T T0 .
Na figura abaixo, a reta tracejada X representa o acréscimo relativo / no comprimento da
barra X, em função da variação da temperatura.
Sabendo que α Y 2α X , assinale a alternativa que indica a reta que melhor representa o
acréscimo / no comprimento da barra Y, em função da variação da temperatura.
a) 1
b) 2
c) 3
d) 4
e) 5
Resposta:
[C]
Da expressão da dilatação linear:
Δ
Δ α ΔT
α ΔT.
Matematicamente, o coeficiente de dilatação ( α) representa a declividade da reta que é igual à
tangente do ângulo que a reta forma com o eixo das abscissas. Então, como α Y 2α X ,
tg θY 2 tg θX .
Com esse raciocínio, concluímos que a reta que melhor representa o acréscimo /
função da variação da temperatura no comprimento da barra Y, é a reta 3.
em
2. (Unesp 2015) Dois copos de vidro iguais, em equilíbrio térmico com a temperatura
ambiente, foram guardados, um dentro do outro, conforme mostra a figura. Uma pessoa, ao
tentar desencaixá-los, não obteve sucesso. Para separá-los, resolveu colocar em prática seus
conhecimentos da física térmica.
Página 1 de 14
Lista de revisão ---------- Nosso diferencial!!!!!!!! ------------------- Prof. Samir
De acordo com a física térmica, o único procedimento capaz de separá-los é:
a) mergulhar o copo B em água em equilíbrio térmico com cubos de gelo e encher o copo A
com água à temperatura ambiente.
b) colocar água quente (superior à temperatura ambiente) no copo A.
c) mergulhar o copo B em água gelada (inferior à temperatura ambiente) e deixar o copo A
sem líquido.
d) encher o copo A com água quente (superior à temperatura ambiente) e mergulhar o copo B
em água gelada (inferior à temperatura ambiente).
e) encher o copo A com água gelada (inferior à temperatura ambiente) e mergulhar o copo B
em água quente (superior à temperatura ambiente).
Resposta:
[E]
Enchendo o copo A com água gelada ele sofre contração e mergulhando o copo B em água
quente ele sofre dilatação, criando uma folga entre eles, possibilitando a separação.
3. (Pucrs 2015) Num laboratório, um grupo de alunos registrou o comprimento L de uma barra
metálica, à medida que sua temperatura T aumentava, obtendo o gráfico abaixo:
Pela análise do gráfico, o valor do coeficiente de dilatação do metal é
a) 1,05 105 C1
b) 1,14 105 C1
c) 1,18 105 C1
d) 1,22 105 C1
Página 2 de 14
Lista de revisão ---------- Nosso diferencial!!!!!!!! ------------------- Prof. Samir
e) 1,25 105 C1
Resposta:
[E]
ΔL L0 α ΔT α
ΔL
801 800
1
0,125 104
L0 ΔT 800 110 100 80.000
α 1,25 105 C1.
4. (Upe 2015) Ao lavar pratos e copos, um cozinheiro verifica que dois copos estão encaixados
firmemente, um dentro do outro. Sendo o copo externo feito de alumínio e o interno, de vidro,
sobre as formas de separá-los, utilizando os princípios básicos de dilatação térmica, analise os
itens a seguir:
I. Aquecendo apenas o copo de vidro.
II. Esfriando apenas o copo de alumínio.
III. Aquecendo ambos.
IV. Esfriando ambos.
Dados: os coeficientes de dilatação térmica do alumínio e do vidro são iguais a
aAl 24 106 C1 e avidro 0,5 106 C1, respectivamente.
Está(ão) CORRETO(S) apenas
a) I e II.
b) I.
c) II.
d) III.
e) IV.
Resposta:
[D]
A figura apresenta os copos A e B firmemente encaixados, sendo A de vidro e B de alumínio.
Página 3 de 14
Lista de revisão ---------- Nosso diferencial!!!!!!!! ------------------- Prof. Samir
As possíveis soluções para soltá-los são:
- resfriar somente o copo A para haver contração, enchendo-o com água gelada;
- aquecer somente o copo B para haver dilatação, imergindo-o em água quente;
- fazer simultaneamente os dois processos anteriores;
- aquecer os dois copos, pois o copo B, de alumínio, tem maior coeficiente de dilatação.
5. (Upf 2014) O diâmetro externo de uma arruela de metal é de 4,0 cm e seu diâmetro interno
é de 2,0 cm. Aumentada a temperatura da arruela de ΔT, observa-se que seu diâmetro externo
aumenta em Δd. Então, pode-se afirmar que seu diâmetro interno:
a) diminui de Δd.
b) diminui de Δd 2.
c) aumenta de Δd.
d) aumenta de Δd 2.
e) não varia.
Resposta:
[D]
Durante o aquecimento, os dois diâmetros aumentam.
Δd 4 α ΔT
ΔL L0 α ΔT
Δd' 2 α ΔT
Δd'
2
Δd 4
Δd'
2
2 Δd' Δd
Δd
.
2
6. (Ufsc 2015) Para determinar o equivalente mecânico do calor, faz-se um experimento que
consiste em deixar cair um recipiente muito resistente com água de uma altura h em relação
ao solo. O recipiente é termicamente isolado para impedir trocas de calor com o meio, mas
contém um termômetro acoplado para medir as variações de temperatura T da água. As
colisões com o solo são inelásticas e toda a energia é transferida para a água. O gráfico abaixo
foi obtido com dados do experimento realizado com 1,0 kg de água. Considere g 10m / s2 .
Sobre o assunto tratado e com base no gráfico acima, é CORRETO afirmar que:
01) para a temperatura da água ser elevada em 1C, a altura h deve ser de 800m.
Página 4 de 14
Lista de revisão ---------- Nosso diferencial!!!!!!!! ------------------- Prof. Samir
02) lançar o recipiente térmico com velocidades iniciais diferentes de zero levaria a maiores
aumentos de temperatura da água do que os apresentados, para as mesmas alturas h do
gráfico.
04) a variação da temperatura da água é diretamente proporcional à massa da água.
08) perdas na forma de energia sonora poderiam ser consideradas no experimento.
16) o equivalente mecânico do calor obtido a partir do gráfico é 1,0 cal 4,0 J.
Resposta:
02 + 08 = 10.
[01] (Falsa) Se a variação de temperatura foi de 0,3 graus para aproximadamente 100 m então
para atingir 1 grau a altura deve ser próxima de 500 m.
[02] (Verdadeira) A energia cinética adicional se somaria à energia potencial gravitacional que
se transfere integralmente para a água, elevando mais a temperatura.
[04] (Falsa) Na realidade a altura da queda é diretamente proporcional à variação de
temperatura da água.
[08] (Verdadeira) A energia total se conserva e, portanto a energia sonora produzida no choque
poderia dar mais precisão para o experimento, pois representa um fator de perda da
energia mecânica inicial além do atrito com o ar e com o choque no solo.
[16] (Falsa) Calculando com a expressão do calor sensível, temos:
Q m c ΔT
cal
Q 1000 g 1
0,3C 300cal
g C
7. (Pucpr 2015) Um gás é confinado dentro de um sistema formado por um pistão e um cilindro
de paredes termicamente condutoras. O cilindro é imerso em um banho formado por uma
mistura de água e gelo a 0C. O gás é submetido a um processo cíclico de modo a produzir o
diagrama PV mostrado na figura. Se a área delimitada pelo ciclo é equivalente ao trabalho de
600 J 600 J e considerando o calor latente de fusão do gelo igual a 3,0 105 J / kg, qual a
massa de gelo que derrete durante esse processo? Considere que as trocas de calor ocorrem
somente entre o gás e a mistura.
a) 2,0 g.
b) 1,0 g.
c) 10 g.
d) 3,0 g.
Página 5 de 14
Lista de revisão ---------- Nosso diferencial!!!!!!!! ------------------- Prof. Samir
e) 5,0 g.
Resposta:
[A]
O trabalho realizado pelo ciclo será convertido em calor que será transmitido para o banho por
intermédio de sua superfície condutora provocando o derretimento de parte do gelo.
Este derretimento é calculado com o calor latente, dado pela expressão:
Q m Lf
Onde,
m massa em quilogramas de gelo que sofre derretimento (kg);
Lf calor latente de fusão do gelo (J/kg)
Q quantidade de calor (J)
Então a massa de gelo derretido será:
Q
600 J
m
0,002kg 2g
Lf
5 J
3 10
kg
8. (G1 - cftmg 2015) Um aluno, ao colocar sua mão sobre o objeto 1, tem a sensação de que o
objeto está “quente” e uma aluna, ao colocar sua mão sobre o objeto 2, tem a sensação de que
o mesmo está “frio”. O professor analisou essa situação, apresentando as seguintes
afirmativas:
I. A temperatura da mão do aluno é maior que a do objeto 1.
II. A temperatura do objeto 2 é menor que a da mão da aluna.
III. O objeto 1 transfere calor para a mão do aluno.
IV. O objeto 2 transfere frio para a mão da aluna.
Sobre as afirmativas do professor, são corretas apenas
a) I e III.
b) I e IV.
c) II e III.
d) II e IV.
Resposta:
[C]
[I] Incorreta. A temperatura da mão do aluno é menor, pois se ele tem a sensação térmica de
que o objeto 1 está quente é porque esse objeto transfere calor para suas mãos.
[II] Correta. Se ela teve a sensação térmica de que o objeto está frio é porque ela perde
transfere calor para ele. Logo, a temperatura do objeto 2 é menor que a da mão dela.
[III] Correta. Já justificado em [I].
[IV] Incorreta. Não existe transferência de frio.
Página 6 de 14
Lista de revisão ---------- Nosso diferencial!!!!!!!! ------------------- Prof. Samir
9. (Ufsm 2015) Um dos métodos de obtenção de sal consiste em armazenar água do mar em
grandes tanques abertos, de modo que a exposição ao sol promova a evaporação da água e o
resíduo restante contendo sal possa ser, finalmente, processado. A respeito do processo de
evaporação da água, analise as afirmações a seguir.
I. A água do tanque evapora porque sua temperatura alcança 100C.
II. Ao absorver radiação solar, a energia cinética de algumas moléculas de água aumenta, e
parte delas escapa para a atmosfera.
III. Durante o processo, linhas de convecção se formam no tanque, garantindo a continuidade
do processo até que toda a água seja evaporada.
Está(ão) correta(s)
a) apenas I.
b) apenas II.
c) apenas III.
d) apenas I e II.
e) I, II e III.
Resposta:
[B]
Justificando as incorretas:
[I] Incorreta. A evaporação é um processo de vaporização que ocorre abaixo da temperatura
de ebulição.
[II] Correta.
[III] Incorreta. Não ocorre convecção porque a água quente, menos densa, está na superfície,
não realizando movimento descendente.
10. (Uece 2015) Um bloco de gelo a 30C repousa sobre uma superfície de plástico com
temperatura inicial de 21C. Considere que esses dois objetos estejam isolados termicamente
do ambiente, mas que haja troca de energia térmica entre eles. Durante um intervalo de tempo
muito pequeno comparado ao tempo necessário para que haja equilíbrio térmico entre as duas
partes, pode-se afirmar corretamente que
a) a superfície de plástico tem mais calor que o bloco de gelo e há transferência de
temperatura entre as partes.
b) a superfície de plástico tem menos calor que o bloco de gelo e há transferência de
temperatura entre as partes.
c) a superfície de plástico tem mais calor que o bloco de gelo e há transferência de energia
entre as partes.
d) a superfície de plástico transfere calor para o bloco de gelo e há diferença de temperatura
entre as partes.
Resposta:
[D]
As alternativas [A], [B] e [C] afirmam que um corpo tem mais ou menos calor estão
equivocadas conceitualmente, uma vez que o calor é energia térmica em trânsito sempre de
um corpo com maior temperatura, no caso o plástico, para o corpo com menor temperatura, o
gelo. Sendo assim, a alternativa correta é a [D].
Página 7 de 14
Lista de revisão ---------- Nosso diferencial!!!!!!!! ------------------- Prof. Samir
11. (Ueg 2015) A mudança do estado físico de determinada substância pode ser avaliada em
função da variação da temperatura em relação ao tempo, conforme o gráfico a seguir.
Considere que a 0C o composto encontra-se no estado sólido.
No gráfico, encontra-se a substância no estado líquido nos pontos
a) I, II e IV
b) III, IV e V
c) II, III e IV
d) I, III e V
Resposta:
[C]
Ao ser submetida ao aquecimento de uma substância pura que esteja no estado sólido,
teremos dois pontos em que a temperatura permanece constante à pressão constante.
Primeiramente há o aquecimento do sólido até o momento em que alcançado o ponto de fusão
onde encontramos duas fases distintas (sólido e líquido) sem que haja alteração da
temperatura (região II do gráfico). Ao derreter todo o sólido, resta apenas o líquido que ao
absorver mais calor aumenta sua temperatura até que a pressão de vapor atinja a pressão
atmosférica (região III), neste ponto estamos diante de mais uma mudança de fase (líquido
para vapor) e a temperatura permanece constante até que todo o líquido vaporize (região IV).
No gráfico temos líquido quando começa a fusão até o término da vaporização, ou seja,
corresponde aos pontos II, III e IV.
12. (Unesp 2015) A energia contida nos alimentos
Para determinar o valor energético de um alimento, podemos queimar certa quantidade desse
produto e, com o calor liberado, aquecer determinada massa de água. Em seguida, mede-se a
variação de temperatura sofrida pela água depois que todo o produto foi queimado, e
determina-se a quantidade de energia liberada na queima do alimento. Essa é a energia que tal
alimento nos fornece se for ingerido.
No rótulo de um pacote de castanha de caju, está impressa a tabela a seguir, com informações
nutricionais sobre o produto.
Página 8 de 14
Lista de revisão ---------- Nosso diferencial!!!!!!!! ------------------- Prof. Samir
INFORMAÇÃO NUTRICIONAL
Porção 15 g
Quantidade por porção
90 kcal
Valor energético
Carboidratos
4,2 g
Proteínas
3g
Gorduras totais
7,3 g
Gorduras saturadas
1,5 g
Gordura trans
0g
Fibra alimentar
1g
Sódio
45 g
www.brcaju.com.br
Considere que 150 g de castanha tenham sido queimados e que determinada massa m de
água, submetida à chama dessa combustão, tenha sido aquecida de 15 C para 87 C.
Sabendo que o calor específico da água líquida é igual a 1cal (g C) e que apenas 60% da
energia liberada na combustão tenha efetivamente sido utilizada para aquecer a água, é
correto afirmar que a massa m, em gramas, de água aquecida era igual a
a) 10000.
b) 5000.
c) 12500.
d) 7500.
e) 2500.
Resposta:
[D]
Em 150 g de castanha temos 10 porções. Portanto, da tabela, a energia liberada nessa queima
é:
E 10 90 900 kcal E 900.000 cal.
Como somente 60% dessa energia são usados no aquecimento da água, aplicando a equação
do calor sensível, temos:
0,6 E 0,6 900.000
Q m c Δθ 0,6 E m c Δθ m
c Δθ
1 87 15
m 7.500 g.
13. (Uerj 2015) Um corpo de massa igual a 500g, aquecido por uma fonte térmica cuja
potência é constante e igual a 100cal / min, absorve integralmente toda a energia fornecida por
essa fonte. Observe no gráfico a variação de temperatura do corpo em função do tempo.
Página 9 de 14
Lista de revisão ---------- Nosso diferencial!!!!!!!! ------------------- Prof. Samir
Calcule o calor específico da substância da qual o corpo é composto, bem como a capacidade
térmica desse corpo.
Resposta:
Dados: m 500 g; P 100 cal/min.
Q m c ΔT
Q
Q PΔt
P
Δt
m c ΔT P Δ t
c
100 30
PΔt
m ΔT 500 50 10
c 0,15 cal/g °C.
C m c 500 0,15
C 75 cal/°C.
14. (Ufes 2015) A figura abaixo apresenta um conjunto de transformações termodinâmicas
sofridas por um gás perfeito. Na transformação 1 2, são adicionados 200 J de calor ao gás,
levando esse gás a atingir a temperatura de 60C no ponto 2. A partir desses dados,
determine
a) a variação da energia interna do gás no processo 1 2;
b) a temperatura do gás no ponto 5;
c) a variação da energia interna do gás em todo o processo termodinâmico 1 5.
Resposta:
Página 10 de 14
Lista de revisão ---------- Nosso diferencial!!!!!!!! ------------------- Prof. Samir
a) Usaremos a 1ª Lei da Termodinâmica ΔU Q W e como na transformação 1 2 não
temos variação de volume (ΔV 0) não haverá realização de trabalho (W 0) e tivemos
absorção de calor (Q 200J), sendo assim ΔU Q, ou seja, ΔU 200J.
b) Neste caso, como dispomos da temperatura do ponto 2, usaremos a Lei dos gases ideais
para os pontos 2 e 5. O sistema é fechado, logo não há perdas de massa para o exterior.
p5 V5 p2 V2
p 2V
2p V
retirando os valores do gráfico 0 0 0 0 T5 T2 T5 60 C.
T5
T2
T5
T2
c) Sabendo que a energia interna depende da somente da temperatura para a condição de gás
ideal, para a transformação de 2 5 temos que a variação da energia interna é nula
(ΔU25 0), pois T5 T2 . Logo, a variação da energia interna de 1 5 é igual à
transformação 1 2 já calculada anteriormente.
Portanto, ΔU15 ΔU12 ΔU25 ΔU15 200J 0 ΔU15 200J.
15. (Uerj 2015) Para aquecer 1L de água contida em um recipiente de capacidade térmica
desprezível, uma pessoa dispõe de um aquecedor elétrico portátil cuja potência é de 1273 W,
quando submetido a uma tensão de 127V. Considere que toda a energia fornecida pelo
aquecedor seja absorvida pela água.
Nessas condições, calcule a variação de temperatura da água após o aquecedor inserido no
recipiente ficar ligado por 165 segundos.
Resposta:
Dados: P 1.273 W; V 1 L m 1.000 g; Δt 165 s; c 4,2 J/g °C.
Q m c ΔT
Q
Q PΔt
P
Δt
m c ΔT P Δ t
ΔT
P Δ t 1.273 165
m c 1.000 4,2
ΔT 50 °C.
16. (Uem 2012) Sobre o consumo e a transformação da energia, assinale o que for correto.
01) Ao realizar exercícios físicos, é possível sentir a temperatura do corpo aumentar. Isso
ocorre porque as células musculares estão se contraindo e, para isso, estão realizando
várias reações exergônicas (exotérmicas).
02) Durante o processo de combustão biológica, a energia é liberada de uma só vez, na forma
de calor, que é entendido como uma forma de energia em trânsito.
04) Os organismos autótrofos, como algas e plantas, conseguem transformar a energia
química do ATP em energia luminosa, obedecendo à lei da conservação da energia.
08) A transformação da energia química do ATP em energia mecânica, como na contração
muscular em um mamífero, obedece à primeira lei da termodinâmica.
16) De acordo com a primeira lei da termodinâmica, pode-se dizer que o princípio da
conservação da energia é válido para qualquer sistema físico isolado.
Página 11 de 14
Lista de revisão ---------- Nosso diferencial!!!!!!!! ------------------- Prof. Samir
Resposta:
01 + 08 + 16 = 25.
Durante o processo de combustão biológico a energia dos alimentos é liberada de forma
gradual. Os organismos autótrofos conseguem transformar a energia luminosa em energia
química que fica armazenada no ATP
16) Correto. É princípio da conservação da energia. No caso da primeira lei da termodinâmica:
Q U W.
O calor trocado (Q) pelo sistema igual à variação da energia interna desse sistema (U)
somada ao trabalho realizado (W) pelas forças por ele aplicadas.
17. (Ufrgs 2015) Sob condições de pressão constante, certa quantidade de calor Q, fornecida
a um gás ideal monoatômico, eleva sua temperatura em T.
Quanto calor seria necessário, em termos de Q, para concluir a mesma elevação de
temperatura T, se o gás fosse mantido em volume constante?
a) 3Q.
b) 5Q / 3.
c) Q.
d) 3Q / 5.
e) 2Q / 5.
Resposta:
[D]
Da primeira lei da termodinâmica:
3
5
Isobárica : QP Q ΔU W Q 2 n R ΔT n R ΔT Q 2 n R ΔT
Q ΔU W
Isométrica : Q ΔU Q 3 n R ΔT
V
V
2
3
n R ΔT
QV
3
3
2
Q V Q.
5
Q
5
5
n R ΔT
2
18. (Fuvest 2015) Certa quantidade de gás sofre três transformações sucessivas, A B,
B C e C A, conforme o diagrama p V apresentado na figura abaixo.
Página 12 de 14
Lista de revisão ---------- Nosso diferencial!!!!!!!! ------------------- Prof. Samir
A respeito dessas transformações, afirmou-se o seguinte:
I. O trabalho total realizado no ciclo ABCA é nulo.
II. A energia interna do gás no estado C é maior que no estado A.
III. Durante a transformação A B, o gás recebe calor e realiza trabalho.
Está correto o que se afirma em:
a) I.
b) II.
c) III.
d) I e II.
e) II e III.
Resposta:
[E]
[I] Incorreta. Como o ciclo é anti-horário, o trabalho é negativo e seu módulo é numericamente
igual a área do ciclo.
[II] Correta. A energia interna (U) é diretamente proporcional ao produto pressão volume.
Assim: pC VC pA VA UC UA .
[III] Correta. Na transformação A B, ocorre expansão, indicando que o gás realiza trabalho
(W 0). Como há também aumento da energia interna (ΔU 0).
Pela 1ª Lei da Termodinâmica:
Q ΔU W Q 0 o gás recebe calor.
19. (Upe 2015) Um ciclista decide pedalar pela cidade e leva uma garrafa térmica para fazer
sua hidratação adequada. Querendo beber água gelada ao final de um longo treino, o ciclista
coloca inicialmente 200 g de água a 25C e 400 g de gelo a 25C.
Supondo que a garrafa seja fechada hermeticamente, que não haja trocas de energia com o
ambiente externo e que o equilíbrio térmico tenha sido atingido, o ciclista ao abrir a garrafa
encontrará:
Dados: o calor específico da água e do gelo é igual a Cágua 1cal / g C e
Cgelo 0,5 cal / g C, respectivamente. O calor latente da água é igual a L 80 cal / g.
a) apenas gelo a 0C.
b) apenas água a 0C.
c) mais gelo que água.
d) mais água que gelo.
e) apenas água.
Página 13 de 14
Lista de revisão ---------- Nosso diferencial!!!!!!!! ------------------- Prof. Samir
Resposta:
[C]
A troca térmica é realizada entre a água e o gelo, devido não haver troca com o meio externo.
Com isso a água vai esfriando enquanto que o gelo se aquece. O equilíbrio térmico se
estabelece quando não houver mais diferença de temperatura.
Então
Q 0
Q1 Q2 0
Analisando o resfriamento da água até o ponto de congelamento:
Q1 m1 c1 ΔT1
Q1 200 g 1
cal
0 C 25 C 5000cal
g C
O aquecimento do gelo até o ponto de fusão:
Q2 m2 c 2 ΔT2
Q1 400 g 0,5
cal
0 C 25 C 5000cal
g C
Temos aqui o equilíbrio térmico atingido: Q1 Q2 0
Como o sistema não troca calor com o meio externo, conclui-se que terá mais gelo do que
água devido à impossibilidade de mudança de fase pela necessidade de mais calor. Como o
sistema continua tendo mais gelo que água, ele continua assim.
Página 14 de 14