Recuperação Paralela de Química – 3ª Série – 1º Bimestre
TESTES
Com base nessas informações, é correto afirmar que:
a) I é um líquido puro e II é uma solução.
b) I é uma solução e II é um líquido puro.
c) I é um líquido puro e II é um azeótropo.
d) I e II são líquidos puros, com diferentes composições
químicas.
e) I e II são soluções com o mesmo solvente e soluto,
mas I é uma solução mais concentrada.
1. (F4) Considere os sistemas a seguir:
Em relação aos sistemas I, II, III e IV, podemos afirmar,
corretamente, que:
a) em I, temos uma substância pura simples.
b) em III, temos uma mistura.
c) em II, temos uma mistura de substâncias compostas.
d) em IV, temos uma mistura de substâncias simples.
e) em IV, temos uma mistura de duas substâncias simples e uma substância composta.
2. (F3) O alumínio tem número atômico 13 e é constituído por um único isótopo, que contém 14 nêutrons.
Com base nessa informação, pode-se afirmar que:
I. a massa atômica aproximada do alumínio é 27 u.
II. o átomo de alumínio pesa 13 vezes mais que 1/12
do átomo de 12C.
III. o átomo de alumínio pesa 14 vezes mais do que o
átomo de 12C.
IV. 12 átomos de alumínio pesam tanto quanto 27 átomos de 12C.
Está correto o que se afirma em:
a) I e IV, apenas.
b) II, III e IV, apenas.
c) I, II e IV, apenas.
d) I, II e III, apenas.
e) I, II, III e IV.
3. (F4) Os líquidos I e II são incolores e transparentes.
Os dois foram aquecidos, separadamente, e mantidos
em ebulição. Os valores das temperaturas
(T) dos líquidos em função do tempo (t) de aquecimento são mostrados na figura a seguir:
4. (F2) A ligação entre
composto de fórmula:
origina um
QUESTÕES DISCURSIVAS
1. (F2) As três partículas fundamentais que constituem
o átomo são: prótons, elétrons e nêutrons.
Considere um átomo de um elemento X que apresenta
18 partículas fundamentais e que apresenta o número
de prótons igual ao número de nêutrons. Determine o
número atômico e o número de massa desse átomo e
represente-o corretamente com o seu número atômico
e o de massa.
2. (F3) Na natureza, cerca de 75% dos átomos de cloro
têm massa atômica 35 u e 25% têm massa atômica 37
u. Com base nessas informações, qual é a massa atômica média do elemento cloro, expressa em u?
3. (F3) Um dos produtos químicos mais importantes
entre os ácidos produzidos atualmente é o ácido nítrico
(HNO3). Esse composto tem inúmeras aplicações: fabricação de fertilizantes, explosivos, remédios etc.
A) Calcule a massa molecular do ácido nítrico.
B) Qual é a massa de uma única molécula de ácido
nítrico?
4. (F1) O número de elétrons do ânion X1– de um elemento utilizado na medicina como antisséptico é igual
ao número de elétrons do átomo do gás nobre xenônio.
Esse átomo de gás nobre, utilizado em cirurgias, apresenta número atômico 54 e número de massa 131.
Determine o número atômico do elemento X.
COLÉGIO OBJETIVO
1
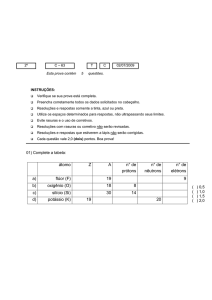
5. (F1) Sabendo-se os números atômicos do molibdênio (Z = 42) e do selênio (Z = 34), indique a distribuição
eletrônica dos íons Mo2+ e Se2 – em subníveis de energia.
6. (F3) Sabendo-se que um medicamento contém
3,6 mg de ácido acetilsalicílico (C9H8O4) por comprimido, qual é o número de moléculas dessa substância
contido em um comprimido?
COLÉGIO OBJETIVO
2