Instituto de Histologia e Embriologia Abel Salazar
Faculdade de Medicina da Universidade do Porto
Coordenação: Drª Sandra Rebelo
Relatório de estágio realizado por:
Patrícia Alves, aluna do 10º ano, Escola Secundária de Águas Santas, Maia
João Sá, aluno do 10º ano, Escola Secundária Alcaides de Faria, Barcelos
Porto, 9-20 de Agosto de 2004
“A arte em movimento: a célula”
Introdução
No dia 9 de Agosto, iniciámos um estágio no Instituto de Histologia e
Embriologia Abel Salazar, da Faculdade de Medicina na Univerisade do Porto, orientado
pela Drª Sandra Rebelo no âmbito do Programa Ciência Viva, denominado “Ocupação dos
Jovens no Verão”.
“A arte em Movimento: a célula” é o título do estágio em que participámos, no
entanto, como este tema é muito vasto e abstracto, especificámo-nos nas áreas da Biologia
Molecular e Histologia. Os nossos objectivos ao participarmos neste estágio eram
profundar os nossos conhecimentos, realizar novas experiências, ambientarmo-nos com o
local de trabalho dos cientistas e, o mais importante, constatarmos se o nosso futuro
profissional passa pela área da ciência.
Neste relatório, apresentaremos de forma sucinta as experiências mais
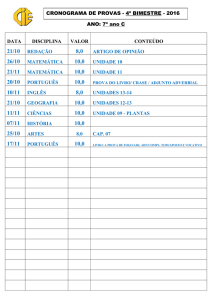
relevantes que realizámos durante o período do estágio.
Técnicas laboratoriais efectuadas
Preparações Histológicas
Observaram-se várias lâminas de preparações histológicas, que com a ajuda de
atlas permitiram a identificação dos vários constituintes tecidulares.
A primeira peça observada foi a polpa do dedo humano, onde pode-se ver as três
camadas da pele: epiderme, derme e a hipoderme. A epiderme consta de uma camada
germinativa formada por células cilíndricas, um estrato espinhoso que é formado por
células poliédricas, o estrato granuloso constituído por um número reduzido de camadas
celulares, o estrato lúcido e o estrato córneo, que é a camada mais superficial formada por
células mortas e de espessura variável. A derme é composta por um tecido conjuntivo sobre
o qual se apoia a epiderme, ambas as camadas interdigitam-se formando as papilas. Abaixo
da derme encontra-se a hipoderme, rica em adipócitos.
Fig. 1 – Camadas da pele
1
“A arte em movimento : a célula”
De seguida, observámos a língua de cão que é constituída pelas papilas, que se
encontram à periferia da língua. No interior, localiza-se o epitélio e no seu seio encontra-se
o músculo esquelético (voluntário), onde estão os vasos sanguíneos.
Músculo Esquelético
Vasos Sanguíneos
Epitélio
fig. 2 – língua de cão
A terceira observação foi o estômago fundo de cão. O estômago fundo ou corpo é
formado por uma mucosa gástrica, a muscular da mucosa, a submucosa e a muscular. Abaixo
da muscular encontram-se as glândulas fúndicas que são tubulosas simples, mas às vezes
ramificadas.
1.
2.
3.
4.
5.
6.
Fig.3 – Estômago fundo
Epitélio estratificado pavimentoso
Tecido conjuntivo
Corpúsculos gustativos
Glândulas serosas
Tecido adiposo
Músculo liso
2
“A arte em movimento: a célula”
De seguida, observámos a traqueia de coelho. Esta é constituída por um epitélio,
abaixo do qual se encontra a mucosa respiratória. No seu seio encontram-se os vasos
sanguíneos. Abaixo da mucosa observa-se o esqueleto cartilagénio, formado por anéis
incompletos de cartilagem, e em baixo de tudo, encontra-se a camada adventícia.
Fig.4 - Traqueia
A preparação do coração do ratinho é constituída por quatro cavidades: dois
ventrículos e duas aurículas, a separar os ventrículos existe o septo e a parede cardíaca. A
parede cardíaca é formada por uma camada interna – o endocárdio, e uma camada externa
ao endocárdio – o miocárdio e acima deste temos o epicárdio. A separar as aurículas dos
ventrículos, encontram-se as válvulas.
Fig. 5 - Coração
3
“A arte em movimento: a célula”
Por último, observámos o sangue. Este é um tecido conjuntivo que se distribui por
todo o organismo e que realiza uma importante função de transporte de múltiplas
substâncias (nutrientes, oxigénio, dióxido de carbono, catabolitos, hormonas,etc).
Na observação realizada vimos os constituintes do sangue: plasma, hemácias ou
glóbulos vermelhos, leucócitos ou glóbulos brancos e plaquetas (no entanto, não foram
visualizadas).
Plasma
Hemácias
Leucócito neutrófilo
Leucócito neutrófilo
Leucócito linfócito
Fig. 6 – Sangue
4
“A arte em movimento: a célula
Imunohistoquímica
A imunohistoquímica é um método histológico para a determinação histoquímica de
proteínas específicas, mediante os anticorpos marcados. Os anticorpos podem estar ligados
a enzimas, a fluorescência, entre outros.
Os métodos histoquímicos baseiam-se na utilização de anticorpos específicos,
marcados mediante um enlace químico com uma substância que se torna visível, sem afectar
a capacidade do anticorpo para formar um complexo com o antigénio.
A realização desta técnica veio a propósito do artigo “The Paired Homeodomain
Protein DRG11 is required for the Projection of Cutaneous Sensory Affernt Fibers to the
Dorsal Spinal Cord”, do qual iremos falar mais adiante.
O objectivo desta experiência foi verificar se num embrião de 18.5 dias, haveria um
terceira vaga de neurogénese, ao nível dos neurónios das lâminas superficiais da medula
espinhal. Como controlo usaram-se lâminas de medula espinhal e DRG de ratinhos com uma
semana de idade pós-natal, uma vez que nesta fase os neurónios daquelas regiões estão
perfeitamente diferenciados. Deste modo, os anticorpos utilizados foram o DRG11
(marcação verde), que marca os neurónios nociceptivos existentes na porção dorsal da
medula espinhal e os neurónios sensitivos do DRG, e o Neu-N (marcação encarnada) que
marca todos os neurónios pós-mitóticos (já formados).
•
Imagens captadas no confocal:
Fig.7 – Imagem da medula espinhal de embrião de ratinho com 18.5 dias
embrionários (E18.5) marcada com Neu-N e DRG11
Nesta imagem de medula espinhal de embrião de E18.5 verifica-se que a zona mais
superficial do corno dorsal da medula espinhal está marcada com DRG11, mas curiosamente
o anticorpo pan-neuronal NeuN só marca os neurónios das lâminas mais profundas e do
corno ventral. Isto parece sugerir que nesta altura poderá haver uma nova vaga de
proliferação neuronal, que está a ser investigada.
5
“A arte em movimento: a célula”
De modo a validar estes resultados usaram-se como controlo lâminas com medula
espinhal e DRGs provenientes de ratinho P7. Aqui mostramos apenas a imagem de um corte
transversal de gânglio raquidiano. Podemos observar marcação dupla com os dois
anticorpos. Como se pode reparar a maior parte do gânglio está marcado de amarelo devido
à sobreposição do verde com o encarnado. Isto quer dizer que o que está amarelo não só
são neurónios nociceptivos como também são neurónios completamente formados. Estes
resultados estão de acordo com a literatura.
Fig. 8 –Gânglio raquidiano de um ratinho com 7 dias (P7) marcado duplamente com
Neu-N e DRG11
Discussão de um artigo científico
Com a leitura e discussão do artigo “The Paired Homeodomain Protein DRG11 is
required for the Projection of Cutaneous Sensory Affernt Fibers to the Dorsal Spinal
Cord” alargámos os nossos conhecimentos acerca do desenvolvimento embrionário do
circuito nociceptivo. Até então, só tínhamos uma noção muito superficial do que era a
medula espinhal. Com este artigo aprendemos que a medula pode ser dividida em duas
partes: corno dorsal e corno ventral. O corno ventral comanda a motricidade do animal,
enquanto que o corno dorsal recebe as informações sensitivas, do tacto, da dor, entre
outros.
Na parte superficial do corno dorsal é expresso o Drg11. Este é o ponto focral do
artigo, ou seja, pesquisava-se a importância do Drg 11. O Drg11 é um factor de transcrição
que é expresso durante o desenvolvimento no corno dorsal e no DRG (Dorsal Root Ganglia)
dos nervos sensitivos. Através de estudos realizados, chegou-se à conclusão que o Drg11 é
importante para a formação inicial das ligações entre os nervos sensitivos aferentes e os
seus alvos centrais, isto é, é vital para o bom desenvolvimento do sistema nociceptivo. Isto
foi provado porque ao causar mutações no Drg11 verificava-se que os ratinhos mutantes,
eram menos sensíveis a estímulos dolorosos que os seus irmãos “selvagens”, enquanto que a
motricidade encontrava-se normal. Portanto, as anormalidades sensitivas detectadas só
poderiam ser devido à ausência do Drg11.
6
“A arte em movimento: a célula”
Desenvolvimento embrionário do ratinho (E12.5)
De modo a perceber em que estado do desenvolvimento se encontra um embrião de ratinho
em E12.5 procedemos a cortes transversais seriados e posteriormente à sua coloração e
observação microscópica. Um embrião foi cortado em criostáto e o outro em micrótomo de
parafina.
•
Cortes em Criostáto
O criostáto é usado para fazer cortes de peças previamente congeladas com um
gel (OCT). Os cortes realizados neste aparelho são fáceis de “talhar”, contudo a morfologia
da amostra nem sempre é bem conseguida.
Fig.9 – Criostáto
Terceiro ventrículo
Aqueduto cerebral
Sulcus limitans
Telencéfalo
vesícula
Hipótalamo
Futuro cortex
cerebral
Fig. 10 – Embrião cortado no criostáto (zona da cabeça)
7
“A arte em movimento: a célula”
•
Cortes em micrótomo de parafina
Neste caso, usou-se a parafina como matriz de inclusão. Esta técnica embora
mais longa e complexa que a anterior, permite cortes com uma morfologia muito melhor.
Antes da inclusão da peça em parafina, é necessário passa-la por uma
concentração crescente de alcóois (70º, 90º, 100º) para a remoção da água que se encontra
nos tecidos. Isto porque a parafina é imiscível com a água e então, se não se tivesse
retirado toda a água, a parafina não iria preencher os espaços que continham água e
consequentemente os cortes ficariam deformados. Termina-se com uma passagem de meia
hora em benzol. Posteriormente a peça é colocada numa solução 1:1 benzol:parafina antes
de ser incluída em parafina líquida (60ºC). A peça fica definitivamente incluída em parafina,
quando em molde apropriado e à temperatura ambiente, se deixa solidificar a parafina que
rodeia a peça. Agora já se pode cortar em micrótomo de parafina.
Medula espinhal
Discos
intervertebrais
Canal central
Fig. 11 – Embrião cortado em parafina
(zona da cauda)
Técnica de coloração pela hematoxilina-eosina
Estes cortes foram corados pela técnica de coloração hematoxilina-eosina. A
hemotoxilina, que é um corante básico (roxo) cora as estruturas ácidas, e a eosina
(vermelho), que é um corante ácido cora as estruturas básicas. O objectivo desta técnica é
visualização do núcleo e do citoplasma das células.
Fig. 12 – Diferenciador, Eosina, Hematoxilina
8
“A arte em movimento: a célula”
Fig. 13 – Embriôes (E12.5, E13.5, E16.5, E18.5)
Fig. 14 – Cortes de embriões corados pela
Técnica de hematoxilina-eosina
Electroforese de ADN
Denomina-se electroforese ao transporte de partículas num campo eléctrico. A
electroforese de ADN é feita normalmente em gel de agarose. O gel é feito diluíndo a
agarose numa solução tampão, com o auxílio de calor; de seguida, adiciona-se brometo de
etídio que se vai incorporar entre as bases do ADN, permitindo a sua futura visualização. A
solução é colocada num molde próprio de acordo com o tamanho do gel que se pretende
fazer, colocam-se os pentes que marcam os poços e deixa-se arrefecer. O gel é colocado
numa tina de electroforese que contém a solução de tampão, adicionam-se em cada poço a
respectiva amostras (previamente coradas com um marcador que possibilita a vizualização
da frente de migração durante a electroforese) e ligam-se os eléctrodos à corrente
eléctrica. Neste caso, como o ADN tem carga negativa a pH neutro, as amostras migram do
pólo negativo para o pólo positivo, ao longo do gel. As amostras são identificadas por bandas
que se formam e que se tornam visíveis quando colocados em luz ultravioleta. Isto é
possível, devido à presença de brometo de etídio, proporcionando às bandas, quando
expostas à luz ultravioleta, emitirem uma fluorescência visível alaranjada.
9
“A arte em movimento: a célula”
ADN fingerprinting
O ADN figerprinting é uma técnica básica de biologia molecular que nos dá a
impressão digital do ADN. Este técnica é usada em testes de paternidade, na identificação
de indivíduos em incidentes, etc.
Nesta experiência, o objectivo era encontrar um criminoso para um determinado
crime. Para isso, recolhida a amostra de ADN da cena do crime, procedemos à recolha de
ADN de 5 suspeitos. Posteriormente, cortámos o ADN com enzimas de restrição
apropriadas, que vão cortar em locais específicos de acordo com a sua capacidade para
reconhecer pequenas sequências nucleótidas ao longo do ADN; e de seguida, fizémos a
electroforese em gel de agarose. Depois, de realizada a electroforese comparámos o
padrão de bandas presentes no gel.
Resultado ADN fingerprinting
Fotografia do gel de Agarose
1
2
3
4
5
6
Legenda:
1 – Amostra do Crime
2 – Suspeito João
3 – Suspeito Patrícia
4 – Suspeito X
5 – Suspeito Y
6 – Suspeito Sandra
Com estes resultados descobrímos que o crimonoso era a Patrícia.
PCR – Polimerase Chain Reaction
Esta técnica tem como objectivo amplificar pequenos segmentos de ADN a partir
de uma quantidade mínima. A amplificação pela PCR necessita da presença de, pelo menos,
uma cadeia de ADN molde.
A PCR desenvolve-se em três etapas: a desnaturacão, que é a abertura da dupla
cadeia de ADN, o annealing, no qual ocorrem as ligações dos primers que vão flanquear o
segmento a ser amplificado, e a polimerização, na qual se sintetiza o ADN a partir da
cadeia molde, pela ADN polimerase.
A PCR possibilita a clonagem de genes com enorme eficiência. Esta técnica só é
possível graças às ADN -polimerases cuja actividade enzimática não é destruída pelas
temperaturas elevadas usadas durante a PCR.
Os primers oligonucleotídeos, utilizados durante o annealing, são sintetizados de
modo a ligarem-se às extremidades opostas de cada uma das cadeias de ADN molde que se
pretende amplificar.
10
“A arte em movimento: a célula”
A ADN polimerase necessita dos primers para iniciar a replicação do ADN e
sintetizar novas cópias do ADN molde.
As diferentes temperaturas usadas durante a PCR são precisas para a separação da
dupla cadeia molde de ADN (quando a 94ºC), para a ligação dos primers à sequência
complementar das cadeias separadas (quando a 64ºC) e para a extensão dos primers pela
enzima Taq, sintetizando-se duas novas cópias de cadeia molde (quando a 72ºC).
O termociclador é o aparelho onde se desenrola a técnica PCR e é programável de
acordo com as situações.
Amplificação do elemento Alu do 8º intron do cromossoma 8
O objectivo desta experiência é tentar identificar a presença ou ausência do
elemento Alu repetitivo no oitavo intron do cromossoma 8, depois de realizada a PCR e a
electroforese. Os introns são regiões não codificadas do ADN e no caso específico do Alu
não se sabe a sua origem nem função.
O elemento Alu está presente em alguns indivíduos e ausente noutros. Os indíviduos
homozigóticos e que possuem dois alelos (+/+), no gel de agarose, apresentam uma única
banda que por ser pesada corre mais devagar no gel, os individuos homozigóticos que não
possuem estes alelos (-/-) também contêm uma única banda, contudo esta é mais leve e
corre mais rápido. Os sujeitos heterozigóticos (+/-) possuem alelos diferentes donde
apresentam duas bandas, uma que é pesada (+) e outra mais leve (-).
Para a realização desta experiência procedemos à recolha de células epiteliais
localizadas na mucosa oral, de modo a extraírmos o ADN. Este foi cortado pelas enzimas de
restrição e de seguida realizámos a PCR. Depois de ocorrida a electroforese, tentámos
identificar os indivíduos que possuíam o elemento Alu nos dois alelos, num só alelo ou em
nenhum.
Resultados do gel de agarose
1
2
3
4
Legenda:
1- João
2- Patrícia
3- X
4- Y
+/-
-/-
+/-
+/+
11
“A arte em movimento: a célula”
Com estes resultados, constatámos que o João e o indivíduo X são heterozigóticos
(+/-), uma vez que possuem duas bandas; enquanto que, a Patrícia é homozigótica -/-, já que
tem uma banda que migrou mais longe, logo não tem o elemento Alu em nenhum dos alelos, e
o sujeito Y é homozigótico +/+ possuindo o elemento nos dois alelos, uma vez que a sua única
banda correu pouco o gel.
Conclusão
No início do estágio, foi um pouco complicado porque os nossos conhecimentos
eram limitados e básicos. Contudo, a nossa integração no grupo de trabalho fez-nos não
desistir de aprofundar os nossos conhecimentos.
Ao longo do estágio, tivemos a oportunidade de visualizar algumas experiências
que estavam a decorrer, nomeadamente a dissecção de um rato, e participar numa
investigação a decorrer no instituto, acerca da presença de neurónios pré-mitóticos na
medula espinhal.
No final deste estágio, estámos contentes por termos tido a oportunidade de
“trabalhar” num ambiente científico, onde aprendemos novidades ao nível da biologia
molecular e celular e da histologia.
Com este estágio constatámos que a nossa escolha realmente pode passar pela
área da investigação.
Por tudo isto, agradecemos o acolhimento, a paciência, a oportunidade e os
conhecimentos que nos foram oferecidos durante a nossa participação nesta aventura.
Ainda, agradecemos ao Programa Ciência Viva por encorajarem e dar oportunidades aos
jovens de trabalhar com verdadeiros cientistas. Por fim, queremos agradecer à Drª Sandra
Rebelo por nos ter “aturado”.
12