1
CIRO VERDI CARNEVALLI
OXIGÊNIO / NITROGÊNIO
Relatório sobre Oxigênio / Nitrogênio –
trabalho elaborado para avaliação parcial
da disciplina de Processos Industriais
Inorgânicos II, componente curricular do
sexto período do Curso Superior de
Tecnologia em Processos Químicos, sob a
orientação do professor Vanderlei Inácio de
Paula.
Jundiaí-SP
2015
2
Sumário
1
Oxigênio ................................................................................................... 3
2
Nitrogênio / Azoto .................................................................................... 6
3
Referências............................................................................................... 9
3
1. Oxigênio
O oxigênio é um elemento químico de símbolo O, número atómico 8 (8 prótons e 8
elétrons) com massa atómica 16.
Na sua forma molecular e à temperatura ambiente, O2 é um gás incolor (azul em
estado líquido e sólido), insípido, inodoro, comburente, não combustível e pouco
solúvel em água. Representa aproximadamente 20% da composição da atmosfera
terrestre. É um dos elementos mais importantes da química orgânica, participando
de maneira relevante no ciclo energético dos seres vivos, sendo essencial na
respiração celular dos organismos aeróbicos. Uma outra molécula também formada
por átomos de oxigénio é o ozôno (O3), cuja presença na atmosfera protege a
Terra da incidência de radiação ultravioleta procedente do Sol.
Nas Condições Normais de Temperatura e Pressão, o oxigénio se encontra no
estado gasoso, formando moléculas biatómicas de fórmula molecular O 2. Essa
molécula é formada durante a fotossíntese das plantas que absorvem dióxido de
carbono (CO2) e libertam oxigénio, e é utilizada pelos seres vivos no processo de
respiração.
O oxigénio, tanto em estado líquido como em estado sólido, tem uma coloração
ligeiramente azulada e, em ambos os estados, é paramagnético. O oxigénio líquido
é usualmente obtido a partir da destilação fracionada do ar líquido, junto com o
azoto (ou nitrogénio). O Oxigénio gasoso, que abastece hospitais e indústrias,
comercialmente vendido em cilindros de alta pressão, pode ser obtido por meio de
um processo de separação do ar, utilizando peneira molecular, chamado adsorção
com alternância de pressão. Oxigênio gasoso também pode ser gerado no local de
utilização por meio de máquinas que utilizam compressores, filtros, secadores de ar
e concentradores de oxigénio com peneira molecular. Trata-se de uma alternativa
viável economicamente a produção de oxigénio no local.
A principal utilização do oxigênio é como oxidante, devido à sua elevada
eletronegatividade, superada somente pela do flúor. Por isso, o oxigênio líquido é
usado como comburente nos motores de propulsão dos carros, embora, nos
processos industriais, o oxigênio para a combustão seja obtido diretamente do ar.
Outras aplicações industriais oxigênio são a soldadura e a fabricação de aço e
metanol. A medicina usa o oxigênio administrando-o como suplemento em
pacientes com dificuldades respiratórias.
Também é engarrafado para ser respirado em diversas atividades desportivas ou
profissionais, como o mergulho, em locais sem ventilação ou de atmosfera
contaminada.
O oxigênio provoca uma resposta de euforia quando inalado. No século XIX, era
utilizado misturado com o óxido nitroso como analgésico. Atualmente, essa mistura
ressurgiu para evitar a dor em tratamentos dentários. Seu isótopo Oxigênio 15,
radioativo com emissão de pósitron, é usado em medicina nuclear, na tomografia
por emissão de pósitrons .
4
Na piscicultura o Oxigênio é utilizado no transporte de carga viva e para
oxigenação dos tanques de crescimento para maior produção intensiva em menor
espaço.
Uma das primeiras experiências conhecidas sobre a relação entre combustão e o
ar foi realizada por Filão de Bizâncio, escritor grego do século II a.C., que tinha
como um de seus interesses a mecânica. Em sua obra Pneumatica, Filão observou
que invertendo um recipiente sobre uma vela acesa e colocando água em torno do
gargalo do vaso resultava que um pouco de água subia para o gargalo. Filão supôs
erradamente que partes do ar no recipiente foram convertidas em elemento
clássico fogo e, portanto, foram capazes de escapar através dos poros do vidro.
Muitos séculos mais tarde, Leonardo da Vinci, com base no trabalho de Filão,
observou que uma parte do ar é consumida durante a combustão e a respiração.
No final do século XVII, Robert Boyle provou que o ar é necessário para a
combustão. O químico inglês John Mayow refinou este trabalho, mostrando que o
fogo requer apenas uma parte do ar, que ele chamou de nitroaereus spiritus ou
apenas nitroaereus. Num experimento, ele verificou que a colocação ou de um rato
ou de uma vela acesa em um recipiente fechado sobre a água levava a água a
subir e substituir um décimo quarto do volume do ar antes de sufocar os objetos da
experiência. A partir disso, ele supôs que nitroaereus é consumido tanto na
respiração como na combustão.
Mayow observou que o antimônio aumentava de peso quando aquecido, e inferiu
que o nitroaereus deve ter combinado com ele. Também pensava que os pulmões
separavam o nitroaereus do ar separada e passavam-no para o sangue e que o
calor animal e o movimento dos músculos resultava da reação do nitroaereus com
determinadas substâncias no organismo.
O elemento oxigênio foi descoberto pelo farmacêutico sueco Carl Wilhelm Scheele
em 1771, porém o seu trabalho não obteve reconhecimento imediato. Muitos
atribuem a Joseph Priestley o seu descobrimento, que ocorreu independentemente
em 1 de agosto de 1774.
O nome oxigênio (do grego ὀξύς = ácido e, -geno, da raiz γεν = gerar), foi dado por
Lavoisier em 1774 após ter observado que existiam muitos ácidos que continham
oxigênio.
Sua alta eletronegatividade o faz reagir com muitos elementos químicos
exceptuando alguns poucos gases nobres (He, Ne e Ar) . Permanece com nox
positivo somente quando está ligado ao flúor.
O composto mais notável do oxigênio é a água (H2O). Outros compostos
importantes que apresentam o elemento oxigênio em sua composição são: dióxido
de carbono, os álcoois (R-OH), aldeídos, (R-CHO), e ácidos carboxílicos (RCOOH).
Os íons clorato (ClO3-), perclorato (ClO<sub((>4-), cromato (CrO42-), dicromato
(Cr2O72-), permanganato (MnO4-) e nitrato (NO3-) são fortes agentes oxidantes. Os
epóxidos são éteres na qual o átomo de oxigênio é um hétero-tomo.
5
O ozônio (O3) se forma mediante descargas elétricas a partir do oxigênio molecular
(durante as tormentas elétricas, por exemplo).
No oxigênio líquido já foi encontrado, em pequenas quantidades, uma dupla
molécula de oxigênio: (O2)2.
O oxigênio respirado pelos organismos aeróbicos, liberado pelas plantas no
processo de fotossíntese, participa na conversão de nutrientes em energia
intracelular.
A redução do nível de oxigênio provoca a hipoxemia e, a falta total ocasiona a
anoxia, podendo provocar a morte do ser vivo.
A hemoglobina é o pigmento que dá a cor aos glóbulos vermelhos (eritrócitos) e
tem a função vital de distribuir o oxigênio pelo organismo.
O oxigênio pode ser tóxico a elevadas pressões parciais.
Alguns compostos de oxigênio como o ozônio, o peróxido de hidrogênio e radicais
hidroxila são muito tóxicos. O corpo humano possui mecanismos de proteção
contra estas espécies tóxicas. Por exemplo, a glutação atua como antioxidante,
como a bilirrubina que é um produto derivado do metabolismo da hemoglobina.
Presente na atmosfera em forma de gás oxigênio (O2) e gás carbônico (CO2), é
também o elemento mais abundante na crosta terrestre e oceanos. Esses dois
gases, juntamente com a água (H2O), são as principais fontes inorgânicas desse
elemento.
Executando papéis extremamente importantes para a regulação da vida no planeta,
o oxigênio troca átomos entre fontes orgânicas e inorgânicas, permitindo sua
utilização e liberação. Esses processos consistem no chamado “ciclo do oxigênio.
Na respiração de seres aeróbicos, por exemplo, o oxigênio é utilizado na forma de
O2, liberando CO2, H2O e energia. Moléculas de água poderão ser liberadas na
atmosfera através da transpiração, excreção e fezes; e também utilizadas na
síntese de diversas substâncias. Aliadas ao CO2 e energia luminosa, participam do
processo
fotossintético.
Na fotossíntese, alguns átomos de oxigênio são incorporados na matéria orgânica
vegetal, podendo ser novamente disponibilizados na atmosfera, em consequência
da decomposição; e outros, liberados na forma de O2, permitindo sua reutilização
na
respiração
aeróbica.
O oxigênio pode, ainda, se ligar a metais do solo, formando óxidos; além de
participar da formação da camada de ozônio, atuando como filtro protetor das
radiações ultravioletas longas do Sol. Neste processo, radiações ultravioletas
curtas rompem algumas moléculas de CO2 da atmosfera, liberando átomos
isolados que reagem com outras moléculas, formando o gás ozônio (O3).
A destruição da camada de ozônio – resultado, principalmente, de atividades
vulcânicas e liberação de gases de aviões supersônicos e clorofluorcarbonetos
(CFC’s) – pode desencadear consequências sérias, como a redução da atividade
fotossintética e aumento da incidência de câncer de pele, catarata e problemas
relacionados à imunidade.
6
2. Nitrogênio ou Azoto
O azoto ou nitrogênio é um elemento químico com símbolo N, número atómico 7 e
número de massa 14 (7 protons e 7 neutrons), representado no grupo (ou família)
15 (antigo VA) da tabela periódica. É o quinto elemento mais abundante no
Universo. Nas condições ambientes (25 °C e 1 atm) é encontrado no estado
gasoso, obrigatoriamente em sua forma molecular biatómica (N2), formando cerca
de 78% do volume do ar atmosférico. As mais importantes aplicações práticas
comerciais do nitrogénio são na obtenção da amônia (NH3) liquida e do gás
amoníaco pelo processo Haber. Considera-se que foi descoberto formalmente por
Daniel Rutherford em 1772 ao determinar algumas de suas propriedades.
Entretanto, pela mesma época, também se dedicou ao seu estudo Scheele que o
isolou.
O nitrogênio (do latim nitrogenium e este do grego νίτρον = nitro, e -genio, da raiz
grega γεν = gerar) considera-se que foi descoberto formalmente por Daniel
Rutherford em 1772 ao determinar algumas de suas propriedades. Entretanto, pela
mesma época, também se dedicaram ao seu estudo Scheele que o isolou,
Cavendish, e Priestley. O nitrogênio é um gás tão inerte que Lavoisier se referia a
ele como azote, que é uma palavra formada pelas raizes gregas a (negativo) e zote
(vivo), ou seja, sem-vida, devido ao fato de que ele não é utilizado para a vida na
Terra como o oxigênio. Em francês, o termo azote é utilizado no lugar de
nitrogênio. Alguns anos depois, em 1790, foi chamado de nitrogénio, por Jean
Antoine Chaptal, que significa “formador de salitre”. Foi classificado entre os gases
permanentes desde que Faraday não conseguiu torná-lo líquido a 50 atm e -110
°C. Mais tarde, em 1877, Pictet e Cailletet conseguiram liquefazê-lo. Alguns
compostos de nitrogênio já eram conhecidos na Idade Média: os alquimistas
chamavam de aqua fortis o ácido nítrico e aqua regia a mistura de ácido nítrico e
clorídrico, conhecida pela sua capacidade de dissolver o ouro.
Ocorre como um gás inerte (N2), não-metal, incolor, inodoro e insípido, constituindo
cerca de 4/5 da composição do ar atmosférico, não participando da combustão e
nem da respiração. Como elemento (N) tem uma elevada eletronegatividade (3 na
escala de Pauling) e 5 electrões no nível mais externo (camada de valência),
comportando-se como ião trivalente na maioria dos compostos que forma.
Condensa a aproximadamente 77 K (-196 °C) e solidifica a aproximadamente 63 K
(-210 °C).
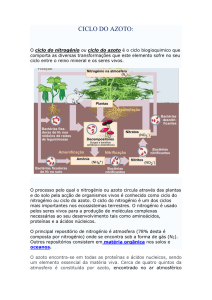
O nitrogénio é o principal componente da atmosfera terrestre. Este elemento chega
ao solo através de compostos orgânicos (restos vegetais e animais) e/ou
inorgânicos. Sua fixação pode ser biológica(simbiótica ou não) ou por descargas
elétricas. No solo o N se encontra na forma orgânica ou inorgânica, podendo se
mudar de forma (ou vice-versa) pelo fenômeno da mineralização ou imobilização.
A mais importante aplicação comercial do nitrogênio é na obtenção do gás
amoníaco pelo processo Haber. O amoníaco é usado, posteriormente, para a
fabricação de fertilizantes e ácido nítrico.
É usado, devido a sua baixa reatividade, como atmosfera inertizada em tanques de
armazenamento de óleos vegetais e animais.[5] Também é usado em tanques de
7
líquidos explosivos, durante a fabricação de componentes eletrônicos (transistores,
diodos, circuitos integrados, etc.) e na fabricação do aço inoxidável.
O nitrogênio líquido, obtido pela destilação do ar líquido, se usa em criogenia, já
que na pressão atmosférica condensa a -196 °C.
É usado como fator refrigerante, para o congelamento e transporte de alimentos,
conservação de corpos e células reprodutivas sexuais, masculinas e femininas ou
quaisquer outras amostras biológicas.
Entre os sais do ácido nítrico estão incluídos importantes compostos como o nitrato
de potássio (nitro ou salitre empregado na fabricação de pólvora) e o nitrato de
amônio como fertilizante.
Os compostos orgânicos de nitrogênio como a nitroglicerina e o trinitrotolueno
(TNT) são muito explosivos. A hidrazina e seus derivados são usados como
combustível em foguetes.
O nitrogênio é o elemento que as plantas necessitam em maior quantidade. É um
macronutriente primário ou nobre. No entanto, devido à multiplicidade de reações
químicas e biológicas, à dependência das condições ambientais e ao seu efeito no
rendimento das culturas, o nitrogênio é também o elemento que apresenta maiores
dificuldades de manejo na produção agrícola mesmo em propriedades
tecnicamente orientadas. As formas preferenciais de absorção de Nitrogênio pelas
plantas são a amônia (NH4+) e o nitrato (NO3-). Compostos nitrogenados simples,
como uréia e alguns aminoácidos, também podem ser absorvidos, mas são poucos
encontrados na forma livre no solo.
Mas, apesar de ser o nutriente mais abundante da atmosfera terrestre, o N não
figura como constituinte de qualquer rocha terrestre. Talvez, seja por este motivo
ele é o elemento mais caro dos fertilizantes, pois, para sua formação são
necessárias diversas reações químicas, as quais necessitam de muita energia. Tal
afirmação e justificada pelo fato da difícil síntese e alto custo energético da
formação do NH3.
As formas em que o N se apresenta nos adubo nitrogenados são: Nítricas (Ex.
Nitrato de Cálcio), amoniacal (Ou ambas como e o caso do Nitrato de Amônia),
orgânica e amídica (Uréia). A concentração de N nos adubos podem variar desde
82% na amônia anidra até alguns décimo de 1% nos adubos orgânicos.
O nitrogênio é o componente principal da atmosfera terrestre (78,1% em volume). É
obtido, para usos industriais, pela destilação do ar líquido ou pelo enriquecimento
através de filtros moleculares. O elemento está presente na composição de
substâncias excretadas pelos animais, usualmente na forma de ureia e ácido úrico.
Tem-se observado compostos que contém nitrogênio no espaço exterior. O isótopo
14N se cria nos processos de fusão nuclear das estrelas.
Com o hidrogênio forma o amoníaco ( NH3 ) e a hidrazina ( N2H4 ). O amoníaco
líquido — anfótero como a água — atua como uma base em solução aquosa
8
formando íons amônio ( NH4+ ). O mesmo amoníaco comporta-se como um ácido
em ausência de água, cedendo um próton a uma base, dando lugar ao ânion amida
(NH2-). Também se conhece largas cadeias e compostos cíclicos de nitrogênio,
porém, são muito instáveis.
Com o oxigênio forma vários óxidos como o óxido nitroso ( N2O) ou gás hilariante,
o óxido nítrico (NO) e o dióxido de nitrogênio ( NO2 ), estes dois últimos são
representados genericamente por NOx e são produtos de processos de combustão,
contribuindo para o aparecimento de contaminantes (smog fotoquímico). Outros
óxidos são o trióxido de dinitrogênio ( N2O3 ) e o pentóxido de dinitrogênio (N2O5),
ambos muito instáveis e explosivos, cujos respectivos ácidos são o ácido nitroso
(HNO2) e o ácido nítrico (HNO3) que, por sua vez, formam os sais nitritos e nitratos.
O azoto é o componente essencial dos aminoácidos e dos ácidos nucleicos, vitais
para os seres vivos. As leguminosas são capazes de desenvolver simbiose com
certas bactérias do solo chamadas de rizóbios, estas bactérias absorvem o azoto
directamente do ar, sendo este transformado em amoníaco que logo é absorvido
pela planta. Na planta o amoníaco é reduzido a nitrito pela enzima nitrito redutase e
logo em seguida é reduzido a nitrato pela enzima nitrato redutase. O nitrato é
posteriormente utilizado pela planta para formar o grupo amino dos aminoácidos
das proteínas que, finalmente, se incorporam à cadeia trófica. Um bom exemplo
deste processo é observado na soja, sendo esta uma cultura que dispensa
adubação nitrogenada. (veja: ciclo do nitrogênio). Em 2015, pesquisadores da
Universidade Cornell desenvolveram um forma de vida livre de oxigênio com base
em metano chamada "azotosoma" que, teoricamente, pode existir no ambiente frio
e agreste da lua gigante do planeta Saturno, Titã, desafiando a idéia de que a água
é necessária à vida.
Há dois isótopos estáveis do azoto: 14N e 15N. O mais comum é o 14N, com uma
abundância relativa de 99,634%, sendo o restante preenchido pelo 15N. No
universo, o 14N é produzida pelo ciclo carbono-azoto das estrelas.
Dos dez isótopos artificiais do nitrogênio (sintetizados em laboratório), o 13N tem
uma vida média de nove minutos enquanto que os demais isótopos, da ordem de
segundos ou menos.
As reacções biológicas de nitrificação e desnitrificação contribuem, de maneira
determinante, na dinâmica do azoto no solo, quase sempre produzindo um
enriquecimento em 15N do substrato.
Os fertilizantes azotados são uma poderosa fonte de contaminação do solo e das
águas. Os compostos que contêm iões cianeto formam sais extremadamente
tóxicos e são mortais para numerosos animais, entre os quais os mamíferos.
9
3. Referências
Disponível em <http://www.daviddarling.info/encyclopedia/N/nitrogen.html>. Acesso em 22
de novembro de 2015.
Disponível em <http://www.tabela.oxigenio.com/nao_metais/elemento_quimico_nitrogenio.htm>.
Acesso em 22 de novembro de 2015.
Disponível em <http://www.brasilescola.com/biologia/ciclo-do-oxigenio.htm>. Acesso em 19
de novembro de 2015.