QUESTÕES DE PROVAS ANTERIORES DO PROCESSO SELETIVO PARA O
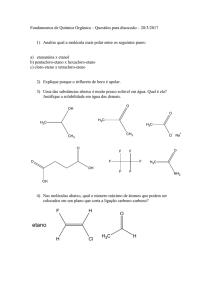
PROGRAMA DE PG EM QUÍMICA DO IME
1a Questão:
Quais das seguintes moléculas apresentam caráter aromático? Justifique sua
resposta.
2a Questão:
Coloque os compostos abaixo em ordem crescente de pKa .
Ácido acético, fenol, t-butanol, anilina, amônia e metano.
3a Questão:
Ordene os alquenos – eteno, propeno e 2-metil-propeno – de acordo com sua
facilidade de sofrer uma reação de hidratação catalisada por ácido. Justifique sua
resposta.
4a Questão:
Indique os reagentes (1, 2, 3 e 4) que você usaria para promover as transformações
abaixo, bem como as estruturas dos produtos A e B.
1
2
A
Cicloexano
carboxaldeído
OH
O
4
B
3
5a Questão:
Qual das substâncias abaixo melhor justifica o espectro apresentado. Explique
objetivamente sua resposta.
O
O
O
OH
H
O
1
6a Questão:
Sabendo que o espectro de massas para o 2-metil-penteno apresenta um fragmento
com valor de m/z = 56, o qual é considerado o de maior abundância (pico base).
Proponha um mecanismo de obtenção para este fragmento.
7a Questão
Um composto com fórmula C8H8O2 mostra absorções fracas no infravermelho por
volta de 3050 cm-1, 2840 cm-1, 2740 cm-1, e absorções fortes em 1683 cm-1, 1260 cm1
, 1025 cm-1 e 834 cm-1. A partir destes dados de infravermelho e do espectro de
RMN apresentado abaixo, considere as seguintes afirmações:
2
OBS. Despreze o sinal em 7,2 ppm referente ao solvente não deuterado
O offset apresenta um valor de 9,9ppm
I – o composto é um ácido carboxílico;
II – o composto possui uma função éter;
III – o composto possui anel aromático e uma função éster;
IV – o composto apresenta um padrão de substituição “meta”.
V – o composto possui uma função aldeído;
São consideradas verdadeiras as afirmações:
(A) apenas a I
(B) I e II
(C) II e V
(D) IV e V
(E) I e IV
8a Questão
Considerando os pares de compostos apresentados abaixo, a técnica de ultravioleta
seria mais adequada para diferenciar qual dos pares? Justifique sua resposta.
A)
B)
O
C)
O
D) NÃO É POSSÍVEL UTILIZAR PARA NENHUM DOS PARES
3
9a Questão
Dois isômeros aromáticos com fórmula C9H9BrO2.quando analisados por RMN de
hidrogênio forneceram os espectros apresentados a seguir. Estabeleça uma
correlação com o padrão de substituição (orto, meta ou para) para cada espectro
apresentado.
10a Questão
Desenhe o espectro de RMN de hidrogênio para o composto abaixo, levando em
consideração o deslocamento químico, a intensidade e multiplicidade dos diversos
sinais.
O
H
CH3
11a Questão
A grandeza diretamente realacionada com o princípio físico da ressonância
magnética nuclear é:
a)
b)
c)
d)
e)
O spin dos eletrons das ligações químicos entre os átomos.
Os níveis de energia dos orbitais atômicos envolvidos.
O spin nuclear.
O momento de inércia da molécula.
Os itens a) e c) acima.
4
12a Questão
A grandeza que permite a determinação da massa dos compostos e dos seus
fragmentos por espectrometria de massas é:
a)
b)
c)
d)
e)
O somatório da massa de todos os átomos na molécula.
A relação carga/massa.
O somatório da carga de todos os átomos da molécula.
O momento de dipolo elétrico.
As afirmações a) e c) acima.
13a Questão
O motivo pelo qual o deslocamento químico dos hidrogênios do benzeno em um
espectro de RMN de hidrogênio ( 7,3) é maior que o deslocamento químico dos
hidrogênios do eteno ( 5,3) é:
a)
b)
c)
d)
e)
A massa do benzeno ser maior que a do eteno.
O efeito anisotrópico dos elétrons do sistema aromático.
A densidade eletrônica do benzeno ser maior que a do eteno.
O eteno ter uma maior proporção C/H do que o benzeno.
Todas as afirmações acima.
14a Questão
Os espectros de RMN de
de 1H porque:
13
C são mais difíceis de obter do que os espectros de RMN
a)
b)
c)
d)
A constante magnetogírica do hidrogênio é maior que a do carbono.
A abundância natural do 13C é menor que a do 1H.
A constante magnetogírica do 13C é maior que a do 1H.
Os espectros de RMN de 13C normalmente tem uma janela espectral de 250
ppm entanto que os espectros de RMN de 1H tem uma janela de no máximo
20 ppm.
e) Os itens b) e d) acima.
5
15ª Questão – A reserpina é um fármaco que já foi muito receitado no passado como
agente hipertensivo, mas que não é mais usado hoje em dia devido a seus sérios efeitos
colaterais como a depressão. Dada a estrutura da reserpina abaixo, responda aos itens da
tabela.
H
N
O
N
H
H
O
H
O
O
O
O
O
O
O
Item
a
b
c
d
e
f
g
h
Questão
Identifique com o número 1 as ligações (─) presentes na estrutura;
Identifique com o número 2 as ligações (sp2─sp2) presentes na estrutura;
Identifique com o número 3 as ligações (sp3─sp3) presentes na estrutura;
Mostre com uma seta os átomos de carbono quirais da reserpina;
Calcule o número de isômeros óticos da reserpina;
Desenhe as estruturas dos três produtos da hidrólise total da reserpina;
Determine pelo menos dois produtos da mononitração da reserpina;
Determine a fórmula molecular da reserpina.
16ª Questão – Escreva as fórmulas estruturais de: a) 4-etil-3,3-dimetil-decano; b) 5,5 –
dimetil-1,3-hexadieno; c) 4-etil-1-metil-cicloexano; d) ácido trans-5-en-octanóico.
17ª Questão – Coloque os compostos abaixo em ordem crescente de acidez (não será
considerada qualquer ordenação diferente da solicitada).
Ácido acético, fenol, t-butanol, anilina, amônia
18ª Questão – Explique que tipo de informação sobre a estrutura molecular é obtida com os
seguintes métodos espectroscópicos:
Espectroscopia no infravermelho
Espectroscopia ultravioleta
Espectroscopia de ressonância magnética nuclear
19ª Questão – Considerando os compostos: acetona, acetato de etila e acetamida, coloqueos em ordem crescente da absorção do grupo C=O num espectro de infravermelho.
20ª Questão – Proponha um espectro de RMN de hidrogênio para o acetato de etila.
6
21ª Questão – Faça o balanceamento das equações abaixo e identifique os agentes de
oxidação e de redução.
a) Pb(OH)4-2(aq) + ClO¯(aq) PbO2(s) + Cl¯(aq) (em meio básico)
b) As2O3(s) + NO3¯(aq) H3AsO4(aq) + N2O3(aq) (em meio ácido)
22ª Questão – Uma mistura contendo 3,15 g de cada um dos seguintes gases: CH4(g),
C2H4(g) e C4H10(g) é confinada em um frasco de 2,00 L a uma temperatura de 64 oC. Com
base nas informações acima responda aos itens abaixo:
a) Calcule a pressão parcial de cada um dos gases na mistura.
b) Calcule a pressão total da mistura.
23ª Questão – Escreva a equação da energia livre de Gibbs, e explique seu significado bem
como o de cada um dos seus componentes.
24ª Questão – Industrialmente, a hidrólise de resíduos celulósicos, visando à obtenção de
açúcares, é realizada pela ação do ácido sulfúrico, em temperatura e pressão elevadas.
Após a hidrólise, a solução apresenta concentração de ácido sulfúrico igual a 49 g/L. Para
facilitar a purificação dos açúcares, a solução deve ser neutralizada à temperatura de 50ºC.
Considere que as seguintes substâncias foram disponibilizadas para a neutralização: óxido
de cálcio (cal virgem), solução aquosa de hidróxido de sódio 0,5 mol/L e solução aquosa de
hidróxido de amônio 0,5 mol/L. Calcule a quantidade em mol de hidróxido de amônio
necessária para a neutralização completa do ácido sulfúrico presente em 20 litros de solução
hidrolisada.
a) 10 mol
b) 20 mol
c) 15 mol
d) 49 mol
e) 0,5 mol
25ª Questão – Óxidos de nitrogênio, NOx, são substâncias de interesse ambiental, pois são
responsáveis pela destruição de ozônio na atmosfera, e, portanto, suas reações são
amplamente estudadas. Num dado experimento, em um recipiente fechado, a concentração
de NO2 em função do tempo apresentou o seguinte comportamento:
O papel do NO2 neste sistema reacional é:
a)
b)
c)
d)
e)
7
reagente.
intermediário.
produto.
catalisador.
inerte.
26ª Questão – Em 1854, com a inauguração da Companhia de Iluminação a Gás, o Rio de
Janeiro passou a ser uma das primeiras cidades, no mundo, a usufruir de iluminação a gás.
O processo era baseado na reação entre carvão incandescente e vapor d’água, produzindo
uma mistura gasosa chamada de gás de água ou gás azul, segundo a reação:
C(s) + H2O(v) → CO(g) + H2(g)
O gás de água era estocado em reservatórios e chegava às casas por meio de uma grande
rede de tubulações. O gás de água continuou sendo usado como combustível doméstico até
1967, quando foi substituído por gás proveniente do processamento de petróleo.
Calcule a entalpia da combustão completa do gás de água.
H de combustão do CO = 280 kJ/mol e H de combustão do H2 = 240
Dados:
kJ/mol
a) 520 kJ/mol
b) -240 kJ/mol
c) 40 kJ/mol
d) -280 kJ/mol
e) -520 kJ/mol
27ª Questão – Um reservatório que contém uma certa quantidade de gás de água a uma
temperatura de 300 K e uma pressão de 2 atm recebe uma quantidade adicional de gás. O
número final de moles de gás no reservatório é seis vezes o número inicial e a temperatura
final do gás é igual a 400 K. Admitindo que o gás seja ideal, determine a pressão no interior
do reservatório ao final do enchimento.
a) 12 atm
b) 18 atm
c) 16 atm
d) 2 atm
e) 32 atm
28ª Questão – Qual das soluções abaixo é a solução eletrolítica mais eficaz (que melhor
conduz corrente elétrica)? Justifique.
a)
b)
c)
d)
e)
solução 0,1M de um diácido que apresenta 100% de grau de ionização
solução 0,4N de um monoácido que apresenta 25% de grau de ionização
solução 0,1M de um monoácido que apresenta 100% de grau de ionização
solução 0,05N de um diácido que apresenta 100% de grau de ionização
solução 0,2N de um monoácido que apresenta 50% de grau de ionização
29ª Questão – Considere a reação de decomposição, em solução, do diazobenzeno abaixo:
C6H5N2Cl (solução) → C6H5Cl(solução) + N2(g)
Essa é uma reação irreversível de primeira ordem e sua velocidade pode ser medida de
diferentes maneiras. O gráfico abaixo que representa corretamente a velocidade da reação
é:
8
30ª Questão – Foram realizados quatro experimentos. Cada um deles consistiu na adição de
solução aquosa de ácido sulfúrico de concentração 1 mol/L a certa massa de ferro. A 25 °C e
1 atm, mediram-se os volumes de hidrogênio desprendido em função do tempo. No final de
cada experimento, sempre sobrou ferro que não reagiu. A tabela abaixo mostra o tipo de
ferro usado em cada experimento, a temperatura e o volume da solução de ácido sulfúrico
usado. O gráfico em seguida mostra os resultados. Correlacione os experimentos da tabela
às curvas do gráfico.
31ª Questão – A velocidade das reações é uma grandeza que apresenta uma grande
importância prática. Certas vezes, tentamos agir sobre ela para aumentá-la (aceleração da
produção na indústria, cozimentos dos alimentos numa panela de pressão, revelação
instantânea das fotografias etc); outras vezes, para diminuí-la (diminuição da corrosão,
conservação dos alimentos pelo frio etc). Com base no acima exposto assinale a afirmativa
INCORRETA:
9
a) Um complexo ativado é uma estrutura intermediária entre os reagentes e os
produtos, com ligações intermediárias entre as dos reagentes e as dos produtos.
b) A energia de ativação é a energia mínima necessária para a formação do complexo
ativado. Seu abaixamento determina o aumento da velocidade da reação.
c) Um catalisador é uma substância que aumenta a velocidade de uma reação,
permanecendo inalterado qualitativa e quantitativamente no final da reação.
d) A ação do catalisador é aumentar a energia de ativação, possibilitando um novo
caminho para a reação.
32ª Questão – A fabricação industrial do ácido sulfúrico, H2SO4, é realizada a partir de
enxofre, oxigênio e água, em 3 etapas, representadas de acordo com o diagrama energético
abaixo:
A indústria usa um catalisador para aumentar a velocidade da fabricação do ácido sulfúrico.
É CORRETO afirmar que o catalisador aumenta a velocidade:
a)
b)
c)
d)
da primeira etapa.
da segunda etapa.
da terceira etapa.
das três etapas.
33ª Questão – A energia livre de Gibbs é definida como G = H – TS. Ao analisar processos
químicos, sob pressão e temperatura constantes, em termos de diferenças de energia livre,
pode-se dizer que para um processo espontâneo:
a)
b)
c)
d)
e)
G > 0
G = 0
G < 0
tende a + infinito
tende a – infinito
34ª Questão – Em todas as questões de múltipla escolha abaixo marque com um “x” todas
as opções verdadeiras em cada caso.
1. As espectroscopias no Infravermelho e no Ultravioleta envolvem a utilização de radiação
eletromagnética de diferente freqüência.
a) A freqüência da radiação ultravioleta é menor que a freqüência da radiação
infravermelha.
10
b) A freqüência da radiação ultravioleta é maior que a freqüência da radiação
infravermelha.
c) A energia da radiação ultravioleta é maior que a energia da radiação infravermelha.
d) A energia da radiação ultravioleta é menor que a energia da radiação infravermelha.
e) A velocidade da radiação ultravioleta é maior que a velocidade da radiação
infravermelha.
2. Para funcionar, um espectrômetro de ressonância magnética nuclear precisa de:
a) Um campo gravitacional e uma fonte de calor.
b) Um campo magnético e uma fonte de radiação eletromagnética.
c) Uma fonte de radiação eletromagnética e um campo elétrico.
d) Uma fonte de calor e um campo magnético.
e)Um campo elétrico e uma fonte de radiação eletromagnética.
3. O princípio da espectrometria de massas está fundamentado em que:
a) Os números atômicos dos diversos elementos da tabela periódica são
diferentes.
b) As massas atômicas dos diversos elementos são diferentes.
c) Os isótopos de um elemento têm o mesmo número atômico.
d) A massa de uma molécula é o somatório das massas dos elementos que a
compõem.
e) A massa de uma molécula é o somatório das massas dos elementos que a
compõem menos a massa dos elétrons de ligação.
4. A frequência, em número de onda ( ), da vibração por estiramento da ligação CO
normalmente aparece entre =1800 e 1500 cm-1. Comparando a freqüência da carbonila
de um éster (RCOOR), uma cetona (RCOR) e uma amida (RCONR2) se observa que:
a) (RCOOR) > (RCOR) > (RCONR2)
b) (RCOR) > (RCOOR) > (RCONR2)
c) (RCONR2) > (RCOOR) > (RCOR)
d) (RCOOR) = (RCOR) > (RCONR2)
5. Dentre os seguintes compostos:
O
H3C
O
A
OH
OH
H3C
O
OH
O
H3C
B
O
C
OH
O
H3C
O
O
D
Podemos afirmar que:
a) O comprimento de onda máximo no espectro de ultravioleta dos compostos segue a
ordem A > B > C > D.
b) O comprimento de onda máximo no espectro de ultravioleta dos compostos segue a
ordem B > A > C > D.
c) O comprimento de onda máximo no espectro de ultravioleta dos compostos segue a
ordem A > B > D > C.
d) O comprimento de onda máximo no espectro de ultravioleta dos compostos segue a
ordem C > A > D > B.
e) O comprimento de onda máximo no espectro de ultravioleta dos compostos segue a
ordem A > D > C > B.
11
6. A multiplicidade dos sinais do espectro de RMN de 1H da seguinte molécula é:
6
10
7
CH3
1
5
8
Cl
4
2
3
Cl
CH3
9
a) H-3 singleto; H-5 dubleto; H-6 dubleto; H-7 tripleto; H-8 octeto; H-9 dubleto e H-10
dubleto.
b) H-3 dubleto; H-5 dubleto; H-6 dubleto; H-7 tripleto; H-8 septeto; H-9 dubleto e H-10
dubleto.
c) H-3 dubleto; H-5 dubleto de dubletos; H-6 dubleto; H-7 dubleto; H-8 septeto; H-9
dubleto e H-10 dubleto.
d) H-3 dubleto; H-5 dubleto de dubletos; H-6 dubleto; H-7 dubleto; H-8 septeto; H-9
quarteto e H-10 quarteto.
e) H-3 dubleto; H-5 dubleto de dubletos; H-6 dubleto de dubletos; H-7 dubleto; H-8
septeto; H-9 dubleto e H-10 dubleto.
7. A seguinte tabela contem os espectros de RMN de H-1 e C-13 dos compostos A, B e C.
Composto
Espectro de RMN de H-1
A
B
C
As estruturas destes compostos são:
12
Espectro de RMN de C-13
A
a)
B
C
O
CHO
H3C
H3CO
O
H3C
CH3
CH3
O
Br
b)
CHO
O
Br
Cl
OCH3
c)
H3C
O
CHO
OCH3
O
CH3
H3C
O
CH3
O
Br
H3C
O
O
CH3
O
d)
CHO
H3C
O
O
CH3
H3C
O
O
CH3
O
Br
OCH3
e)
O
OCH3
CHO
Br
H3C
O
O
CH3
CH3
O
8. O espectro abaixo é o espectro de massas por ionização eletrônica de um composto
orgânico:
Esse espectro corresponde ao composto:
a) Acetato de etila.
b) 3-metilbutanona.
c) n-Butiraldeído.
d) 2-butanona.
e) Metietilcetona
13
9. Com relação às espectroscopias no Infravermelho (IV) e no Ultravioleta-Visível (UV-Vis)
podemos afirmar:
a) UV-Vis está relacionado aos processos de excitação eletrônica.
b) IV está relacionado principalmente a processos rotacionais moleculares.
c) UV-Vis e IV são espectroscopias de absorção.
d) UV-Vis e IV são espectroscopias de emissão.
e) IV está principalmente relacionada a processos vibracionais moleculares.
10. Com relação radiação eletromagnética (REM) podemos afirmar que:
a) A REM é composta por um campo magnético oscilante perpendicular a um campo
elétrico oscilante.
b) O comprimento de onda é inversamente a frequência.
c) As ondas de maior energia apresentam menor frequência.
d) A REM é formada por partículas.
e) A REM é formada por ondas
35ª Questão – Considere o esquema abaixo e responda:
A)
B)
OTs
NC
Cl
H2O
CN
OH
TsO
HCl
Os mecanismos principais pelos
quais as reações A e B devem
ocorrer são:
a) A e B = radicalar
b)A = E1 ; B = SN1
c) A = SN1; B = SN2
d) A = SN2 ; B = SN1
e) A e B = SN2
36ª Questão – Qual das ordenações abaixo representa com fidelidade uma ordem de acidez
para os diferentes compostos abaixo:
a) III>IV>II>I
O
O
O
O
F
b) III>I>II>IV
Cl
OH
OH
OH
OH c) III>IV>II>I
FF
F
d) I>II>IV>III
III
I
II
IV
e) III>II>I>IV
37ª Questão – Sabendo que os compostos abaixo podem fornecer produtos quando tratados
com Br2 / FeBr3. Em sua opinião qual seria a ordenação crescente da reatividade para os
compostos apresentados?
14
NO2
NMe2
OCH3
I
II
III
a) I<III<IV<II
b) III<I<II<IV
c) I<II<III<IV
d) I<II<IV<III
e) I<IV<III<II
IV
38ª Questão – Considerando a sequência de transformações abaixo, qual o item contem
uma afirmação verdadeira?
a) O composto (I) é um epóxido;
Pd / H2
(V)
b) O composto (II) é uma amida;
c) O composto (III) é um alcano;
d) O composto (IV) é uma cetona;
NaCN
AcOOH
Pd / H2
(I)
(II)
(III) e) Os compostos (IV) e (V) são
alcanos.
H3O
(IV)
39ª Questão – Considerando que a reação abaixo fornece um produto (I) de condensação.
Qual a alternativa verdadeira que reporta todas as funções presentes neste composto?
a) O composto (I) é um hidróxi-ácido;
O
1) CH3ONa
b) O composto (I) é um diol;
produto (I)
c) O composto (I) possui um alqueno e um
2) H3O / calor
álcool;
d) O composto (I) é uma hidróxi-amida;
e) O composto (I) é uma enona.
40ª Questão – A reação de solvólise do cloreto de t-butila com água para fornecer t-butanol
acontece:
a) Através de um mecanismo SN1.
b) Através de um mecanismo SN2.
c) Através de um mecanismo E2
d) Através de um mecanismo E1
e) Através de um mecanismo pericíclico
41ª Questão – A teoria de acidez de Lewis diz que:
a) Um ácido é um aceptor de hidrogênio.
b) Um ácido é um doador de prótons.
c) Um ácido é um doador de elétrons.
d) Um ácido é um aceptor de elétrons.
e) Um ácido é um aceptor de hidróxido.
42ª Questão – Um orbital atômico é:
a) A órbita ocupada por um elétron ao redor do núcleo atômico.
b) Uma região do espaço onde há mais probabilidade de se encontrar os elétrons de um
átomo.
c) Um volume espacial com forma lobular onde se encontram os elétrons do átomo.
d) A região do espaço onde a probabilidade de se encontra eletrons é zero.
e) A superfície da esfera onde tem mais elétrons.
43ª Questão – Qual das seguintes características não é necessária para um composto ser
aromático:
a) Possuir conjugação.
15
b)
c)
d)
e)
Ser planar.
Possuir 4n+2 elétrons .
Ser cíclica.
Ter aroma característico.
44ª Questão – O nome do seguinte composto CH3CH2OCHCH2 é:
a) Dietil éter.
b) Metilmetilenoxivinil éter.
c) Etil-vinil éter.
d) Éter dietílico.
e) Etóxi-etano.
45ª Questão – Escreva a fórmula estrutural abreviada (condensada) ou a fórmula de linhas
dos seguintes compostos: a) trinitro tolueno; b) 2 - metil - 5 - neopentil, 7 - dodecino; d) 2 etil - 1,3 - dimetilciclo-hexano; e) Isômero cis do 2,3,4 - trimetil - 1,3,5 - heptatrieno;
46ª Questão – Determine as estruturas dos produtos A e B gerados a partir da reação do
3,3-dimetil-1-buteno com HCl, conforme mostrado abaixo, e mostre os respectivos
mecanismos que levam a formação desses produtos.
47ª Questão – Desenhe as estruturas dos principais produtos da reação de nitração dos
compostos aromáticos abaixo.
48ª Questão – Explique suscintamente quais propriedades físicas a espectrometria de
infravermelho mede e que tipo de informação sobre a estrutura molecular pode ser obtida em
um espectro de infravermelho.
49ª Questão – Em relação à espectrometria de massas explique o que é um íon molecular e
o que o seu valor significa.
50ª Questão – Proponha um espectro de RMN para o p-cloro-clorobenzeno.
51ª Questão – Considere a reação:
2Al(s) + 3Cl2(g) 2AlCl3(s)
Em determinado experimento, deixa-se reagir uma mistura de 1,50 moles de Al e 3,00
moles de Cl2. Com base nestas informações determine:
16
a) Qual é o reagente limitante.
b) Qual a quantidade de matéria de AlCl3 formada;
c) Qual a quantidade de matéria do reagente em excesso que sobra ao final da
reação.
52ª Questão – Faça o balanceamento das equações químicas abaixo:
a) TiCl4(l) + H2O(l) TiO2(s) + HCl(aq)
b) NH4NO3(s) N2(g) + O2(g) + H2O(g)
c) Ca3P2(s) + H2O(l) Ca(OH)2(aq) + PH3(g)
d) N2H4(g) + N2O4(g) H2O(g) + N2(g)
e) AgNO3(aq) + Na2SO4(aq) Ag2SO4(s) + NaNO3(aq)
53ª Questão – Correlacione a primeira coluna com a segunda.
Estuda as velocidades das reações
químicas
e
como
elas
são
influenciadas pela maneira como os
reagentes são transformados em
produtos.
Expressão matemática que relaciona
a
taxa
de
reação
com
a
concentração de cada reagente.
Tempo necessário para que a
concentração inicial do reagente caia
pela metade.
1
À V constante, P de uma massa fixa de gás
varia linearmente com a T do gás em 0C. À P
constante, V de uma massa fixa de um gás
varia linearmente com a T do gás em 0C.
2
PV nRT
3
0,082057 atm.L.mol -1.K -1
4
“Todo gás é um vácuo para qualquer outro gás”
variação da concentraç ão
tempo
5
6
Lei da taxa
Cinética química
Tempo de meia vida de uma reação de primeira
ordem.
Taxa de reação
Constante dos gases.
Lei de Charles e Gay-Lussac.
7
8
Lei das pressões parciais.
Equação dos gases ideais.
54ª Questão – Coloque em ordem crescente de ponto de ebulição as moléculas abaixo:
Dê uma justificativa. (não será considerada qualquer ordenação diferente da solicitada)
OH
NH2
I
II
III
IV
V
55ª Questão – Desenhe a equação química e classifique as reações seguintes dentre uma
das seguintes opções: (1) reação de adição; (2) reação de substituição nucleofílica; (3)
reação de condensação e (4) reação de substituição eletrofílica.
(a) reação do iodo, fenil metano com água; (b) hidrogenação do butino; (c) reação da
metilamina com ácido butanóico (d) reação de água com 1-iodo-1,1-dimetiletano; (e) reação
de 3-clorohexano com hidróxido de sódio concentrado;
56ª Questão – Desenhe as estruturas das moléculas abaixo, indique quais apresentam
atividade ótica, identifique nelas os carbonos quirais e calcule o número de isômeros óticos
de cada uma.
(a) CH3CHBrCl; (b) C6H5CHClCH3; (c) 1,2-dibromobutano; (d) CH3CHBrCH2CH3;
17
(e) CH3CHBrCHBrCH3.
57ª Questão – Explique, mostrando os respectivos mecanismos, porque uma reação SN1
ocorre sem inversão de configuração enquanto que uma reação SN2 ocorre com inversão de
configuração.
58ª Questão – Dados a estrutura e o espectro de massas do colesterol abaixo sugira
mecanismos de fragmentação e estruturas para pelo menos 05 íons dentre os indicados no
espectro.
59ª Questão – Quando o óxido de lítio (Li2O) é dissolvido em água a solução torna-se básica
pela reação do íon óxido (O-2) com a água. Escreva a reação que ocorre e identifique os
seus pares ácido-base conjugados.
60ª Questão – Explique o que você entende por: (a) Processos reversíveis e irreversíveis;
(b) primeira lei da termodinâmica; (c) Entropia e a segunda lei da termodinâmica; (d)
Energia livre de Gibbs e constante de equilíbrio.
61ª Questão – Considerando que os dados da tabela abaixo foram medidos para a reação
do óxido nítrico com hidrogênio: 2NO(g) + 2H2(g) → N2(g) + 2H2O(g). responda os itens a
seguir:
(a) Determine a lei da velocidade para essa reação. (b) Calcule a constante de velocidade.
(c) Calcule a velocidade quando [NO] = 0,050 mol/L e [H2] = 0,150 mol/L.
Número do
experimento
1
2
3
[NO] (mol/L)
[H2] (mol/L)
0,10
0,10
0,20
0,10
0,20
0,10
Velocidade inicial
(mol.L-1.s-1)
1,23 x 10-3
2,46 x 10-3
4,92 x 10-3
62ª Questão – A rifampicina é um antibiótico semissintético feito a partir da rifamicina B. Um
antibiótico isolado do fungo Streptomyces mediterranei. Ela é capaz de inibir bactérias grampositivas se ligando não covalentemente à enzima RNA polymerase inibindo, assim, a
síntese de RNA e, consequentemente, levando a bactéria a morte. Dada a estrutura da
rifampicina responda as questões da tabela abaixo.
18
Item
a
b
c
d
e
Questão
Identifique com o número 1 as ligações ( ─ ) presentes na estrutura;
Identifique com o número 3 as ligações (sp3─sp3) presentes na estrutura;
Mostre com uma seta os átomos de carbono quirais da rifampicina;
Calcule o número de isômeros óticos da rifampicina;
Desenhe as estruturas dos três produtos da hidrólise total da rifampicina;
63ª Questão – Escreva as fórmulas estruturais de: a) ácido 4-etil-3,3-dimetil-decanóico; b)
5,5 – dimetil-undecano; c) 4-etil-1-metil-ciclocteno; d) ácido 5-in-dodecanóico; e) isopentanal
64ª Questão – Coloque os compostos abaixo em ordem crescente de basicidade. (não será
considerada qualquer ordenação diferente da solicitada).
Amônia, ácido acético, anilina, fenol, t-butanol
65ª Questão – Dado o espectro de massas do esteróide abaixo sugira estruturas para os
íons cujas massas estão indicadas.
66ª Questão – Proponha um espectro de RMN de hidrogênio para a acetona.
19
67ª Questão – Faça o balanceamento das equações abaixo e indique se são reações de
combinação, decomposição, ou combustão.
a) C3H6(g) + O2(g) CO2(s) + H2O(g)
b) NH4NO3(s) + N2O(g) + H2O(g)
c) C5H6O(l) + O2(g) CO2(s) + H2O(g)
d) N2(g) + H2(g) NH3(g)
e) K2O(s) + H2O(l) KOH(aq)
68ª Questão – O ácido ascórbico (vitamina C) contém 40,92 % de C, 4,58 % de H e 54,50 %
de O em massa. A partir dessas informações determine a fórmula mínima do ácido
ascórbico.
69ª Questão – Uma amostra de 0,50 moles do gás oxigênio é confinada em um cilindro a 0
o
C com um pistão móvel. O gás tem pressão inicial de 1,0 atm. Ele é, em seguida,
comprimido por um pistão de tal forma que o volume final seja a metade do inicial. A pressão
final do gás é de 2,2 atm. Qual é a temperatura final do gás em graus Celsius?
20