Representação simbólica dos átomos
Objectivos da simbologia
● Representar a diferente composição das substâncias
● Simplificar a representação
● Tornar a representação universal – símbolos universais.
Regras da simbologia química (Berzelius séc. XIX)
● Cada tipo de átomos deve ser representado por um símbolo próprio,
correspondendo à primeira letra, maiúscula, do seu nome em latim ou grego.
Mas…quando átomos diferentes têm nome com inicial igual…
● Acrescenta-se à letra maiúscula inicial uma segunda letra, minúscula, também
pertencente ao nome, de forma que átomos diferentes tenham sempre símbolos
diferentes.(Ex: Carbono – C , Cloro – Cl , Cálcio – Ca , Cobre – Cu , Cobalto –
Co )
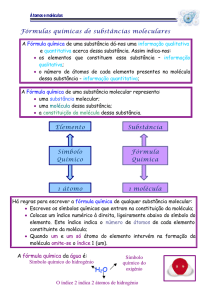
Representação simbólica de substâncias
As moléculas são representadas por fórmulas químicas. Cada tipo de moléculas tem a
sua fórmula química. A fórmula química indica que tipo de átomos constituem a
molécula e qual a quantidade de átomos de cada tipo.
Regras para as fórmulas químicas
● Escrevem-se os símbolos dos diferentes átomos que constituem a molécula.
● Indica-se, em índice à direita do símbolo, o número de átomos de cada tipo (se
for um não se escreve)
Ex:
Ozono – molécula constituída por três átomos de oxigénio – O3
Água – molécula constituída por dois átomos de hidrogénio e um átomo de
oxigénio – C
● Para representar vários átomos independentes de um mesmo elemento ou várias
moléculas da mesma substância, indica-se o número à esquerda do símbolo ou
fórmula química correspondente.
Ex: Dez átomos de ouro – 10 Au ; oito moléculas de água – 8H 2O
Exercícios
1 - Representa simbolicamente:
● Um átomo de oxigénio
● Três átomos de hidrogénio
● Dois átomos de oxigénio
● Uma molécula de oxigénio (com dois átomos de oxigénio)
● Três moléculas de oxigénio
● Uma molécula de ácido clorídrico (com um átomo de hidrogénio e um de cloro)
● Uma molécula de glicose (com seis átomos de carbono, doze de hidrogénio e
seis de oxigénio)
● Vinte moléculas de glicose
2 – Escreve a fórmula química do cloreto de magnésio, cuja “molécula” é constituída
por um átomo de magnésio e dois átomos de cloro.
3 – A fórmula química do ácido sulfúrico é H 2 SO4
a) Indica como é constituída a molécula de ácido sulfúrico.
b) Indica, justificando, se o ácido sulfúrico é uma substância elementar ou
composta.
4 – Indica a constituição das moléculas representadas pelas seguintes fórmulas
químicas:
a) KNO3
b) PbI 2
c) S 8
d) Das substâncias anteriores, indica quais são elementares e quais são compostas.
5 – Completa a tabela:
Substâncias
H2
3H
2H 2
4H 2 SO4
Nº de moléculas
Nº de átomos
Representação simbólica de iões
Os iões derivam de átomos ou moléculas, possuindo carga eléctrica. Como tal, a sua
representação simbólica tem regras idênticas às dos átomos e moléculas que lhes
deram origem, indicando-se como expoente a carga eléctrica do ião. Alguns iões têm
nome próprio, outros assumem o nome do átomo que lhes deu origem (Ex: Cl - ião
cloreto; Na - ião sódio).
Classificação de iões
Iões
Carga negativa
Aniões (ganharam electrões)
Carga positiva
Catiões (perderam electrões)
(atraídos pelo ânodo – eléctrodo +)
(atraídos pelo cátodo – eléctrodo -)
Ex:
Cl
Ex:
Na
Iões
Monoatómicos
Poliatómicos
(derivados de um só átomo)
Ex:
(derivados de uma molécula, conjunto de átomos)
Cl , Na
Ex:
2
CO3 , NO3 , NH 4
Iões
Monovalentes
Polivalentes
(carga unitária)
Ex:
Cl , Na , NO3 , NH 4
(carga múltipla)
Divalentes
Trivalentes
(carga dupla)
Ex:
2
CO3 , Ca
(carga tripla)
2
Ex:
Al 3
Compostos iónicos
A matéria no seu todo é neutra.
Num composto iónico
Nº de cargas positivas = nº de cargas negativas
As substâncias iónicas no estado sólido são cristalinas.
Um composto iónico é sempre composto por apenas dois tipos de iões: um positivo e
um negativo. Na fórmula química escreve-se sempre primeiro o ião positivo e depois
o negativo (mas no seu nome é ao contrário).
Ex: O cloreto de sódio (sal vulgar) é um composto iónico.
Os iões que o constituem são: Ião sódio - Na
Ião cloreto - Cl
Como são iões com carga simétrica de igual valor, combinam-se na proporção 1:1
Fórmula iónica: Na Cl
Fórmula química: NaCl
Nome do composto iónico: cloreto de sódio
A Professora
Helena Lança