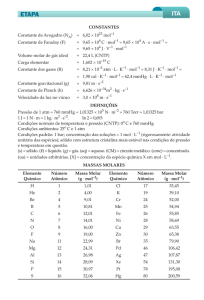
TEMPERATURA
pressão
e volume molar
Roberto Ribeiro da Silva
D
e acordo com a Lei de Avo22,4 L/mol.
gadro, volumes iguais de
A partir de 1982, a União Intergases diferentes, nas mesnacional de Química Pura e Aplicada
mas condições de temperatura e
(IUPAC) alterou o valor da pressão
pressão, contêm o mesmo número
padrão, de forma que as novas
de moléculas. Numa dada condição
condições normais de temperatura
de temperatura e pressão, portanto,
e pressão são:
os volumes ocupados por diferentes
t = 0 °C ou T = 273,15 K
amostras de gases são diretamente
CNTP:
proporcionais às quantidades de
p = 100000 Pa = 1 bar
12 matéria dos gases contidos nas
amostras.
As razões que levaram a IUPAC
Assim, para poder comparar
a alterar o valor da pressão padrão
quantidades de gases diretamente
foram: valor numérico igual a 1 (1 x
através de seus volumes, con10 5 Pascals), compatibilidade com
vencionou-se utilizar determinados
as unidades SI, produção de altevalores de pressão e
rações muito pequetemperatura. Essas
nas nas tabelas de
O valor da pressão
condições são conhedados termodinâmicidas como condições atmosférica num dado cos e considerável
local depende das
normais de temperasimplificação dos cálcondições
tura e pressão (CNTP).
culos. Um segundo
meteorológicas da
Até 1982, a pressão
aspecto diz respeito
região onde as
padrão era tomada coàs dificuldades enexperiências estão
mo uma atmosfera (1
contradas no estabesendo realizadas
atm ou 101 325 Pa) e a
lecimento do valor
temperatura como
exato para a pressão
0 °C (273,15 K) e, portanto, o vode uma atmosfera, normalmente delume molar de um gás nas CNTP era
finida com a pressão ao nível do mar.
{
V = V (CNTP) = 8,3145J / (kmol) x 273,15
m
n
100000Pa
2
V = 0,022711 J
x [ 1 Nm] x [ 1 Pa m ] =
n
1J
1N
Pa mol
= 0,022711m 3 / mol = 22,711 L / mol
Quadro 1: Equação para cálculo do volume molar de um gás.
QUÍMICA NOVA NA ESCOLA
Ora, o mar tem diferentes níveis no globo terrestre (na
América Central, por
exemplo, o mar tem
um nível no Oceano
Pacífico e outro no
Oceano Atlântico), e
o valor da pressão
atmosférica num dado local depende
das condições meteorológicas da re-
Pressão, Temperatura e Volume Molar
gião onde as experiências estão
sendo realizadas.
Nessas novas condições, podese calcular o volume molar de um
gás, isto é, o volume ocupado por
um mol de qualquer gás, através da
seguinte equação mostrada no
Quadro 1.
V = R x nT
P
Como o valor da pressão padrão
foi reduzido de 101 325 Pa para
100 000 Pa, houve um conseqüente
aumento no volume molar. O valor
recomendado pela IUPAC é:
Vm(CNTP) = 22,71 L/mol
Roberto Ribeiro da Silva é doutor em química
orgânica e professor adjunto do Departamento de
Química da Universidade de Brasília.
Para saber mais
MILLS, Ian; CVITAS, Tomislav;
HOMANN, Klaus e KUCHITSU, Kozo.
Quantities, units and symbols in physical chemistry. Oxford: Blackwell Scientific Publications, 1993 [Esse manual é
editado pela International Union of Pure
and Applied Chemistry (IUPAC) e
contém as recomendações relativas a:
a) uso da álgebra de grandezas nos
cálculos envolvendo grandezas físicoquímicas; b) regras gerais para os
símbolos das grandezas e respectivas
unidades de medida, resultantes de
acordos internacionais; c) uso das
unidades SI e dos fatores de conversão
entre unidades SI e não-SI; d) recomendações sobre notação matemática e e)
últimos valores obtidos para as grandezas e constantes físico-químicas].
N° 2, NOVEMBRO 1995