Fisiologia Animal
Carlos de Matos
2006/2007
Capítulo I
- Sistema Nervoso -
2
1. Constituição do sistema nervoso
1.1. Constituição geral do sistema nervoso
O sistema nervoso (SN) é constituído por:
- sistema nervoso central (SNC)
via aferente (sensorial)
- sistema nervoso
periférico (SNP)
sistema nervoso somático
via eferente
sistema nervoso
sistema nervoso simpático
autónomo
sistema nervoso
parassimpático
- sistema nervoso entértico
Tudo começa com um estímulo, que é captado por um receptor sensorial.
Ocorre um sensory input, que é transmitido ao sistema nervoso central (SNC), onde se
podem gerar sensações que levam a uma resposta pelos órgãos efectores. Estes
incluem os músculos esqueléticos e as glândulas. Pode também haver um motor
output, no qual a comunicação entre o sistema nervoso central e os órgãos efectores se
dá directamente.
1.2. Organização celular do sistema nervoso
O sistema nervoso é composto por neurónios e células da glia.
Neurónios
Os neurónios são constituídos por um corpo celular, dendrites, um axónio e
terminais axónicos. O corpo celular apresenta um núcleo e organitos. As dendrites
captam a informação, recebendo-a de outras células, e conduzem-na até ao axónio, cuja
função é a condução do impulso nervoso. Nos terminais axónicos existem as
sinapses.
Células da glia
As células da glia do sistema nervoso central são os oligodendrócitos, os
astrócitos, a micróglia e as células ependimais.
Os oligodendrócitos promovem a mielinização dos axónios, pois enrolam-se
em torno daquelas estruturas, formando a bainha de mielnina, e isto permite que o
sistema nervoso conduza a informação mais rapidamente. No sistema nervoso
periférico, a mielinização é feita pelas células de Schwann.
3
Os astrócitos conferem suporte físico e metabólico e são constituintes da
barreira hematoencefélica, a barreira entre o sangue e o cérebro. Os capilares que
existem no cérebro são muito pouco permeáveis, pois as células estão muito juntas e
estes vasos ainda são envolvidos por oligodendrócitros, o que isola ainda mais,
impedindo a passagem de substâncias para o líquido que envolve o cérebro. Os
astrócitos também libertam (secretam) factores neurotróficos, que são estímulos
necessários para que as células nervosas sobrevivam. Durante o processo de
transmissão nervosa, os neurónios libertam neurotransmissores¸ (isto) através dos
astrócitos, que são capazes de recaptar essa moléculas.
terminal sináptico
astrócito
Os astrócitos recolhem os neurotrasnmissores mas também os libertam.
A micróglia é composta por células do sistema imunitário e tem função de
defesa e de scavanger, isto é, de neutralizar substâncias que podem ser tóxicas para o
sistema nervoso.
As células ependimais revestem os ventrículos, que são espaços vazias (ocos).
4
2. Transmissão do impulso nervoso
2.1. Transmissão da informação ao longo das células
Impulso nervoso
As células do sistema nervoso comunicam através de impulsos nervosos. Tanto
o sistema nervoso humano como o computador funcionam à base de impulso nervoso,
de impulso eléctrico.
Potencial de membrana
No axónio da lula, grande e espesso, há uma diferença de potencial entre o
interior e o exterior de – 70 mV, o que significa que no interior existem mais cargas
negativas que no exterior.
A membrana é uma barreira de que dificulta a passagem dos iões devido à sua
hidrofobicidade. No entanto, a permeabilidade a um ião pode variar, pois existem
canais iónicos, proteínas que formam canais e que quando abrem deixam passar os iões.
Estes canais iónicos abrem por acção de estímulos eléctricos ou químicos.
A membrana é muito pouco permeável ao cloreto (Cl-) e, em condições de
repouso, a permeabilidade desta estrutura ao potássio (K+) é cerca de 40 vezes superior
à permeabilidade ao sódio (Na+) (1).
Em = – 74,1 mV ΔΨm
Há uma desigual distribuição de cargas e o interior está mais carregado
negativamente que o exterior. Se se variar a permeabilidade (P) ao Na+ ou K+, isso vai
causar uma alteração ao ΔΨm. A temperatura, a permeabilidade e a concentração
são variantes.
Células excitáveis, alteração do potencial de membrana e potencial de acção
As células excitáveis respondem a um estímulo, alterando o seu Ψm, através da
abertura de canais iónicos. Num potencial de acção gera-se uma alteração (estímulo) de
Ψm das células, devido à abertura de canais de Na+.
– 70 mV
– 40 mV
Alterando a permeabilidade ao sódio, que entra, há uma despolarização (Ψ
menos negativo). Ψm ficou menos negativo, aproximam-se de zero. Sofrendo-se uma
pisadela (o estímulo), há activação de mecanorreceptores, abertura de canais de Na+,
este entra, e há uma despolarização, que depende da intensidade do estímulo.
Potenciais graduais
Algumas células conseguem então alterar o potencial da membrana em
resposta a um estímulo. Os potenciais diminuem de intensidade à medida que se
afastam da zona onde são gerados e um estímulo forte provoca uma maior
despolarização, e vice-versa.
5
Potenciais de acção e estrutura e funcionamento dos canais iónicos
Nos axónios existem canais iónicos sensíveis à voltagem, que justificam a
formação de um potencial de acção e que não existem noutros locais. Estes canais
formam uma passagem a iões, mas selectivamente: quando aberto, o canal deixa passar
dado ião e não outro. Existem canais de potássio (K+), sódio (Na+), cloro (Cl-), e
outros iões. Não estão sempre abertos, podendo abrir ou fechar, e esta capacidade
depende de uma “cancela” de activação, que pode impedir a passagem de iões e que
está ligada a um sensor que detecta a voltagem, a variação do potencial, fazendo abrir
ou fechar a cancela. Se o potencial vai de –70 a –55, o canal pode abrir, tornando-se
permeável a iões, já que a voltagem é detectada pelo sensor. São estes canais que
permitem a formação de potencial de acção.
Numa curva de potencial de membrana, há uma fase de repouso,
despolarização, seguida da repolarização, hiperpolarização e, de novo, repouso.
Na situação em que a membrana (ou parte dela) está em repouso, pode
representar-se um canal de sódio ou de potássio. O canal de potássio tem uma só
cancela, enquanto o outro tem duas, uma de activação e outra de inactivação.
Em repouso, os canais não deixam entrar sódio nem sair potássio. Uma pequena
despolarização que seja detectada pelas células e pelas moléculas leva a uma abertura
do canal de (da cancela de) sódio, pelo que este ião entra. A despolarização deve-se à
entrada de sódio. As duas cancelas do canal de sódio, como foi referido, são a de
inactivação e a de activação. A primeira detecta a voltagem, abrindo ao fazê-lo; a
cancela de inactivação (de sódio) é controlada pela cancela de activação, que detecta a
despolarização, pois a sua abertura leva a que a outra feche, pelo que esta é dependente,
de forma indirecta, da voltagem. O canal de sódio, inactivo, mesmo não fechado, não
deixa passar sódio.
Os canais de potássio são mais lentos a abrir e a fechar. O fecho do canal de
sódio e a abertura do de potássio leva a que não haja entrada de sódio e a que haja saída
daquele segundo catião, o que leva à repolarização. O fim da entrada de sódio e a saída
de potássio tornam o potencial mais (menos) negativo e mais próximo do potencial de
repouso.
Na fase de hiperpolarização, já não há entrada de sódio e já saíram muitas
cargas positivas levando a uma hiperpolarizção. O sensor de voltagem demora algum
tempo a levar ao fecho.
Passado algum tempo do fecho da cancela de activação, a cancela de inactivação
abre. Basta que uma cancela do canal de sódio esteja fechada para que não haja
permeabilidade. Depois volta-se ao estado de repouso.
Isto é um potencial de acção. A cancela de activação só fecha quando o
potencial está abaixo do valor linear.
Um potencial de acção não é gerado por um canal de sódio e um canal de
potássio. A despolarização está directamente relacionada com o facto de a membrana se
tornar permeável ao sódio e a permeabilidade aumenta gradualmente. O gráfico relativo
a esta situação apresenta uma linha com alguma inclinação. A linha só seria vertical se
todos os canais abrissem ao mesmo tempo. Os canais vão abrindo gradualmente, até que
o máximo de canais está aberto. Os primeiros canais a abrir são aqueles que têm limiar
mais baixo. A permeabilidade começa a diminuir a partir de certo ponto, com o fecho
dos canais, e, ao mesmo tempo, abrem os canais de potássio, que vão abrindo e
fechando mais lentamente. A inactivação que fechou os canais de sódio abriu também
os canais de potássio, que são mais lentos. Há um ciclo de feedback positivo que é
acabado pela cancela de inactivação. Há uma grande permeabilidade ao potássio que
6
permite a repolarização da membrana. O potencial de acção é determinado pela abertura
e pelo fecho dos canais de sódio e de potássio.
Períodos refractários
Durante o período refractário, é impossível gerar num determinado (naquele)
local da membrana um novo potencial de acção. Mesmo que chegue áquele local um
grande potencial., a membrana não é capaz de gerar um novo potencial de acção. Um
segundo estímulo, mesmo superior ao primeiro, não é capaz de gerar um segundo
potencial de acção. Isto deve-se às cancelas de inactivação dos canais de sódio, que
estão fechadas e só abrem depois das de activação fecharem. O facto de permanecerem
fechadas impede a entrada de sódio, continuando a sair apenas potássio. Este é o
período refractário absoluto.
O período refractário relativo segue-se a este e, nele, é possível gerar outro
potencial de acção, mas apenas desde que o estímulo seja maior que o inicial, isto é, o
estímulo tem de ser maior que o normal.
– 55 mV
15 mV
– 70 mV
25 mV
Neste período, a cancela de inactivação já está aberta; só assim é possível um
novo potencial de acção.
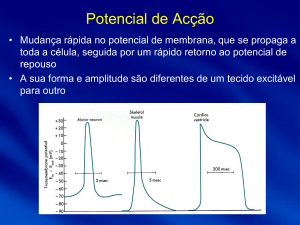
Lei do tudo ou nada e intensidade do estímulo
Quando se sofre uma pisadela, que pode ser mais forte ou mais fraca, ela é
transmitida por potenciais de acção ao sistema nervoso central, a uma zona do córtex
cerebral. Isto obedece à lei do tudo ou nada, não se detectando diferença de
intensidade em estímulos mais intensos, isto é, não há diferença de amplitude.
Estímulos mais fortes geram mais potenciais de acção, no mesmo período de tempo, isto
é, com o aumento do estímulo, aumenta-se a frequência dos potenciais de acção. Uma
pisadela muito forte não leva à fusão de potenciais de acção, isto é, pode aumentar-se a
frequência dos potenciais de acção, mas não fundi-los, devido à existência de um
período refractário absoluto.
Potenciais de acção e potenciais graduais
Os potencias de acção existem apenas nos axónios, onde há os canais iónicos
referidos. Os potenciais graduais existem no corpo central e nas dendrites, onde
ocorrem canais sensíveis. Neste tipo de potenciais, um receptor, que pode perceber
estímulos químicos ou mecânicos, gera um potencial de receptor que se desloca até ao
axónio. Os potenciais graduais têm uma amplitude dependente do estímulo, ao contrário
dos outros, que, por sua vez, não perdem intensidade.
Propagação do estímulo e mielinização
Num axónio não mielinizado, a chegada de um potencial leva à abertura dos
canais de sódio, entrando este ião. A abertura destes canais de sódio leva a uma
7
corrente de despolarização que permite que outros canais, mais à frente, abram, e o
potencial de acção desloca-se, assim, ao longo do axónio. O potencial de acção não se
desloca para traz pois a cancela de inactivação impede a entrada de mais sódio. Se se
tivesse, ao longo do axónio, vários eléctrodos, detectar-se-ia o potencial a percorrer toda
esta estrutura. No entanto, o potencial de acção não percorre, de facto, o axónio. Um
gera o outro, este, outro, e assim sucessivamente, ocorrendo algo semelhante à queda de
peças de dominó. De qualquer modo, em termos práticos, o que ocorre é o mesmo que a
deslocação do potencial.
A bainha de mielina é constituída por bainhas de células da glia, no sistema
nervoso central, ou de células de Schwann, no sistema nervoso periférico. As bainhas de
mielina isolam a membrana, não havendo, nos locais onde ocorrem, passagem de iões
entre o exterior e o interior. È nas zonas sem bainha, os nódulos de Ranvier, que
ocorrem os canais. O potencial de acção não percorre todo o axónio (,percorrendo todo
o axónio); ele salta de nódulo em nódulo, e este sistema é bastante mais rápido.
O neurónio motor, mielinizado, conduz o potencial a uma velocidade de 120
m/s, enquanto o neurónio gigante da lula, não mielinizado, o conduz a uma velocidade
de 25 m/s. A velocidade depende do diâmetro do neurónio e do facto de ser
mielinizado ou não. Se for mielinizado, quanto menor for, maior a velocidade de
transmissão.
Por vezes há uma desmielinização. Isto ocorre em doenças como a esclerose
múltipla, na qual pode haver problemas na transmissão do impulso. Numa
dismielinização, o impulso pode demorar mais tempo a chegar ao nódulo seguinte e, em
alguns casos, o potencial que chega ao nódulo seguinte não é suficiente para gerar o
potencial de acção, o que pode levar á falta de reacção a estímulos.
2.2. Transmissão da informação entre as células
As células têm um receptor que gera potenciais que são conduzidos ao longo dos
neurónios, mas o impulso passa também para outras células: passa para outros
neurónios, por vezes para células musculares, e outras vezes para células secretoras.
Rede neural
Fala-se de rede neural ou neuronal quando uma célula recebe informação de
muitas outras células ou envia informação a muitas outras células. Alguns neurónios
inibem (este) um outro neurónio, enquanto outros o activam.
Sinapses eléctricas e sinapses químicas
Durante muito tempo, pensou-se que o único mecanismo de comunicação entre
estas células era a comunicação eléctrica. O investigador, Loussi, que estudou outro
modo, recebeu o Prémio Nobel pelos seus trabalhos. Já se sabia na altura que o nervo
____ era responsável pelo ritmo cardíaco. Estimulando o nervo de um coração, levavase também à diminuição do ritmo de batimento de outro coração, banhado pela mesma
solução. Haveria, assim, um mensageiro químico que estava na solução e que levava
também o outro coração a bater. Descobriram-se, assim, substâncias responsáveis pela
transmissão do sinal, designadas de neurotransmissores.
A comunicação eléctrica existe em algumas células e é muito rápida, na
passagem da membrana pré-sináptica para a membrana pós-sináptica. As células,
8
nestas duas membranas, estão ____ em contacto. Estas são as sinapses eléctricas
(químicas), em que há uma ligação entre as células por tigh juntions. Nestas sinapses há
canais iónicos que deixam passar iões, corrente, entre as células, havendo continuidade
citoplasmática. Nas sinapses químicas, as mais comuns, as células não estão em
contacto, havendo ____ um espaço na sinapse. O processo é mais lento, é
unidireccional e envolve mensageiros químicos.
Funcionamento das sinapses químicas
Os mensageiros químicos, neurotransmissores, estão armazenados em vesículas
sinápticas. Quando o potencial chega até elas, os neurotransmissores são libertados
pelas vesículas, vão difundir-se pelo espaço sináptico e vão ligar-se a receptores na
membrana pós-sináptica.
É através da exocitose que as vesículas se fundem com a membrana e os
neurotransmissores são libertados. A despolarização, o potencial de acção, vai ser
detectado por canais de cálcio sensíveis à voltagem, e estes canais abrem, pelo que o
cálcio tem de entrar ao nível do terminal nervoso, pois está mais concentrado no
exterior. Há, assim, uma subida no nível deste catião.
potencial de acção
A despolarização origina, assim, a subida do nível de cálcio no terminal nervoso,
no qual existem várias proteínas da maquinaria exocitótica (mais de 20), que
promovem a ligação das proteínas da vesícula com proteínas da membrana. Assim, as
vesículas fundem-se com a membrana, dando-se, depois, a exocitose.
Os neurotrasmissores ligam-se, depois, a receptores da membrana, mas têm de
ser removidos da fenda sináptica, não podendo permanecer lá durante muito tempo. Se
não fossem removidos, havia uma activação contínua. Uma das funções das células da
glia é remover os neurotransmissores.
O processo de transmissão do estímulo tem, assim, muitas fases, e é muito
complexo, podendo haver interferência em várias partes.
Neurotransmissores
Há muitas moléculas que funcionam como neurotransmissores: acetilcolina,
dopamina, epinefrina, histamina, norepinefrina, serotonina, glutamato, glicina, ácido
gama-aminobutírico, entre outros..
A acetilcolina é responsável pela comunicação entre os neurónios e os
músculos. O aumento dos níveis de cálcio no terminal leva à exocitose de acetilcolina,
que se liga ao receptor próprio na membrana pós-sináptica. Nesta membrana, há uma
enzima que provoca a degradação da acetilcolina em colina e adetato; só a acetilcolina
provoca a resposta, e não a colina ou o acetato. Destas, a primeira é recaptada pelo
neurónio anterior, que sintetiza mais acetilcolina com recurso a acetil-coenzima A,
restanto a coenzima A. A colina-acetil-transferase tranfere o acetato da acetlcoenzima A para a colina. A acetilcolina é depois incluída em vesículas. Este é o ciclo
9
da acetilcolina, que não é um verdadeiro ciclo, uma vez que o acetato resultante da
____ não é retomado e difunde-se logo.
Os receptores de acetilcolina podem ser (são) receptores nicotínicos, que (pois)
também ligam nicotina, e têm de ligar duas moléculas de acetilcolina para abrir. São
receptores ionotrópicos, um vez que a ligação do neurotransmissor leva á abertura de
um canal iónico, que deixa passar sódio, o que leva à despolarização. Outros receptores
da acetilcolina são os receptores muscarínicos, que também ligam muscarina. Estes
receptores, por intermédio de proteínas G, levam à abertura de canais de potássio que,
saindo, leva à hiperpolarização.
A acetilcolina, assim como muitos outros neurotransmissores, tem um efeito
dependente dos receptores. O glutamato é o principal neurotransmissor excitatório,
levando a uma despolarização, mas, por vezes, leva também a uma hiperpolarização.
Quando se diz que um neurotransmissor é excitatório, deve ter-se em conta o receptor.
Há receptores ionotrópicos e receptores metabotrópicos. Os primeiros, como
foi dito, abrem canais iónicos, enquanto os outros podem abrir canais iónicos (de
potássio, por exemplo) por intermédio de proteínas G, mas não só, podendo provocar
uma grande variedade de processos.
Os agonistas são substâncias que têm o mesmo efeito que a substância
endógena, levando ao mesmo efeito. As substâncias antagonistas ligam-se ao receptor,
mas não produzem o efeito. Os agonistas provocam o mesmo efieto que a substância
endógena enquanto os antagonistas não. O curare é uma toxina antagonisa da nicotina
usada por povos africanos para caçar.
Os níveis de neurotransmissores na fenda sináptica têm de descer rapidamente e
isto pode fazer-se por vários mecanismos, dependendo do neurotransmissor em causa.
Podem ser removidos pelo sangue, pelas células da glia ou ser degradados por enzimas,
como acontece com a acetilcolina.
Muitas doenças conhecidas estão envolvidas com neurotransmissores.
Parkinson e Alzaimer relacionam-se com desregulações na fenda sináptica. O Prozac e
muitas drogas de abuso relacionam-se com o aumento dos níveis de certos
neurotransmissores.
Toxinas relacionadas com as sinapses químicas
O botox, a toxina do botulismo, leva a que não haja rugas de expressão, por
acabar com a contracção dos músculos da face. Ele bloqueia parte da maquinaria
exocitótica, influenciando não só a exocitose de acetilcolina, que leva á contracção
muscular, mas de outros neurotransmissores também. Como o tratamento é local, não
costuma haver problemas, mas pode haver, se houver difusão para outros locais, pois a
exocitose de outras substâncias também é bloqueada. O tratamento também não dura
muito tempo.
O curare, referido acima, é uma toxina usada pelos índios para caçar. Ela é
retirada da resina de árvores e bloqueia receptores nicotínicos, levando a paralisia da
caça.
Muitos venenos de cobra, cones (Género Conus), aranhas e outros animais
venenosos têm toxinas relacionadas com estes processos. A α-bungarotoxina ocorre no
veneno de uma cobra ________ e bloqueia, também, os receptores nicotínicos, levando
à paralisia das presas. Os cones têm venenos com substâncias que bloqueiam os canais
de cálcio, responsáveis pela exocitose. A tetracloto___ existe no peixe-balão (fugu),
consumido no Japão, que, se não for bem preparado, leva á morte.
10
O gás dos nervos tem uma toxina retirada de um feijão nigeriano, que inibe a
acetilcolinaesterase, levando a uma contracção constante, responsável por paralisia.
Muitas substâncias são ____ responsáveis pela alteração do fluxo nervoso. O
Xanax e o Prozac também se relacionam com isto.
Tipos de sinapses químicas e somação espacial e temporal
Existem dois tipos de sinapses químicas. Num, há aumento da permeabilidade ao
sódio, levando-se a uma despolarização; noutro, há aumento da permeabilidade ao
potássio ou ao cloreto, levando-se a hiperpolarização. As sinapses do primeiro tipo
são sinapses excitatórias, enquanto as outras são sinapses inibitórias. O problema
ocorre quando uma só célula recebe informação de muitas outras, dependendo o efeito
do efeito somado e todas as sinapses. Os efeitos somam-se.
Alguns estímulos não são capazes de gerar um potencial de acção, mas, se dois
estímulos chegarem próximos, somam-se e já se pode gerar um potencial de acção. Há
um efeito de somação temporal. Dois terminais diferentes, por somação espacial,
também podem levar á formação de um potencial de acção. A soma de uma inibição de
uma activação pode levar á anulação mútua. Deve considerar-se a soma dos efeitos.
Neste capítulo, estudou-se como os impulsos eram gerados e passavam de uma
célula para a outra.
11
3. Sistema nervoso central
3.1. Constituição do sistema nervoso central
Quando se fala em sistema nervoso, fala-se normalmente do sistema nervoso
central, que é formado pelo encéfalo e pela espinal medula.
O cérebro é uma das partes constituintes do encéfalo, a maior, com um volume
de 1,4-1,5 l, mas existem também o diencéfalo, com o tálamo e o hipotálamo, e o
tronco cerebral, com o mesencéfalo, a ponte e o bolbo raquidiano. Existe ainda o
cerebelo, responsável pelo equilíbrio. Esta é a estrutura do encéfalo humano. O
encéfalo tem dois hemisférios separados por uma fissura e é também dividido em
lobos.
3.2. Meios de protecção
O encéfalo e a medula estão protegidos.
Barreiras de protecção
Contra agressões externas, o crânio confere protecção ao encéfalo, enquanto a
coluna vertebral protege a medula. Em ambos os órgãos existem também as meninges,
três estruturas membranosas, que também conferem protecção contra agressões
externas. São elas, da mais externa para a mais interna: dura mater, aracnoidea e pia
mater, difícil de separar do cérebro.
Líquido céfalo-raquidiano
Existe um líquido cefalo-raquidiano ou cérebro-espinhoso, um fluido
produzido pelos ventrículos, que reveste todas as estruturas, como o encéfalo (envolve
o encéfalo) e a medula espinal. A sua constituição é semelhante à do plasma, excepto
no que se refere às proteínas e células. A água, os sais e a glicose, entre outros
componentes, passam dos capilares dos complexos coróides para o encéfalo, não
passando proteínas nem células.
O líquido protege contra impactos, à semelhança do que acontece com um ovo
agitado dentro de uma caixa com água – a água absorve parte da energia, protegendo
contra agressões físicas. O líquido cefalo-raquidiano protege contra agressões físicas,
impedindo o contacto entre o sistema nervoso central e a estrutura ________. Se se
perder líquido, pode haver dores intensas pelo contacto do sistema nervoso central com
estruturas duras. Depois, o líquido é reestabelecido. Os corpos, quando imersos em
líquidos, tornam-se relativamente mais leves, pelo que o líquido promove uma redução
relativa do peso, impedindo compressão nervosa entre as células.
Barreira hematoencefálica
Os capilares do cérebro não são muito permeáveis. As células dos capilares estão
muito aderentes, o que impede a troca de componentes entre estes vasos e o líquido
intersticial. Para além disso, as células dos capilares são envolvidas por astrócitos,
células da glia, que aumentam a sua aderência. Todos os capilares do sistema nervoso
12
central estão envolvidos por astrócitos. O tecido nervoso não admite grandes variações
das ____ do meio interno; as células nervosas, os neurónios, não suportam grandes
variações das substâncias que outras células toleram (aminas e toxinas, por exemplo),
pelo que o ambiente interno dos neurónios deve ser mantido, e é por isso que há este
isolamento. A barreira designa-se de hematoencefálica.
O isolamento é vantajoso, mas em alguns casos não. Em alguns locais, a barreira
não é tão significativa. No lóbulo posterior da hipófise, em que há libertação de
hormonas, é necessário que elas passem pela barreira. No bolbo raquidiano há um
centro de vómito, responsável por este fenómeno. Neste local, a barreira também é
menos eficaz, para que possa haver detecção das substâncias tóxicas que devem ser
vomitadas, para que não haja problemas.
A doença de Parkinson caracteriza-se por perda de neurónios produtores de
dopamina. Poder-se-ia administrar este neurotransmissor ao paciente, mas a barreira
hematoencefálica não permite a sua passagem. Usa-se antes uma molécula precursora
da dopamina que passa a barreira e que, nas células nervosas, é convertida naquele
neurotransmissor. Este é um exemplo.
3.3. Cérebro
Estrutura do cérebro
O cérebro tem vários lobos. O tamanho do cérebro dos homens e das mulheres é
semelhante, mas o dos homens é sempre maior, em todas as idades.
O corpo caloso á a principal zona de comunicação entre os dois hemisférios. Há
____ que estabelecem a comunicação entre a parte esquerda e direita.
Matéria branca e matéria escura
A parte central (como é possível ver em corte) é mais clara, enquanto a externa é
mais escura. A diferença de cor relaciona-se com a presença de mielina: a parte da
matéria branca é constituída por células mielinizadas, enquanto a matéria escura é
constituída por neurónios não mielinizados, corpos celulares, dendrites e terminais
nervosos.
Córtex cerebral
A parte superior do cérebro é o córtex cerebral. A superfície do cérebro é
enrugada, som sulcos e fissuras, e estas últimas estruturas permitem que haja uma maior
superfície onde se estenda o córtex. Diferentes zonas do córtex são responsáveis por
diferentes actividades: há uma zona, junto da nuca, relacionada com a visão, e zonas
relacionadas com a geração de sensações. Há depois o córtex motor. Do córtex motor
primário partem os estímulos para o músculo esquelético, mas existem outras zonas
do córtex envolvidas em movimentos complexos. Isto envolve o córtex motor primário,
mas também outras áreas. No lobo frontal há áreas de associação. Existem zonas
específicas e sabe-se que, se uma parte for afectada, as actividades correspondentes
podem também sê-lo.
Nas áreas sensoriais, o estímulo é detectado por receptores específicos. Tocando
em algo quente, só se tem a sensação que está quente quando a informação chega ao
córtex. Os receptores específicos geram potenciais de acção, que são conduzidos até ao
13
córtex, onde é elaborada a sensação de calor. Pisando um vidro, há um movimento
reflexo, em que o córtex não tem participação, e o estímulo chega ____ a essa estrutura,
onde se elabora a sensação. Uma pessoa que não sinta a dor pode ter uma lesão na zona
de transmissão do potencial de acção ao córtex.
Existem zonas muito definidas responsáveis pela detecção de sensações em
diferentes partes do corpo e nota-se que a proporção ocupada no córtex não é a mesma
que a proporção corporal. As partes mais representadas são as mais sensíveis, (e) são
aquelas que têm mais terminais nervosos. Os lábios estão muito representados no
cérebro. Músculos grandes podem não “ocupar muito espaço no córtex”, pois os
movimentos são simples. Para falar são necessários muitos músculos, pelo que a zona
ocupada pela fala é maior.
Estímulos diferentes, captados no mesmo local do corpo, podem utilizar vias
diferentes. Uma informação gerada no lado direito é processada na parte esquerda, e a
mudança de lado dá-se na transmissão do sinal.
14
4. Sistema nervoso periférico
4.1. Vias aferentes e eferentes e sistemas nervoso somático e
autónomo
Vias aferentes e eferentes
As vias aferentes trazem a informação até ao córtex, enquanto as vias eferentes
são responsáveis por transmitir informação aos órgãos efectores, os órgãos-alvo.
Sistemas nervoso somático e autónomo
A informação vai por vias diferentes conforme o órgão: os movimentos
voluntários vão pelo sistema nervoso somático, enquanto, para os órgãos involuntários,
a informação vai pelo sistema nervoso autónomo. Os estímulos vão, assim, por duas
vias.
Os órgãos-alvo dos sistemas nervosos autónomo e somático são uma das
diferenças entre eles. O músculo esquelético é controlado por neurónios motores. Para
o músculo contrair, a informação vem do sistema nervoso central e passa para um
neurónio motor, que liberta acetilcolina. Na via do sistema nervoso autónomo, os
órgãos-alvo são diferentes e participam dois neurónios, em vez de um. É necessário uma
transmissão de informação de um neurónio para outro, na região dos gânglios
autónomos. O músculo esquelético recebe informação de um neurónio vindo
directamente do sistema nervoso central, enquanto na via autonómica a informação
passa de um neurónio vindo do sistema nervoso central para outro, e só deste passa aos
órgãos efectores.
Na primeira via, não há um neurotransmissor que inibe e outro que activa. Um
neurónio motor que controla um determinado músculo que não está contraído propaga
potenciais de acção (está activado), mas a uma frequência baixa. Para contrair o
músculo, aumenta-se a frequência e, para relaxar, diminui-se. No sistema nervoso
autónomo, muitas vezes, um neurónio estimula e outro inibe.
É possível controlar a respiração, algo voluntária ou involuntária, mas o controlo
voluntário deve-se aos músculos esqueléticos do tórax, e não ao diafragma.
4.2. Sistemas nervoso autónomo
Sistemas nervosos simpático e parassimpático
Os sistemas nervosos simpático e parassimpático, relativos ao sistema
nervoso autónomo (é deste sistema que se está a falar) têm, muitas vez, efeitos
antagónicos. Muitas vezes, o primeiro estimula e o segundo inibe. O simpático, numa
ameaça, pode levar ao aumento do ritmo cardíaco, do ritmo respiratório e da libertação
de adrenalina. Algumas pessoas podem fugir ou não, mas isto já é relativo ao músculo
esquelético. _____________________________________
No simpático, o neurónio preganglionar é curto e o posganglionar é extenso.
A comunicação dá-se junto da coluna, antes do órgão-alvo. No parassimpático, a
comunicação entre os dois neurónios dá-se no órgão-alvo ou perto dele, porque o
15
neurónio preganglionar é longo e o outro é curto. Ao nível do gânglio, o
neurotransmissor utilizado é a acetilcolina. Na via do parassimpático pode haver
comunicação por acetilcolina e na via do simpático pela noradrenalina (norepinefrina
é a “versão americana” da noradrenalina). Na via do parassimpático há sempre,
portanto, acetilcolina.
Transmissão da informação no sistema nervoso autónomo
Como foi referido, o sistema nervoso autónomo controla órgãos não controlados
voluntariamente. A informação parte de locais específicos do tronco cerebral e é
enviada pelas vias vistas, isto é, é conduzida pelo simpático ou pelo parassimpático. A
informação para aumentar ou diminuir o ritmo cardíaco parte de locais próximos, mas
não do mesmo. Existem locais para diferentes actividades, alguns próximos, embora
distintos, e a transmissão pode dar-se pelo sistema nervoso simpático ou parassimpático.
Efeitos da dupla enervação do sistema nervoso autónomo
Normalmente, o simpático e o parassimpático têm funções antagónicas, mas, em
algumas situações, têm efeitos semelhantes, embora não exactamente iguais. O
parassimpático induz a produção de saliva aquosa, enquanto o simpático provoca a
produção de saliva viscosa.
Em alguns casos, têm efeito cooperativo. Na digestão ambos são importantes; o
parassimpático estimula a libertação de enzimas digestivas do pâncreas para o intestino
e o simpático estimula as contracções intestinais. São efeitos diferentes, mas
cooperativos, contribuindo para a digestão.
16
5. Drogas de abuso
5.1. Sistema límbico e sistema de recompensa
Sistema límbico
O sistema límbico é parte do sistema nervoso central, sendo constituído por
várias estruturas, muito próximas, deste sistema, e controla muitas das nossas emoções e
comportamentos. O facto de haver poucas conecções com o córtex cerebral explica o
facto de não haver grande controlo sobre eles.
Sistema de recompensa
Há vários comportamentos importantes para a sobrevivência da espécie que dão
prazer que leva à repetição desses comportamentos. Eles activam o sistema de
recompensa, que leva á repetição e que faz parte do sistema límbico, sendo também é
designado sistema mesolímbico dopaminérgico. Nele é usada dopamina. Uma das
suas áreas é a área ventral tegumentada (VTA). O estímulo passa para o nucleus
accumbens, e daí para o córtex prefrontal. Do VTA partem neurónios que libertam
dopamina e do nucleus accumbens partem neurónios que também libertam este
neurotransmissor, desta feita para o córtex.
Numa experiência, um ratinho tinha um eléctrodo instalado no nucleus
accumbens. Quando ele pressionava uma alavanca, aquela estrutura libertava dopamina
e o animal tendia a repetir o comportamento. Há uma activação do sistema de
recompensa. Aquele comportamento ocorre se o eléctrodo for colocado naquela zona,
mas não no córtex. Se o eléctrodo for colocado no córtex, o ratinho vai lá uma vez, mas
não repete.
O sistema límbico relaciona-se com o abuso de drogas.
5.2. Toxicodependência
Habituação, viciação e dependência
Habituação ou tolerância é um caso em que, para uma mesma resposta, é
necessária uma dose maior. Tem de se aumentar a dose, para o mesmo efeito. O facto de
se ter de aumentar a dose deve-se a haver uma habituação do organismo, que se pode
dar por aumento da produção de enzimas que metabolizam a substância ou por downregulation, por diminuição dos receptores expressos ou por diminuição da sua afinidade
(pelo que é necessária uma maior concentração)
Uma coisa é viciação e outra é dependência. Na viciação, a pessoa vai consumir
para se sentir bem. Uma pessoa é dependente quando necessita da substância para
funcionar normalmente e, quando não têm a substância, tem dores fortes e mádisposição generalizada. Na dependência ____ o síndroma da abstinência. Na
dependência evita-se sentir mal, enquanto na viciação procura-se bem-estar, e uma
pessoa pode ser dependente sem ser viciado, e vice-versa. Os locais que causam
dependência são diferentes dos locais que causam viciação.
17
Cocaína
A cocaína afecta o VTA, o nucleus accumbens e o nucleus caudatus, uma
zona responsável por comportamentos obsessivos, não relacionada com o sistema
límbico, em que ____ os comportamentos obsessivos, como roer as unhas. A dopamina,
em casos normais, é libertada nas sinapses e liga-se ao receptor, sendo depois
reabsorvida e degradada. A cocaína impede a reabsorção, pelo que a dopamina se
mantém na fenda sináptica. Na experiência do ratinho, o comportamento dele seria o
mesmo se se desse cocaína ao animal após ele mexer na alavanca, em vez de se
estimular o eléctrodo.
Num viciado em cocaína, é possível ver uma redução da actividade do cérebro.
Numa pessoa naquela situação, 10 dias depois de deixar a cocaína, há uma redução
bastante ____ da actividade cerebral, e, 100 dias depois, a actividade é maior, mas ainda
baixa. A actividade pode nunca voltar a restabelecer-se. A regeneração de neurónios é
um processo limitado, que só ocorre em certas zonas.
Opiáceos
A heroína, a morfina e a codeína são opiáceos, (são) derivados da papoila do
ópio, que actuam nos receptores de opiáceos. A heroína é convertida em morfina. Há
opiáceos endógenos, como as endorfinas, e os seres humanos produzem a sua própria
morfina.
A libertação de dopamina está controlada por outro neurotransmissor, o GABA;
normalmente, a libertação de dopamina está refreada pelo GABA, um inibidor. Os
receptores para opiáceos inibem a libertação de GABA, e, assim, há maior libertação de
dopamina. É um mecanismo de acção diferente do da cocaína, mas o efeito é o mesmo:
aumentam-se os níveis de dopamina na fenda sináptica. A cocaína interfere com o
transportador.
Existem muitos outros locais de actuação dos opiáceos. Ao nível do córtex
cerebral, o consumo de opiáceos produz sensações estranhas. O córtex é responsável por
sensações, e o consumo de heroína influenciará as sensações produzidas. Na zona do
tálamo, também actua.
Os opiáceos causam muita dependência. Desencadeiam variações do nível
proteico, funcionando a célula de um modo diferente. Há uma influência ao nível da
síntese proteica.
Ecstasy
Outra droga, ainda muito na moda, é o ecstasy (MDMA), um derivado das
anfetaminas, sintetizado pela Mesck em 1912. Foi inicialmente produzido para regular
o apetite, mas tinha outros efeitos e por isso foi deixado. Foi também usado para
estimular soldados americanos a combater mais tempo, mas abandonou-se este projecto
(isto). O ecstasy aumenta as actividades físicas, a boa disposição, entre outros efeitos.
O ecstasy interfere com os níveis de serotonina, inibindo o transporte deste
neurotransmissor para o interior do neurónio pré-sináptico, para ser degradado. Assim, a
sua concentração aumenta na fenda sináptica. Ele actua em vários locais, incluindo na
zona responsável pelo apetite. _____.
Pode haver dificuldades de raciocínio, aumento da agressividade, problemas a
nível motor (um muito caracterizado, que é uma rigidez do maxilar), e hipertermina, a
subida exagerada da temperatura corporal, que é ainda salientada pelo consumo de
18
álcool e pelo próprio movimento de dança. No dia seguinte, as pessoas estão irritadas e
deprimidas, devido aos baixos níveis de serotonina. O ecstasy pode causar a morte pela
hipertermia. O mais grave são os efeitos a longo prazo. Num consumidor que consumiu
70 pastilhas, 2 por fim-de-semana, durante 9 anos, os receptores para serotonina
diminuiram muito. Em macacos sujeitos a ecstasy, verificou-se que ao fim de 2
semanas, os níveis de serotonina eram muito baixos, e, 7 anos depois, os níveis ainda
eram baixos. Estes estudos foram criticados pois as doses seriam muito altas. Então,
deram-se doses normais. Este último estudo foi publicado na Science. Três macacos
toleraram o tratamento, um ficou inactivo ao fim da primeira dose e outro morreu. Nos
três sobreviventes verificou-se que, no ____ ____, havia uma redução drástica do
sistema seratoninérgico (averiguaram-se os níveis de serotonina e de um metabolisto
de serotonina). Averiguando a dopamina e um metabolito seu, verificou-se que os
níveis de dopamina também são afectados, sendo baixados. Por isso, pode haver
síntomas de Parkinsonismo, uma doença relacionada com a dopamina.
19
6. Sentidos
6.1. Sensação e sentidos
Áreas sensoriais do córtex cerebral
Como foi já referido, no córtex cerebral há zonas especializadas em diferentes
funções. Nas áreas sensoriais geram-se as sensações, que são originadas por estímulos,
mas, para haver sensações, não basta haver estímulo num receptor para esse estímulo.
Sentidos
Os sentidos especiais, assim designados por estarem localizados em órgãos
específicos, são o olfacto, a visão, o gosto, a audição e o equilíbrio. Os sentidos
somáticos, que se localizam, de uma forma geral, em todo o corpo (embora haja zonas
mais sensíveis que outras), são o tacto, a pressão, a temperatura, a propriocepção e a
dor. Propriocepção é a noção da posição do corpo. Os sentidos viscerais são relativos
ao interior do corpo e à percepção da dor e da pressão.
Sensação
Para haver sensação é necessário um estímulo, que é detectado por um receptor
e convertido por ele em potenciais de acção. De seguida os potenciais de acção têm de
ser conduzidos até ao sistema nervoso central, e sofrem, então, uma transformação,
sendo convertidos em informação. Por fim, a informação é processada para se ter
consciência do estímulo.
Depois da sua formação, o potencial de acção vai para a área respectiva do
córtex cerebral. A sensação é a percepção de um estímulo e só ocorre no córtex
cerebral, gerando-se nessa estrutura e não no local do estímulo.
No exemplo de um toque, o toque activa receptores, os potenciais de acção são
conduzidos ao córtex somatossensorial e há sensação de toque no dedo. Se o estímulo
não for muito forte, pode não se gerar sensação. Quando há insensibilidade, como em
paraplégicos, não há condução do estímulo, mas também ao nível do córtex pode haver
problemas na interpretação.
6.2. Receptores sensoriais cutâneos
Receptores sensoriais cutâneos
Em toda a pele, e também no interior do corpo, há receptores sensoriais.
Alguns estão mais à superfície e outros são mais profundos: os mais superficiais, como
os do toque, são activados com menor pressão, enquanto os mais profundos só são
activados com estímulos mais intensos.
Há receptores livres e receptores noutras estruturas. Por vezes não é necessário
tocar a pele, bastando tocar o pêlo, cuja raiz está associada a receptores.
20
Transmissão e processamento da informação sensorial no sistema nervoso
Os receptores captam o estímulo e levam-no para o córtex cerebral, dependendo
as vias de passagem de informação, do estímulo. Para a dor e para a temperatura há uma
via. A informação cruza a um nível inferior, na medula, e vai para o hemisfério oposto
do córtex cerebral (um estímulo no lado direito provoca sensação no hemisfério
esquerdo). O estímulo sensorial cruza mais acima, no bolbo raquidiano.
Diferentes zonas do córtex somatossensorial são responsáveis pela elaboração de
sensações de estímulos de diferentes zonas. Como foi já referido, a superfície não é
proporcional à superfície dessa zona do corpo, mas ao número de receptor.
Inibição lateral
Um alfinete que estimula a pele, é capaz de activar três receptores sensoriais, e
os três libertam neurotransmissores para neurónios de segunda ordem. A célula B,
sobre a qual o alfinete é aplicado, liberta mais, pois o estímulo é mais intenso e provoca
potenciais com maior frequência. O neurónio de segunda ordem activado pela célula B
inibe os outros neurónios secundários. Estes também têm capacidade de inibir o outro,
mas não o fazem porque não foram suficientemente estimulados. Passa-se de uma
situação em que estão estimulados três neurónios, para uma situação em que está um
activado e dois inibidos. O que os inibe são neurotransmissores inibitórios e o GABA
pode fazer isso.
Campos receptores
Este é um mecanismo. Outro relaciona-se com o maior ou menos número de
receptores. Duas zonas da pele devem estar cobertas por neurónios sensoriais. Numa
zona pequena com muitos neurónios, cada neurónio será responsável por uma zona
muito pequena. Numa zona grande com menos neurónios, uma zona maior estará sobre
a alçada de menos neurónios. Numa zona destas, dois estímulos próximos activam o
mesmo neurónio e são interpretados como o mesmo estímulo. Numa zona com mais
neurónios, os dois estímulos seriam interpretados como tal.
Pode fazer-se uma experiência, sujeitando diferentes zonas ao toque de bicos
uma tesoura, com maior ou menor afastamento. Nas costas da mão e noutras zonas é
mais difícil distinguir estímulos, enquanto na palma da mão é mais simples.
Nem sempre dois neurónios sensoriais vão provocar estímulos
independentemente, mesmo que estimulados por estímulos diferentes (que recebidos
por neurónios diferentes). Neste caso, os neurónios convergem para um único neurónio
de segunda ordem. Só nos casos em que os estímulos estão suficientemente afastados
para activar neurónios com neurónios de segunda ordem diferentes é que se entendem
dois estímulos diferentes. A vantagem do primeiro caso é que, por vezes, um estímulo
não é capaz e estimulas um neurónio secundário, mas a somação de estímulos já pode
ser capaz.
21
6.3. Sentidos especiais
6.3.1. Visão
Espectro electromagnético
Os olhos são capazes de captar energia. Os humanos são capazes de captar uma
zona pequena do espectro, apenas a luz visível, entre os 450 e 700 nm. Outros animais
são capazes de captar parte da luz ultravioleta (UV) ou infravermelha (IF).
Globo ocular
O globo ocular tem a córnea, mais ou menos transparente, a íris, a pupila, o
cristalino e a retina, onde é gerado o sinal que é enviado ao cérebro.
A íris determina o tamanho da pupila, através da qual a luz tem de passar para
atingir a retina. Pode contrair ou dilatar, diminuindo ou aumentando o diâmetro da
pupila, e isto ocorre de forma a impedir a entrada de luz, ou permitir. A íris é constituída
por músculos e a cor não tem muita importância. Quando há pouca luz, a íris é
controlada pelo simpático, enquanto que, quando há muita luz, é controlada pelo
parassimpático. A pupila é controlada involuntariamente, pelo ____.
A luz chega invertida à retina.
Cristalino e capacidade de acomodação
O cristalino é muito importante, pois permite acomodar a visão à distância e à
proximidade. Os raios de luz chegam ao cristalino quase paralelos e têm de ser focados
na retina. Se se aproximar o objecto, os raios não chegam paralelos, e a imagem formarse-ia para lá da retina, pelo que não se forma imagem nítida. A forma da córnea não é
alterada, pelo que se altera a forma do cristalino, que se torna mais esférico, e, assim, a
imagem já é focada. Quando o objecto está próximo deve haver uma maior
convergência dos raios. A capacidade do cristalino alterar a sua forma designa-se de
acomodação.
O cristalino está suspenso por uma série de ligamentos a um aro de fibras
musculares. Quando as fibras estão contraídas, fica mais esférico, pois os ligamentos
deixam de estar esticados e o cristalino deixa de estar esticado, adquirindo a sua forma
normal, mais arredondada. Quando os ligamentos esticam, o cristalino fica mais plano.
Com a idade, a capacidade de acomodação vai-se perdendo, e é por isso que as pessoas
mais idosas têm de afastar os objectos para os poderem ver.
O cristalino é normalmente transparente e, se ele começar a ficar opaco,
formam-se as cataratas. A sua formação é potenciada por diabetes.
Organização da retina
A luz tem de passar através da córnea e do cristalino e chegar à retina. Esta
estrutura tem vários neurónios: tem os cones e os bastonetes, os fotorreceptores,
células bipolares, células ganglionares (essenciais para a visão), células horizontais e
células amácrinas. Têm-se também células da glia, como asterócitos e células de
Müller. Na retina há, então, os cones, os bastonetes e outras células.
A luz tem de passar por outras células antes de incidir sobre os fotorreceptores,
excepto numa zona, a fóvea, muito importante na visão. A retina é incolor, mas, na
22
fóvea, onde só há fotorreceptores, a imagem é mais nítida. Existe uma outra zona da
retina, o disco óptico ou ponto cego, onde não existem fotorreceptores e onde confluem
as fibras nervosas. Nesta zona não há detecção da luz e qualquer imagem focada lá não
é vista, mas o cérebro consegue preencher essa zona, automaticamente.
Os fotorreceptores passam o estímulo para as células bipolares, que o passam
para as células ganglionares, que o conduzem para o nervo óptico. São os seus axónios
que formam o nervo óptico, que leva a informação, em última instância, para o córtex
visual. As células horizontais podem controlar, estimulando ou inibindo, a passagem do
estímulo nas sinapses dos fotorreceptores para as células bipolares. As células
amacrinas também regulam sinapses.
Fotorreceptores
Existem, como foi referido, dois tipos de fotorreceptores, os cones e os
bastonetes. Os cones existem em muito menor número, permitem ver as cores e ver com
muita definição. Só permitem isto em condições de muito boa iluminação. Os
bastonetes são muito mais numerosos, fornecem imagem sem ser a cores e permitem
ver à noite. À noite vêm-se as coisas a cinzento e não se vê branco, por este resultar da
conjunção das cores. A detecção do movimento está relacionada com células amácrinas
e outras.
Na zona da fóvea há mais cones, mas na zona periférica há mais bastonetes. À
noite, não se usa a fóvea; à noite usam-se os bastonetes. Os bastonetes são muito
sensíveis e saturam com muita luz, não respondendo. À noite, os cones não conseguem
responder.
Existem 120 milhões de bastonetes, 6 milhões de cones e apenas 1,2 milhões de
células ganglionares, pelo que tem, obrigatoriamente, de ocorrer convergência. Vários
bastonetes confluem para a mesma célula ganglionar. O sinal dos bastonetes é fraco,
pelo que é favorável amplificá-lo. Os cones já têm um sinal bom, e isto permite uma
boa resolução.
Fotorrecepção e fototransdução
O processo de fototransdução ocorre nos fotorreceptores. Só os fotorreceptores
recebem os estímulos, pois só eles têm pigmento fotossensível.
É mais fácil estudar os bastonetes porque são mais numerosos e, para além disso,
a sua zona onde se encontra o pigmento é maior. O pigmento responsável pela
fotorrecepção é a rodopsina, que é constituída por opsina e por retinal, um derivado
da proteína A. O retinal alterna entre duas conformações, de acordo com a estimulação
da luz, ou a falta dela. No escuro, a conformação é cis e o GMP cíclico é abundante, o
que leva a que o sódio entre, levando a despolariação. Na ausência de luz, o bastonete
está despolarizado. Na presença de luz, o retinal passa de cis para trans, activando-se o
pigmento. A rodopsina activa uma proteina G, que activa a fosfodiesterase (A
23
rodopsina vai activar a fosfodiesterase) que, por sua vez, converte o GMP cíclico em
GMP. A fosfodiesterase degenera o GMPc, baixa os níveis desta molécula. Com menos
GMPc, o canal fecha e a membrana pode repolarizar. Isto passa-se nos discos, nas
“bolachas”, do ____. Os níveis de GMPc são altos no escuro e baixos na luz,
repolarizando a membrana nesta última situação. Se se retirar a luz volta-se à situação
inicial. Neste caso, ao contrário do que costuma acontecer, o estímulo provoca uma
hiperpolarização. No escuro libertam-se menos neurotransmissores do que na presença
de luz. O neurotransmissor, o glutamato, passa para a célula bipolar. Na maior parte
dos casos, mesmo na presença de luz há libertação de glutamato.
Cores e cegueira às cores
Nos cones acontece algo semelhante, mas o pigmento fotossensível é diferente.
Existem três tipos de cones, os azuis, os verdes e os vermelhos, com diferentes partes
proteicas dos pigmentos fotossensíveis e cada um absorvendo mais a cor respectiva.
Apesar de só haver estes três cones, é possível detectar milhares de cores, que
dependem de ____ níveis de estimulação dos vários cones. O branco, por exemplo, é
devido à máxima estimulação dos três tipos de cones. Se se observar muito tempo uma
bola vermelha e depois se observar um plano branco, é possível ver uma bola azulturquesa. Os cones vermelhos ficam saturados e, quando são necessários para ver o
branco, apenas os verdes e os azuis são activados.
A cegueira às cores ou daltonismo é mais frequente no sexo masculino do que
no feminino, pois a parte proteica do pigmento, responsável por esta condição, está
codificada no cromossoma X, e os homens têm apenas um destes cromossomas.
Visão de animais não-humanos
A diferente capacidade de visão de diferentes animais relaciona-se com o
espectro que é visível e a capacidade de absorver luz.
Os gatos vêem bem no escuro, em parte por conseguiram dilatar mais a pupila.
Por traz da retina, os humanos têm um epitélio preto e é por isso que se vê a pupila
preta (nos coelhos é vermelha). A cor preta absorve todos os comprimentos de onda. Os
gatos, em vez da camada preta, têm um tapete reflector, que permite que a luz passe
dessa zona pelos fotorreceptores. O tapete é que faz com que os olhos dos gatos
reflictam luz, à noite. A melhor visão dos gatos deve-se à maior entrada de luz e ao
tapete. No entanto, os gatos não distinguem tantas cores. Os touros também não e não
vêm o vermelho, distinguindo apenas os movimentos do capote. A íris dos gatos é
radiada.
Vias de transmissão dos impulsos
Nos cones, no escuro, há uma inibição por (de) um neurotransmissor inibitório,
que impede a célula bipolar de estimular a célula ganglionar. Na luz, a célula bipolar
passa a libertar o neurotransmissor, que estimula a célula ganglionar. Isto só é verdade
para algumas células. Neste caso, o glutamato tem um efeito inibitório sobre os seus
receptores.
No escuro, há uma maior libertação de glutamato, que pode fazer coisas distintas
na célula bipolar. Pode inibi-las, ou, noutra via, activar as células bipolares. Esta
diferença deve-se ao receptor. Numa primeira via, referida acima, existem receptores
metabotrópicos para o glutamato, que actuam por intermédio de proteínas G, levando
24
a hiperpolarização e à não libertação de neurotransmissores. Na segunda via, os
receptores activados são ionotrópicos e despolarizam a célula. As células vão libertar
glutamato, pelo que se propaga o potencial de acção, ao contrário do caso anterior. Isto
passa-se no escuro.
Na presença de luz, acontece o contrário. Por este motivo, a primeira via
designa-se de “ON” e a outra de “OFF”, já que a primeira se torna activa com a luz e a
outra fica inactiva (na ausência de luz). Na primeira, já não há libertação de glutamato,
pelo que a célula ganglionar pode ser activada. Na segunda via, o glutamato era
necessário para estimular e, como não é libertado, a célula ganglionar não é estimulada.
Assim, na visão, existem vias activas na ausência de luz e vias activas na
presença de luz, e em ambos os casos há libertação de neurotransmissores. O glutamato
pode causar despolarização ou hiperpolarização, dependendo do receptor: os receptores
ionotrópicos abrem canais de sódio que levam à despolarização, enquanto os receptores
metabotrópicos levam à hiperpolarização, fazendo sair potássio e entrar cloro.
A única diferença das vias são os receptores para glutamato. Este
neurotransmissor pode inibir ou estimular, dependendo do receptor. A diferença entre a
via ON e a via OFF são os receptores, e em ambas há passagem de informação para o
córtex visual. A ida para uma via ou outra, por parte das células, resulta da organização
embrionária da retina.
O processo é ainda mais complexo e, em alguns casos, há vias alternativas de
passagem do estímulo das células bipolares para as células ganglionares.
Visão binocular e condução do sinal visual
A visão humana é binocular, o que permite ver a três dimensões, permitindo a
noção de profundidade. A sobreposição do campo visual permite a noção da
profundidade. Nos humanos e outros animais há visão com sobreposição de campos
visuais, visão binocular que permite a noção de profundidade. Para os predadores é
melhor ter uma visão melhor, com noção de profundidade, enquanto que, para uma
presa, é preferível ter um campo visual maior.
Cada olho tem um campo visual, isto é, cada olho capta uma área do campo
visual, que se sobrepõe, em certa parte, mas a cada hemisfério cerebral só chega a
informação de metade do campo. A imagem é projectada sobre a retina, pelo que a parte
do campo esquerdo captada pelo olho direito não passa pelo quiasma óptico. As partes
temporais passam directamente para o cérebro, enquanto as partes frontais cruzam no
quiasma óptico e vão para o outro hemisférico. Isto acontece porque há sobreposição
parcial. Metade das fibras de um olho cruzam assim com metade das fibras do outro,
pois em cada um dos olhos vê-se algumas partes de campo coincidentes. Se as vias se
cruzassem completamente, a visão de cada olho seria independente.
6.3.2. Paladar
Língua e bolbos gustativos
Neste caso ocorrem quimiorreceptores, localizados nos bolbos gustativos, que
se encontram essencialmente na língua. Na superfície deste órgão, as células receptoras
emitem microvilosidades (com os quimiorreceptores).
25
Sabores e sua detecção
Existem quatro sabores básicos: o doce, o salgado, o amargo e o azedo.
• Salgado
O sabor salgado deve-se a sal. Em solução, não se encontra sal, mas Na+ e Cl-. O
aumento da concentração de Na+ no exterior leva a que ele entre por canais
permeáveis, os níveis de Na+ aumentam, há despolarização, abrem canais de cálcio
sensíveis à voltagem e activa-se a maquinaria exocitótica. Ocorre, portanto, libertação
de glutamato, que estimula neurónios.
• Azedo
No caso de alimentos ácidos, há excesso de protões. Os canais de (permeáveis
a) sódio podem ser permeáveis a protões, que entram quando a sua concentração
aumenta no exterior, levando a uma despolarização. Isto provoca despolarização e,
depois, pelo mesmo processo, libertação de glutamato. Se dois estímulos, relativos a
alimentos salgados e ácidos, ocorrerem na mesma célula, não há detecção do sabor, pois
o neurónio aferente é o mesmo.
Os protões podem, noutra via, inibir os canais de potássio. Se este ião deixar de
sair (ele está mais concentrado no interior), há despolarização, que leva à abertura de
canais de cálcio.
• Doce
Para os açúcares há receptores metabotrópicos, associados a proteínas G,
que, quando activas, vão activar a adenilato ciclase. Esta vai transformar ATP em
AMPc, que vai activar uma cinase, que fosforila (fosforilar significa adicionar um
grupo fosfato) o canal de potássio, que fica menos permeável. Deixa de sair potássio,
pelo que a célula é despolarizada. Isto leva à abertura de canais de cálcio e à libertação
dos neurotransmissores, o glutamato.
• Amargo
Relativamente ao amargo, existem algumas substâncias amargas que inibem os
canais de potássio. Há despolarização, entrada de cálcio e libertam-se
neurotransmissores.
Algumas moléculas ligam-se a receptores metabotrópicos, que activam
proteínas G, mas a maquinaria seguinte é diferente. A proteína G activa a fosfolipase
C¸ que forma IP3 e ____ a partir de ____. O IP3 liga-se a receptores da membrana de
reservatórios intracelulares de cálcio (como o retículo endoplasmático) e isto leva à
libertação de cálcio, cuja concentração aumenta, levando-se à libertação de glutamato.
Na subida dos níveis de cálcio, o ião pode vir do exterior das células ou dos
reservatórios intracelulares. Os reservatórios servem para armazenar cálcio e, após a sua
entrada, os níveis devem descer, e isso dá-se com saída de cálcio ou com a sua
integração nos reservatórios.
26
• Umami
Os sabores referidos são os quatro sabores básicos, mas há mais. Um quinto
sabor é o umami (delicioso, em japonês), que é relativo a glutamato. Este é adicionado
na comida nos restaurantes chineses e em comida congelada, sob a forma de glutamato
monossódico. O glutamato ou a ____ vão activar os canais de sódio, que deixam entrar
este ião, levando à despolarização e à libertação de glutamato.
Mapas de sabores
Em muitas fontes refere-se que os receptores para o doce estão localizados na
ponta da língua, que os receptores para o azedo estão dispostos lateralmente e que os
receptores para o salgado e para o amargo se localizam, também, em zonas particulares.
Estes mapas de sabores não são, no entanto, correctos.
Nas zonas com receptores que respondem bem a açúcar, também há uma elevada
resposta a compostos que não são açúcares, e o mesmo se pode dizer para zonas que
respondem bem a sais ou zonas que respondem bem a ácidos. Posto isto, não se pode ter
mapas de sabores como aqueles que foram vistos.
A informação, para chegar ao córtex, tem de chegar pelo tálamo.
6.3.3. Olfacto
Olfacto e paladar
Por vezes confunde-se paladar com olfacto. Há comidas que não são
verdadeiramente saborosas, mas aromáticas. Quando se perde capacidade de saborear,
numa constipação, os receptores gustativos não são afectados.
Epitélio olfactivo
No epitélio olfactivo há neurónios que se estendem até à superfície e células de
suporte, também. Os neurónios têm cílios, com receptores, que estão embebidos
continuamente em muco. É o único caso em que há neurónios expostos directamente ao
meio externo.
O epitélio olfactivo está continuamente a ser regenerado, estão sempre a formarse novos neurónios e, tendo isto em conta, está a procurar-se regenerar neurónios, com
aplicações na regeneração da espinal medula. Isto faz-se em Portugal. Tira-se parte do
epitélio olfactivo, que é colocada directamente na medula, não havendo problema de
rejeição. Este trabalho faz-se com sucesso, recuperando os pacientes algumas
capacidades.
Mecanismo de percepção de estímulos olfactivos
As moléculas de odor activam receptores metabotrópicos, que activam
proteínas G, que activam a adenilato ciclase. Esta converte ATP em AMPc, que leva
à abertura de canais de sódio e de cálcio. Estes entram, levando à despolarização da
membrana, e a entrada de cálcio leva à abertura de canais de cloro, que sai,
aumentando ainda mais a despolarização. Esta percorre toda a célula, chega ao bolbo
oilfactivo, aí há libertação dos neurotransmissores e activam-se neurónios de segunda
27
ordem, que levam a informação ao córtex cerebral. Este é o único sentido em que a
informação não passa pelo tálamo.
Distinção de odores
Há capacidade de distinguir 10.000 odores diferentes. Existem odores que
activam vários receptores em simultâneo e a sobreposição leva à percepção de um odor
particular. Com quatro receptores, por exemplo, existem muitas combinações.
Não se sabe quantos receptores têm os humanos, mas no rato existem 1.000
receptores diferentes e ele é capaz de distinguir muitos odores. Existindo muitos
receptores, existem muitas proteínas diferentes e, tendo os humanos 30.000 genes,
muitos são dedicados a receptores. Isto é devido ao facto de o olfacto ser um sentido
primordial.
Os cães e outros animais têm uma maior acuidade olfactiva que os humanos. Isto
deve-se a um maior epitélio olfactivo e a um maior número de receptores.
6.3.4. Audição
Som e suas características
O som é relativo a vibrações, que se propagam num meio, como ar, água, ou
outros. Normalmente é o ar. As cordas vocais levam a vibrações do ar, que são
detectadas pelos ouvidos.
A amplitude da onda é relativa à intensidade do som. O limiar é considerado 0
dB, numa conservação normal emitem-se 50 dB e a música alta pode emitir mais de 130
dB. A frequência é relativa ao tom, mais grave ou agudo. Os humanos captam entre
____ e ____, mas outros animais captam outras gamas. Os cães conseguem detectar
ultrassons, de maior frequência, não detectados pelos humanos. Os apitos para cães
usam ultrassons, que só são detectados por eles.
Ouvido e condução do som
O som vem do ouvido externo, passa pelo canal auditivo e atinge o tímpano.
Do canal auditivo vêm ondas que fazem vibrar o tímpano, isto é, o som é conduzido até
ao tímpano e fá-lo vibrar. Desta estrutura passa para uma estrutura membranar, a janela
oval, e, daí, para a cóclea (caracol). No ouvido médio, existem três ossos, os mais
pequenos do corpo: martelo, bigorna e estribo. A vibração do tímpano faz vibrar os
ossos, que fazem vibrar outra membrana, a janela oval. O martelo movimenta a bigorna
e esta movimenta o estribo, que movimenta a membrana. O facto de os ossos estarem
ligados ao crânio por músculos protege a membrana oval. O crânio absorve parte da
vibração.
O ouvido médio está cheio de ar, que deve ter uma pressão igual ao exterior. Isto
é mantido pelo canal auditivo (trompa de Eustáquio), que comunica com a boca. Em
viagens de avião, a impressão nos ouvidos é resolvida com movimentos da boca, que
abrem o canal. Na otite pode haver acumulação de líquido (pús), que causa problemas.
Se o tímpano ou a membrana oval não vibram correctamente, a capacidade
auditiva diminui. O facto de o tímpano comunicar a vibração à membrana oval, mais
pequena, amplifica o sinal.
28
A cóclea tem três canais que estão cheios de líquido. O canal vestibular
comunica com o canal timpânico, na zona do ericotrema, e estão ambos cheios de
perilinfa. O canal central, coclear, tem endolinfa. São três canais cheios de líquido,
perilinfa e endolinfa. A vibração da janela oval leva à movimentação do líquido do
canal vestibular e vão ser criadas ondas que percorrem todo o canal até ao canal
timpânico. Frequências mais altas levam à encurtação do caminho, passando a onda do
canal vestibular para o canal coclear e deste para o canal timpânico. No fim deste
último, as ondas encontram uma membrana e dissipam-se. Se encontrassem uma
estrutura rígida, como osso, elas voltariam para traz.
Persepção do som
É no canal coclear, no órgão de Corti, onde se localizam as células sensoriais.
No órgão de Corti há uma membrana tectorial que se liga, por cílios, a células. Os
cílios estão normalmente na vertical, mas podem deslocar-se para um lado ou para o
outro e este movimento que estimula os neurónios.
Quando os cílios se deslocam no sentido do maior cílio, há entrada de potássio.
Estas células, ao contrário do que é costume, têm uma baixa concentração daquele ião,
enquanto que a endolinfa tem potássio em níveis elevados. A sua entrada leva á
despolarização, à entrada de cálcio e à libertação de neurotransmissores. Se os cílios se
inclinarem para o outro lado, não há entrada de potássio (sódio).
A frequência é detectada de acordo com o local em que ____ é detectada.
Estímulos de elevada frequência são detectados próximo da janela oval, enquanto
estímulos de baixa frequência são detectados longe da janela oval.
A informação tem de chegar ao córtex auditivo, mas tem de passar pelo tálamo.
6.3.5. Equilíbrio
Papel do ouvido no equilíbrio
Ligado à cóclea está o aparelho vestibular, relacionando com o equilíbrio. Ele
tem três canais semicirculares, que detectam movimentos da cabeça nos três eixos. Há
ainda o utrículo e o sáculo, que detectam acelerações e desaceleraçãos verticais e
horizontais.
Mecanismo de detecção do movimento
O aparelho vestibular está preenchido com endolinfa. Também existem células
ciliadas e, dependendo do sentido da sua deslocação, há entrada ou não de potássio, da
mesma forma que acontece no caso anterior. Não há uma membrana tectorial, mas uma
membrana otolítica, revestida por otólitos, cristais de carbonato de cálcio que
conferem inércia à membrana. O início de um movimento é acompanhado com a
permanência da membrana para trás, movimentando-se as células. A certa altura a
membrana vai para a frente e estabiliza, depois da estabilização do movimento. Se
depois se abrandar, a membrana tem tendência a manter o movimento, pelo que fica à
frente e as células dobram. Isto permite detectar acelerações e em diferentes sentidos,
____.
Na ampola, que existe nos canais semicirculares, há uma líquido que, quando há
uma viragem, fica para trás, e as células deslocam-se. Depois elas estabilizam. Depois
29
de uma paragem, o líquido vai para a frente, dobrando-se as células. Isto permite
detectar movimentos de rotação. A ampola ocorre noutros órgãos, permitindo detectar
movimentos da água, em peixes, por exemplo.
Problemas de equilíbrio
Quando há uma rotação e uma paragem repentina, há perda de equilíbrio. Isto
deve-se a um conflito entre a informação dos olhos, que informam que se está parado, e
a informação dos ouvidos, que devido à permanência do movimento do líquido
informam que se está em movimento.
Noutros problemas de equilíbrio há uma participação do aparelho vestibular.
O movimento num carro e a informação visual de que se está parado podem
levar a enjoo.
6.4. Sentidos de outros animais
Existem animais que vêem luz infravermelha e/ou ultravioleta. A visão de
ultravioleta pode, por exemplo, revelar “setas” que indicam aos insectos o centro da
flor. Certas serpentes conseguem ver na gama do infravermelho, o que permite detectar
o calor das presas.
Alguns animais, como elefantes, comunicam através de ultrassons, que se
propagam por longas distâncias. Alguns animais, como os morcegos, utilizam o eco dos
ultrassons para detectar a localização das presas no escuro. Os golfinhos também usam
ecolocação.
Alguns peixes detectam campos eléctricos (outros geram-os).
30
Capítulo II
- Músculos e Movimento Animal -
31
1. Tipos de músculo
1.1 Contracção voluntária e involuntária
___
A contracção do músculo esquelético é voluntária. A informação vem do
córtex motor do cérebro e resulta de potenciais de acção das células nervosas.
O músculo cardíaco e o liso apresentam contracções independentes da vontade.
No caso do músculo cardíaco, há um ritmo provocado por contracção própria do
músculo. O músculo liso também tem contracção involuntária. Este músculo existe nos
brônquios, que podem estar mais ou menos dilatados, e, quando estão dilatados, o ar
entra mais facilmente nos alvéolos pulmonares.
1.2. Estrutura dos músculos
Músculo esquelético
No músculo esquelético, os núcleos são parietais, dispondo-se junto à parede, e
existem vários, resultantes da diferenciação dos mioblastos. Os mioblastos fundem,
durante a diferenciação celular, e os filamentos das células empurram os núcleos para a
periferia. Nas células do músculo esquelético observa-se a estriação transversal. A luz
passa mais facilmente onde não há sobreposição de filamentos, sendo estas zonas claras;
as zonas escuras resultam da sobreposição de filamentos. A diferenciação dos
filamentos contrácteis e o início da contracção é visível durante o desenvolvimento
embrionário, em pintos, por exemplo. As células são paralelas. No músculo esquelético
cada célula distribui-se ao longo de todo o músculo.
Músculo cardiaco
No músculo cardíaco, as células não se distribuem ao longo do músculo;
também são paralelas, mas algumas dispõem-se topo-a-topo. As regiões de contacto
entre as células adjacentes são chamadas discos intercalares, e, nessas zonas (de
contacto entre células adjacentes), existem junções gap junctions. Nos locais onde
existem estas junções, a comunicação é mais fácil, e a sua existência permite que,
quando uma célula desenvolve um potencial de acção, todas elas se contraiam, quase
simultaneamente. Uma membrana plasmática de uma célula tem, normalmente, 100 Å,
e duas têm uma espessura de 200 Å. Nas gap junctions, a espessura de duas membranas
é menor. Só assim é possível que um ventrículo inteiro contraia simultaneamente. De
outra forma não seria possível expulsar o sangue.
Músculo liso
O músculo liso tem células fusiformes, que não se dispõem de forma paralela e
são mononucleadas. O citoplasma parece homogéneo.
32
2. Músculo esquelético
2.1. Estrutura do músculo esquelético
Aspectos gerais
O músculo esquelético é aquele que tem sido mais estudado e aquele cujo
mecanismo de acção e função são mais conhecidos. Estes músculos unem-se aos ossos
do esqueleto por tendões e a sua contracção e distensão permite o movimento dos
membros.
Constituição e estrutura do músculo esquelético
As células ____ ou fibras (são fibras pois são muito longas, indo de um lado ao
outro) organizam-se em feixes e o conjunto de feixes forma o músculo.
Há várias membranas de tecido conjuntivo: a célula ou fibra é envolvida pelo
endomizio; o feixe ou fascículo de fibras é envolvido pelo perimizio; o músculo é
envolvido pelo epimízio. O tecido conjuntivo mantém a estrutura do músculo. O tecido
muscular, com fibras, é flexível. Os tecidos conjuntivos permitem alguma lubrificação
das células e feixes, permitindo que deslizem mais facilmente, aquando da contracção.
Nas miofibrilhas estão organizados os filamentos de proteínas contrácteis.
2.2 Mecanismo da contracção do músculo esquelético
Sistema nervoso e músculo esquelético
Para que as células do músculo esquelético sejam estimuladas a contrair têm de
sofrer enervação de neurónios motores, que têm o corpo celular na matéria cinzenta
da espinal medula. Cada nervo motor que traz os potenciais para o músculo tem
numerosos neurónios motores, tem feixes destes neurónios, e cada um deles, quando
chega aos músculos, ramifica-se. Cada ramificação enerva uma fibra.
Uma unidade motora consiste de um neurónio motor e das fibras que enerva. A
intensidade da contracção do músculo depende do número de unidades motoras postas a
funcionar, e, quanto maior a contracção, maior é este número. É possível utilizar apenas
as unidades motoras necessárias. É fácil manter um peso leve ____ durante muito
tempo. São usadas poucas unidades motoras, que podem ir permutando; as unidades
motoras são rotativamente mobilizadas, o que impede o cansaço e a fadiga da
contracção muscular.
Os neurónios motores fazem sinapse com neurónios vindos do córtex cerebral,
de onde vêm potenciais de acção. Os neurónios motores desenvolvem potenciais de
acção e libertam neurotransmissores nas células musculares. Este neurotransmissor é a
acetilcolina que se liga a receptores nicotínicos do sarcolema, levando ao
desenvolvimento de potenciais de acção da célula muscular e à sua contracção. Depois
da acetilcolina se ligar, aumenta a permeabilidade do sarcolema ao sódio, há uma
despolarização que gera um potencial de acção. O neurotransmissor, na membrana, é
depois clivado em acetato e colina, e esta última é reabsorvida e reage com ácido
acético, formando mais actilcolina, que integra as vesículas.
33
Sarcómero e teoria da contracção muscular
Cada fibra ou célula muscular esquelética tem miofibrilhas com filamentos de
proteínas contrácteis, actina e miosina, que se polimerizam. Os filamentos
organizam-se ao longo das miofibrilhas em sarcómeros. Cada um deles localiza-se
entre duas linhas Z, no topo existem filamentos finos de actina e no centro filamentos
de miosina. Há muitos sarcómeros dispostos topo-a-topo nas miofibrilhas (nos
filamentos). A organização dos filamentos (das fibras) resulta na estriação.
A teoria da contracção muscular propõe que, durante a contracção, os
filamentos de actina deslocam-se para o centro do sarcómero. Os filamentos de miosina
aproximam-se da linha Z e, na concentração máxima, quase que a (se) tocam.
Uma das premissas é que os filamentos não encurtam. Para se provar a teoria,
pretender-se-ia verificar que, durante a contracção, a zona H, onde só há filamentos de
miosina, desaparace, a banda A, onde há miosina, se mantém, e a banda I, só com
actina, diminui. Ao usar microscopia electrónica foi possível ver a alteração das bandas.
Na contracção há aproximação das linhas Z. Os filamentos de actina deslizam sobre os
de miosna, sem que mudem de tamanho. Há um deslize até que o sarcómero obtenha o
comprimento dos filamentos de miosina.
Estrutura e funcionamento das proteínas contrácteis
Para se estudar a interacção entre as proteínas, solubilizam-se as proteínas do
músculo (de pata de coelho, por exemplo). Verifica-se que a actina e a miosina
polimerizavam, formando filamentos. O filamento de actina assemelham-se a um colar
de pérolas e, ao microscópio electrónico, é possível observar que os filamentos ____ de
miosina têm uma projecção para fora do filamento. São as cabeças das moléculas ____
de miosina.
Durante a contracção, as cabeças da miosina ligam-se aos filamentos de actina e
puxam esta proteína para o centro.
Todos os mecanismos hoje conhecidos resultam de investigação de muitos anos.
A ligação entre os filamentos consiste na formação de pontes transversais. É
descrita por etapas mas, no músculo, é tudo muito rápido. A cabeça da miosina, para
além de formar a ponte transversal, cataliza a hidrólise de ATP, formando-se ADP e
Pi, que ficam ligados à cabeça da molécula de miosina, ficando a energia da hidrólise
nela armazenada. De seguida estabelece-se a ponte, a ligação entre os filamentos e,
depois, liberta-se o grupo fosfato, que leva a uma alteração da conformação da
molécula de miosina. Ela está perpendicular e desloca-se, e é daí que resulta o
deslizamento. A contracção resulta de muitos destes deslizamentos conjuntos. O deslize
34
é da ordem dos angstrons e, no processo, liberta-se a molécula de ADP. Depois de se
ligar ATP, os filamentos separam-se e, após a hidrólise, repete-se o processo.
Há outras proteínas que regulam a contracção. Ao longo dos filamentos existe a
troponina, globular, há também uma proteína filamentosa, a tropomiosina. A
troponina tem três subunidades e está ligada à tropomiosina. Em repouso, não se
estabelece ligação entre a molécula de miosina e o filamento de actina, porque a
tropomiosina dispõem-se de tal forma que o impede. Quando se inicia a contracção,
aumenta a concentração de cálcio, que se liga a uma subunidade da troponina, alterando
a conformação desta proteína, que leva a que a tropomiosina se desligue, podendo
estabelecer-se a ligação e, portanto, a contracção. O ADP é limitante aquando do
movimento da cabeça, que se desliga quando o ATP se liga.
Libertação e re-armazenamento de cálcio
No espaço entre as miofibrinhas existe o retículo sarcoplasmático, onde se
armazena o cálcio, quando em repouso. Esta estrutura envolve as miofibrilhas (fibras)
musculares de uma forma muito eficiente e extensa. O sarcolema, a membrana
plasmática da célula muscular, tem invaginações que formam tubos em forma de T,
chamados tubos T. Os tubos T são invaginações do sarcolema e estão muito próximos
das partes mais largas do retículo, as cisternas terminais.
O cálcio está armazenado no retículo sarcoplasmático, quando em repouso e,
quando o potencial chega, vindo dos tubos T, leva a que o retículo sarcoplasmático
liberte aquele catião. Quando a célula é despolarizada, o potencial de acção propaga-se
ao longo do sarcolema e, depois, para o interior, pelo ____ dos tubos T. Há uma
interacção entre ele e o retículo, que liberta cálcio, que permite, como foi visto, a
contracção.
Para terminar as contracções, tem de haver um re-armazenamento de cálcio. A
recaptação de cálcio faz-se contra o gradiente de concentração, sendo necessária
energia, e é uma cálcio-ATPase que promove esse transporte.
No retículo sarcoplasmático, cerca de 90% das proteínas corresponde à cálcioATPase. Numa electroforese, praticamente só há uma banda, preponderante.
Na contracção (/), a concentração de cálcio vai (,assim,) aumentar na célula; no
fim da contracção, diminui.
Se se aplicarem microeléctrodos, um dentro da fibra muscular, e outro fora, pode
medir-se o potencial na fibra. O mesmo se pode fazer no terminal nervoso, no qual a
medição da alteração do potencial revela uma despolarização, uma repolarização e uma
hiperpolarização. No sarcolema, o potencial de repouso é cerca de -90 mV. A ligação da
acetilcolina ao receptor leva a uma alteração de potencial no ponto respectivo, que, mais
tarde, (que) se restabelece.
Tudo isto é rápido e a contracção das fibras musculares ocorre muito depois da
geração do potencial de acção. Há uma fase de contracção e outra de relaxamento, e
antes da contracção há uma fase de latência, que varia com o músculo. (O tempo entre
a alteração de potencial e a contracção e o tempo que leva à libertação de cálcio, à sua
35
ligação à troponina e aos processos dessa fase.) A fase latente da contracção muscular
é a que está entre o desenvolvimento do potencial e a contracção.
O potencial de acção é muito rápido e desencadeia o aumento do cálcio
intracelular. Mais tarde desencadeia-se a contracção, e, quando o cálcio diminui, mais
tarde conduz-se ao relaxamento. O sarcómero está activo enquanto o cálcio não
recuperar os níveis basais. A libertação de cálcio é mínima, ficando muito, e pode levarse a libertações sucessivas, sendo o limite da libertação o do estabelecimento de um
novo potencial de acção. Podem somar-se contracções da mesma célula se se aplicar
estímulos uns a seguir aos outros. Isto é possível pois o potencial de acção e a
contracção estão separados temporalmente. Podem somar-se contracções adjacentes, por
soma de potenciais de acção, desde que se limite o período refractário. Isto faz com que
seja possível a contracção contínua.
Relação entre comprimento e tensão no músculo esquelético
Outra propriedade da contracção do músculo esquelético é a relação entre o
comprimento do sarcómero, do músculo, e o grau de tensão que se pode desenvolver.
Como a contracção se deve ao movimento das pontes, quanto mais pontes se poderem
formar, maior o deslize, o somatório dos deslizes individuais.
É possível medir a força da contracção para diferentes comprimentos do
músculo. O músculo muito esticado tem os filamentos de actina muito pouco
sobrepostos. Se se ____ o músculo, aquando da contracção, não se desenvolve
contracção, por mais cálcio que se liberte, pois os filamentos não estão suficientemente
próximos. No comprimento intermédio já se estabelecem algumas pontes. Se o
comprimento for muito pequeno, quando o sarcómero está demasiado curto, os
filamentos de actina ficam parcialmente indisponíveis, não se formando o número
máximo de pontes. Os comprimentos de que se parte são relativos ao repouso. Os
músculos não estão normalmente encurtados, mas é possível torna-los assim em
laboratório.
O comprimento do sarcómero determina a força que se desenvolve. A força da
contracção depende do comprimento dos sarcómeros, que influencia a disposição das
fibras. Todos os músculos com sarcómeros têm esta relação entre o comprimento e a
força.
No músculo cardíaco isto também acontece. Neste músculo, o comprimento de
repouso varia com o grau de enchimento dos ventrículos, isto é, o comprimento dos
sarcómeros em repouso varia com o volume de sangue. Se, __ ________, ____ um
maior volume de sangue ao coração, os sarcómeros têm maior comprimento. Depois, a
força para libertar o sangue varia com o volume de sangue.
2.3. Energética da contracção muscular
Vias de recuperação de ATP
O ATP é gasto no movimento e tem de ser reposto. As células utilizam a
fosfocreatina, que fornece o seu grupo fosfato ao ADP, resultante do ATP que se
gasta. Durante o exercício, o ADP que se forma é fosforilado à custa de fosfocreatina, e,
depois do exercício, o ATP é sintetizado a partir de alimentos. A fosfocreatina é
ressintetizada a partir de ATP.
36
Nas células, a glicose pode levar à síntese de ATP pela glicólise ou pela
fosforilação oxidativa. Os ácidos gordos são moléculas muito calóricas que formam
intermediários do ciclo de Krebs (acetil-CoenzimaA) e equivalentes de redução, que
permitem recuperar o ATP celular. As gorduras permitem formar mais energia do que
os açúcares. Pode não haver oxigénio suficiente para o metabolismo anaeróbio e, com
falta de oxigénio, o ácido pirúvico origina ácido lácteo, que diminui ligeiramente o pH
da célula. Isto pode activar terminais nervosos da dor, que é sentida.
Estas são as três vias de recuperar o ATP que está a ser gasto no exercício.
Também no relaxamento o ATP é utilizado na remoção de Ca2+, na redução dos níveis
de Ca2+, no citossol.
Influências do tempo e intensidade do exercício
O tempo de duração do exercício no músculo esquelético determina o tipo de
nutrientes utilizado na síntese de ATP. Geralmente usam-se ácidos gordos, mesmo
durante o repouso. Se se fizer 45-90 minutos de exercício moderado a intenso, há
respiração anaeróbia e formação de ácido lácteo. Se o exercício for entre moderado a
intenso, durante os primeiros 45-90 minutos, não há oxigénio suficiente para permite a
respiração aeróbia, até que aumenta o ritmo cardíaco, a vasodilatação ou outro
mecanismo de fornecimento de oxigénio.
No músculo há algumas gorduras e glicogénio, que podem ser degradados em
glicose, glicose sanguínea, normalmente em circulação, e ácidos gordos. Normalmente,
em exercício de baixa intensidade (em repouso), usam-se ácidos gordos, por respiração,
mas também alguma glicose plasmática ou triglicerídeos, não se recorrendo, nesta
fase, ao glicogénio armazenado. No exercício, há libertação de adrenalina e, portanto,
indução da libertação de ácidos gordos no sangue. A consideração feita para os ácidos
gordos no exercício de intensidade baixa é verdadeira para o exercício de 0-30 minutos
ou o exercício de 90-120 (0-90). Os ácidos gordos só são usados para ressintetizar ATP
no ciclo de Krebs e na fosforilação oxidativa. Em falta de oxigénio, recorre-se à
glicose e à sua fermentação láctea. No exercício moderado, recorre-se ao glicogénio
armazenado no músculo e, em exercício intenso, recorre-se ainda mais ao glicogénio
armazenado. Para o exercício moderado, a consideração é a mesma para ambos os
tempos de duração do exercício.
2.4. Velocidade de contracção e tipos de fibras
Velocidades de contracção
Diferentes músculos têm diferentes tempos de contracção. O músculo
extraocular tem contracção muito rápida. O músculo gastrocnémico é um músculo
muito forte que tem tempo de contracção maior e permite-nos a nós, e às rãs, por
exemplo, saltar. Outros músculos têm contracção e relaxamento mais prolongados,
dizendo-se músculos lentos.
Tipos de fibras
Estas diferentes velocidades de contracção e relaxamento devem-se às
características das fibras musculares dos músculos. Há três tipos de fibras, que
predominam mais ou menos nos diferentes músculos. As fibras do tipo II têm
37
velocidade de contracção rápida e ciclos contrácteis curtos, enquanto as do tipo I têm
velocidade de contracção lenta e ciclos longos. A rapidez relaciona-se com a actividade
de ATPase da miosina, que é alta nas fibras do tipo II. As fibras do tipo I têm actividade
de ATPase e contracção lenta. A Ca2+-ATPase tem actividade rápida nas fibras do tipo
II e lenta nas fibras do tipo I. A remoção rápida de cálcio impede a formação de pontes
transversais, levando ao relaxamento.
Estes tipos de fibras também diferem na actividade metabólica. As fibras lentas
recuperam o ATP por fosforilação oxidativa (é elevada) e, por isso, requerem oxigénio,
pelo que existem capilares abundantes, nos sistemas onde ocorrem estas fibras, e
grandes quantidades de mioglobina. Esta molécula pode mobilizar o O2 quando há uma
depleção muito grande. Músculos com muita mioglobina são mais vermelhos (esta cor
não se deve à irrigação). Duas moléculas de glicose, na fosforilação oxidativa, formam
38 moléculas de ATP. Estas fibras não usam muito a glicólise como fonte de energia.
Têm pouco oxigénio armazenado nas suas células e geralmente são fibras de menor
diâmetro. As fibras do tipo II, IIA e IIB têm contracção semelhante, variando nas
características metabólicas. As do tipo IIA têm capacidade de fosforilação oxidativa
(usando ácidos gordos) e um pouco a glicólise. Têm um conteúdo médio de glicogénio,
que permite usar a glicose na glicólise e na fosforilação oxidativa. As do tipo IIB usam
muito a glicose e têm muito glicogénio. Usam muito a glicólise e têm baixa irrigação
sanguínea (não necessitam de muito oxigénio). Estas fibras são raras e tornam os
músculos em que existem __ mais brancos. Poder-se-ia distinguir os músculos
marcando constituintes como o glicogénio.
2.5 Fadiga da contracção muscular
Na fadiga da contracção muscular, quando se aplica uma força muito grande,
há uma fusão de contracções adjacentes (e não ciclos), designada tétano. Depois há
fadiga e a tensão diminui. Nos estímulos muito intensos, há um tétano, uma alta
contracção, que começa a diminuir, entrando-se, depois, me fadiga. Após um período de
descanso pode desenvolver-se tensão outra vez, mas a fadiga surge mais rapidamente.
Os níveis de ATP podem descer um pouco na fadiga muscular, mas não podem
explicá-la. Na repolarização, há uma grande saída de K+. A despolarização surge com a
entrada de sódio e a repolarização surge com o fim da entrada (saída) de sódio e a saída
de potássio. É o gradiente de K+ a maior responsável pelo potencial da célula. A fadiga
resulta da falta de resposta, resultante da não recuperação do potencial de repouso. Pode
haver um gasto de glicogénio armazenado, podem gastar-se as reservas de glicogénio. A
falta de reservas pode levar a que o músculo fique fatigado. A acumulação de ácido
lácteo baixa o pH, o que influencia o transporte de cálcio, levando também a fadiga.
38
3. Músculo cardíaco
3.1. Estrutura do músculo cardíaco
O músculo cardíaco também tem sarcómeros e estriação transversal, com
bandas claras e bandas mais escuras, sendo o tecido mais opaco nas ____, em que há
ambas as proteínas, e mais claro onde só há actina. Nos pontos de contacto entre células
topo-a-topo há discos intercalares com junções especiais entre as células, gap juntions,
com poros. Quando se gera um potencial nas células, ele passa para as outras pelos
poros. As membranas interpenetram, havendo invaginações e evaginações.
3.2. Contracção do músculo cardíaco
Neste tipo de músculo há também actina e miosina, organizadas em
sarcómeros, túbulos T e retículo sarcoplasmático, e o processo de contracção é o
mesmo. Neste músculo, para além do retículo sarcoplasmático, há outra fonte de cálcio;
algum vem do exterior, entrando na célula por canais, após despolarização. Este cálcio é
importante e pode ser aumentado. Podem ser administrados fármacos (a pessoas com
insuficiência cardíaca) que aumentam a quantidade de cálcio e, portanto, a contracção.
O músculo cardíaco contrai ritmicamente e durante toda a vida.
Se se representar a alteração do potencial de acção numa célula do ventrículo,
obtém-se um registo diferente do de uma célula nervosa. Na célula nervosa, o ciclo do
potencial de acção dura 7 ms, enquanto que, na célula muscular, o processo é mais lento
e a repolarização dá-se passados 25 ms. No máximo, o ritmo cardíaco é de 240
pulsações por minuto, e isto deve-se ao facto de ser necessário recuperar o potencial de
repouso para se voltar a contrair. É favorável não haver um ritmo demasiado grande. Só
se pode desenvolver um novo potencial e uma nova contracção após a repolarização
(essa contracção). Isto permite que o sangue entre no coração, antes de uma nova
contracção. Em consequência disto, há uma boa eficiência do coração, enchendo-se de
sangue no relaxamento e esvaziando-se na contracção. O facto de existir um potencial
de acção muito longo, quase tão longo como o ciclo contractivo, permite fazer com que
haja um período de relaxamento em que o coração se enche de sangue, antes da
contracção.
No músculo esquelético, a duração do potencial de acção era curta. O ciclo
contractivo é desfasado do potencial e acção, ocorrendo este antes da contracção. Por
este motivo, o músculo pode contrair continuamente. Estas diferenças resultam da
diferença nos canais iónicos, por exemplo.
39
4. Músculo liso
4.1. Estrutura do músculo liso
No músculo liso, as células não são estriadas, são alongadas e fusiformes. Elas
têm feixes de filamentos à superfície do sarcolema e eles cruzam-se em pontos, corpos
densos. Numa forma contraída, encolhem. Os filamentos contrácteis são menos
abundantes e distribuem-se obliquamente, relativamente à superfície da célula. As fibras
de actina são predominantes havendo, entre elas, filamentos de miosina. O filamento
de miosina resulta da polimerização das moléculas desta proteína. As cadeias
distribuem-se por toda a superfície, em vez de se orientarem para as extremidades. As
fibras de actina também resultam da polimerização de moléculas da forma globular
desta proteína. Não há sarcómeros, chamando-se antes aquilo que existe nesta situação
de unidades contrácteis.
4.2. Mecanismo de contracção do músculo liso
Formação de pontos e deslizamento de filamentos
A contracção dá-se pela formação de pontes entre a miosina e a actina e o
deslize entre filamentos. No músculo esquelético, há uma gama limitada na qual se
podem formar pontes e quanto maior o número de pontes, maior a tensão. No músculo
liso, essa gama é maior.
Capacidade de distensão e contracção
O músculo liso existe na parede da bexiga e do intestino, órgãos cujo conteúdo
pode aumentar. É possível distender este músculo liso e, ainda assim, contrair, de
seguida. Esta é uma característica importante do músculo liso, dados os órgãos em que
ele ocorre. Todos os músculos estriados, com sarcómeros, têm uma certa limitação para
desenvolver uma máxima contracção após repouso. No coração aumenta a força de
contracção se o aumento de volume for muito grande.
Papel do cálcio
No músculo liso, a contracção e o relaxamento também envolvem cálcio. As
fontes deste ião duas: o exterior, de onde ele vem através de canais da membrana, e o
retículo sarcoplasmático. Não há tubos T, pelo que a abertura dos canais do retículo
sarcoplasmático dá-se por indução do cálcio que vem do exterior (calcium-mediuated
calcium release). O ião liga-se a calmodulina, uma proteína com baixa afinidade por
ele, tendo de haver uma alta concentração para que ligue. O complexo Ca2+calmodulina activa a proteína MLCK.
40
O fosfato inorgânico vindo de ATP vai fosforilar as cabeças, sendo esta reacção
catalizada por MLCK, isolada pelo Professor Euclides Pires. Isto equivale a introduzir
cargas negativas nas proteínas (PO43-, fosfato). A proteína modifica-se, se se fosforilar,
e adquire actividade de ATPase, que permite a contracção.
Para haver relaxamento, tudo tem de ser invertido e o cálcio tem de diminuir. O
Ca2+ tem de ser transportado para o retículo sarcoplasmático, por uma Ca2+ATPase. Há
dois processos de extruir Ca2+ do interior das célula. Um é um trocador Na+-Ca2+, nas
células nervosas, mas há também uma ATPase que transporta Ca2+ para o exterior. À
medida que o cálcio vai diminuindo, o complexo Ca2+-calmodulina vai desaparecendo e
a baixa concentração de ião faz com que não se forme o referido compelxo, deixando de
haver fosforilação, pois a MLCK vai ficar inactiva. Activa-se uma fosfatase, que retira
os grupos fosfato da cabeça da miosina. No músculo esquelético, o Ca2+ liga-se à
troponina, uma proteína diferente.
Regulação da contracção
O músculo liso existe na parede dos vasos sanguíneos. Algumas pessoas têm
uma demasiada contracção desses músculos, diminuindo o diâmetro dos vasos e
levando a hipertensão arterial (é uma das causas da hipertensão). Há medicamentos
que combatem a hipertensão arterial, pois bloqueiam os canais de Ca2+ do músculo liso.
Outros medicamentos causam a vasodilatação periférica, combatendo a hipertensão
arterial e outros combatem a angina de peito, reduzindo o espasmo das coronárias.
41
Capítulo III
- Sistema Cardiovascular e o Transporte Interno -
42
1. Constituição e funções do sistema circulatório
1.1. Componentes do sistema circulatório
O sistema circulatório envolve dois componentes: o sistema cardiovascular
propriamente dito, e o sistema linfático.
No primeiro circula o sangue, que é bombeado de forma rítmica pelo coração,
para todo o corpo.
O sistema linfático é importante para manter o volume sanguíneo, recuperando o
sangue que se perde para os tecidos. È nele que se localizam várias células do sistema
imunitário, sendo os organismos patogénicos destruídos nos nódulos linfáticos. O
organismo localiza nessa região macrófagos e linfócitos.
1.2. Funções do sistema circulatório
As funções do sistema sanguíneo são:
- transporte de substâncias, como o O2, o CO2, e nutrientes;
- a excreção;
- regulação hormonal, uma vez que e é no sangue que são transportadas as
hormonas, que vão para o tecido alvo;
- regulação da temperatura (quando há calor, há um fluxo de sangue na
superfície, para baixar a temperatura);
- é também no sangue que se localiza parte do sistema imunitário;
- quando um vaso é perfurado, há coagulação, que impede hemorragia.
1.3. Constituintes do sistema circulatório
O principal órgão do sistema circulatório é o coração, do qual partem diversos
vasos. Do ventrículo esquerdo sai a artéria aorta, que leva o sangue arterial a todo o
corpo. Do ventrículo direito sai a artéria pulmonar, que leva o sangue venoso aos
pulmões, onde se torna arterial. Depois, as veias pulmonares trazem o sangue à
aurícula esquerda e ele passa para o ventrículo esquerdo. O sangue que regressa do
corpo passa para a aurícula direita e vai para o ventrículo direito. No lado esquerdo, a
comunicação entre a aurícula e o ventrículo dá-se por uma válvula bicúspidam que tem
duas pregas, ou valvas. A comunicação entre a aurícula e o ventrículo direitos dá-se por
uma válvula tricúspida, com três pregas ou valvas. A comunicação entre os ventrículos
e as artérias dá-se por válvulas semilunares, uma aórtica e outra pulmonar.
O débito cardíaco é calculado multiplicando o ritmo cardíaco pelo volume que
é bombeado por batimento. Em regra, é cerca de 5L/min. O coração impulsiona o
sangue para o sentido pulmonar e corporal, permitindo o transporte te nutrientes.
43
2. Sangue
2.1. Constituintes do sangue
O hematócrito é a percentagem total do sangue que é ocupada por células
sanguíneas e é obtido centrifugando-se um pequeno volume de sangue num capilar
muito fino. Se o tubo for graduado ou se se medir, pode determinar-se esta entidade. O
hematócrito médio é de 45 %. Se o valor for muito inferior (30 %), pode haver algum
problema, e, como a maior parte que falta são glóbulos vermelhos, poderá ser um caso
de anemia. Entre o plasma sanguíneo, um líquido mais ou menos amarelo, e os
glóbulos vermelhos, as células mais numerosas, há uma camada buffy coat, com
glóbulos brancos e plaquetas, menos numerosos.
2.2. Células sanguíneas e plaquetas
Tipos de células e plaquetas
Os glóbulos vermelhos são células achatadas, bicôncavas, sem núcleo e com
grandes quantidades de hemoglobina. Estas células, os eritrócitos, têm como função
transportar O2 e CO2, se bem que parte do CO2 é transportada no plasma. São ainda as
células mais numerosas e duram 120 dias.
Os glóbulos brancos, ou leucócitos, são maiores e têm núcleos, mais ou menos
lobados. Estas células são menos numerosas, duram de 12 horas a 5 dias e a sua função
é de defesa. Alguns tipos de glóbulos brancos têm uma granulação, facilmente visível.
Nos neutrófilos há granulação fininha e os núcleos têm mais lóbulos à medida que
envelhecem. Estes leucócitos procedem à fagocitose e constituem 54-62 %. Os
eosinófilos têm uma grande granulação e, juntamente com os basófilos, têm núcleo
bilobado. Os primeiros constituem 1-3 % e promovem a desintoxicação e dissolução de
coágulos. Os grânulos dos segundos libertam substâncias anticoagulantes. Os linfócitos
e os monócitos são agranulócitos, isto é, não têm grânulos. Os monócitos, 3-9 %, têm
um volume de citoplasma muito maior, um núcleo reniforme e procedem à fagocitose.
Os linfócitos, 25-35 %, formam os anticorpos e participam na defesa imunológica.
As plaquetas são “farrapos” de citoplasma, importantes na coagulação
sanguínea (procedem à coagulação sanguínea).
Hematopoiese
Para se manterem as funções do sangue têm de se substituir as células que se vão
perdendo. A hematopoiese, a formação das células sanguíneas, dá-se a partir de células
estaminais que provêm do saco vitelino. No feto, a hematopoiese dá-se no fígado,
enquanto que, nos adultos, dá-se na medula dos ossos longos (tecido mielóide), onde
se originam todos os tipos de células sanguíneas. No tecido linfóide (nódulos
linfáticos, baço e timo), os linfócitos vindos do tecido mielótico sofrem maturação.
Células indiferenciadas originam, a certa altura, células comprometidas a dar
origem às células sanguíneas. No início, a partir das células ainda não comprometidas,
mas já na linha hematopoiética, diferem-se células comprometidas para várias vias e
células que originam linfócitos.
44
As células comprometidas originam, por uma via, células que formam
eritoblastos, que produzem hemoglobina e que formam reticulócitos que, por sua vez,
originam eritrócitos. Às vezes, em casos de produção acelerada de glóbulos vermelhos,
encontram-se reticulócitos, que ainda têm núcleo, em circulação. Há uma quantidade
muito grande de células da medula óssea a formar eritrócitos. A mitose é inibida por
radiação de alta energia pelo que, pessoas sujeitas a esta condição, podem sofrer de
anemia. As radiações impedem a formação do fuso mitótico, pelo que as células da
medula óssea podem ter divisões reduzidas ou não ter divisões. Para manter normal o
número de eritrócitos têm de se produzir, por segundo, 2,5 milhões.
As plaquetas derivam de megacariócitos, que libertam pedaços de citoplasma
que formam as plaquetas sanguíneas.
A hematopoiese divide-se em eritropoiese e linfopoiese. A eritropoetina é
produzida pelos rins e vai para o sangue em (com) maior ou menor concentração, em
resposta ao grau de distribuição do oxigénio no tecido daquele órgão. Quando o sangue
circula no tecido renal, há células no rim que detectam uma diminuição de O2 nas
células. O rim detecta a falta de O2, que pode corresponder a uma diminuição dos
glóbulos vermelhos. Na medula óssea, a eritropoieina leva à produção de eritrócitos. Os
proeritroblastos têm receptores para a eritropoietina, e aumenta-se a produção de
eritrócitos, aumentando-se a capacidade do sangue para transportar oxigénio, pelo que
se volta ao normal. Os receptores de eritropoietina nos proeritroblastos é que levam à
sua diferenciação. Cada vez que há níveis baixos de O2, há maior produção de
eritropoietina. Na leucopoiese, há citocinas com receptores nas células correspondentes
e o processo é semelhante.
2.3. Plasma sanguíneo
Constituição do plasma sanguíneo
O plasma sanguíneo é fundamentalmente constituído por água, iões, moléculas
orgânicas, como aminoácidos, gases e outros elementos. Parte da quantidade de gases
vai para os glóbulos vermelhos e outra parte vai para o plasma. As proteínas mais
importantes são a albumina, as globulinas e o fibrinogénio. A ____ é a proteína mais
abundante e contribui para a osmolaridade, enquanto as globulinas se dividem em α, β
e γ, sendo que as últimas constituem os anticorpos. Os principais produtos do
metabolismo são a ureia, o ácido úrico e a bilirrubina, relacionada com a bílis e que,
depois das refeições, vai ser degradada no tubo digestivo. Os principais sais têm os iões
sódio, bicarbonato, cobre e potássio, que estão em solução no plasma.
Osmolaridade do plasma
Os sais e as proteínas contribuem para a osmolaridade, que deve ser regulada,
pois, caso contrário, as células mudam de volume. O NaCl é o sal que mais contribui
para a osmolaridade.
Plasma ≈ 150 mM NaCl
150 mM Na+ + 150 Cl300 mOsm
45
Considerando apenas o NaCl, a mais importante molécula no que respeita à
osmolaridade, esta grandeza é de 300 mOsm. Devem contabilizar-se também os outros
sais e as proteínas.
A osmolaridade dos glóbulos vermelhos é semelhante à do plasma, embora as
contribuições sejam diferentes. Deve haver um equilíbrio na osmolaridade pois, de outra
forma, pode haver mudanças indesejáveis no volume dos glóbulos vermelhos, por trocas
de água. Se a diferença de osmolaridade não for grande, a forma bicôncava dos glóbulos
vermelhos permite que eles absorvam alguma água, tornando-se esféricos. Se a
diferença for grande e a absorção de água intensa, há hemólise, isto é, rebentamento das
células. Se os glóbulos vermelhos estiverem no final da vida, próximos dos 120 dias, há
fragilidade da membrana, que tem maior facilidade de ruptura.
2.4. Hemostase
Processos evolvidos no estacamento de sangue
Quando ocorre um corte de um vaso, perde-se algum sangue, mas desenvolvemse mecanismos para estancar esta perda. Os mecanismos responsáveis constituem a
hemostase. O primeiro mecanismo é a vasoconstrição, pelo qual o fluxo sanguíneo é
reduzido, na zona traumatizada. Pode dever-se a reflexo nervoso ou a factores libertados
localmente. Forma-se depois um tampão plaquetário, composto pelas plaquetas que
acorrem e que impede a perda de sangue. Depois começa a ocorrer a coagulação, o
mecanismo mais importante, formando-se um coágulo que impede a perda de mais
sangue.
Formação do tampão plaquetário
Quando ocorre um corte as plaquetas começam a agregar-se na zona do corte, e
o que as atrai são as fibras de colagénio que ficam expostas aquando do sucedido.
Essas plaquetas vão libertar factores que atraem novas plaquetas, formando-se, por fim,
o tampão plaquetário.
A aspirina é um anticoagulante que inibe a libertação de alguns destes factores
pelas plaquetas. As pessoas idosas, sujeitas a coágulos mesmo sem haver cortes, podem
tomar aspirina em doses baixas, para impedir que esses coágulos se formem. No período
menstrual, a aspirina pode aumenta a perda de sangue, pelo eu não deve ser tomada.
Coagulação sanguínea e vias intrínseca e extrínseca
A coagulação consiste na formação de um coágulo de fibrina, que se forma a
partir do fibrinogénio. Este composto é uma proteína que ocorre no sangue e que não
coagula normalmente. Se houver corte do vaso sanguíneo, desencadeia-se um conjunto
de processos que conduzem à conversão do fibrinogénio em fibrina. O fibrinogénio é
uma proteína solúvel no plasma, __ esférica, enquanto a fibrina é uma fibra, resultante
da polimerização do fibrinogénio, após alteração da estrutura. As fibras que se agregam
formam o coágulo.
A primeira proteína a ser activada é o factor XII (uma das proteínas que não foi
referida), que, nessa situação, adquire actividade de protease. Ela vai clivar o factor
factor XI (actuando por proteólise), que cliva o factor IX. Há, assim, uma cascata de
activação por proteólise, em que esses factores, quando estão activos, adquirem
46
actividade proteolítica. Para serem activados por proteólise, há quebra de uma ou mais
ligações peptídicas. O cálcio permite a reacção de activação dos diversos factores, à
medida que são activados em cascata. O factor VIII não é uma enzima proteolítica,
embora seja necessário para a activação do factor X. Na hemofilia não há produção de
factor VIII, necessário à activação do facto X. Para se o activar, é necessário factor VIII,
cálcio e fosfolípidos. Quando o factor X fica activo, adquire actividade proteolítica e
actua sobre uma proteína plasmática, a protrombina, que origina trombina. A
trombina converte o fibrinogénio em fibrina; é, também, uma enzima proteolítica, que
actua sobre o fibrinogénio do plasma, que deixa de ser solúvel e polimeriza. Para se
activar a trombina é necessário cálcio, fosfolípidos e _____. A fibrina é estabilizada
pelo factor XIII (o último a ser descoberto), que é activado pela trombina, também.
Todos estes factores existem no plasma, mas só depois de o colagénio activar o factor
XII é que se dá a cascata. Esta é a chamada via intrínseca da coagulação sanguínea.
Certos traumatismos podem levar ao rebentamento interno de vasos, que perdem
sangue para os tecidos. Há factores que podem activar um factor III, que activa o
factor VII. Estes dois podem activar o factor IX, da mesma forma que o XI, e, depois, a
via é a mesma. Esta via é designada da via extrínseca.
As enzimas não se gastam na reacção, pelo que cada uma delas activa várias
outras, levando-se à formação de um coágulo rapidamente. Certas enzimas, como
enzimas digestivas pancreáticas, são libertadas na forma de zimogénios e activadas por
proteólise. Os zimogénios são cadeias proteicas que, quando são clivadas, por
proteólise, se tornam em enzimas activas.
Em resumo, os factores são:
Factor I – Fibrinogénio
Factor II – Protrombina
Factor III – Factor tecidual; tromboplastina
Factor IV – Cálcio
Factor V – Proacelarina
Factor VII – Proconvertina
Factor VIII – Factor anti-hemofílico
Factor IX – Componente da tromboplastina plasmática; factor Christmas
Factor X – Factor Stuart
Factor XI – Antecendente da tromboplastina plasmática
Factor XII – Factor Hageman
Factor XIII – Factor estabilizador da fibrina
Estas proteínas são sintetizadas no fígado e libertadas no sangue.
Dissolução do coágulo
O coágulo tem de dissolver, depois da sua função estar cumprida. A sua
dissolução designa-se de fibrinólise e, no processo, as fibras são fragmentadas em
fragmentos cada vez mais pequenos. A activação do plasminogénio para plasmina, que
cliva as fibras, depende da ocorrência de fibrina activa. A trombina activa a plasmina,
que fragmenta as fibras de fibrina, mas o efeito da trombina é mais rápido na activação
do fibrinogénio do que na activação do plasminogénio. O coágulo pode ter aprisionadas
várias moléculas de plasminogénio; rapidamente forma-se o coágulo, que aprisiona
plasminogénio. O coágulo dissolve-se de dentro para fora.
47
Anticoagulantes
Há substâncias que se administram para evitar a formação de coágulos, que na
medicina quer na culinária. Todas as substâncias que ligam cálcio impedem a
coagulação; o sumo de limão, com ácido cítrico, liga cálcio, e o vinagre tem o mesmo
efeito. Todos os quelantes de cálcio, substâncias que ligam cálcio, como EDTA, usado
em laboratório para regular a concentração do ião, e citrato de sódio, por exemplo,
impedem a coagulação.
A heparina, aparentemente, activa a antitrombina III, que impede a actividade
da trombina.
A cumarina ou cumarol é um medicamento que é administrado a pessoas que
têm níveis de coagulação maiores que o normal. Para impedir a formação de coágulos,
tomam-se estas substâncias, que impedem a síntese de vitamina k no fígado, o que
impede a síntese de factores de coagulação.
Anomalias da coagulação sanguínea
A hemofilia é uma deficiência hereditária na produção do factor VIII.
Antigamente o tratamento da hemofilia fazia-se por transfusão de plasma com factor
VIII, mas os perigos de contágio com hepatite ou SIDA levaram a que isto não fosse
efectuado. Actualmente usa-se o factor VIII recombinante, produzindo-se esse factor em
bactérias.
Deficiência de vitamina K leva a uma formação inadequada do mesmo factor.
48
3. Coração
3.1. Anatomia do coração
…
3.2. Ciclo cardíaco
…
3.3. Actividade eléctrica do coração e sua contracção
Tipos de células cardíacas
As células miocardiais localizam-se nas aurículas e nos ventrículos, e
apresentam função de contracção e de geração de força. (/)
As células marcadoras do ritmo cardíaco ou pacemaker formam dois nódulos
excitáveis, o sinoauricular (AS) e o atrioventricular (AV). As células pacemaker
fazem parte da parede da aurícula direita, junto da comunicação com a veia cava.
Estas células, normalmente as do nódulo sinoauricular, desenvolvem potencial de
acção, desencadeando contracção, e também podem alterar o ritmo cardíaco.
As células condutoras conduzem o potencial de acção; transmitem, propagam,
rapidamente os potenciais de acção, coordenando a contracção. Elas permitem propagar
o potencial de acção, permitindo a contracção das aurículas e dos ventrículos, e
localizam-se no feixe de His, nas fibras de Purkinje e nas fibras auriculares. O feixe
de His ramifica-se em dois ramos, esquerdo e direito, estendendo-se, cada um, para um
ventrículo. As fibras terminais chamam-se fibras de Purkinje.
Sistema condutor cardíaco
Toda a actividade eléctrica se vai gerar na parede do coração. O nódulo
sinodoauricular, da aurícula direita, tem tecido excitável, que comunica o sinal
eléctrico aos ventrículos. Nas válvulas não há geração nem propagação de potencial de
acção.
Quando se gera um potencial no nódulo sinoauricular, o potencial propaga-se
rapidamente pelas aurículas, através das gap junctions. O único ponto onde os
potenciais de acção podem passar para os ventrículos é o feixe (a fibra) de His, onde
convergem os potenciais de acção das aurículas, pois através das válvulas não há
passagem de potencial de acção. O sangue que chega ao coração, aquando da
concentração das aurículas passa para os ventrículos, e, quando estes contraem, o
sangue vai pela aorta para todo o corpo e pela artéria pulmonar para os pulmões.
Ritmo de batimento do nódulo sinoauricular
Se se isolar um coração de uma rã e se ele for colocado numa solução nutritiva,
ele mantém-se em batimento durante muito tempo. A contracção é iniciada no nódulo
49
sinoauricular e é propagado para todo o coração. O ritmo é que pode ser alterado. Se se
cortar o coração, separando os ventrículos, as aurículas e o seio venoso, correspondente
ao nódulo sinoauricular, as estruturas continuam a bater. No entanto, o ritmo das
aurículas é mais baixo e o dos ventrículos ainda mais.
Isto acontece porque o ritmo das células do nódulo sinoauricular é maior que o
das restantes células e impõem-se ao delas, propagando-se por gap juntions. Todas as
células, incluindo as miocardeais, são excitáveis, mas o ritmo do nódulo sinoauricular
comanda. O ritmo que se mede é o do nódulo sinoauricular, e não o eventual ritmo dos
ventrículos, menor. Se o ritmo estiver muito elevado, há fármacos que actuam no
nódulo sinoauricular e que o baixam.
Potencial pacemaker
O potencial de repouso (ritmo) normal é de 70 mV, mas, nas células pacemaker,
existe um potencial de repouso instável (estável). Depois da repolarização, há uma
despolarização linear, e depois gera-se um novo potencial de acção. As células não
têm um potencial de repouso estável, desenvolvendo-se, continuamente, potenciais de
acção. A despolarização linear pode chamar-se potencial pacemaker. Primeiro há o
potencial pacemaker, depois o potencial de acção, com repolarização, e, de novo,
despolarização lenta.
A despolarização lenta não requer enervação. Nesta fase, os canais de cálcio
(Ca2+) T activam lentamente, e quando se atinge o valor linear de potencial de
membrana, gera-se o potencial de acção, com activação dos canais de cálcio (Ca2+) L
(longlasting), que ficam activados durante mais tempo. Os canais L são activados pela
despolarização causada pela entrada de Ca2+ através dos canais T. São esses canais de
cálcio, L, (/) que conduzem à geração de potencial de acção. Eles mantêm-se abertos
durante algum tempo, havendo um plateau de despolarização. Quando os canais L
fecham e os canais de sódio (K+) abrem ocorre a repolarização. O fecho dos canais de
sódio e a abertura dos canais de Ca2+ do tipo T conduz à formação do potencial
pacemaker.
Nestas células, as células do nódulo sinoauricular, ao contrário das células
nervosas, não há canais de sódio, mas estes canais de cálcio. Estas células são especiais
por possuírem estes canais. Elas têm um ritmo próprio devido à alteração rítmica da
permeabilidade.
Potencial de acção nas células miocardiais
As células miocardiais têm potencial de repouso estável e canais de sódio (Na+).
Quando se atinge um valor linear de despolarização, os canais de sódio sensíveis à
voltagem abrem, levando a uma grande e rápida despolarização. Estas células também
têm canais de Ca2+ L, pelo que as células se mantêm durante algum tempo
despolarizadas, devido à entrada continuada de Ca2+. Mais tarde ocorre a entrada de K+
através de canais, levando à repolarização e ao restabelecimento do potencial de
repouso, que se mantém até outro estímulo. Se não houver excitação, há de novo
despolarização mais tarde, mas o processo não é muito claro.
50
Como as células pacemaker provocam um ritmo mais elevado, o ritmo destas
células é igualmente elevado.
Durante os primeiros 200 ms do potencial de acção, há um período refractário
absoluto, em que não se gera um novo potencial de acção. Daí até aos 250 ms, há um
período refractário relativo, em que já se pode desenvolver um novo potencial. Após
esse período atinge o potencial de repouso e, pouco depois, o relaxamento. Isto permite
que, no caso do ventrículo, ele contraia e, depois, se encha de sangue. Isto permite que o
ventrículo se encha de sangue antes da contracção e impede a tetanização do coração.
A demora dos potencias de acção ao nível do nódulo aurículo-ventricular leva
a que os ventrículos só contraiam depois de receberam o sangue vindo das aurículas.
Isto permite que os ventrículos contraiam maximamente cheias de sangue.
Os potenciais de acção espalham-se rapidamente por todo o coração, havendo
uma contracção quase simultânea de todas as células dos ventrículos.
Electrocardiogrma
A onda P do electrocardiograma é devida às aurículas, isto é, corresponde ao
somatório da despolarização das aurículas. A demora deve-se ao nódulo
auriculoventicular e as ondas Q, R e S devem-se aos ventrículos, isto é, correspondem
ao somatório da despolarização dos dois ventrículos. Há, depois, uma fase de repouso.
A onda T, que ocorre mais tarde, é relativa à repolarização dos ventrículos
(despolarização).
Com o electrocardiograma não se registam alterações de potencial reais, mas
alterações relativas. Por isso se mede também a repolarização. A repolarização das
aurículas coincide com as ondas Q, R, e S e não se distingue.
Desde o pico da onda R ao pico da onda T há a sístole, com aumento de pressão
no interior dos ventrículos e uma diminuição no final (_________). Depois do pico da
onda T, a pressão diminui ainda mais.
Sons cardíacos
O primeiro som cardíaco é causado pelo fecho das válvulas aurículoventriculares, no início da geração de pressão dentro dos ventrículos. Depois continua
o aumento da pressão dentro dos ventrículos, e, a certa altura, abre a válvula aórtica,
devido á pressão que se desenvolveu. De seguida a pressão diminui _____ o
relaxamento e a válvula fecha, registando-se o segundo som cardíaco. As pregas da
válvula vibram, emitindo o som.
Há um terceiro som, inaudível com os estetoscópios normais, que ocorre na
diástole, numa altura em que as aurículas já armazenaram muito sangue, as válvulas
aurículo-venticulares abrem e o sangue desliza, causando uma vibração. Este som só é
audível com estetoscópios especiais.
51
4. Vasos sanguíneos
4.1. Tipos de vasos e sua estrutura
Tipos de vasos
A aorta é o vaso de maior calibre e é também aquele que tem uma parede mais
espessa. Ela ramifica-se em artérias mais finas, com paredes menos espessas e menor
diâmetro. Estas ramificam-se em arteríolas, e estas em capilares, que se reúnem em
vénulas. Estas reúnem-se em veias e todas estas se reúnem na veia cava.
Estrutura e constituição dos vasos
As artérias grandes, em espessura, têm uma camada mais interna, o endotélio,
com apenas uma camada de células, que, juntamente com o tecido elástico, forma a
túnica interna das artérias. Externamente há a túnica média, de tecido muscular, e,
externamente a esta, a túnica externa, de tecido conjuntivo. Nas artérias de menor
espessura, as camadas são menos espessas, nomeadamente a muscular. Nas arteríolas
há menos camadas de tecidos, mas também há endotélio. Se as artérias estão contraídas
têm pouco sangue; se estão dilatadas aumenta o fluxo de sangue. A contracção e
distensão são relativas ao músculo liso.
Os capilares têm apenas endotélio, formado por uma única camada de células,
que podem estar (ser) completamente encostadas, ou ter poros intecelulares. Este último
caso é relativo aos capilares fenestrados. Só há trocas com os tecidos ao nível dos
capilares. Há esfíncteres pré-capilares que, se estiverem contraídos, impedem o fluxo
de sangue para os capilares. Entre as artérias e as veias há ligações arterio-venosas, em
que o sangue passa das primeiras para as segundas directamente, se o esfíncter estiver
contraído. Isto permite desviar o sangue para onde ele é necessário, por exemplo, no
exercício.
As vénulas, não têm camada muscular, que já ocorre nas veias de maior calibre.
As veias de calibre médio e grande têm túnica externa, média e interna, com
endotélio. As vénulas e as veias têm válvulas que impedem o refluxo de sangue. O
sangue, devido à gravidade, tem tendência a ir para baixo, mas, no entanto, nas veias,
não passa para traz, devido às válvulas, que fecham. A presença destas válvulas,
juntamente com a contracção dos músculos, leva ao retorno do sangue ao coração. A
contracção muscular auxilia no retorno o sangue ao coração.
4.2. Arterosclerose
Arterosclerose e problemas relacionados
A arterosclerose é uma forma de arterioesclerose (esclerose significa morte de
alguma parte) em que se formam placas. Contribui para a morte por acidente vascular
cerebral, se estas placas se localizarem em artérias do cérebro, dificultando a irrigação
sanguínea, ou, se se localizarem nas coronárias, podem levar a enfarte do miocárdio,
por falta de irrigação. É uma doença muito grave, responsável por 50 % das mortes por
AVC ou enfarte do miocárdio.
52
A doença é causada por placas, ateromas, formados por células cheias de
gordura. Quando há ruptura, há derrames e formam-se coágulos, dificultando a
irrigação. As células de gordura acumulam-se por baixo do endotélio, isto é, no
interior dos vasos, entre o endotélio e o tecido muscular. Quando maior for a placa,
maior a obstrução. Por vezes há ulceração por detrás do endotélio e activam-se os
factores de coagulação, podendo iniciar-se um coágulo que obstrui o fluxo sanguíneo.
Se a obstrução ocorrer no cérebro há risco de AVC, enquanto que, se ocorrer nas
coronárias, há risco de enfarte.
Factores de risco
Os factores de risco são vários. O primeiro é presença de colesterol em
concentração acima do normal: quanto mais colesterol houver, maior a probabilidade de
se formarem as placas. A hipertensão, o fumo do tabaco, a inflamação do endotélio
dos vasos, a diabetes (concentração de glicose em níveis elevados) e o sedentarismo
também são factores.
Lipoproteínas e transporte de colesterol
O colesterol e outras gorduras são transportados sob a forma de lipoproteínas.
A LDL (low density lipoproteins) são as maiores, enquanto as HDL (high density
lipoproteins) são as menores. Na periferia há o colesterol e no centro os triglicerídeos e
colesterol na forma de éster. Há volta há fosfolípidos, com as partes polares na
superfície, e há também uma parte proteíca.
Estas lipoproteínas formam-se e transportam as gorduras no sangue. São lá
transportadas pois têm a parte polar à superfície, que é, portanto, hidrofílica. As
lipoproteínas são todas sintetizadas no fígado, pelo qual as gorduras passam, embora
sejam absorvidas no fígado.
As LDL têm uma razão lípidos / proteínas grande, pelo que são leves apesar de
serem grandes. Estas (As) partículas lipoproteicas têm apoproteína B. As partículas
mais pequenas têm menor proporção lípidos / proteínas, pois, apesar de mais pequenas,
têm mais proteínas, sendo mais pesadas.
As LDL são consideradas o “mau colesterol”, enquanto as HDL são o “bom
colesterol”. Tudo se deve à diferença proteica. Nas LDL há apoproteína B, e nas HDL
há apoproteína A. Para a apoproteína A não há moléculas que a ligam na parede dos
vasos, enquanto que, para a B, há. Assim, as LDL passam para fora do endotélio e
concentram-se lá.
Mecanismo de génese da arterosclerose
Na formação de ateromas participam LDL, mas também (outras) células.
Participam monócitos que se localizam na parede dos vasos, mas não aderem à
superfície do endotélio, normalmente. Quando há inflamação, as células do endotélio
passam a expressar, na superfície, proteínas de adesão, que fazem com que os
monócitos adiram à superfície desta camada. Se os monócitos aderirem, facilmente
penetram por diapdese a parede do vaso e vêm para a região subendotelial.
Nesta região, e geralmente devido à inflamação da parede do vaso, podem existir
células do sistema imunitário atraídas para esta região, linfócitos T, que levam à
diferenciação dos monócitos em macrófagos, por libertação de citocinas. Estes passam
a expressar receptores escavadores (scavenger), que ligam as LDL. Os macrófagos
53
têm receptores scavenger para as LDL e estes receptores só passam a ser expressos após
a diferenciação destas células. Nessa altura, o gene que codifica os receptores passa a
ser expresso. Os macrófagos internalizam as LDL, formando células cheias de gordura,
células derivados de monócitos, cheias dessas partículas. Os macrófagos, após
fagocitarem os LDL, transformam-se em foam cells (“células espumosas”) e isto leva à
formação do ateroma, que pode interromper o fluxo de sangue.
Por vezes, as células musculares abaixo da íntima, onde ocorre o processo visto,
também vão para a íntima e tomam partículas LDL. No estado adulto não há aumento
do número de células musculares mas, em inflamação, isto pode ocorrer. As células
musculares expressam os receptores e podem contribuir para a formação das células de
gordura.
As células do endotélio, para além de expressarem partículas de adesão, podem,
elas próprias, produzir citocinas e factores de crescimento, que contribuem para a
diferenciação de macrófagos e, portanto, para a formação de ateromas. Há, portanto,
uma alteração da expressão genética.
A expressão genética pode também ser alterada em resposta à concentração de
colesterol, ou de outros lípidos, como triglicerídeos. Nas LDL há colesterol e
triglicerídos. Os lípidos que fazem parte das partículas LDL podem sofrer oxidação e só
nesse estado têm maior influência nas células do endotélio. Um dos factores que oxida
os lípidos das LDL no plasma são certos compostos do fumo do tabaco. Por isso é que
o tabaco é um factor de risco.
Uma forma de combater o colesterol alto é consumir fármacos que reduzem a
expressão dos receptores scavenger. Deve também fazer-se exercício e ter uma
alimentação em que se ingerem poucas gorduras.
Avaliação do risco
Há uma proteína que é produzida no fígado sempre que há uma inflamação, a
proteína C reactiva (PCR). Para determinar se uma pessoa tem risco de arterosclerose
avalia-se também o colesterol total/HDL (HDL são as partículas que não passam para
fora dos vasos). Quando menor for a inflamação, medida pela PCR, e os níveis de
colesterol, menor o risco. Deve, portanto, manter-se os níveis de lípidos normais e
combater as doenças que levam à inflamação dos vasos.
Isquémia do miocárido
A arterosclerose de uma coronária pode levar à isquémia de parte das células
musculares, isto é, um enfarte. Numa pessoa que sofre um enfarte é efectuado um
electrocardiograma, que permite avaliar a zona que foi afectada. Podem também
analisar-se, no plasma do doente, proteínas libertadas pelas células mortas. Procura-se
logo combater esta situação e estabilizar o doente, fornecendo vasodilatadores. Se os
casos não forem graves, é possível recuperar, mas o mesmo não acontece se a situação
for grave.
Quando há um trombo muito desenvolvido, o que se faz é recuperar o fluxo
sanguíneo, na parte ____. Fazem-se bypasses coronários, o que consiste em colocar
artérias no coração, que permitem a passagem de sangue da aorta para os músculos. As
artérias que são colocadas são retiradas da própria pessoa. À volta da zona obstruída há
angiogénese. Também se pode procurar desobstruir os vasos com cateteres.
54
5. Sistema linfático
5.1. Constituição do sistema linfático
Outro sistema importante de vasos, onde circula líquido, é o sistema linfático,
que é formado pelos vasos linfáticos, que se distribuem por todo o corpo. Os capilares
(vasos) linfáticos ocorrem junto dos capilares e reúnem-se em vasos maiores. Há
nódulos na região cervical, no pescoço e em torno das glândulas mamárias.
5.2. Funções do sistema linfático
O sistema linfático tem várias funções, a mais importante das quais é retomar o
excesso de líquido que passa para os tecidos e não volta para o sangue. Os vasos
linfáticos que percorrem todo o organismo absorvem o líquido em excesso e juntam-no
de novo ao sangue. Os vasos linfáticos da parede do intestino são importantes, pois é
para eles que se absorvem as gorduras (os alimentos). A linfa vai ser restabelecida ao
sangue principalmente ao nível da veia cava superior.
Nos nódulos linfáticos há células fagocitárias que limpam a linfa de bactérias e
outros agentes patogénicos dos tecidos. Nesses nódulos, onde a linfa circula, é possível
destruir agentes patogénicos ante dela ser canalizada para os vasos e ser lançada para a
corrente sanguínea.
55
6. Regulação da circulação
6.1. Regulação do débito cardíaco
Factores que afectam o débito cardíaco
No que respeita à regulação do débito cardíaco, isto é, o volume de sangue
lançado por minuto na circulação, ele pode ser alterado através da regulação do ritmo e
através da regulação do débito sistólico. O débito cardíaco depende, então, do ritmo
cardíaco, isto é, o número de vezes que o coração contrai, e o volume de sangue que é
lançado.
Controlo nervoso do débito cardíaco
A regulação do ritmo cardíaco, independente da vontade, é provocada pelo
sistema nervoso autónomo, simpático e parassimpático. O primeiro, os nervos
simpáticos com ramificações __ __, aumenta o ritmo cardíaco e o débito sistólico,
afectando a força da contracção, enquanto o segundo diminui o ritmo cardíaco. O grau
de contracção depende do enchimento dos ventrículos.
O ritmo cardíaco é determinado pelo ritmo das células do nódulo sinoauricular
(aurículo-ventricular), as células pacemaker. Numa situação em que o sistema nervoso
autónomo não está a actuar, as células do nódulo geram potencia se acção a um dado
ritmo. Quando os nervos simpáticos estão activos, aumenta o número de potenciais de
acção por unidade de tempo. Se o parassimpático estiver activo, o número de potenciais
de acção diminui. As diferenças estão na despolarização até ao limiar, ou antes, as
diferenças estão nos canais de sódio responsáveis pela despolarização até ao limiar.
Os neurotransmissores libertados nos terminais do coração destes dois sistemas
são diferentes: no simpático é a noradrenalina e no parassimpático é a acetilcolina.
Efeito do sistema nervoso parassimpático
Numa célula do nódulo sinoauricular, a acetilcolina liga-se a receptores
muscarínicos, associados a proteínas G. As subunidedes β e γ destas proteínas
dissociam-se e ligam-se a canais de potássio, que abrem, saindo o catião. A entrada de
cálcio que leva á despolarização é atrasada., ocorre mais lentamente, devido à saída de
potássio. Assim, a acetilcolina, por intermédio dos receptores muscarínicos, mantém os
canais de K+ abertos, e isto diminui o ritmo cardíaco, diminuindo a excitabilidade das
células do coração.
O sistema parassimpático diminui muito o ritmo cardíaco (/) quando se recebe
uma má notícia, o que pode levar a desmaios. A adrenalina, com efeito semelhante ao
da noradrenalina, pode ser administrada para contrariar isso.
Efeito do sistema nervoso simpático
Quando a noradrenalina se liga aos seus receptores nas células pacemaker,
também há activação de proteínas G, mas, desta feita, são as subunidades α que se
libertam, ligando-se à adenilato ciclase, que produz AMP cíclico a partir de ATP. O
AMPc activa uma cinase, que abre canais iónicos. Os iões vão entrar de acordo com os
56
gradientes respectivos: o K+ sai e o Ca2+ entra. Os canais de cálcio T activam mais
rapidamente, pelo que o ritmo aumenta.
Estes efeitos ocorrem ao nível do nódulo sinoauricular, mas também há
ramificações do sistema nervoso simpático para os ventrículos. A noradrenalina,
nestas células, leva à entrada de cálcio vindo do exterior e do retículo
sarcoplasmático, as duas fontes deste ião.
A hormona aumenta a actividade dos canais de cálcio, pelo que, na sua
presença, ocorre uma maior despolarização. O maior influxo de cálcio aumenta a
despolarização durante esse fenómeno. Geralmente não dura mais tempo.
A activação do sistema nervoso simpático tem dois efeitos: o aumento do ritmo e
o aumento da força da contracção. No nódulo sinoauricular, os canais de cálcio são
diferentes (T). Contracções mais fortes aumentam o volume de sangue expulso, o
débito sistólico, e, portanto, o débito cardíaco.
Efeito de Frank-Starling
Os comprimentos dos sarcómeros que levam à variação da força contractiva
são relativos a repouso. Na contracção seguinte, a formação de pontes variará com o
comprimento da célula. O volume de sangue que o coração contém define o
comprimento de repouso.
O efeito de Frank-Starling explica a relação entre o comprimento das células e
a força contractiva. Se o volume se sangue for baixo, está ____ ____, mas há zonas
indisponíveis, devido ao comprimento demasiadamente pequeno dos sarcómeros.
Sarcómeros maiores, que formam um maior número de pontes, levam a uma contracção
maior (este será o valor máximo da contracção). O aumento do sarcómero torna certas
partes indisponíveis, o que leva a uma menor formação de pontes. A partir deste
comprimento, o aumento do volume veria contraproducente, e a contracção seria cada
vez menor. Se o volume de sangue for grande, a distensão das células pode levar a que
não haja formação de pontes, ou, pelo menos, de muitas pontes.
57
Comprimento dos sarcómeros
(volume de sangue armazenado
na diástole)
A força contractiva aumenta com o aumento do volume de sangue armazenado,
até certo ponto, em que a contracção começa a diminuir. Esta é a lei de Frank-Starling.
O comprimento dos sarcómeros no músculo cardíaco depende do volume de sangue que
regressa na diástole, sendo ele um músculo fechado e extensível.
Para se formarem pontes é necessário disponibilidade de pontes, e cálcio, para se
estabelecerem as pontes. O sistema nervoso simpático, que aumenta os níveis de cálcio,
facilita a formação de pontes. Em exercício, esse sistema é activado.
6.2. Regulação do volume de sangue
Factores que afectam o retorno venoso e o volume de sangue diastólico
Há vários factores que determinam o volume de sangue diastólico no coração.
Ele depende do sangue que regressa pelas veias cavas e pelas veias pulmonares, do
volume de líquidos eliminado pela urina ou pelo suor, e do volume de líquido retido
nos tecidos.
Outros parâmetros que afectam o retorno venoso é o ritmo da respiração e a
sua profundidade. Quando se inspira, a caixa torácica aumenta de volume, e, antes de
entrar ar nos pulmões, cria-se um vácuo temporário. Como o coração está na caixa
torácica, a pressão negativa “aspira” o sangue, facilitando o retorno venoso.
Outro parâmetro que afecta o retorno venoso relaciona-se com a pressão do
sangue nas veias, a pressão venosa. A contracção dos músculos esqueléticos aumenta
o retorno venoso, empurrando (fazendo empurrar) o sangue no sentido do coração.
Quando há estimulação do sistema nervoso simpático, há uma venoconstrição, que
facilita o retorno do sangue ao coração.
Todos estes factores afectam o volume de sangue no coração em diástole e,
portanto, afectam a sístole.
Troca de líquido entre os capilares e os tecidos
A pressão que o sangue traz quando chega aos capilares faz com que parte do
líquido saia por poros. A saída de líquido nos capilares é cada vez mais baixa, à medida
que os capilares se tornam vénulas. Esse líquido tem tendência para voltar para os
capilares e a intensidade da retoma vai aumentando com a chegada à vénulas.
A pressão dentro dos vasos é menor.
58
O plasma tem de 6 a 7 % de proteínas que não saem para fora do vaso. As
proteínas plasmáticas que existem nos capilares formam uma pressão osmótica
coloidal, pelo que a água tem tendência a entrar, devido a essa pressão. Essa tendência
manifesta-se mais onde não há pressão nos capilares. A pressão osmótica coloidal tem
mais efeito onde a pressão do sangue não é tão grande, isto é, perto das vénulas. Cerca
de 90% do líquido é retomado deste modo, e apenas 70% volta pelo sistema linfático.
6.3. Regulação do fluxo de sangue nos vasos
Factores que afectam o fluxo de sangue
O fluxo nos vasos é dado pelo volume de sangue que passa por unidade de
tempo (unidade) numa secção do vaso. Varia com a diferença de pressão entre as
extremedidades, aumentando com o aumento da pressão, e diminui com o aumento da
resistência, que é tanto maior quanto maior o comprimento dos vasos e a viscosidade
do sangue. Quanto maior o raio do vaso, menor a resistência.
Duplicando o raio, o fluxo é 16 vezes maior. Em vasos mais largos, menor a
percentagem de sangue que interage com a parede e sofre o seu atrito. O raio é o factor
que mais influencia a resistência e o fluxo de sangue.
Pressão sanguínea e velocidade do sangue ao longo dos vasos da circulação
sistémica
A pressão à saída do ventrículo esquerdo varia entre 120 e 80 mmHg, na sístole
e na diástole. No momento de retorno ao coração, a pressão é 0. À medida que o sangue
se afasta do coração e das grandes artérias, diminui a pressão. Na sequência arteríolascapilares-vénulas __ ____ a pressão diminui.
Os capilares são vasos pequenos, pelo que a soma da secção de todos os vasos
mostra que essa entidade é máxima nos capilares. Por este motivo, quando o sangue
passa para os capilares, fica distribuído por uma área de secção maior, o que vai
influenciar a velocidade do sangue nessas regiões. A velocidade linear do sangue nos
capilares será muito baixa. na aorta é alta, 30 cm/seg, nas arteríolas é de 1,5 cm/seg e
nos capilares 0,4 mm/seg. Nas vénulas a velocidade aumenta para 5,0 mm/seg e nas
veias para 3cm/seg. O sangue permanece nos capilares muito tempo, o que permite um
troca eficiente entre ele e os tecidos.
6.4. Barorreceptores
Os barorreceptores são receptores que interpretam a pressão e respondem-lhe
gerando potenciais de acção cuja frequência é tanto maior, quanto maior a pressão.
Esses potenciais são encaminhados para o centro cardiovascular do bolbo
raquidiano. Se a pressão for alta, o sistema nervoso responde de forma diminuir o
ritmo cardíaco.
59
Capítulo IV
- Troca de Gases e Equilíbrio Ácido-Base -
60
1. Constituição do sistema respiratório
1.1. Zona conductora
…
1.2. Zona respiratória
…
Alvéolos pulmonares
…
Os alvéolos têm células do tipo I e células do tipo II Em alguns casos há
macrófagos, células do sistema imunitário que fagocitam microrganismos.
Entre os capilares e os alvéolos dão-se as trocas de gases. Os gases, devido à
sua natureza, exercem uma pressão, e o total dos gases exerce uma pressão total. O O2
vai difundir dos alvéolos para os vasos sanguíneos, de acordo com a sua pressão
parcial. O O2 difunde de acordo com o gradiente de pressão parcial. O CO2 tem uma
pressão parcial maior nos capilares, difundindo, de acordo com gradiente, para os
alvéolos.
Depois do revestimento dos alvéolos há uma membrana respiratória, muito
fina, e, logo depois, o endotélio. Ela permite que haja um equilíbrio de pressões parciais
e é por lá que os gases se difundem.
As células alveolares do tipo II projectam-se para o interior e produzem um
surfatante pulmonar, composto por lípidos e proteínas, que reveste internamente os
alvéolos pulmonares. Ele reduz a tensão superficial da água que reveste internamente
os alvéolos, tensão essa que influencia a pressão dos gases no alvéolo. De acordo com a
Lei de Laplace, a pressão criada pela tensão superficial é directamente proporcional à
tensão superficial e inversamente proporcional ao raio do alvéolo. Isto significa que os
alvéolos de menor tamanho geram sobre o ar uma maior pressão (o denominador, o raio,
é menor). Quando se quer fazer sair ar dos álveolos, o volume dos pulmões diminui.
Como o tecido é elástico, os alvéolos também diminuem de volume e o ar é libertado
dessas estruturas. Pode haver o perigo de o ar ir para alvéolos maiores e os pequenos
alvéolos colapsarem, mas, alterando a tensão superficial, evita-se isto. A presença de
surfactante pulmonar (clonar) evita que a pressão seja demasiado grande, o que impede
o colapso dos alvéolos. Os bebés prematuros ainda não produzem eficientemente
surfactante pulmonar (clonar), o que pode levar ao colapso de alguns pequenos
alvéolos. Em alguns casos, é necessário injectar surfactante. Os pulmões são usados
pela primeira vez aquando do nascimento.
61
2. Ventilação pulmonar: mecânica da repiração
2.1. Estruturas envolvidas na ventilação pulmonar
Pulmões
Os pulmões localizam-se na cavidade torácica, havendo um de cada lado. À
frente está o coração, atrás a coluna vertebral e, lateralmente, os dois pulmões. À frente
da caixa torácica há o esterno e a parte inferior (O inferior) da caixa torácica é
delimitado por um músculo que se estende, o diafragma.
Cada pulmão é envolvido por uma dupla membrana completamente contínua, a
pleura: a pleura interna é a visceral,e a externa é a parietal. Entre as duas há uma
espécie de vácuo, uma pressão negativa, que leva a que os pulmões estejam estendidos
contra a parede torácica. Os pulmões são tecido muito elástico. O pericárdio, que
envolve o coração, também é duplo. A perfuração de um pulmão pode levar ao seu
colapso. Se o interior dos pulmões ficar em contacto com a atmosfera, perde-se a
pressão negativa. A essa perda chama-se pneumotórax. Antes da descoberta dos
antibióticos, pensava-se que a indução de pneumotórax ajudava no combate à infecção,
o que estava errado.
Quando se faz um raio X dos pulmões, a máxima inspiração permite ver o
volume total desses órgãos e permite que os raios atravessem melhor, facilitando a
detecção de eventuais nódulos de infecção.
A cavidade torácica é fechada, o que faz com que, com a inspiração e a
expiração, o volume aumente ou diminua, respectivamente.
Músculos envolvidos na ventilação
Entre as costelas estão os músculos intercostais, e as variações de volume são
devidas ao movimento desses músculos. Os músculos intercostais externos unem as
costelas pelo lado de fora, enquanto os músculos intercostais internos as unem
internamente. Há também músculos do pescoço e músculos que unem as costelas ao
esterno. Inferiormente, isto é, a delimitar inferiormente a caixa torácica, está o
diafragma.
Todos estes músculos são esqueléticos, apresentando contracção voluntária.
Os músculos envolvidos na alteração do volume da caixa torácica, e no ritmo
respiratório, são controlados pelo sistema nervoso somático.
Durante a inspiração, o os músculos que mais contraem são os intercostais
externos, que levantam as costelas, aumentando o volume anteroposterior, e o
diafragma, que desce. A contracção do diafragma aumenta o diâmetro vertical. Estes
são os músculos mais importantes cuja contracção leva ao aumento da caixa torácia. S
se procurar inspirar mais profundamente que o normal, os músculos do pescoço
contraem.
O que determina a expiração, a saída do ar após cada inspiração, é a distensão
dos músculos referidos. Quando se tenta expirar mais do que o normal, reduzindo mais
do que o normal o volume anteroposterior da caixa torácica, contraem-se os músculos
intercostais internos. Os outros músculos mencionados também podem actuar, mas a
menor escala.
O ritmo respiratório normal é 16, isto é, por cada minuto, há 16 inspirações.
62
2.2. Movimentos de ar nos pulmões
Ventilação, inspiração e expiração
A pressão do ar atmosférico ao nível do mar é de 760 mmHg. Em descanso,
não há diferença de pressão e, portanto, não há movimento de ar. A contracção dos
músculos leva a que a caixa torácica expanda, aumentando o volume dos pulmões. A
pressão intrapulmonar desce como consequência da expansão da caixa torácia, e o
gradiente de pressão leva a que o ar entre nos pulmões, já que a pressão intrapulmonar
é inferior.
A seguir à inspiração os músculos relaxam, o que leva a que o volume dos
pulmões diminua, aumentado a pressão intrapulmonar, o que leva à saída de ar desses
órgãos.
Não são as entradas e saídas de ar que fazem variar o tamanho dos pulmões; é a
variação do tamanho dos pulmões que faz entrar e sair o ar.
A ventilação são os movimentos de ar que se dão em consequência da variação
do volume da caixa torácia. Isso permite as trocas gasosas nos alvéolos: a aquisição de
O2 e a eliminação de CO2.
Variações do volume dos pulmões
O volume tidal é a alteração de volume entre os volumes expiratório e
inspiratório normais e mede, normalmente, 500 ml. Se se inspirar maximamente,
contraindo maximamente os músculos e aumentando maximamente o volume os
pulmões, fazendo entrar o ar, é possível conferir 6 l ao volume dos pulmões. Esse é o
volume inspiratório (respiratório) de reserva. Se se expirar maximamente, fica
sempre nos pulmões um volume residual de 1,2 l.
O volume total máximo dos pulmões é a capacidade pulmonar total. A
determinação deste valor, que inclui a diferença entre a inspiração máxima e a
inspiração mínima, permite determinar alguns problemas.
Numa pessoa normal, dos 500 ml inspirados, só 350 ml vão entrar em contacto
com os capilares, ficando os restantes 150 ml nas vias respiratórias. À parte onde não se
dão trocas com o sangue dá-se o nome de espaço respiratório morto. O outro é o
espaço ou volume respiratório funcional.
Espaço respiratório morto 150 ml
350 ml
Se uma pessoa inspirar insuficientemente (200 ml), o volume que chega aos
pulmões pode ser insuficiente. Respirar através de um tubo equivale a aumentar o
espaço respiratório morto. Passado algum tempo, há necessidade de aumentar a
profundidade da respiração, e o ritmo, também.
Teste do volume expiratório forçado
Quando há problemas respiratórios faz-se vulgarmente o teste do volume
expiratório forçado, que ocorre no primeiro segundo de expiração. O teste inicia-se
63
respirando maximamente, e, a certa altura, faz-se um inspiração máxima e, __ __ __,
expiração máxima, o mais rapidamente possível. Enquanto isso regista-se o volume dos
pulmões.
Uma pessoa normal consegue reduzir o volume dos pulmões para 1,8 l, sendo
essa diminuição de cerca de 80 %. Uma pessoa com problemas respiratórios reduzirá
menos. O valor calculado, o FEV1,0, terá um valor inferior ao normal (80 %). Poderá
haver alguma obstrução.
64
3. Trocas de gases nos pulmões
3.1. Problemas relacionados com as trocas de gases nos pulmões
Num pulmão normal existe um equilíbrio na pressão parcial de O2 entre o
sangue e os alvéolos. As trocas dão-se muito rapidamente. Há várias doenças do sistema
pulmonar que podem dificultar as trocas daquele gás com o sangue.
Na fibrose pulmonar há um espessamento da parede dos alvéolos, tornando-se
a difusão de O2 para o sangue menor do que o normal. A asma faz com que os
bronquíolos tenham um diâmetro menor do que o normal, o que impede a ventilação
dos alvéolos, pelo que a pressão de O2 é inferior ao que seria normalmente. A difusão de
O2 é normal, mas nunca se atinge uma pressão parcial normal no sangue. O efisema
pulmonar destrói alguns alvéolos pulmonares. Os 300 milhões de alvéolos pulmonares
aumentam muito a superfície para trocas, pelo que a destruição de alguns alvéolos
diminui essa superfície. A acumulação de líquido no tecido dos pulmões, entre os
capilares e os alvéolos, é comum, e a isso chama-se edema pulmonar. O fenómeno
aumenta a distância entre os alvéolos e os vasos, dificultando a difusão de O2 para o
sangue. O que se faz é procura eliminar o excesso de líquido, entre outras coisas.
3.2. Pressão parcial dos gases numa mistura
A pressão atmosférica ao nível do mar é, como foi já referido, de 760 mmHg.
Numa situação em que o mercúrio está em contacto com a pressão atmosférica, o metal
sobe até uma altura de 760 mm (mmHg) num tubo de 1 mm de diâmetro (?), se se
estiver ao nível do mar. Num ponto alto será menor.
Se se souber a percentagem em que os gases estão representados no ar, bem
como a pressão atmosférica, é possível determinar a pressão parcial desses gases. A
soma das pressões parciais dos gases permite obter o total da pressão atmosférica.
Inspiram-se todos os gases do ar. O ar não sai todo dos pulmões quando se
expira, ficando (/) pelo menos 1,2 l, pelo que, quando se inspira, o ar inspirado vai
misturar-se com o ar que já está nos pulmões (que lá está), que tem muito CO2 e menos
O2 que o ar atmosférico. Para além disso, há também um certo volume de vapor de
água. Há, portanto, contributo de H2O e CO2 para a pressão total (pressão parcial de 47
e 40 mmHg, respectivamente). As inspirações procuram equilibrar as pressões.
65
4. Regulação da respiração
4.1. Regulação da respiração pelo sistema nervoso
Centros respiratórios
Como foi já referido, os músculos responsáveis pela respiração são músculos
esqueléticos, voluntários, que só contraem por estimulação dos nervos. A informação
para isso vem dos centros respiratórios, compostos por um conjunto de neurónios. A
área rítmica está no bolbo raquidiano, enquanto as áreas pneumotáxica (superior) e
apnêustica estão na ponte.
A área rítmica tem neurónios I, que terminam nos músculos, e há também
neurónios E. Os neurónios I estimulam neurónios da medula espinal e, através dos
neurónios motores desse órgão, saem nervos que enervam os músculos intercostais
externos e o diafragma. A contracção destes músculos leva à inspiração. Esses
neurónios, I, são depois inibidos, permitindo as trocas gasosas. Os neurónios E inibem
os I, ____ que há um ritmo, não muito elevado. O ritmo de respiração normal deve-se à
contribuição dos neurónios I e E. Os I levam à contracção e os E inibem-nos de uma
forma alternada, permitindo a inspiração e a expiração.
Os outros centros localizam-se então na região da ponte ou protuberância. O
centro apnêustico estimula os neutónios I, através dos neurónios que vão ara a medula
oblongata. O centro pneumotáxico inibe a inspiração, antagonizando o centro
apnêustico.
Controlo integrado da respiração
O córtex motor permite o controlo voluntário. No controlo da respiração
participam os neurónios dos centros rítmico, apnêustico e pneumotáxico, e também
neurónios do córtex cerebral. Apesar da informação proveniente dos neurónios motores,
há dois centros que terminam um ritmo. As contracções são, no entanto, voluntárias.
A medula oblongata é responsável pelo ritmo respiratório, através dos sinais
que saem da medula espinal para os músculos. Os centros estimulam ou inibem: o
centro apnêustico estimula, enquanto o pneumotáxico inibe. O córtex cerebral pode
controlar directamente pela interacção com a espinal medula, ou por intermédio de
outros intervenientes.
4.2. Regulação química da respiração
Quimiorreceptores
Há um controlo químico, também, através das alterações a que as pressões
parciais dos gases conduzem.
Os quimiorreceptores são células sensoriais que se localizam em botões nos
corpos aórticos da aorta e no seio das caróticas. Nesses locais há também
barorreceptores, que detectam a pressão do sangue, mas os quimiorreceptores detectam
variações na concentração de CO2 e no pH. Há quimiorreceptores junto dos
barorreceptores (detectores da pressão) da aorta, que detectam a pressão parcial de CO2
e o pH e enviam informações para o sistema nervoso central. Há também
66
quimiorreceptores muito próximos das zonas do bolbo raquidiano que enviam a
informação, chamados de quimiorreceptores centrais.
Efeito do aumento da concentração de CO2
Quando a pressão parcial de CO2 aumenta muito, os quimiorreceptores
periféricos transmitem potenciais de acção para o bolbo raquidiano. O O2 e o pH
estimulam também os quimiorreceptores e têm o mesmo efeito, provocando o aumento
do ritmo da respiração. Os quimiorreceptores detectam então um aumento da pressão de
CO2 e uma diminuição do pH, e emitem potenciais de acção para o bolbo raquidiano. O
ritmo dos potenciais de acção dos neurónios I aumenta, aumentando o ritmo
respiratório, o que permite eliminar mais CO2. O maior movimento de ventilação
aumenta a saída de CO2 dos alvéolos. O aumento deste gás no plasma também ser
detectado pelos quimiorreceptores centrais localizados perto do núcleo respiratório do
bolbo raquidiano. Também se leva ao aumento do ritmo respiratório, facilitando a
remoção de CO2.
A ventilação e determinada pelo ritmo de respiração vezes o volume
respiratório.
Vent. pulm. = ritmo × vol. insp.
15/min × 500 ml
= 7.500 ml/min
O aumento da pressão parcial de CO2 nos alvéolos conduz ao aumento da
ventilação pulmonar. O aumento do ritmo faz-se no sentido de eliminar o aumento de
CO2 no sangue.
Efeito da diminuição da concentração de O2
Só abaixo de 60 mmHg de pressão parcial de O2 é que se altera o ritmo
respiratório em resposta. Há uma estimulação da respiração pela baixa concentração de
O2. Ao nível do mar, normalmente, não há grandes alterações na pressão de O2, mas, em
altitude, a pressão pode ser menor e pode duplicar-se o ritmo respiratório.
A falta de oxigénio também é detectada nos quimiorreceptores. A saturação da
hemoglobina com O2 também aumenta com a quantidade desse gás. Há uma relação
entre as duas. Só o O2 em circulação é detectado.
Efeito da diminuição do pH
O pH normal do sangue é 7,40. A diminuição é detectada pelos
quimiorrecepores, levando a um aumento do ritmo respiratório.
Quando o CO2 reage com a água, forma bicarbonato e ácido carbónico. Se se
injectar ácido (cítrico, por exemplo) de forma a reduzir o pH do sangue, o efeito do pH
será averiguado independentemente do do CO2 e do O2, que também pode formar ácido.
Há quimiorreceptores periféricos e quimiorrecepores centrais, localizados no
bolbo raquidiano. Nos centrais e nos periféricos, as células são mais sensíveis ao H+ do
que a CO2, detectando menores variações de pH do que de CO2. No líquido
cerebrospinhal, o CO2 (vindo dos vasos com que o líquido contacta) reage com H2O,
67
originando H2CO3 que se torna H+ e HCO3-. São os H+ que são detectados pelos
quimiorreceptores do bolbo raquidiano (medula oblongata).
Comparação entre o efeito do CO2 e o efeito do O2
O efeito do CO2 é muito maior que o do O2. O aumento da ventilação com a
diminuição de O2 quando o CO2 se mantém constante é muito menor do que quando o
CO2 aumenta e o O2 se mantém constante (A diminuição de O2 quando o CO2 se
mantém constante é muito maior do que quando o CO2 aumenta e o O2 se mantém
constante). O O2 precisa de descer para metade do normal para começar a estimular a
ventilação.
Normalmente, o parâmetro que aumenta mais é a pressão de CO2 no plasma, que
é detectado quer directamente (a detecção pode ser feita directamente no bolbo
raquidiano) quer pelo H+ que produz. Conduz à formação de potenciais de acção com
maior frequência, que vão para o sistema nervoso central e levam ao aumento do ritmo
respiratório. Quando este gás volta a níveis normais, no plasma, há uma inibição deste
efeito. A falta de O2 tem um menor efeito.
O maior estimulador químico da respiração é o CO2 e não o O2. A paragem
voluntária da respiração leva ao aumento do CO2 no sangue. O que se varia mais é o
CO2, e não o O2. Conduz-se ao retomar da respiração, mesmo que involuntariamente.
68
5. Transporte de gases no sangue e equilíbrio ácido-base
5.1. Transporte de oxigénio
Hemoglobina
O transporte de O2 é feito, em grande parte, na hemoglobina. Uma experiência
que evidencia o facto de ser a hemoglobina a responsável pelo transporte da maior parte
do O2 do plasma consiste em borbolhar __ ____ uma pressão parcial de O2 de 100
mmHg em dois compoartimentos, um sem hemoglobina, e outro com esta proteína, com
quatro subunidades. Depois, mede-se a quantidade de oxigénio. No caso do
compartimento com hemoglobina, a conteúdo de O2 é maior.
A hemoglobina permite então ao sangue transportar O2 para os tecidos. A
molécula tem quatro subunidades: há duas cadeias α (α1 e α2) e duas cadeias β (β1 e
β2). Em cada uma delas existe um grupo prostético heme, com ferro que se liga a
azotos, mas que pode antes ligar-se a outros átomos. Para ligar o O2 tem de estar no
estado ferroso de Fe II (e não Fe III).
Na curva de saturação da hemoglobina com oxigénio, em abcissa tem-se a
pressão parcial do gás e na ordenada a percentagem de saturação. Com o aumento da
pressão, aumenta a saturação. Num estado em que a pressão seja alta, como no sangue
ao nível dos pulmões, o nível de saturação é muito grande; ao nível dos tecidos, em que
a pressão de O2 é baixa, a afinidade é menor (75 %). Isto permite ao sangue “recolher”
O2 ao nível dos pulmões, e libertá-lo ao nível das células. A hemoglobina deixa algum
O2 nos tecidos, mas mantém uma elevada saturação. A diminuição de 25 % da saturação
equivale a deixar o volume correspondente a 50 mmHg. O grau de saturação diminui
para pressões parciais de O2 mais baixas.
Mioglobina
Há outra molécula que liga O2, ao nível dos músculos: a mioglobina. Esta
proteína é equivalente a uma subunidade da hemoglobina, ligando apenas um oxigénio,
e mantém-se saturada para valores mais baixos de pressão parcial, libertando o O2 para
valores de pressão parcial mais baixos do que aquele para o qual a hemoglobina liberta.
A mioglobina liberta o O2 em condições particulares, como exercício intenso, em que a
pressão parcial de O2 diminui muito. A mioglobina é muito importante.
Músculos com muita mioglobina são mais vermelhos, tendo muito ferro.
Factores que conduzem à libertação do oxigénio por parte da hemoglobina
O aumento da capacidade da hemoglobina deixar O2 nos tecidos depende de três
factores: diminuição do pH, aumento da temperatura e aumento de 2,3-DPG. Tudo
isto são alterações que podem ocorrer durante o exercício físico.
A variação do pH desloca a curva referida. A diminuição do pH desloca a curva
para baixo, diminuindo a afinidade da hemoglobina, comparativamente a valores de pH
normais. O contrário também acontece.
69
Efeito do monóxido de carbono
O CO é perigoso por ter afinidade pelo grupo heme muito superior à do O2. Na
presença deste gás, o CO é transportado para os tecidos (cérebro, por exemplo), em vez
do O2 e, se assim for, pode haver perda de consciência e, mais tarde, destruição das
células cerebrais e/ou cardíacas, as mais afectadas.
O organismo, ao nível dos quimiorreceptores, não detecta o CO e a falta de O2 a
chegar aos tecidos. As células sensoriais detectam estímulos que fazem ____ o
conteúdo do plasma. Nas presença de CO, apesar das partículas de O2 transportadas
serem menos, a quantidade no plasma, que é detectada, é a mesma.
O CO aumenta o risco de ataque cardíaco, pois leva à morte celular, e também
apresenta riscos para a gravidez. Mães que fumam têm fetos com menor peso à
nascença e mais incidência de morte súbita.
5.2. Transporte de dióxido de carbono
O CO2 pode ser transportado por 3 processos. Cerca de 10 % é transportado
dissolvido no plasma e cerca de 20 % combina-se com hemoglobina, em grupos laterais
de alguns aminoácidos, geralmente amínicos, formando carbaminohemoglobina.
Dentro dos glóbulos vermelhos há uma enzima muito abundante, a anidrase carbónica,
que converte CO2 e H2O em H2CO3, que se dissocia em H+ e HCO3-. O H+ combina-se
com a hemoglobina e o HCO3- vai para fora, trocado por Cl-, por acção de um trocador
bicarbonato-cloreto. Cerca de 70 % do CO2 é transportado assim, na forma de
bicarbonato, no plasma. Nos pulmões, quando o sangue venoso passa, tudo ocorre no
sentido inverso. O gás passa para os alvéolos, diminuindo a sua pressão parcial nos
glóbulos. Entra bicarbonato, trocado com, cloreto, e é convertido em CO2, __. A
carbaminohemoglobina vai perder o CO2, que sai.
5.3. Equilíbrio ácido-base
À medida que __ CO2 e ácido carbónico é produzido, diminui o pH. Isso é
normalizado nos pulmões, em que se elimina CO2 e H2. Os pulmões contribuem para a
normalização do pH sanguíneo, eliminando CO2.
Em situações de acidose, há hipoventilação (baixa ventilação), o CO2 aumenta
nos tecidos, o pH decresce (acidose de origem respiratória) e o HCO3- aumenta, no
plasma. Em hiperventilação pode haver alcalose respiratória. O CO2 decresce
excessivamente, o pH aumenta (alcalose) e o HCO3- diminui.
O bicarbonato, no plasma, pode ter uma função na tamponização do sangue.
Outro sistema de tampão, outra molécula que pode ligar H+, é a hemoglobina.
Na função renal também há regulação do pH do sangue.
70
6. Respiração durante exercício e em altitude
6.1. Respiração durante exercício
Em exercício, há estimulação do centro respiratório, por parte do sistema
nervoso, aumentando-se o ritmo respiratório, pelo que o O2 se mantém e o CO2 até
diminui, especialmente em exercício intenso. O pH nos músculos e no sangue diminui
ligeiramente, devido á produção inicial de ácido lácteo. A certa altura, após normalizar,
o ácido lácteo é removido e o pH restabelece-se.
Existem diversos efeitos sobre o centro respiratório, que fazem com que a
ventilação se adeqúe ao exercício e com que haja uma eliminação de CO2 e captação de
O2.
6.2. Respiração em altitude
Em altitude, a pressão de O2 pode ser mais baixa no ar, nos alvéolos e no
sangue arterial. Neste caso, a resposta é dada em consequência da falta de O2.
Em altitude, detectam-se também outros efeitos. Ao nível da parede dos vasos
produz-se óxido nítrico (NO), pela NO sintase, a partir da arginina. Este gás foi
recentemente descoberto e provoca vasodilatação e aumento do fluxo sanguíneo ao
nível pulmonar, o que permite maior difusão do oxigénio para o sangue. Nos tecidos a
hemoglobina dissocia mais oxigénio.
Se uma pessoa se mantiver em altitude, pode aumentar o nível de hemoglobina.
Na medula óssea, há aumento da produção de hemoglobina e de glóbulos vermelhos.
O hematócrito (a percentagem de glóbulos vermelhos) aumenta. Embora a hemoglobina
não sature completamente, o total de oxigénio transportado, após aumento da síntese, é
maior. O aumento do número de glóbulos vermelhos leva a que a viscosidade do
sangue aumente e o fluxo diminua, por aumento da resistência.
A oxigenação não é tão eficiente como ao nível do mar, e a falta de O2 pode
levar a dores de cabeça, por falta de O2 no sangue.
71
Capítulo V
- Rim e Regulação dos Líquidos do Corpo -
72
1. Excreção
1.1. Produtos tóxicos
Os alimentos são ingeridos, digeridos, absorvidos e, por fim, são utilizados
pelas células. Resultam produtos tóxicos que devem ser eliminados, na excreção. As
moléculas azotadas resultantes do metabolismo dos aminoácidos são os principais
produtos tóxicos resultantes do metabolismo, que devem ser eliminados.
A amónia é o composto azotado mais simples. Em organismos aquáticos, ela é
difundida para o meio, sendo muito solúvel em água. Nestes organismos, é o principal
produto de excreção.
Em animais terrestres, a amónia não pode ser eliminada por difusão, devendo ser
convertida noutro composto, pois é muito tóxica. Nos mamíferos, é convertida em
ureia, 100.000 vezes menos tóxica. A conversão de amónia em ureia requer quatro
enzimas e gasta-se também energia. A energia é gasta porque é favorável produzir este
composto menos tóxico, a ureia, que é, depois, excretada.
Alguns animais passam grande parte do tempo em ambientes confinados (ovos,
no caso de répteis e aves), pelo que seria desfavorável produzir ureia, que se torna muito
concentrada. Produzem antes ácido úrico, pouco solúvel, o que faz com que ele
precipite e não atinja nunca grandes concentrações em solução. Os humanos também
produzem ácido úrico.
Estes são os principais produtos tóxicos produzidos pelos organismos e, para os
eliminar, é necessário um sistema excretor.
1.2. Diversidade de sistemas excretores
Organização e funcionamento básicos dos sistemas excretores
O sistema excretor dos humanos tem uma estrutura básica semelhante á dos
outros animais, não só mamíferos, mas também anelídeos. Há um líquido circulante,
sangue ou não, que passa por uma membrana semipermeável para outro tubo. Parte
desse fluido é reabsorvido e há ainda secreção de certos compostos vindos do fluido
circulante. Só depois há a excreção. Isto é ____ para vários organismos.
Sistema excretor das planárias
Nas planárias______________________________________________________
______________________________________________________________________
______________________________________________________________________.
Sistema excretor dos Anelídeos
Nos Anelídeos, em cada segmento há um sistema excretor, isto é, em cada
segmento há estruturas autónomas. Há nefróstomos, onde ocorre a filtração inicial, e o
filtrado passa para uma rede de tubos, em contacto com vasos sanguíneos. Com eles
dão-se as trocas até se produzir a urina.
73
2. Sistema excretor humano
2.1. Aparelho urinário
A urina é produzida nos rins, sendo aí que ocorre a filtração, a reabsorção e a
secreção. Desses órgãos a urina é conduzida pelos ureteres para a bexiga, e, daí, sai
pela uretra.
2.2. Rins
Os rins têm uma parte mais externa, o córtex renal, e uma parte central, a
medula renal. São órgãos muito importantes, mas é possível viver só com um.
Representam cerca de 1 % do corpo e recebem 20 % do sangue de cada batimento, isto
é, 1 l de sangue por minuto, não havendo proporção tão grande em outros órgãos.
Para além da eliminação de substâncias tóxicas, quer ingeridas, quer produzias
pelo próprio organismo, os rins regulam a concentração de substâncias no meio
intracelular.
2.3. Nefrónios
Tipos de nefrónios
Nos rins há estruturas designadas de nefrónios. Aqueles que penetram mais na
parte medular são os justamedulares; no córtex renal há nefrónios corticais, que
também penetram na medula. Os primeiros têm uma ansa maior. Os elementos
vasculares conduzem o sangue.
Elementos vasculares
O sangue entra no nefrónio por uma arteríola aferente. Há depois uma rede de
capilares glomerulares, que forma o glomérulo, e depois o sangue é recolhido por
uma arteríola eferente, que o traz para outra rede de capilares, os capilares
peritubulares. Estes reúnem-se em vénulas renais, que se reúnem numa veia renal.
Nesta circulação, há algo de incomum: o sangue vem de uma arteríola, passa por
capilares, e depois por uma arteríola outra vez.
Na primeira rede de capilares ocorre a filtração, enquanto na segunda rede de
capilares à reabsorção e secreção.
Elementos tubulares
A cápsula de Bowman do nefrónio envolve o glomérulo, e recebe o filtrado.
Depois o filtrado passa para o túbulo proximal, de seguinda para a ansa de Henle, e
depois para o túbulo distal. Este contacta com o tubo colector, onde também pode
haver reabsorção de água. Só no final deste tubo se fala de urina; antes fala-se de
filtrado.
Nestas estruturas ocorrem os três processos.
74
3. Processos que ocorrem ao longo do nefrónio
3.1. Tipos de processos
A filtração é o movimento do fluido dos capilares para o lúmen do nefrónio, na
cápsula de Bowman. Nas zonas seguintes pode haver reabsorção de algumas
substâncias, como glicose. Algumas substâncias que não podem ser filtradas são, então,
secretadas. Outras são filtradas e secretadas podendo, assim, ser removidas mais
depressa.
Ao conjunto entre o glomérulo e a cápsula renal dá-se o nome de corpúsculo
renal, e é aí que se dá a filtração. Ao longo de todo o nefrónio pode haver reabsorção e
secreção. Os processos podem ocorrer ao longo de todo o nefrónio, mas os mecanismos
de reabsorção de diferentes substâncias ocorrem em locais específicos. A maior parte da
reabsorção ocorre no túbulo proximal. A secreção ocorre mais ao nível da ansa, do
túbulo distal e do tubo colector e, mais uma vez, diferentes substâncias são mais
secretadas em zonas particulares.
3.2. Filtração
Membrana de filtração
Os capilares glomerulares têm poros grandes na membrana, fenestras, que os
tornam muito permeáveis, facilitando as trocas. A envolvê-los há células, os podócitos,
com prolongamentos citoplasmáticos que se interlaçam, se interdigitam, revestindo o
capilar, o que permite que existam fendas entre estes prolongamentos. O conjunto
destas estruturas forma a membrana de filtração, através da qual o fluido tem de
passar para ir para a cápsula.
Todos os iões e moléculas pequenas passam com facilidade a membrana de
filtração. Células (glóbulos vermelhos e brancos) e proteínas não conseguem passar; só
proteínas muito pequenas passam (são muito poucas). Deste modo, o filtrado inicial não
contém proteínas nem células.
Pressão de filtração
É uma pressão que favorece a passagem através da membrana de filtração. Essa
pressão é a pressão capilar glumerular, a força que leva à passagem das substâncias
para o nefrónio. Há forças contra: a pressão oncótica, das proteínas que ficam, e a
pressão da cápsula, osmótica.
A pressão de filtração, a soma destas componentes, não é muito alta, mas a sua
associação a uma grande permeabilidade aumenta muito a capacidade de filtração.
Taxa de filtração glomérular
A taxa de filtração glomérular, em situações normais, ronda 120 ml/min. É
muito importante regular o volume de filtrado produzido. Para uma pressão arterial
normal produzem-se 180 l/dia; há uma reabsorção de 178,5 l/dia, tendo a urina
excretada 1,5 l/dia. Este é um caso normal.
75
Para uma pressão arterial muito elevada, a taxa de filtração glomérular seria
maior (225 l/dia). A maior pressão ao nível das arteríolas do glomérulo leva a uma
maior filtração. Com mesma absorção, a urina excretada teria 46,5 l/dia, o que é
impraticável, tendo o plasma 3 l. Se todo o filtrado fosse constituir a urina, produzir-seiam 172,8 l de urina por dia, pelo que seria necessário beber 4,8 garrafas de água por
hora. A reabsorção permite produzir apenas 2 L por dia.
Há três mecanismos de regulação da taxa de filtração glomérular. O diâmetro
dos vasos sanguíneos é regulado pelo sistema nervoso simpático. Numa situação
normal, os neurónios do simpático estão a conduzir potenciais de acção a uma dada
frequência e libertam noradrenalina, que não provoca vasoconstrição dos vasos. Se
houver uma activação no simpático, a frequência dos potenciais de acção aumenta e
liberta-se mais noradrenalina, havendo vasoconstrição. Uma inibição no simpático
provoca, do modo inverso, vasodilatação (vasoconstrição). Se houver uma
hemorragia, deve reduzir-se a quantidade de urina produzida. A decaída da pressão
sanguínea vai ser detectada por barorreceptores. Vai aumentar-se o débito cardíaco e
há vasoconstrição, diminuindo-se o volume de filtrado. Diminui-se a pressão glomérular
e, portanto, o volume de filtrado produzido. Retém-se mais água, o que vai levar a um
aumento (uma diminuição) do volume de sangue, aumentando-se a pressão. Este
mecanismo é referente á enervação pelo sistema nervoso simpático.
Há um outro mecanismo, de autorregulação. Mesmo cortando a enervação,
certas variações de pressão sanguínea não causam a variação correspondente na
filtração. É um mecanismo intrínseco aos próprios vasos. O aumento da pressão arterial
leva à distensão das paredes das arteríolas, que resulta na abertura de canais iónicos
sensíveis à distensão. Há despolarização das células do músculo liso da parede dos
vasos, por entrada de sódio e cálcio, o que leva à sua contracção, provocando a
vasoconstrição. A pressão diminui e a taxa de filtração glomérular também,
relativamente ao esperado.
O terceiro mecanismo é relativo á regulação tubulo-glomerular. Na verdade, o
túbulo (tubo) distal passa entre a arteríola aferente e a arteríola eferente. Nesta zona
existe aquilo que se designa de aparelho justaglomerular, formado pelas células da
mácula densa mais as células justaglomerulares. A maior pressão leva ao aumento do
fluxo no nefrónio, que é detectado pelas células da mácula densa, que vão libertar
factores para as células justaglomerulares, que levam à vasoconstrição. Existem várias
substâncias libertadas pelas células endoteliais que causam a contracção (tromboxano
A2, endotelina e factor de constrição derivado do endotélio) ou relaxamento (óxido
nítrico, PGI2 e factor de hiperpolarização derivado do endotélio) das células
musculares lisas. O óxido nítrico é um vasodilatador.
Composição do filtrado
No filtrado inicial haverá muita água. A glicose também passa e a sua
concentração é semelhante, acontecendo o mesmo com substâncias como a ureia, o
ácido úrico, a creatina, o Na+, o K+, o Cl- e o HCO3- (Substâncias como a ureia, o
ácido úrico, a creatina, o Na+, o K+, o Cl- e HCO3-). As proteínas encontram-se em
muito menor concentração que no plasma.
Algumas das substâncias filtradas devem ser reabsorvidas, nomeadamente
glicose, alguns iões, como o bicarbonato, muito importante na tamponização do pasma,
e água.
76
3.3. Reabsorção
Localização da reabsorção
A reabsorção dá-se ao longo de todo o nefrónio: nos túbulos proximal e distal,
na ansa de Henle e no tubo colector. A reabsorção de glicose, proteínas, iões e alguma
ureia dá-se mais no tubo proximal.
Mecanismos de reabsorção
A reabsorção pode dar-se por transporte activo, primário ou secundário,
difusão e endocitose.
Reabsorção de sódio
A reabsorção de sódio dá-se por acção de uma bomba Na+-K+-ATPase,
gastando-se energia para absorver este ião. É necessário bombear o sódio deste modo
para fora das células da parede do tubo para manter o gradiente, necessário para a
passagem do ião do lúmen ara as células, por canais.
Também no túbulo (tubo) próximal há, na membrana das células junto do lúmen,
um co-transportador de sódio e glucose. Para funcionar, é necessário o gradiente de
Na+ ____ pela Na+-K+-ATPase, que transporta K+ para o interior (exterior). É um
transporte facilitado de glicose, mas que requer energia. Não se gasta energia
directamente, mas ela é necessária para ____ o ião.
Reabsorção de ureia
No túbulo (tubo) proximal há uma reabsorção passiva de ureia. Como foi visto,
nessa zona, há reabsorção de sódio e de outros solutos como a glucose. Retirando
solutos, diminui, no filtrado inicial, a osmolaridade. Deste modo, há um potencial
osmótico que leva à ____ de água do túbulo próximal para o plasma. Como diminui lá a
água, a concentração de ureia, no filtrado, aumenta. Nem toda é reabsorvida, pois é
tóxica e constitui um dos produtos que se pretende excretar.
Reabsorção de proteínas
Não há passagem directa de proteínas do filtrado para o citoplasma, pelo que
elas sofrem endocitose e, aí, dentro das células da parede do túbulo proximal, são
digeridas, formando-se aminoácidos que passam para o plasma.
Reabsorção de glicose
A concentração de glicose da normal, na urina (no plasma), é zero, pois ela é
totalmente reabsorvida por transportadores. São específicos, isto é, transportam apenas
uma substância ou substâncias semelhantes, e apresentam saturação, pelo que, a partir
de certas concentrações, não há um transporte completo. A concentração de glicose no
filtrado é a mesma que no plasma e, se esta aumentar, a outra também o faz. A
reabsorção de glicose é feita por transportadores e, neste fenómeno, à medida que a
concentração do açúcar aumenta, aumenta a taxa de reabsorção, mas, se ocorrer
saturação dos transportadores, a taxa mantém-se constante. A partir desse momento, que
77
se verifica quando a concentração de glicose no plasma é superior a 300 mg/100ml,
aparece glucose na urina. A glicose só aparece na urina a partir do momento em que há
saturação dos transportadores.
A glicosúria, o aparecimento de glicose na urina, pode ser devida a diabetes
mellitus, em que os níveis de glicose são elevados. Também pode aparecer glicose na
urina sem que a sua quantidade no sangue seja elevada. Nesse caso, há problemas
genéticos ao nível dos trasportadores.
3.4. Secreção
Localização da secreção
Há substâncias que são excretadas mas não aparecem no filtrado, resultando,
portanto, de secreção. No túbulo proximal são secretados H+, NT, ácido úrico, drogas
e amónia, entre outras substâncias. Ao nível do túbulo distal secretam-se H+ e K+.
Secreção de penicilina
A penicilina pode ser injectada mas tem um tempo de vida curto no sangue, pois
é facilmente excretada. A secreção, ao contrário da filtração, é específica. No caso da
penicilina (/) era favorável inibir os transportadores. No entanto, o que se faz é (era)
injectar, juntamente com a penicilina, outra substância, para a qual os transportadores
têm maior afinidade. Deste modo, a penicilina permanece mais tempo no plasma.
Avaliação das substâncias secretadas
Por comparação entre o filtrado e a urina, conclui-se que:
- a água é reabsorvida, embora não totalmente;
- as proteínas e a glicose são totalmente reabsorvidas;
26 mg
x
100 ml
180.000 ml
46.800 mg
1.820 mg
x
100 ml
1.500 ml
27.300 mg
- a ureia foi parcialmente reabsorvida.
Deve ter-se em conta que o volume de filtrado é maior que o de urina.
Depois de tudo isto tem-se urina.
78
4. Micção
4.1. Percurso da urina
A urina vem dos rins para a bexiga, passando pelos ureteres, e, após passar pela
uretra, é expulsa.
4.2. Bexiga
Músculo liso da bexiga
A bexiga é revestida por tecido muscular liso, o que é favorável, pois este é
mais flexível. Se fosse esquelético, o aumento de volume poderia impedir a contracção,
por falta de sobreposição dos filamentos contrácteis. No músculo liso também há actina
e miosina.
Regulação da micção
As pessoas não estão continuamente a urinar, pois há dois esfíncteres.
Normalmente o esfíncter é contraído, sendo mantido fechado por impulsos vindos do
córtex cerebral.
Se a bexiga estiver muito cheia, há sinais que vão para o cérebro, pois o músculo
liso está distendido. Há também um interneurónio, inibitório, que inibe o efeito do
neurónio motor que fecha o esfíncter de músculo esquelético. Há outro interneurónio,
excitatório, que leva à contracção do músculo liso. Tudo isto leva à saída involuntária
de urina. (Isto ocorre)
Se não se estiver numa situação destas, com muita urina, normalmente é possível
controlar a micção. Nas pessoas mais idosas, a falta de controlo pode dever-se à
degeneração do esfíncter externo.
79
5. Determinação de valores importantes
5.1. Taxa de depuração
A taxa de depuração é o volume de plasma que é depurado de um determinada
substância em cada minuto. A depuração pode ser usada para calcular a taxa de filtração
glomérular, desde que se faça a monitorização de uma substância que:
- atravesse facilmente a membrana de filtração;
- não seja reabsorvida;
- não seja secretada.
A substância usada é, normalmente, a inulina. Ela é administrada e, depois,
avalia-se a sua quantidade na urina. Se uma substância for filtrada, mas não for
reabsorvida nem secretada (filtrada), a depuração será igual à taxa de filtração
glomérular. Um exemplo é, então, a inulina. Se uma substância for filtrada e
parcialmente reabsorvida, a depuração será menor que a taxa de filtração glomérular.
Um exemplo disso é a ureia. Se uma substância for filtrada e totalmente reabsorvida, a
depuração é zero. Se for filtrada e secretada, a depuração será maior que a taxa de
filtração glomérular.
5.2. Fluxo sanguíneo renal
Outra análise muitas vezes pedida é a determinação do fluxo sanguíneo renal.
Também é feita de acordo com a depuração renal, mas, neste caso, a substância
utilizada terá de:
- atravessar facilmente a membrana de filtração;
- não ser reabsorvida;
- ser quase inteiramente secretada para o lúmen.
Um composto usado é o ácido para-amino-hipúrido, uma substância filtrada,
não reabsorvida, mas muito secretada. Ela informa quanto ao fluxo de plasma que passa
nos rins. Atendendo ao hematócrito, a quantidade de células presente no sangue, é
possível saber o fluxo sanguíneo.
80
6. Regulação dos líquidos corporais
6.1. Reabsorção de água
Mecanismos para evitar a desidratação
No deserto, a perda de água por respiração e transpiração aumentam muito.
Isto causa perda de volume de plasma, desidratação, e aumento da osmolaridade do
sangue. Aquilo que se pode fazer é produzir fezes mais secas, ou produzir menos urina.
Aumento da reabsorção ao nível dos rins
Os rins conseguem variar bastante o volume de urina produzido, não se variando
muito a taxa de filtração glomérular, mas a reabsorção de água. A maior parte da
reabsorção de água dá-se no túbulo proximal e também no ramo descendente da ansa de
Henle. Pode também haver reabsorção de água ao nível do tubo colector, se houver
hormona anti-diurética. Se se produzir esta hormona, dá-se reabsorção no tubo
colector, ____ _ __ ____ água.
Produção da hormona antidiurética
A hormona é produzida por células secretoras que a enviam para o lóbulo
posterior da hipófise.
Há barorreceptores na aorta e nas carótidas que detectam variações de
pressão arterial. A diminuição, que ocorre aquando da perda de água, leva a que eles
sejam estimulados. Há também osmorrecepotores que detectam variações da
osmolaridade do plasma. Os estímulos destes receptores vão conduzir ao aumento dos
níveis de hormona antidiurética. Uma pequena variação na osmolaridade causa uma
grande variação dos níveis da hormona no plasma. A pressão e o volume arteriais, que
estão directamente ligados, não causam resposta tão grande.
Efeito da hormona antidiurética nas aquaporinas
A hormona actua ao nível do tubo colector. Há canais permeáveis a água,
aquaporinas, através dos quais a água passa, mas apenas se houver gradiente de
osmolaridade. Quando a hormona é expressa, liga-se a receptores da superfície das
células da estrutura em questão, o que provoca o aumento dos níveis de AMP cíclico
(AMPc) que, indirectamente, levam á exocitose de vesículas com aquaporinas na
membrana, à fusão dessas vesículas (/) com a membrana celular. Assim, aumentam-se
as aquaporinas na membrana. Esta é uma resposta rápida.
A hormona pode também levar à fosforilação dos canais que já existem,
aumentando a permeabilidade, o que é outro efeito rápido. O AMP cíclico activa as
proteínas cinases A (PKA), que promovem as fosforilações.
Ela leva ainda à alteração da expressão genética, aumentando-se a produção de
aquaporinas.
Existem várias classes de aquaporinas, e as referidas são as do tipo II. Há outras
nas células dos rins, dos tipos III e IV, mas não são afectadas por estes processos.
81
Efeito da hormona antidiurética nos transportadores de ureia
Não basta haver canais de água; é também necessário o gradiente. É também
necessário que se afecte o gradiente de osmolaridade, e a hormona antidiurética
também provoca isso. A reabsorção de ureia leva a alterações da osmolaridade, que
levam à reabsorção de água. As proteínas cinases A, activadas por AMP cíclico,
fosforilam transportadores de ureia e aumentam a sua expressão, favorecendo a
reabsorção de ureia.
Existem vários tipos de transportadores de ureia, mas nem todos são regulados
pela hormona antidiurética. Os referidos são os do tipo T1.
Comparação da osmolaridade do filtrado, na presença e ausência da
hormona antidiurética
A reabsorção de água é maior no tubo proximal, e, como a osmolaridade não
varia, conclui-se que também há reabsorção de sais e outras substâncias. Na presença ou
ausência da hormona, a reabsorção é sempre maior no túbulo proximal. O fluxo
diminui. No ramo descendente da ansa de Henle, aumenta a osmolaridade. (Isto deve-se
ao aumento da osmolaridade.), enquanto que, no ramo ascendente, a osmolaridade
diminui, por reabsorção de sais. A osmolaridade, que inicialmente era 300 mOsm,
torna-se próxima de 100 mOsm. Na ausência de hormona antidiurética, há muito pouca
reabsorção de água, pelo que a osmolaridade não varia muito, enquanto que, na
presença da hormona, há reabsorção de água e, portanto, aumento da osmolaridade.
Enurese nocturna
A quantidade de hormona não é constante ao longo do dia, sendo maior à noite.
Em crianças, e também em adultos, pode não ocorrer isso, levando-se a enurese
nocturna.
Sistema multiplicador de contracorrente
As aquaporinas não promovem o transporte de água; são apenas canais. É o
gradiente osmótico ____ que leva à reabsorção de água. Essa reabsorção resulta de um
mecanismo de contracorrente.
Na ansa de Henle, há uma parte permeável à água e outra parte em que os iões
são transportados por ____. No ramo ascendente da ansa de Henle, há transporte de
iões para o plasma. Chega líquido à ansa, no ramo descendente, e, como há maior
osmolaridade no (que o) plasma, a água é reabsorvida. O transporte activo de iões para
o líquido intersticial leva à subida da osmolaridade desse fluido, e a água do ramo
descendente tem tendência a ir para o fluido, devido ao gradiente de osmolaridade.
Atinge-se um equilíbrio. Depois chega novo líquido, arrastando o anterior. O transporte
activo de iões aumenta a osmolaridade do fluido intersticial, pelo que pode reabsorverse mais água. A repetição deste ciclo leva a grande reabsorção de água.
A osmolaridade máxima da urina é 1200 mOsm, a osmolaridade máxima do
líquido intersticial. Para a urina ter maior osmolaridade, teria de haver mais transporte
de iões para o líquido intersticial. O mecanismno de contracorrente contribui com 60 %
para a osmolaridade e a ureia contribui com 40 %. Se se consumir muita carne, produzse mais ureia, pelo que a urina será mais concentrada.
82
6.2. Regulação da concentração de sódio
Importância do sódio
É importante regular os níveis de Na+. Este ião representa 90–95 % da
osmolaridade do líquido extracelular, e é importante manter a osmolaridade. Os
humanos ingerem muito sal, em média, 10 g de NaCL, por dia, pelo que há um excesso
de sal que deve ser controlado.
Aumento da eliminação de sódio
Em condições normais, as células são pouco permeáveis a Na+. O aumento da
sua concentração leva ao aumento da osmolaridade do líquido intercelular
(intracelular), pelo que a ingestão de muito sal aumenta a osmolaridade. Aumenta-se a
expressão de vasopressina, o que leva a que se consuma água, produzindo-se mais
urina. A ingestão de muito sal provoca sede. A ingestão de água provoca o aumento
deste líquido no fluido extracelular, diminuindo a osmolaridade. O aumento do volume
de sangue, por aumento da reabsorção, leva ao aumento da pressão arterial. As pessoas
que sofrem de hipertensão não devem comer comida salgada.
Efeito da aldosterona
Há uma hormona, a aldosterona, que é libertada por glândulas supra-renais e
promove a reabsorção de sódio. Ela liga-se aos receptores, o que leva ao aumento do
número de Na+-K+-ATPase e causa aumento da sua actividade. Estas enzimas
bombeiam Na+ para fora das células, o que mantém o gradiente de concentração deste
ião, para que ele possa entrar por canais de sódio. A hormona aumenta o número de
bombas, a sua actividade e a permeabilidade dos canais.
O aumento da osmolaridade do plasma provoca a diminuição da expressão da
hormona, já que não é necessário receber Na+.
O aumento da concentração de K+ extracelular aumenta a libertação da hormona.
Via renina-angiotensina-aldosterona
Há uma via, a via renina-angiotensina-aldosterona, pela qual, quando os
centros de controlo cardiovasculares detectam diminuição da pressão, aumenta a
libertação de renina, nas células justaglomerulares. Elas próprias são sensíveis à
pressão arterial, libertando renina, quando aumenta. Há um retrocontrolo pela mácula
densa, no qual, quando o fluido que passa pelo túbulo distal aumenta, há libertação de
óxido nítrico por esta estrutura, que diminui a libertação de renina. O fígado produz
continuamente angiotensinogénio e a enzima ACE está sempre presente. O que
controla os níveis de angiotensina 1 é a renina, convertendo o precursor inactivo
naquele composto, que é, seguidamente, transformado em angiotensina 2. Esta
estimula as glândulas supra-renais a libertar aldosterona. Esta leva á reabsorção de
sódio, pelo que aumenta a reabsorção de água, o volume de plasma sanguíneo e a
pressão sanguínea. A angiotensina 2 aumenta a vasopressina, que aumenta a reabsorção
de água, aumentando a pressão arterial. A angiotensina 2 provoca diversos mecanismos
que resultam no aumento da pressão arterial. Esta é a via da renina-angiotensina-
83
aldosterona. Há diversos compostos que controlam a pressão (expressão) arterial,
inibindo a ACE.
Efeito dos mecanismos na concentração de sódio no plasma
Para certos aumentos da ingestão de Na+, os seus níveis no plasma não alteram
muito, devido aos mecanismos vistos. O bloqueio da hormona antidiurética e da sede
levam a que a quantidade varie mais com a ingestão. O bloqueio da aldosterona não
causa uma alteração tão grande.
Outros mecanismos de controlo da pressão arterial
Há um peptídeo libertado no miocárdio que induz a produção de aldosterona
quando a pressão aumenta muito. Também há indução da vasopressina, para se diminuir
a reabsorção de água. Se a pressão aumentar, é importante que não haja aumento do
volume de sangue.
6.3. Regulação da concentração de potássio
Importância do potássio
É importante regular os níveis de K+, que é importante no potencial eléctrico.
Efeito da aldosterona
Os níveis de potássio são regulados pela aldosterona, que leva ao transporte
deste ião para o lúmen do túbulo distal (tubo ____).
O bloqueio do sistema de aldosterona leva a maior variação da concentração de
potássio consoante a ingestão. Esta hormona é mais importante na regulação deste ião.
Problemas relacionados com os níveis de sódio
Em hiperkalemia, as células são mais excitáveis. Os baixos níveis de potássio, a
hipokalemia ___________________________________________________________
______________________________________________________________________.
Na doença de Addison há destruição do córtex das glândulas supra-renais. É
uma doença auto-imune em que há baixos níveis de aldosterona, grande perda de Na+,
acumulação de K+, fadiga e potenciais de acção baixos.
No síndroma de Conn há o contrário. Há níveis reduzidos de K+, pelo que há
acumulação de Na+, sendo a pressão arterial muito elevada.
6.4. Regulação do pH do plasma
Processos de regulação do pH no organismo
Todos os dias surgem protões no plasma, como resultado da ingestão ou do
metabolismo. Os rins também contribuem para a regulação do pH do plasma, embora,
como foi visto, o sistema respiratório também é importante neste processo. É, de facto,
84
o processo mais importante, isto é, a respiração é o principal mecanismo de eliminação
de H+.
Regulação do pH ao nível dos rins
A regulação do pH pelos rins é feita por excreção de H+ e reabsorção de HCO3-,
que é um dos tampões do plasma.
Os protões vão para o filtrado e, depois, podem ser secretados. O H+ pode ser
transportado activamente para fora, por uma ATPase e, para além disso, pode também
ser trocado por potássio, que entra.
bicarbonato não é totalmente reabsorvido, mas esse fenómeno pode ser
regulado. Este ião é filtrado e parcialmente reabsorvido ao nível do túbulo proximal. A
membrana das células do túbulo próximal não é permeável a bicarbonato. A anidrase
carbónica converte este ião em H2O e CO2, que entra. No interior das células, CO2 e
H2O, por acção da mesma enzima, formam bicarbonato, que pode ser transportado para
o sangue.
pH da urina
A urina é ácida mas não é muito ácida, pois ela própria tem tampões, fosfato e
amónia, que tamponizam o seu pH. A acidez da urina ajuda a limpar as vias urinárias e
a evitar infecções bacterianas.
6.5. Diuréticos
Função dos diuréticos
Os diuréticos, que levam a uma maior produção de urina, são usados por
pessoas hipertensas, para se diminuir o volume de sangue. Pessoas idosas que passam
muito tempo deitadas formam edemas, acumulações de líquidos, nas pernas. Nesse
caso, também se devem usar diuréticos.
Tipos de diuréticos e sua actuação
Os diuréticos podem ser inibidores da reabsorção de Na+; a retenção de sódio
leva a que a osmolaridade aumento no tubo, saindo menos água. Outros são
poupadores de K+; são antagonistas da aldostrerona, impedindo a reabsorção de Na+ e
a excreção de K+. Do mesmo modo, o aumento do Na+ no filtrado aumenta a sua
osmolaridade, pelo que menos água será reabsorvida. Os osmóticos, como o manitol,
aumentam a osmolaridade do filtrado. Outros diuréticos são inibidores da anidrase
carbónica, inibindo a reabsorção de bicarbonato, o que pode ser prejudicial, pois pode
impedir a regulação do pH do sangue.________________________________________
______________________________________________________________________
______________________________________________________________________.
85
6.6. Volume de urina mínimo
Um homem de 70 Kg necessita de excretar 600 mOsm de solutos/dia e a
osmolaridade máxima da urina é 1200 mOsm/l. O volume mínimo de urina/dia terá de
ser 0,5 l. A água do mar tem, em média, osmolaridade de 2400 mOsm/l. Para manter a
osmolaridade, consumindo-se 1 l de água do mar, seria necessário eliminar 2 l.
86