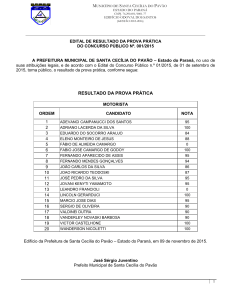
TERMODINÂMICA
CONCEITOS FUNDAMENTAIS
Sistema termodinâmico:
• Demarcamos um sistema termodinâmico em
Universidade
função do que
Santa
desejamos
Cecília – Santos
estudar/ SP
termodinamicamente.
• Tudo que se situa fora do sistema
termodinâmico é chamado meio ou vizinhança.
• É demarcado através de uma FRONTEIRA que
pode ser móvel, fixa, real ou imaginária.
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
CONCEITOS FUNDAMENTAIS
Sistema termodinâmico:
• Sistema Fechado - não há fluxo de massa
Universidade
atravésSanta
da fronteira.
Cecília – Santos / SP
• Volume de Controle - ocorre fluxo de
massa através da fronteira.
• Sistema Isolado - não existe qualquer
interação entre o sistema termodinâmico e a
sua vizinhança. (não ocorre fluxo de calor,
massa, trabalho etc. )
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
Universidade Santa Cecília – Santos / SP
SISTEMA FECHADO
VOLUME DE CONTROLE
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
Fases, Estado e Propriedades de uma
Substância
Uma massa de água pode ser inicialmente
líquida,
se tornar
após
aquecida
Universidade
Santavapor
Cecília
– Santos
/ SP ou
sólida quando resfriada, ou seja, a água
pode existir em diferentes fases.
Uma fase é definida como uma quantidade
de matéria totalmente homogênea; quando
mais de uma fase está presente, as fases se
acham separadas entre si por meio dos
contornos das fases.
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
Em cada fase a substância pode existir a várias pressões e
temperaturas ou, usando a terminologia da termodinâmica, em vários
estados.
O estado pode ser identificado ou descrito por certas propriedades
Santa
Cecíliadas
– Santos
SP
macroscópicasUniversidade
observáveis;
algumas
mais/familiares
são:
temperatura, pressão, volume, etc.
Cada uma das propriedades de uma substância tem sempre o
mesmo valor para um dado estado, independente da forma pela qual
a substância chegou a ele.
A propriedade depende do estado do sistema e é independente do
caminho pelo qual o sistema chegou ao estado considerado.
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
As propriedades termodinâmicas podem ser
divididas em:
Propriedade Extensiva - depende do
tamanho Santa
( extensão
sistema
Universidade
Cecília) –do
Santos
/ SP ou
volume de controle.. Exemplo: Volume
Propriedade Intensiva - independe do
tamanho do sistema. Exemplo:
Temperatura, Pressão etc.
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
Propriedade Específica - obtida dividindo-se uma
propriedade extensiva pela massa da substância.
Uma propriedade específica é também uma
propriedade intensiva do sistema.
Universidade
Santa Cecíliaespecífica:
– Santos / SP
Exemplos
de propriedade
Volume específico , v = V / m
[m3/kg]
Energia Interna específica , u = U / m
[kJ/kg]
onde: m é a massa do sistema, V o volume e U
é a energia interna
do sistema.
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
Mudança de Estado
Quando qualquer propriedade do sistema é alterada
houve uma mudança de estado no sistema
Universidade Santa Cecília – Santos / SP
termodinâmico.
Processo – É a maneira como ocorre a mudança de
estado, definida pela sucessão de estados através dos
quais o sistema passa.
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
Exemplos de processos:
- Processo
- Processo
- Processo
- Processo
- Processo
- Processo
Isobárico
pressão constante
Isotérmico
temperatura constante
Universidade Santa Cecília – Santos / SP
Isocórico ( isométrico ) volume constante
Isoentálpico
entalpia constante
Isoentrópico
entropia constante
Adiabático
sem transferência de calor
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
Ciclo Termodinâmico - Quando um sistema (substância )
passa por certo número de mudança de estados e retorna
ao estado inicial, o sistema executa um ciclo
termodinâmico.
Universidade Santa Cecília – Santos / SP
Observar a diferença entre ciclo termodinâmico e ciclo
mecânico. Um motor de combustão interna de quatro
tempos executa ciclos mecânicos. Entretanto o fluido de
trabalho não percorre um ciclo termodinâmico dentro do
motor.
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
Lei Zero da Termodinâmica
" Se dois corpos estão em equilíbrio térmico
com um terceiro eles estão em equilíbrio
térmico
entre si
". Cecília – Santos / SP
Universidade
Santa
Quando dois corpos tem a mesma temperatura
dizemos que estão em equilíbrio térmico entre si.
A lei zero da termodinâmica é aplicada nos
medidores de temperatura, os TERMÔMETROS.
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
Temperatura está associada ao movimento (vibração)
aleatório das partículas.
Escalas de Temperatura
Universidade Santa Cecília – Santos / SP
Temperatura zero absoluto: todos os átomos e
moléculas estão no estado fundamental (estacionário).
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
Escreva a relação entre graus Celsius ( ºC ) e Fahrenheit ( ºF )
Solução:
Considere-se a escala dos dois Termômetros, Celsius e Fahrenheit
como mostrado na figura:
Universidade Santa Cecília – Santos / SP
Interpolando linearmente as escalas entre
a
referência
de gelo fundente e a
referência de vaporização da água temos:
O
C 0 O F 32
100 0 212 32
O
5
C (O F 32)
9
Universidade Santa Cecília – Santos / SP
P
lim
A
A
i
FN
A
TERMODINÂMICA
Pressão
Relação entre força e a área normal onde
está sendo aplicada a força.
Universidade Santa Cecília – Santos / SP
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
Leituras de pressão obtidas com um manômetro
em U contendo como fluido manométrico: água,
mercúrio, Alcool:
Universidade Santa Cecília – Santos / SP
Onde:
g é a aceleração da gravidade, em m/s2,
é a densidade do fluido manométrico, em kg/m 3 ;
L é a altura da coluna de líquido, em m (metros) .
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
OBS. A pressão atmosférica padrão é definida como a
pressão produzida por uma coluna de mercúrio
exatamente igual a 760 mm sendo a densidade do
mercúrio de 13,5951 gm / cm3 sob a aceleração da
gravidade padrão de 9,80665 m / s2
Universidade Santa Cecília – Santos / SP
Uma atmosfera padrão = 760 mmHg =101325 Pascal =
14,6959 lbf / in2
1 Pa = 1 N / m2 = 1 kg . (m/s2) / m2 = 1 kg / (m.s2 )
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
Sistema Internacional de Unidades:
Massa: quilograma (kg)
Comprimento: metro (m)
Tempo: segundo (s)
Universidade
Santa Cecília – Santos / SP
Força: newton
(N)
Energia: Joule (J)
Potência: Watt (W)
Temperatura: graus celsius (ºC)
Temperatura absoluta: Kelvin (K)
Pressão: Pascal (Pa)
1 bar = 105 Pa
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
COMPORTAMENTO DAS SUBSTANCIAS PURAS
Substância pura: tem composição química
invariável e homogênea.
Universidade Santa Cecília – Santos / SP
Pode existir em mais de uma fase, mas a sua
composição química é a mesma em todas as
fases.
Exemplo: água líquida e vapor d'água ou uma
mistura de gelo e água líquida são todas
substância puras; cada fase tem a mesma
composição química.
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
COMPORTAMENTO DAS SUBSTANCIAS PURAS
Mudança de Fase Líquido – Vapor
[ Tsat = temperatura de saturação (mudança de fase) ]
Universidade Santa Cecília – Santos / SP
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
DIAGRAMA TERMODINÂMICO
temperatura x volume específico
Universidade Santa Cecília – Santos / SP
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
DIAGRAMA TERMODINÂMICO
presão x volume específico
Universidade Santa Cecília – Santos / SP
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
Temperatura de saturação - temperatura na qual se dá a mudança de fase
líquido - vapor de uma substância pura “a uma dada pressão”, chamada
“pressão de saturação” .
Para cada pressão corresponde uma única temperatura de saturação (e viceUniversidade Santa Cecília – Santos / SP
versa)
Líquido Saturado - Substância na fase líquida à temperatura e pressão de
saturação.
Líquido Subresfriado - A temperatura do líquido é menor que a temperatura
de saturação para a pressão existente.
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
Vapor Saturado - Substância na fase vapor que está com a temperatura de
saturação.
Vapor Úmido – Mistura de líquido e vapor saturados
Universidade Santa Cecília – Santos / SP
Vapor Saturado seco – Presença somente de vapor saturado (sem mistura de
líquido saturado)
Vapor Superaquecido - Vapor com temperatura maior que a temperatura de
saturação.
Universidade Santa Cecília – Santos / SP
TERMODINÂMICA
Título ( x ) - Definido para substâncias que se encontram na saturação (parte
líquida e parte vapor).
É a relação entre a massa de vapor pela massa total, isto é, massa de líquido mais a
massa de vapor.
Universidade Santa Cecília – Santos / SP
Matematicamente:
x = mV / (mV + mL)
Umidade ( y ) : relação entre a massa de líquido pela massa total.
Matematicamente:
y = mL / (mV + mL)
Notar que : y + x = 100%
Universidade Santa Cecília – Santos / SP