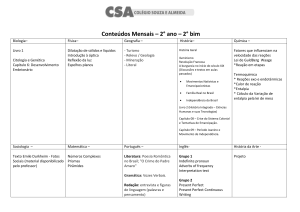
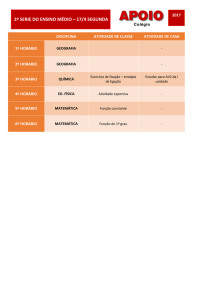
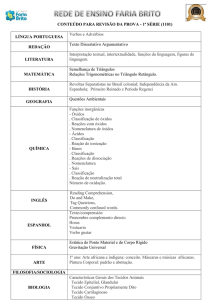
Aula 8 – Termoquímica: Transformações Químicas
1 – Variações da entalpia padrão
Agora vamos entender as variações de entalpia associadas às reações químicas. A
entalpia da reação depende das condições (estados dos reagentes, estados dos produtos,
da pressão e da temperatura) sob as quais a reação ocorre. Os químicos acharam, então,
que seria conveniente tabular os seus dados para um conjunto de condições padrões na
temperatura de sua escolha:
O estado padrão de uma substância é a substância pura na pressão exata de 1
bar (105 Pa).
O estado físico e, quando apropriado, a fase sólida precisam ser especificados
também, pois podemos falar dos estados padrões das fases sólida, líquida e gasosa da
substância. A temperatura não faz parte da definição do estado padrão. No entanto, é
convencional tabular os dados termoquímicos a 298,15 k (25 ºC), e esta será a
temperatura que iremos utilizar de agora em diante, salvo menção em contrário.
Quando escrevemos ∆Hө em uma equação termoquímica, sempre queremos dizer
que a variação de entalpia ocorre com os reagentes em seus estados padrões se
transformando em produtos, também em seus estados padrões. Por exemplo, da equação
termoquímica:
2H2(g) + O2(g) → 2H2O(l)
∆Hө=-572 kJ
sabemos que, quando 2 moles de H2, na forma de hidrogênio gasoso puro a 1 bar, se
combinam com 1 mol de O2, na forma de oxigênio gasoso puro a 1 bar, formando 1 mol
de H2O, na forma de água líquida pura a 1 bar, tudo na temperatura de 25 ºC, a entalpia
do sistema decresce de 572 kJ, ou seja 572 kJ de calor são liberados para as vizinhanças
(pressão constante).
89
Uma reação muito comum é a reação de combustão, a reação completa de um
composto, na maioria dos casos um composto orgânico, com oxigênio, como na
combustão do metano na chama do gás natural:
CH4(g) + 2O2(g) → CO2(g) + 2 H2O(l)
∆Hө=-890 kJ
A entalpia padrão de combustão, ∆cHө , é a variação de entalpia padrão por mol
da substância combustível. Alguns valores típicos de entalpia padrão de combustão
podem ser encontrados na tabela abaixo:
Note que ∆cHө é uma quantidade molar, obtida pela divisão do valor de ∆cHө pelo número
de moles do reagente consumido.
As entalpias de combustão são normalmente medidas em uma bomba
calorimétrica, um dispositivo em que o calor é transferido a volume constante. Como já
discutimos nas aulas anteriores, o calor transferido a volume constante é igual à variação
de energia interna, ∆U, e não da entalpia, ∆H. Para converter a variação de energia
interna em variação de entalpia devemos observar que a entalpia molar de uma substância
está relacionada com a sua energia interna molar por Hm = Um + pVm. Para fases
90
condensadas, o produto pVm é tão pequeno que pode ser desprezado. Para gases, tratados
como perfeitos, o produto pVm é escrito como RT. Portanto, se na equação química a
diferença (produtos – reagentes) nos coeficientes estequiométricos das espécies em fase
gasosa é ∆vgás, podemos escrever:
∆ c H = ∆ cU + ∆v gás RT
(9.1)
Exemplo 1: O calor liberado na queima da glicina em uma bomba calorimétrica é 969,6
kJ.mol-1, a 298,15 K, logo ∆cU = -969,6 kJ.mol-1. A equação química para a reação é:
9
5
1
NH 2 CH 2 COOH(s) + O2 ( g ) → 2CO2 ( g ) + H 2 O(l ) + N 2 ( g )
4
2
2
1 9 1
Vemos que ∆v gás = 2 + − = . Portanto,
2 4 4
1
1
RT = −969,6kJ .mol −1 + × (8,31451J .K −1 .mol −1 ) × (298,15K )
4
4
−1
−1
∆ c H = −969,6kJ .mol + 0,62kJ .mol
∆ c H = ∆ cU +
∆ c H = −969,0kJ .mol −1
2 – Combinação das entalpias de reação
Muito frequentemente a reação pela qual estamos interessados não tem a sua
entalpia de reação tabelada. Entretanto, por ser a entalpia uma função de estado, podemos
obter o valor desejado a partir de entalpias de reações conhecidas. Já nos deparamos com
um caso simples, onde a entalpia de sublimação foi obtida como a soma das entalpias de
fusão e de vaporização. A única diferença é que, agora, vamos aplicar a mesma técnica a
uma seqüência de reações químicas. O procedimento é resumido pela lei de Hess:
A entalpia padrão de uma reação é a soma das entalpias padrões das reações nas
quais a reação global pode ser dividida.
91
Apesar de o procedimento ter o status de uma lei, ele é apenas uma conseqüência de ser a
entalpia uma função de estado, o que implica poder expressar a variação de entalpia de da
reação global como a soma das variações de entalpia de cada etapa de um caminho
indireto que conduz à reação desejada. As entalpias individuais não precisam,
necessariamente, ser reações factíveis, ou seja, reações que possam ser realizadas em
laboratório. Elas podem ser reações hipotéticas, desde que as equações que descrevem o
processo fiquem completamente balanceadas. Cada etapa deve corresponder à mesma
temperatura que a reação global.
Exemplo 2: Aplicação da lei de Hess
Duas equações termoquímicas
C3H6(g) + H2(g) → C3H8(g)
∆hHө = -124 kJ
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(l)
∆cHө = -2220 kJ
onde C3H6 é o propeno e C3H8 é o propano, calcule a entalpia padrão de combustão do
propeno.
Resp:
9
C 3 H 6 ( g ) + O2 ( g ) → 3CO2 ( g ) + 3H 2 O(l )
2
∆cHө
Podemos formar essa equação termoquímica a partir da seguinte seqüência:
C3 H 6 ( g ) + H 2 ( g ) → C3 H 8 ( g )
∆hHө = -124 kJ
C 3 H 8 ( g ) + 5O2 ( g ) → 3CO2 ( g ) + 4 H 2 O(l )
∆cHө = -2220 kJ
1
H 2 O(l ) → H 2 ( g ) + O2 ( g )
2
∆dHө = +286 kJ
9
Global: C 3 H 6 ( g ) + O2 ( g ) → 3CO2 ( g ) + 3H 2 O(l )
2
∆cHө = -2058 kJ
Logo a entalpia padrão de combustão do propeno é igual a -2058 kJ.mol-1
92
3 – Entalpias padrões de formação
A entalpia padrão de reação, ∆rHө, é a diferença entre as entalpias molares dos
reagentes e dos produtos, com cada termo ponderado pelo seu respectivo coeficiente
estequiométrico, v, na equação química:
∆ r H θ = ∑ vH mθ ( produtos) − ∑ vH mθ (reagentes)
(9.2)
A entalpia padrão de reação é a variação de entalpia do sistema quando os
reagentes em seus estados padrões (puros, pressão de 1 bar), são completamente
convertidos em produtos em seus estados padrões (puros, pressão de 1 bar), sendo essa
variação expressa em quilojoules por mol da reação, como ela está escrita. O problema
com tal definição é que não temos como saber os valores das entalpias absolutas das
substâncias. Para evitar esse problema, podemos imaginar que a reação ocorre por uma
via indireta, na qual os reagentes são inicialmente fragmentados em seus elementos e os
produtos são, então, formados a partir dos elementos. Definimos, então, a entalpia
padrão de formação, ∆fHө, de uma sustância como a entalpia padrão (por mol da
substância) para a sua formação a partir dos seus elementos em seus estados de
referência. O estado de referência de um elemento é a sua forma mais estável nas
condições vigentes.
93
Exemplo3: A entalpia de formação da água líquida a 25 ºC, é obtida da equação
termoquímica:
H 2 (g) + 12 O2 ( g ) → H 2 O(l )
∆Hө= -286 kJ
Com a introdução das entalpias padrões de formação, podemos escrever:
∆rHө =
∑ v ∆fHө(produtos) - ∑ v ∆fHө(reagentes)
(9.3)
O primeiro termo do lado direito é a entalpia de formação de todos os produtos a partir de
seus elementos; o segundo termo é a entalpia de formação de todos os reagentes a partir
de seus elementos. O fato de a entalpia ser uma função de estado significa que a entalpia
da reação calculada dessa forma é idêntica ao valor que poderia ter sido calculada pela
equação: ∆ r H θ = ∑ vH mθ ( produtos ) − ∑ vH mθ (reagentes) , se dispuséssemos das entalpias
absolutas de cada participante da reação. Os valores de algumas entalpias de formação a
25 ºC estão listados na tabela 3.8.
A entalpia padrão de formação de um elemento em seu estado de referência é
zero, por definição, pois a sua formação corresponde à reação nula elemento → elemento.
Entretanto, a formação de um elemento em uma fase diferente não é zero:
C(s,grafita) → C(s,diamante)
∆Hө= +1,895 kJ
Portanto apesar de ∆fHө C(s,grafita) = 0, ∆fHө C(s,diamante) = +1,895 kJ.
94
Exemplo 4: Aplicação das entalpias padrões de formação.
Calcule a entalpia padrão de combustão do benzeno líquido a partir das entalpias de
formação dos reagentes e dos produtos da reação.
Resp: A equação química é:
C 6 H 6 (l ) + 152 O2 ( g ) → 6CO2 ( g ) + 3H 2 O(l )
Segue-se então que:
∆rHө= {6 ∆fHө(CO2, g) + 3 ∆fHө(H2O, l)} – { ∆fHө(C6H6, l) +
95
15
2
∆fHө(O2, g)}
{
} {
}
∆rHө= 6 × (−393,51kJ .mol −1 ) + 3 × (−285,83kJ .mol −1 ) − (49,0kJ .mol −1 ) + 0
∆rHө= -3268 kJ.mol-1
Uma inspeção na equação química mostra que, por exemplo, o “por mol” quer dizer por
mol de C6H6, que é exatamente o que necessitamos para a entalpia de combustão. Logo, a
entalpia de combustão do benzeno líquido é -3268 kJ.mol-1.
Compostos que têm entalpias padrões de formação negativas (tais como a água)
são classificados como compostos exotérmicos, porque tem uma entalpia mais baixa que
os seus elementos correspondentes. Compostos com entalpias padrões de formação
positivas são ditos compostos endotérmicos, pois possuem entalpia mais alta que os seus
respectivos elementos.
3.6 – Variação da entalpia de reação com a temperatura.
É comum o caso em que dispomos de dados termoquímicos em uma temperatura,
mas desejamos esses mesmos dados em outra temperatura. Em trabalhos de precisão
deve-se fazer todos os esforços para medir a entalpia de reação na temperatura de
interesse, mas é conveniente ter uma forma de estimar a direção da variação de entalpia e
até mesmo um valor numérico relativamente confiável para essa variação. A figura
abaixo mostra a técnica que vamos utilizar:
96
Como sabemos, a entalpia de uma substância aumenta com a temperatura;
portanto, tanto a entalpia total dos reagentes quanto a entalpia total dos produtos aumenta
com a temperatura, como mostrado na ilustração acima. Uma vez que o aumento de
entalpia é desigual para reagentes e produtos, a entalpia padrão da reação (a diferença
entre as duas entalpias mencionadas) varia com a temperatura. A variação da entalpia de
uma substância depende do coeficiente angular do gráfico da entalpia versus a
temperatura, portanto, a capacidade calorífica das substâncias a pressão constante.
Podemos então esperar que a dependência da entalpia de reação com a temperatura esteja
relacionada à diferença entre as capacidades caloríficas dos produtos e dos reagentes.
Como um exemplo simples, considere a reação:
2H2(g) + O2(g) → 2 H2O(l)
onde a entalpia padrão da reação é conhecida em uma certa temperatura (por exemplo, a
25 ºC, pelas tabelas fornecidas nesse texto).
Pela equação 9.2, podemos escrever:
{
}
∆rHө= 2 H mθ ( H 2 O, l ) − 2 H mθ ( H 2 , g ) + H mθ (O2 , g )
para a reação a temperatura T
Se essa reação ocorrer a uma temperatura mais alta, T’, a entalpia molar de cada
substância que participa da reação aumenta, pois mais energia é armazenada, e a entalpia
padrão da reação se torna:
{
}
∆ r H θ ' = 2 H mθ ' ( H 2O , l ) − 2 H mθ ' ( H 2 , g ) + H mθ ' (O2 , g )
para a reação a temperatura T’
onde a linha indica o valor da nova temperatura.
O aumento da entalpia molar de uma substância é dado por: Cp,m∆T, onde Cp,m é a
capacidade calorífica a pressão constante da substância e ∆T = T’- T é a diferença de
temperatura. Por exemplo, a entalpia molar da água se altera para:
H mθ ' ( H 2 O , l ) = H mθ ( H 2 O, l ) + C p , m ( H 2 O , l ) × ∆T
97
Quando substituímos termos como esse na expressão geral, obtemos:
∆ r H θ ' = ∆ r H θ + ∆ r C p × ∆T
(9.4)
onde:
∆ r C p = 2C p , m ( H 2 O , l ) − {2C p , m ( H 2 , g ) + C p , m (O 2 , g )}
Observe que essa combinação tem a mesma forma que a de uma entalpia de reação, e que
os coeficientes estequiométricos também aparecem de forma semelhante. Em geral, ∆rCp
é a diferença entre as somas das capacidades caloríficas dos produtos e dos reagentes,
ponderadas pelos coeficientes estequiométricos correspondentes:
∆rCp =
∑ v Cp,m(produtos) - ∑ v
Cp,m (reagentes)
(9.5)
A equação 9.4 é a lei de Kirchhoff. Através dela vamos verificar que a entalpia
padrão de uma reação, em uma dada temperatura, pode ser obtida da entalpia padrão da
mesma reação em outra temperatura, se conhecermos as capacidades caloríficas a pressão
constante de todas as substâncias que participam da reação. A obtenção da lei de
Kirchhoff pressupõe que as capacidades caloríficas são constantes na faixa de
temperatura de interesse; a lei funciona melhor se a variação de temperatura é pequena
(no máximo de aproximadamente 100K).
Exemplo 5: Aplicação da lei de Kirchhoff
A entalpia de formação da água gasosa, a 25 ºC, é -241,82 kJ.mol-1. estime o seu valor a
100 ºC.
Resp: A equação química é: H 2 ( g ) + 12 O2 ( g ) → H 2 O( g )
98
As capacidades caloríficas, a pressão constante, da H2O(g); do H2(g) e do O2(g) são:
33,58 J.K-1mol-1; 28,84 J.K-1mol-1; e 29,37 J.K-1mol-1 respectivamente. Segue-se que:
∆ r C p = C p , m ( H 2 O , g ) − {C p , m ( H 2 , g ) + 12 C p , m (O 2 , g )}
{
}
∆ r C p = (33,58 J .K −1 .mol −1 ) − ( 28,84 J .K −1 .mol −1 ) + 12 × ( 29,37 J .K −1 .mol −1 )
∆ r C p = −9,95 J .K −1 .mol −1
Então sendo ∆T = +75K, obtemos da equação 9.4:
∆ r H θ ' = ∆ r H θ + ∆ r C p × ∆T
∆ r H θ ' = ( −241,82 kJ .mol −1 ) + ( −9,95 J .K −1 ) × 75 K
∆ r H θ ' = ( −241,82 kJ .mol −1 ) − (0,75 kJ .mol −1 )
∆ r H θ ' = −242 ,57 kJ .mol −1
Ou seja, podemos verificar que a reação é levemente mais exotérmica em temperatura
mais alta.
99
Exercícios – Lista 7
Considere todos os gases como perfeitos, a menos que exista uma informação em
contrário. Todos os dados termoquímicos são a 298,15 K.
1º) Um projeto eficiente de plantas industriais para processos químicos depende da
habilidade do projetista em estimar e usar o calor produzido em uma etapa do
processo para alimentar um outro processo. A entalpia padrão da reação: N2(g) +
3H2(g) → 2 NH3(g) é – 92,22 kJ. Qual é a variação de entalpia quando (a) 1,00 mol
de N2(g) é consumido? (b) 1,00 mol de NH3(g) é formado?
2º) O etano é descartado por queima em larga escala ao sair dos poços de petróleo,
pois é abundante e de uso comercial muito restrito. Ele seria um bom combustível? A
entalpia padrão da reação 2C2H6(g) + 7O2(g) → 4CO2(g) + 6H2O(g) é 3120 kJ. (a)
Qual é a entalpia padrão de combustão do etano? (b) Qual é a variação de entalpia
quando 3,00 moles de CO2(g) são formados na reação?
3º) As entalpias padrões de formação são encontradas com facilidade, mas
precisamos, muitas vezes, das entalpias padrões de combustão. A entalpia padrão de
formação do etilbenzeno é -12,5 kJ.mol-1. Calcule a sua entalpia padrão de
combustão.
4º) As reações de combustão são relativamente fáceis de serem realizadas e
estudadas, e os resultados obtidos podem ser combinados para fornecer valores de
entalpias de outros tipos de reação. Como uma ilustração, calcule a entalpia padrão de
hidrogenação do cicloexeno a cicloexano, sabendo-se que as entalpias padrões de
combustão dos dois compostos são -3752 kJ.mol-1 (cicloexeno) e - 3953 kJ.mol-1
(cicloexano).
5º) A entalpia padrão de combustão do naftaleno é 5157 kJ.mol-1. Calcule sua entalpia
padrão de formação.
6º) Quando se queimam 320 mg de naftaleno, C10H8(s), em uma bomba calorimétrica,
a temperatura se eleva de 3,05 K. Calcule a constante do calorímetro. De quanto a
temperatura se elevará na combustão de 100mg de fenol, C6H5OH(s), no mesmo
calorímetro e nas mesmas condições?
7º) As reservas de energia da glicose são da maior importância na determinação de
processos metabólicos. Quando 0,3212g de glicose são queimados em uma bomba
calorimétrica de capacidade calorífica 641 J.K-1, a temperatura sobe de 7,793K.
Calcule (a) A entalpia padrão de combustão; (b) A energia interna padrão de
combustão; (c) A entalpia padrão de formação da glicose.
8º) Calcule a entalpia padrão de dissolução do AgBr(s) em água com os dados de
entalpias padrões de formação do solido e dos íons em solução aquosa.
100
9º) A entalpia padrão de decomposição do complexo amarelo NH3SO2 em NH3 e SO2
é +40 kJ.mol-1. Calcule a entalpia padrão de formação do NH3SO2.
10º) A entalpia padrão de combustão da grafita é -393,5 kJ.mol-1 e a do diamante é 395,41 kJ.mol-1. Calcule a entalpia da transição C(s,grafita) → C(s,diamante).
Respostas
1º) -46,11 kJ
2º) (a) -1560 kJ.mol-1; (b) -2340 kJ.mol-1
3º) -4564,7 kJ.mol-1
4º) -84,8 kJ.mol-1
5º) + 78,6 kJ.mol-1
6º) 0,77 K
7º) (a) 2,8 x 103 kJ.mol-1; (b) 2,8 x 103 kJ.mol-1; (c) -1,28 x 103 kJ.mol-1
8º) 84,1 kJ.mol-1
9º) + 383 kJ.mol-1
10º) + 1,9 kJ.mol-1
101