Biotecnologia Vegetal
BIOTECNOLOGIA VEGETAL I
Universidade de Évora
Prof. Amely Zavattieri
2002
Micropropagação
!Introdução
!Multiplicação conforme
!Etapas
!Automatização
!Dupla fase
!Robotização
!Bioreactores
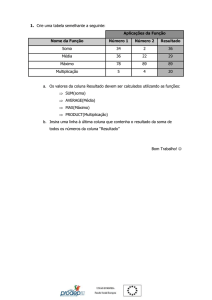
A Micropropagation é a propagação fiel de um genótipo
seleccionado por meio das técnicas da cultura in vitro.
Geralmente a micropropagação é também associada com a
produção em grande escala a preços competitivos.
O Prof. Murashige (Univ. de California, Riverside) definiu 3 fases
principais na multiplicação in vitro de plantas, tanto para os
laboratórios comerciais como para os de investigação.
Estas fases descrevem passos a seguir no processo, como
assim também momentos na cultura nos quais as necessidades
do ambiente da cultura devem ser modificados.
A figura seguinte representa um esquema das diferentes fases
do processo de micropropagação como proposto por Deberg e
Maene (1981).
in vivo
in vitro
Fase 0: preparação da planta mãe
Fase 1: Iniciação asséptica
Fase 2: multiplicação
Fase 3a: Alongamento
Fase 3b: Indução radicular e preaclimatação
in vivo
Fase 4: aclimatação
Teoricamente as plantas que não são
quimereas podem ser propagadas
usando diferentes técnicas: rebentos
axilares; rebentos adventícios;
embriogénese,...
Para efeitos da micropropagação a
técnica de multiplicação via rebentos
axilares é a preferida para a maioria
das plantas. Isto em princípio produz
plantas conformes. É a única técnica
que pode ser aplicada á propagação de
quimeras.
Com o aumento do número de subculturas o meio que originalmente
tinha sido preparado para dar
rebentos axilares pode ser mudado
para a produção de rebentos
adventícios. Como consequência o
número de variação somaclonal se
incrementa.
Rebentos axilares
obtidos de uma
Dracaena
(quimera).
Desenvolvimento de
gomos adventícios
em Dracaena
(quimera).
Fases da Micropropagação
"Fase 0
"Fase 1
"Fase 2
"Fase 3
"Fase 4
Fase 0. Preparação das plantas mãe
1. Plantas saudáveis
2. Evitar rega excessiva das plantas mães
3. Induzir crescimento vigoroso nas plantas
mães
Fase 0. Foi originalmente concebido
para melhorar as condições higiénicas
das plantas mãe.. Prévio ao inicio da
cultura deverá prestar-se uma atenção
especial da planta da qual serão
retirado/s o/s explants. As plantas
mães poderão ser previamente
tratadas com hormonas,
desinfectantes, fazer testes de viroses,
etc. todo em vista ao êxito da cultura in
vitro.
A desinfecção do material vegetal é
essencial nesta fase. O crescimento, a
morfogénese e as taxas de
crescimento e propagação da cultura
dependerão do tratamento prévio da
planta mãe.
Fase O
Possíveis pre-tatamentos
Poda; perda da dominância apical
Rega gota -a gota
das plantas mães.
Soluções forçadas contendo GA3;
citocininas; hidroxiquinoleina
Etiolamento
Injecção de
citocininas
Enxertia em
cascada
Fase1: Estabelecimento da cultura
1. Selecção do explant
2. Desinfecção superficial
3. Meio de cultura
4. Acastanhamento do meio
5. Consistência do meio
6. Condições ambientais
Condições ambientais a considerar
Temperatura
1. Afecta o crescimento das culturas
2. Efeito sobre a morfogénese
Humidade relativa
Luz
1. Qualidade
2. Quantidade
3. Efeito sobre a morfogénese
Fase 1
Estabelecimento da cultura
Objectivos
#Dar início á cultura
#Em princípio o método usado deve ser
reproduzível
Deve existir um compromisso entre uma adequada
desinfecção do material vegetal e uma boa taxa de
sobrevivência dos explants “não contaminados”.
Procedimento
Frequentemente para o início da cultura são usados
gomos axilares ou meristemas. Em certos casos são
usados outras partes da planta. Ex. Sendo difícil
obter gomos axilares não contaminados em Ficus
lyrata e Anthurium spp. Gomos adventícios são
primeiramente obtidos sobre folhas, os rebentos
assim obtidos são então seccionados para ser os
explants iniciais da fase 2.
É recomendável não iniciar a propagação durante a
fase de iniciação.
Exemplo: início da cultura em Roseira
Exemplo: Fase de iniciação em roseiras
Plantas mãe
com rega
gota -a gota
Lavar 3x
com água
estéril
São retirados
ramos jovens.
Cortar os ápices e
as bases dos
ramos
São retiradas as folhas
ficando os pecíolos
nas secções cortadas.
Cortar os extremos o mais próximo
possível do nó.
Colocação de um nó
em um tubo de ensaio.
Lavar com 80% etanol,
desinfectar em lexivia
comercial 10% (NaOCl)
por 15 minutos
Entre nós cortados.
Cada nó contêm um
meristema axilar.
Transladar os tubos
para a sala de
cultura
Fase 2. Multiplicação
O objectivo desta fase é a multiplicação propriamente dita dos
órgãos e estruturas que são capazes de dar origem a plantas
completas. De acordo com os métodos de propagação que sejam
empregues estas estruturas poderão ser: rebentos axilares ou
adventícios, embriões o órgãos em miniatura como
microtubérculos, cormos, etc.
Em alguns programas de micropropagação este estado inclui
uma indução prévia de centros ou zonas meristemáticas a partir
da qual se desenvolverão os órgãos adventícios.
Os rebentos produzidos na fase 2 são considerados como
propágulos pois podem ser propagados ou multiplicados para
aumentar o seu número em sucessivas subculturas.
1. Produção de rebentos adventícios
2. Produção de rebentos axilares
3. Embriogénese somática
Multiplicação Vegetativa por Gomos
(rebentos) Adventícios.
Adventícios
A- O explant é
constituído de um
fragmento de órgão, de
uma porção de tecido ou
mesmo de células
isoladas (grãos de
pólen, protoplastos, etc.
B- Os rebentos são neoformados (formados de
novo) a partir de células
do explant inicial.
C- Estes rebentos
desenvolvem-se em
caules, geralmente
sobre um meio de
alongamento
E- O calo primário pode ser subcultivado
D- As células do explant
inicial dividem-se
rapidamente e formam,
de maneira
desorganizada, um calo
primário ligado ao
explant de partida
em meio sólido para crescimento do calo
F- O calo forma rebentos sob um meio de indução apropriado
G- Todos os ramos obtidos são transferidos para um meio neutro ou
enriquecido em auxinas que provocam o posterior enraizamento.
A conformidade do material das plantas obtidas por este método, não
pode ser garantida.
Multiplicação Vegetativa por
gomos (rebentos) Axilares.
A- O explant pode
conter um meristema
isolado, um gomo
terminal ou axilar, uma
extremidade de um
ramo, um fragmento de
ramo que possua pelo
menos 1 gomo axilar
B- Num meio com
citocininas o meristema
cresce, o gomo
desenvolve-se em um
ramo folhoso
C- Este ramo pode ser
cortado em fragmentos
(nós que permanecem
sobre o mesmo meio
dando novos ramos
folhosos
D- Se o explant inicial é depositado num meio rico em citocininas, os
gomos desenvolvem-se dando um ramo folhoso que se ramifica ele
próprio dando ramos secundários e posteriormente terciários, e assim
sucessivamente
E- Os tufos de rebentos são fragmentados e a multiplicação realiza-se
nesta fase
F- Os rebentos são transferidos para meio de alongamento para preparar
os mesmos para a fase de enraizamento
G- Os ramos podem ser agora transferidos par um meio neutro
(S/hormonas) ou com auxinas para enraizarem.
A taxa de multiplicação pode variar entre 2 a mais de 20 por mês.
Fase 2
Multiplicação
Taxa de
Multiplicação
A
Fig. 1. Teoricamente o
numero de plantas que
podem ser produzidas
em 1 ano quando a
taxa de multiplicação é
de 2 (A) ou 4 (B) por
mes.
B
Para a maioria dos sistemas de micropropagação os
sistemas de ramificação axilar são os mais favoráveis.
Em outros sistemas mais avançados podem ser usados
embriões, gomos adventícios, nós,
conjuntos meristemáticos.
Multiplicação porEmbrigénese
Somática.
A embriogénese
somática aparece a
maior parte das vezes
em suspensões
celulares, ocasionalmente sobre calos, e
mais raramente
directamente sobre
órgãos
A- O explant de partida
pode ser um fragmento
de órgão, de tecido, ou
células isoladas.
B- Forma-se um calo
primário (em órgãos) ou
um micro calo (em
células isoladas).
C- Subcultura de calo
primário ou de microcalos
D- O calo pode dissociar-se e multiplicar-se sob a forma de suspensão
celular
E- Em certas condições, as culturas celulares em meio líquido ou sólido
organizam-se em pequenos maciços de estruturas bipolares chamados
embrióides, ou embriões somáticos
F- Os embriões somáticos se desenvolvem directamente em plântulas
com raiz como as derivadas de uma semente.
Exemplo: multiplicação de roseiras.
Fase 3
Enraizamento
Fase 3: Enraizamento
Os rebentos ou plântulas derivadas da fase 2, são muito
pequenas e incompletas, não sendo possível a sua
transferência directa para o solo ou outro substrato, pelo
que nesta fase, são seguidos certos procedimentos para
que estas pequenas plantas desenvolvam a sua
capacidade fotossintética e sejam capazes de sobreviver
em condições naturais sem a adição artificial de
carbohidratos.
B
É recomendável dividir esta fase em fase de alongamento
(3a) e fase de indução radicular e pre-aclimatação (3b).
Enraizamento (cont.)
Fase 3a: alongamento
Em certos casos o alongamento dos caules é um pre-requisimo
para a fase de enraizamento
$Os meios de cultura desta fase geralmente não contêm
citicininas como as usadas na fase 2
$Nesta fase pode ser necessário adicionar carvão activado para
neutralizar os efeitos das citicininas da fase 2
$Dependendo do tipo de planta, o alongamento pode pode ser
feito em caules singulares ou em caules agrupados (roseta).
Fase 3b: indução radicular e pre-aclimatação
Frequentemente são as auxinas os reguladores de crescimentos
usados para induzir enraizamento. No entanto, há que ter em
conta que as auxinas inibem o posterior crescimento das raízes.
Melhor enraizamento é geralmente obtido em meios com baixa
concentração de sais (ex. Knop 1/2).
$As raízes que se desenvolvem em condições in vitro, não são
frequentemente aptas para as condições de estufa e podem
ocasionar problemas no momento do transplante (stress hídrico).
$A indução pode ser feita em caules simples ou em caules em
rosetas
$Para além do enraizamento esta fase deve favorecer a
aclimatação posterior das plantas. Para isto pode-se: favorecer
as condições autotróficas;
suplementar as plantas com
carbohidratos, diminuir a humidade relativa dos recipientes da
cultura, micorrização, utilização de substratos inertes (e.g.
rockwool, tacos de celulose, espuma de poliuretano.
Fase 4
Aclimatação
Fase 4: Aclimatação
Factores ambientais
Humidade relativa
Luz
Enfermidades patogénicas
Factores da Planta
Morfologia estomática
Funcionamento estomático
Dormência
Formação da cera epi-cuticular
Capacidade fotossintética
Fase 4: aclimatação
(cont.)
O objectivo desta fase é a de optimizar a
transferência das plantas da condição in vitro as
condições de campo ou de estufa.
A maior preocupação deverá ser a de minimizar as
perdas e acelerar os procedimentos.
Exemplo: aclimatação em roseiras
Ver também: aclimatação
Fases da micropropagação
(esquema geral)
Técnica da dupla-fase
Sistema de dupla fase aplicado á multiplicação in vitro de
Cordyline terminalis.
Adicionar 20 ml de meio líquido sobre o meio da fase final
(sólido) (inicialmente 100 ml), de maneira a evitar as subculturas.
Isto reduz os custos do processo.
O sistema é usado :
•Durante a fase 2 para plantas que requerem um longo
período de subculturas (e.g. orquídeas, uma subcultura leva
aproximadamente 6 meses, meio fresco é adicionado aos 3
meses em cultura);
•Na fase final para induzir alongamento e/ou enraizamento.
Os ingredientes clássicos usados na técnica de dupla fase
são: macro nutrientes de Knop ½ concentração;
"carvão activado;
"açúcares;
"auxinas
Desenvolviment
o posterior
Rosas em contendor
de plástico
Enchimento com
meio para dupla-fase
Efeito do sistema de dupla fase no crescimento
in vitro de Cordyline terminalis.
Tratamento
Peso
Peso médio
Peso meio Nº médio médio dos dos rebentos
rebentos
(g) 4
por
de
contenedo rebentos
no
semanas
depois do
r
com > transplant
(g)
2.5 cm
e
transplante
(g)
(g)
Fase 2 cultura
transferidas para
meio fresco no
início da Fase 3
23.3 ± 5.5
22.4 ±
5.5
0.139 ±
0.013
Fase 2 cultura na
qual foi adicionado
meio fresco na Fase
3
28.0 ± 1.6
51.4 ±
6.9
0.191 ±
0.022
0.174
0.269
Vantagens da Micropropagação
! As plantas são frequentemente mais uniformes
! Pode ser a única forma de as propagar
vegetativamente
! As plantas tem geralmente um crescimento mas
rápido
! Maduram mais rápido que as propagadas por
sementes
! Pode ser usada para produzir linhas parentais
para produzir sementes. Para manter as linhas
parentais. Para prevenir depressão por
consanguinidade
Desvantagens da
Micropropagação
!
A propagação massiva não pode ser aplicada
actualmente em todas as espécies vegetais
! A regeneração pode não ser possível.
Especialmente para árvores lenhosos
adultos. Existem mais problemas para obter
raízes que rebentos
! Podem não ter um crescimento uniforme e
em lugar disso ter diferentes taxas de
crescimento e maduração in vitro
Aplicações da
Micropropagação
%1. Propagação clonal
%2. Propagação de plantas difíceis de
propagar por outra via ou plantas muito
valiosas
%3. Introdução de novos cultivares
%4. Propagação vegetativa de plantas mães
ou parentais
%5. Eliminação de patogenias
%6. Armazenamento de germoplasmas
Alguns exemplos
Robotização
A mão de obra representa aproximadamente
70% do custo de uma planta micropropagada.
Por este motivo muitos laboratórios de
micropropagação estão instalando-se em
países onde a mão de obra é mais barata.
Uma alternativa é a utilização de robots.
Existem no entanto, alguns problemas
específicos com a robotização da cultura de
tecidos, alguns destes são:
!Os tecidos vegetais são frágeis
!Não estão presentes tecidos vegetais
idênticos
!È necessária uma manipulação asséptica
A figura seguinte representa a configuração
de um sistema robótico totalmente
automatizado para a multiplicação de
Chrysanthemum. Neste sistema o braço do
robot efectua as operações de corte e
transplante.
Bio reactores a pequena escala
Bio reactores em grande escala não são favoráveis á
micropropagação pois são demasiado caros e
representam um sistema com alto risco em perdas de
grande número de plantas simultaneamente.
Pequenos bio reactores dão maior flexibilidade e permitem
um controlo individual dos componentes. São exemplos:
Nalgene TM unidades de filtração, o RITA TM (Cirad,
Montpellier) e LifeReactor TM da Osmotek.
Nalgene
TM filter
units
Lifereactor TM
RITA TM