1.2.
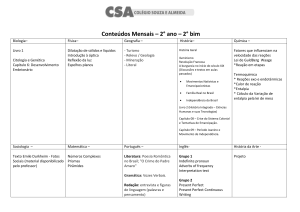
Lei dos Gases
A lei de Charles, da luz a teoria cinética dos gases,
permite-nos conceituar a temperatura de uma
forma diferente da tradicional ou clássica. Pela lei
de Charles, mantendo-se a massa, a espécie
química, o estado gasoso e a pressão, e
aumentando-se o volume, a temperatura deve
aumentar. Mantendo-se a massa, o número de
moléculas (ou de moles) permanece constante.
Aumentando-se o volume, o percurso que cada
molécula deve efetuar até chocar-se com a parede
do recipiente aumenta. Se a velocidade molecular
permanecesse constante, o número de colisões por
unidade de tempo diminuiria e seria de se esperar
uma queda de pressão. Como a pressão
permanece constante admitimos que a velocidade
molecular aumenta. Percebemos aí uma relação
entre velocidade molecular e temperatura, o que
nos induz a pensar em temperatura absoluta como
uma medida da energia cinética molecular média
de um conjunto de moléculas. O conceito de
temperatura absoluta torna-se claro e o zero
absoluto representaria o repouso molecular
(translacional). Tanto a lei de Boyle quanto a lei de
Charles referem-se a transformações que ocorrem
em um sistema gasoso fechado, ou seja, no qual a
massa não atravessa as fronteiras do mesmo.
1.2.1.
Lei de Boyle
1.2.3.
GASES E TERMODINÂMICA
1. Gases
1.1.
Generalidades
Num gás a densidade é baixa e, portanto, as
moléculas estão em média muito afastadas umas das
outras. As suas interações são muito fracas, porque
as forças entre moléculas decrescem muito
rapidamente com a distância. As densidades
suficientemente baixas, todos os gases se comportam
da mesma forma, isto é, o volume V que ocupam é
inversamente proporcional à pressão p e diretamente
proporcional à temperatura T e à quantidade de
substância n. Estas relações constituem as
conhecidas leis dos gases, que foram muito
importantes no desenvolvimento da Química. A
relação entre V e p, a chamada lei de Boyle, é
conhecida há muito mais tempo que as outras duas.
Ao contrário de quantidade de substância e
temperatura, pressão e volume são grandezas de que
temos uma noção intuitiva e que foi, portanto, possível
medir muito antes daquelas.
A primeira destas leis foi estabelecida por Robert
Boyle em 1662 e diz que "o volume de uma dada
massa de gás mantida a temperatura constante é
inversamente proporcional à pressão"
𝑉𝑜𝑙𝑢𝑚𝑒 ∝
1
𝑃𝑟𝑒𝑠𝑠ã𝑜
𝑃𝑉 = 𝐶𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒
Ou simplesmente 𝑉 ∝
𝑃=
1
𝑃
𝐶𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒
𝑉
A força total (ou resultante) exercida pelas moléculas
do gás, num instante t, sobre a unidade de área do
recipiente, é a pressão P. Ou seja, P = F/A, em que F
é a força resultante agindo sobre uma área
macroscópica A. Aumentando-se o volume V do
sistema o percurso que cada molécula deve efetuar,
até chocar-se com a parede do recipiente, aumenta,
diminuindo o número de colisões na unidade de
tempo e, consequentemente, diminuindo a pressão p,
o que está em acordo com a equação.
1.2.2.
A lei de Avogadro (1811) diz que "volumes iguais
de gases de natureza diversa, nas mesmas
condições de pressão e temperatura, contém o
mesmo número de moléculas". Da forma como está
exposta, a lei de Avogadro refere-se à comparação
entre sistemas gasosos. Interessa-nos explorá-la
de uma forma mais ampla, qual seja, adaptá-la a
determinadas transformações que possam ocorrer
num
sistema gasoso constituído por um
componente (não obrigatoriamente fixo). Essa lei
está relacionada ao volume molar de gases.
Conceito de volume molar de gases: volume
ocupado por um mol de qualquer gás, a uma
determinada pressão e temperatura. Considerando
que o volume molar para qualquer gás seja de 22,4
L/mol, temos que a relação entre o volume e
número de mol é constante:
𝑉
=𝐾
𝑛
Lei de Charles
A lei de Charles (1781) diz que "o volume de uma
massa fixa de um gás, mantido a pressão constante,
é diretamente proporcional à temperatura absoluta":
Lei de Avogadro
A equação expressa que 22,4 litros de qualquer
gás possuem 6,02 x 1023 moléculas (condições de
1 atm e 0 °C).
𝑉𝑜𝑙𝑢𝑚𝑒 ∝ 𝑇𝑒𝑚𝑝𝑒𝑟𝑎𝑡𝑢𝑟𝑎 𝑜𝑢 𝑆𝑖𝑚𝑝𝑙𝑖𝑠𝑚𝑒𝑛𝑡𝑒 𝑉 ∝ 𝑇
1.3.
A Equação de Clapeyron
Vimos através das três leis anteriores como um gás
perfeito se comporta quando mantemos uma variável
constante e variamos as outras duas. A equação de
Clapeyron pode ser entendida como uma síntese
dessas três leis, relacionando pressão, temperatura e
volume.
Em uma transformação isotérmica, pressão e volume
são inversamente proporcionais e em uma
transformação isométrica, pressão e temperatura são
diretamente proporcionais. Dessas observações,
podemos concluir que a pressão é diretamente
proporcional
à
temperatura
e
inversamente
proporcional ao volume.
É importante também salientar que o número de
moléculas influencia na pressão exercida pelo gás, ou
seja, a pressão também depende diretamente da
massa do gás. Considerando esses resultados, Paul
Emile Clapeyron (1799-1844) estabeleceu uma
relação entre as variáveis de estado com a seguinte
expressão matemática:
𝑃𝑉
=𝑅
𝑛𝑇
Onde n é o número de mols e R é a constante
universal dos gases perfeitos. Essa constante pode
assumir os seguintes valores:
𝑎𝑡𝑚. 𝐿
𝐽
𝑅 = 0,082
= 8,31
𝑚𝑜𝑙. 𝐾
𝑚𝑜𝑙. 𝐾
1.4.
Equação de Van der Waals
𝑉
=𝐾
𝑇
A relação entre volume e temperatura pode ser
demonstrada pela fórmula:
𝑉1 𝑉2
=
𝑇1 𝑇2
1.5.2.
Transformação isovolumétrica:
Nesse caso o volume permanece constante e a
pressão e temperatura é que variam. Um aumento na
temperatura de um gás influi no aumento da pressão
por ele exercida, de forma que o quociente seja
constante.
𝑃
=𝐾
𝑇
Logo se estabelece a relação:
𝑃1 𝑃2
=
𝑇1 𝑇2
1.5.3.
Transformação isotérmica:
A temperatura permanece constante e as variáveis
são a pressão e o volume. Quando aumentamos a
pressão sobre um gás, o volume ocupado por ele
diminui, o que faz com que o produto dessas
grandezas seja constante:
𝑃𝑉 = 𝐾
A equação de estado de um gás ideal não tem em
consideração dois factos que estão presentes em
sistemas constituídos por gases reais (como o
oxigénio, o azoto, entre outros):
As moléculas formam o gás e têm volume, por
isso ocupam espaço;
As moléculas possuem forças de interação
entre elas, sendo essencialmente forças
atrativas.
Sendo assim, com o objetivo de corrigir a equação de
estado de um gás ideal, surge a equação de estado
de Van der Waals.
K= constante
Logo se estabelece a relação:
𝑃1 𝑉1 = 𝑃2 𝑉2
2. Termoquímica
2.1.
É a quantidade de calor necessária para aquecer 1,0
grama de água pura em 1°C [1caloria = 4,18400
joules]
2.2.
1.5.
Transformações Gasosas
1.5.1. Transformação isobárica
Acontece quando a pressão é constante e o volume e
a temperatura variam. Se aumentarmos a temperatura
de um gás e mantivermos constante sua pressão,
observaremos um aumento do volume ocupado pelo
gás.
Caloria
Entalpia (H) e variação de entalpia (∆𝑯)
Entalpia é uma grandeza física que mede a energia
térmica de um sistema. Essa energia está presente
nas ligações internas das substâncias. Nas reações
químicas essas ligações se rompem para se
reagrupar, podendo, nesse processo, ceder ou
receber energia térmica. Não existe uma maneira de
se determinar a entalpia H de uma substância, mas
existem métodos seguros de medir a variação de
entalpia ∆𝐻
2.3.
Entalpia Padrão (H°)
Como a determinação da entalpia da substância é
impossível, determina-se uma entalpia padrão igual a
zero como referência. Logo a entalpia padrão de uma
substância corresponde à sua forma mais estável à
pressão de 1 atm e a 25°C de temperatura, sendo
indicada por H°. Todas as substâncias simples no
estado padrão e na sua forma mais estável (mais
comum) tem entalpia igual a Zero
2.4.
Reações Endotérmicas
São as reações químicas que absorvem calor. Neste
caso, a entalpia dos produtos (HP) é maior que a
entalpia dos reagentes (HR), ou seja, a variação da
entalpia é positiva (∆𝐻 > 0)
3.
3.1.
Termodinâmica
Introdução
A Termodinâmica é a ciência que estuda as trocas de
energia que ocorrem entre o sistema e as vizinhanças
durante uma mudança de estado. Está baseada em
quatro generalizações, conhecidas como Princípios ou
Leis da Termodinâmica, que governam as
transformações de um tipo de energia em outro.
3.2.
Quanto
à
Sistema Aberto – quando há troca de matéria com
a vizinhança.
Sistema Fechado – quando não há troca de matéria
com a vizinhança.
Sistema Isolado – quando não há nenhum tipo de
interação com a
Reações Exotérmicas
São as reações químicas que liberam calor. Neste
caso, a entalpia dos Produtos (HP) é menor do que a
entalpia dos reagentes (HR), ou seja, a variação da
entalpia é negativa (∆𝐻 < 0)
2.5.
ensaio, uma garrafa térmica.
classificação, o sistema pode ser:
Conceitos Básicos
Antes de estudar a Termodinâmica propriamente dita,
é necessário compreender os seus termos mais
usuais, definidos a seguir:
Sistema: é a parte do universo que está sob
investigação; pode ser, por exemplo, um tubo de
Nos dois primeiros casos, pode haver troca
de Energia com a vizinhança.
Vizinhança: é o restante do universo, onde os
efeitos das trocas de energia são observados.
Fronteira: é o espaço que separa o sistema da
vizinhança. Nos dois primeiros casos, pode haver
troca de Energia com a vizinhança.
Propriedades do sistema: são atributos físicos
percebidos pelos sentidos ou por métodos
experimentais de investigação. Podem ser
mensuráveis e não mensuráveis.
Mudança de estado: é a transformação sofrida
pelo sistema ao passar de um estado inicial para
um estado final, ambos bem definidos.
Caminho: é o percurso realizado pelo sistema
durante a mudança de estado, ou seja,
compreende o estado inicial, os estados
intermediários e o estado final.
Processo: é o método pelo qual a mudança de
estado é efetuada. A descrição do processo
consiste em estabelecer as condições das
mudanças de estado: sistema, vizinhanças,
fronteiras, estado inicial, estado final, caminho,
efeitos produzidos nas vizinhanças, entre outros.
Ciclo: é o caminho que o sistema percorre quando,
ao sofrer uma mudança de estado, retorna ao
estado inicial.
Variável de estado: é uma grandeza que não
depende do caminho, mas somente dos estados
inicial e final.
Equação termodinâmica
Em uma equação termodinâmica devemos
indicar:
A variação de entalpia
O estado físico de cada participante
As variedades alotrópicas de cada participante
A temperatura e pressão em que ocorrem as
transformações
Os números de mol de cada participante
Por exemplo:
𝐶𝑔𝑟𝑎𝑓 + 𝑂2(𝑔) → 𝐶𝑂2(𝑔) ∆𝐻 = −394 𝑘𝑗 𝑎 25°𝐶 𝑒 1 𝑎𝑡𝑚
Estes conceitos básicos devem ser bem assimilados a
fim de que se possa iniciar um estudo termodinâmico.
3.3.
Lei Zero da Termodinâmica
“Se dois sistemas estão em equilíbrio entre si e
em equilíbrio térmico com um terceiro sistema,
consequentemente
os
três
sistemas
se
encontrarão em equilíbrio térmico”. R. H. FOWLER
A importância da Lei Zero da Termodinâmica para o
conceito da temperatura não foi completamente
compreendida até que a Termodinâmica tivesse
atingido certo grau de desenvolvimento. A igualdade
de temperatura entre dois sistemas em equilíbrio
térmico constitui o postulado básico para que se
disponha de uma definição desta grandeza. A lei zero
define temperatura sem depender da sensação
fisiológica de quente e frio.
3.4. Primeira Lei da Termodinâmica
3.4.1.
na variação da altura de uma massa nas das
vizinhanças.
Conclusões importantes sobre a definição de W:
W aparece apenas nas fronteiras do sistema;
W aparece apenas nas mudanças de estado;
Os efeitos do W são observados na vizinhança;
W = m.g.h (Gravitacional; h = Altura);
W = F. L (Mecânico; F = força; L = Comprimento);
W = P. ∆V (Expansão / Compressão Volumétrica;
∆V = variação de volume);
Quantidade algébrica: (+ ou –);
Introdução
Chamamos de 1ª Lei da Termodinâmica, o princípio
da conservação de energia aplicada à termodinâmica,
o que torna possível prever o comportamento de um
sistema gasoso ao sofrer uma transformação
termodinâmica. Analisando o princípio da conservação
de energia ao contexto da termodinâmica:
Um sistema não pode criar ou consumir energia, mas
apenas armazená-la ou transferi-la ao meio onde se
encontra, como trabalho, ou ambas as situações
simultaneamente,
então,
ao
receber
uma
quantidade Q de calor, esta poderá realizar um
trabalho 𝜏 e aumentar a energia interna do
sistema ΔU, ou seja, expressando matematicamente:
Calor
Trabalho
Energia
Interna
∆𝑼
Recebe
Realiza
Aumenta
>0
Cede
Recebe
Diminui
<0
Não
troca
Não realiza e
nem recebe
Não varia
=0
Exemplo: Ao receber uma quantidade de calor Q=50J,
um gás realiza um trabalho igual a 12J, sabendo que a
Energia interna do sistema antes de receber calor era
U=100J, qual será esta energia após o recebimento?
3.5.
Trabalho e Calor
São conceitos de fundamental importância na
termodinâmica e que precisam ser completamente
entendidos, uma vez que têm significados mais
restritos (são quantidades que podem assumir valores
positivos ou negativos).
Trabalho (W) – É qualquer quantidade que escoa
através das fronteiras de um sistema durante uma
mudança de estado e é completamente conversível
Calor Q – é qualquer quantidade que escoa através
das fronteiras de um sistema, durante uma
mudança de estado, devido à diferença de
temperatura entre o sistema e as vizinhanças.
Fluxo: Maior temperatura para menor temperatura.
Conclusões importantes sobre a definição de Q:
Q aparece somente na fronteira do sistema;
Q aparece somente durante a mudança de estado;
Q se manifesta através dos efeitos nas
vizinhanças;
Q = m. c. ∆T é a quantidade em gramas de água
nas vizinhanças que sofre aumento de 1ºC em
condições iniciais de pressão e temperatura bem
definidas;
É uma quantidade algébrica (positiva ou negativa);
3.6.
Entalpia
É uma função de estado de um sistema que reflete a
capacidade de troca de calor do sistema com a
vizinhança, durante mudança de estado a pressão
constante. É uma consequência da Primeira Lei da
Termodinâmica e surge como combinação de duas
outras funções de estado.
𝐻 = 𝑈 + 𝑃𝑉; ∆𝐻 = ∆𝑈 + 𝑃𝑉
Exemplo: Quando a reação se processar em um
recipiente aberto (pressão constante) e o volume final
for maior que o volume inicial, tem-se:
1ª Lei ∆𝑈 = 𝑄 − 𝑊 ; Sabendo-se que 𝑊 = 𝑃∆𝑉
∆H = ∆U + P∆V
igual a zero. Por exemplo, para descobrir a entalpia da
molécula de água é só usar o valor da entalpia da
reação de formação dessa molécula:
o Entalpia de Combustão:
CH4(g) + ½ O2 → 1CO2(g) + 2 H2O ΔH = -890,4 kJ/mol
o Entalpia de Neutralização:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
ΔH = -57,7 kJ/mol
o Entalpia de Solução:
KI(s) → K+(g) + I-(g) ΔHret = +623 kJ/mol
K+(g) + I-(g) → K+(aq) + I-(aq) ΔHhid = -611 kJ/mol
KI(s) → K+(aq) + I-(aq) ΔHsol = ΔHret + ΔHhid
ΔHsol = (+623 + (-611)) kJ/mol
ΔHsol = + 21 kJ/mol
∆U = ∆H – P∆V
3.7.
Lei de Hess
Substituindo em ∆𝑈 = 𝑄 – 𝑊:
Logo ∆𝐻 – 𝑃∆𝑉 = 𝑄 – 𝑃∆𝑉
∆𝐻 = 𝑄; Fluxo de
calor entre o sistema e as vizinhanças durante
mudança de estado a pressão constante.
Isto implica que:
“A variação de entalpia (quantidade de calor
liberada ou absorvida) em uma reação química
depende apenas dos estados inicial e final da
reação”.
∆H > 0; Q > 0: Calor absorvido pelo sistema e
resfriamento das massas nas vizinhanças.
∆H < 0; Q < 0: Calor é liberado pelo sistema e
aquecimento nas vizinhanças. Da mesma forma, a
variação de energia interna pode ser associada a
QV.
Sinal de ∆H
∆H > 0
Processo Endotérmico – Resfriamento
das vizinhanças.
∆H < 0
Processo Exotérmico – Aquecimento
nas vizinhanças.
Existem vários tipos de reações e mudanças de
estado físico, existem também vários tipos de entalpia.
A esses dois caminhos correspondem dois valores
experimentais, para as variações de entalpia, supondo
pressão e temperatura constantes.
Entalpia de Mudança de Estado Físico:
como o próprio nome diz, ela designa a energia
necessária para que 1 mol de substância, nas
condições-padrão de temperatura e pressão, mude de
estado físico. Dentro desse tipo de entalpia, temos:
o Entalpia de Vaporização:
H2O(l) → H2O(v) ΔH vaporização = +44 kJ/mol
o Entalpia de Fusão:
H2O(s) → H2O(l) ΔH fusão = +7,3 kJ
o Entalpia de Liquefação:
H2O(v) → H2O(l) ΔH liquefação = -44 kJ/mol
o Entalpia de Solidificação:
H2O(l) → H2O(s) ΔH solidificação = -7,3 kJ/mol
Entalpia de Formação: calor liberado ou
absorvido na formação de 1 mol de uma substância a
partir de seus elementos constituintes, que são
substâncias simples, no estado padrão, com a entalpia
Primeiro caminho:
C(grafite) + O2(g) CO2(g) ΔH = -393,3 kj
Segundo caminho:
C(grafite) + 1/2O2(g) CO(g) ΔH1 = -110,3 kj
CO(g) + 1/2O2(g) CO2(g) ΔH2 = -283,0 kj
Somando: ΔH1 + ΔH2 = -110,3 + (-283,0) = -393,3
Portanto: ΔH = ΔH1 + ΔH2
Conclusão
“Partindo-se sempre de um mesmo estado inicial e
chegando-se sempre a um mesmo estado final, o
ΔH será sempre o mesmo, quer a reação seja
direta, quer ela se efetue em várias etapas. ”
O ΔH independe do caminho percorrido durante a
reação. Cada estado tem uma entalpia ou conteúdo
de calor (H) fixo e bem definido:
● no estado inicial: H inicial tem valor fixo;
● no estado final: H final também tem valor fixo.
A entalpia é função de estado, ou seja, o valor de ΔH
é fixo e bem definido, não dependendo dos estados
intermediários. Por isso, a lei de Hess é também
conhecida como a lei dos estados inicial e final.
3.7.1.
Consequências da lei de Hess
1ª As equações termoquímicas podem ser somadas
como se fossem equações matemáticas, daí a lei de
Hess ser também chamada de lei da soma dos
calores de reação.
2ª Invertendo uma equação termoquímica, devemos
trocar o sinal de ΔH.
Isso representa a conservação de energia entre os
estados inicial e final.
3ª Multiplicando (ou dividindo) uma equação
termoquímica por um número diferente de zero, o
valor de ΔH será também multiplicado (ou dividido) por
esse número.
As equações termoquímicas podem sofrer tratamentos
matemáticos desde que esses tratamentos sejam
feitos também com os valores de ΔH.