Enviado por
common.user10321
REAÇÃO DE SÍNTESE OU ADIÇÃO

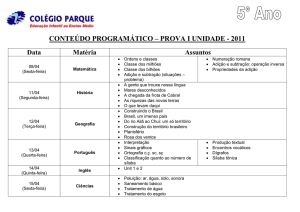
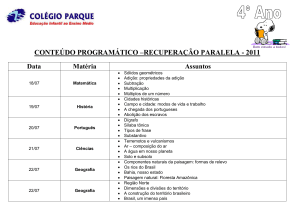
REAÇÃO DE SÍNTESE OU ADIÇÃO INTRODUÇÃO • Reações químicas são processos que transformam uma ou mais substâncias, chamados reagentes, em outras substâncias, chamadas produtos. Em uma linguagem mais acadêmica, dizemos que uma reação química promove mudança na estrutura da matéria. TIPOS DE REAÇÕES • Reações de síntese ou adição • Reações de análise ou decomposição • Reações de deslocamento • Reações de dupla-troca REAÇÃO DE SÍNTESE OU ADIÇÃO • As reações de síntese ou adição são aquelas onde substâncias se juntam formando uma única substância. Representando genericamente os reagentes por A e B, uma reação de síntese pode ser escrita como: REAÇÃO DE SÍNTESE OU ADIÇÃO • Veja alguns exemplos: Fe + S 2H2 + O2 H2O + CO2 FeS 2H2O H2CO3 • Perceba nos exemplos que os reagentes não precisam ser necessariamente substâncias simples (Fe, S, H2, O2), podendo também ser substâncias compostas (CO2, H2O) mas, em todas elas o produto é uma substância "menos simples" que as que o originaram. REAÇÃO DE SINTESE OU ADIÇÃO • As reações de síntese ou adição podem ser classificadas em total ou parcial: • SÍNTESE PARCIAL Será parcial quando pelo menos um dos reagentes for um composto, ou seja, uma substância formada por mais de um tipo de elemento, como nos exemplos abaixo: CaO + H2O → Ca(OH)2 REAÇÃO DE SÍNTESE OU ADIÇÃO HCl(g) + NH3(g) → NH4Cl(s) Esse último exemplo ocorre quando aproximamos dois frascos contendo, respectivamente, ácido clorídrico aquoso (HCl(aq)), que libera o gás clorídrico(HCl(g)), e o hidróxido de amônio (NH4OH(aq)), que libera o gás amônia (NH3(g)). O produto, cloreto de amônio (NH4Cl(s)), pode ser visualizado pela névoa que é formada. REAÇÃO DE SÍNTESE OU ADIÇÃO • SÍNTESE PARCIAL A reação de síntese ou adição será total, quando todos os reagentes forem substâncias simples, ou seja, formadas apenas por um único tipo de elemento. Conforme os exemplos abaixo: 3 H2(g) + N2(g) → 2 NH3(g) C + O2 → CO2 S + O2 → SO2 2 Mg(s) + 1 O2 → 2 MgO(s) REAÇÃO DE SÍNTESE OU ADIÇÃO 2 Mg(s) + 1 O2 → 2 MgO(s) Consiste na queima de uma fita de magnésio, originando o óxido de magnésio (2 MgO(s)). É possível ver uma grande liberação de luz branca, que é utilizada em flashes fotográficos descartáveis e foguetes sinalizadores. EXERCÍCIO RESOLVIDO (UEFS) A equação química: Na2O(s) + SO2(g) → Na2SO3(s) representa uma reação de: a) deslocamento; b) dupla-troca; c) oxirredução; d) síntese; e) análise. (UEFS) A equação química: Na2O(s) + SO2(g) → Na2SO3(s) representa uma reação de: a) deslocamento; b) dupla-troca; c) oxirredução; d) síntese; e) análise. Letra d). Como essa reação apresenta apenas um único produto, trata-se de uma reação de síntese.