Lista de Exercícios
Equilíbrio Químico – 2º Ano
1. Sabendo-se que no equilíbrio: H2(g) + I2(g)
2HI(g) A pressão parcial do Hidrogênio é
0,22 atm, a do Iodo é 0,22 atm e a do ácido Iodídrico é 1,56 atm, o valor do Kp é?
2. N2O4 e NO2, gases poluentes do ar, encontram-se em equilíbrio, como indicado:
N2O4
2NO2
Em uma experiência, nas condições ambientes, introduziu-se 1,50 mol de N2O4 em um reator
de 2,0 litros. Estabelecido o equilíbrio, a concentração de NO 2 foi de 0,060 mol/L. Qual o valor
da constante Kc, em termos de concentração, desse equilíbrio?
a) 2,4 x 10-3
c) 5,0 x 10-3
b) 4,8 x 10-3
d) 5,2 x 10-3
e) 8,3 x 10-2
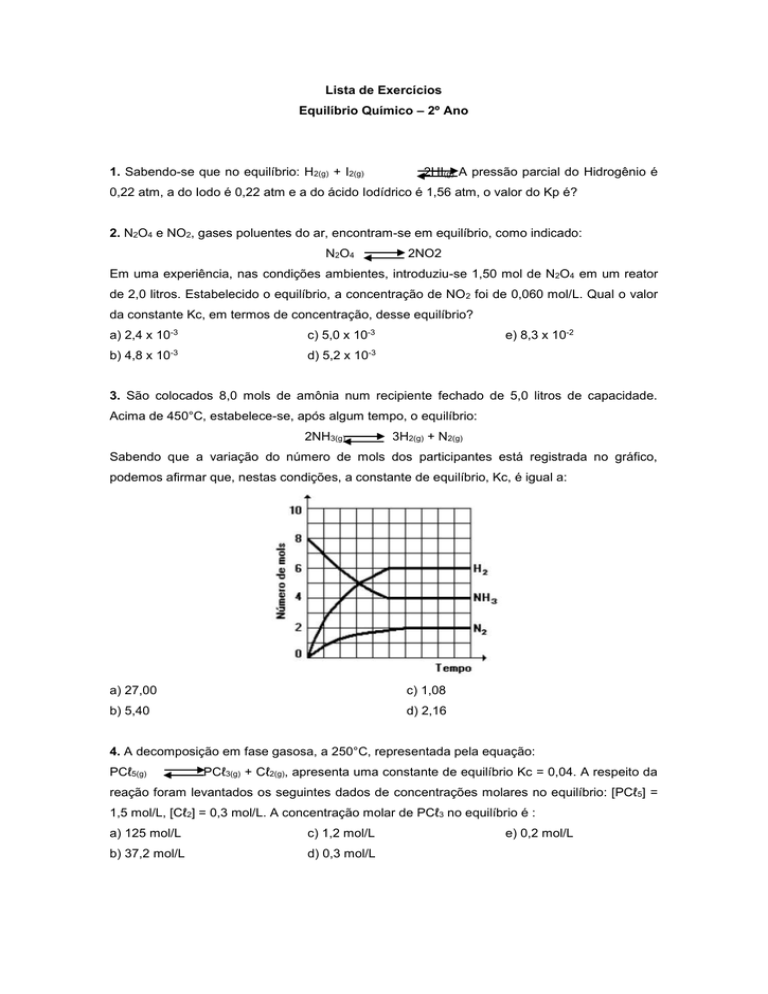
3. São colocados 8,0 mols de amônia num recipiente fechado de 5,0 litros de capacidade.
Acima de 450°C, estabelece-se, após algum tempo, o equilíbrio:
2NH3(g)
3H2(g) + N2(g)
Sabendo que a variação do número de mols dos participantes está registrada no gráfico,
podemos afirmar que, nestas condições, a constante de equilíbrio, Kc, é igual a:
a) 27,00
c) 1,08
b) 5,40
d) 2,16
4. A decomposição em fase gasosa, a 250°C, representada pela equação:
PCℓ5(g)
PCℓ3(g) + Cℓ2(g), apresenta uma constante de equilíbrio Kc = 0,04. A respeito da
reação foram levantados os seguintes dados de concentrações molares no equilíbrio: [PCℓ5] =
1,5 mol/L, [Cℓ2] = 0,3 mol/L. A concentração molar de PCℓ3 no equilíbrio é :
a) 125 mol/L
c) 1,2 mol/L
b) 37,2 mol/L
d) 0,3 mol/L
e) 0,2 mol/L
5. Bicarbonato de sódio sólido é usado como fermento químico porque se decompõe
termicamente, formando gás carbônico, de acordo com a reação representada pela equação
química:
2NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(g)
Escreva a expressão matemática para a constante de equilíbrio expressa em termos de
concentração (Kc) e em termos de pressões parciais (Kp).
6. (PUC-RS) O monóxido de dinitrogênio, quando inalado em pequenas doses, produz uma
espécie de euforia, daí ser chamado de gás hilariante. Ele pode ser obtido por meio da
decomposição do nitrato de amônio, conforme equação representada a seguir:
NH4NO3(s)
N2O(g) + 2H2O(g)
ΔH = - 36,03 kJ/mol
Com relação a essa reação em equilíbrio, está correto
a) a produção de monóxido de dinitrogênio aumenta com o aumento de temperatura.
b) a adição de um catalisador aumenta a formação do gás hilariante.
c) o equilíbrio químico é atingido quando as concentrações dos produtos se igualam.
d) um aumento na concentração de água desloca o equilíbrio químico no sentido da reação de
formação do monóxido de dinitrogênio.
e) uma diminuição na concentração de monóxido de dinitrogênio desloca o equilíbrio químico
no sentido da reação de decomposição do nitrato de amônio.
7. Atualmente, o processo industrial utilizado para a fabricação de H 2SO4 é chamado "processo
de contacto". Nesse processo, o enxofre é queimado originando SO 2(g). Este gás, juntamente
com O2(g), é introduzido num conversor catalítico, quando ocorre a reação:
2 SO2(g) + O2(g)
2 SO3(g)
Supondo que o espaço livre do conversor seja de 400 litros e nele estejam confinados 80 mol
de SO2, 120 mol de O2 e 200 mol de SO3 sob dadas condições de pressão e temperatura, o
valor de Kc para a reação acima representada, é:
a) 20,8
b) 4,8 x 10-2
c) 8,33
d) 2,4
e) 10,6
8. Podemos afirmar que o equilíbrio químico da reação de obtenção de cloreto de hidrogênio a
partir dos gases hidrogênio e cloro, dada abaixo, pode ser deslocado no sentido da formação
do produto pelo seguinte recurso:
H2 (g) + Cl2 (g)
a) aumentando-se a pressão do sistema.
b) diminuindo-se a pressão do sistema.
2 HCl(g)
c) diminuindo-se a pressão parcial de Cl2.
d) aumentando-se a pressão parcial de Cl2.
e) adicionando-se um catalisador ao meio reacional
9. Considere o equilíbrio
Fe3O4(s) + 4H2(g) → 3Fe(s) + 4H2O(g)
A 150ºC, em recipiente fechado.
Escreva a expressão da constante de equilíbrio da reação. Preveja, justificando, qual será o
efeito da adição ao sistema em equilíbrio de:
a) mais H2(g);
b) mais Fe(s);
c) um catalisador.
10. Em uma câmara de 1,0 L foi adicionado 1,0 mol de nitrogênio e 1,0 mol de hidrogênio,
ambos no estado gasoso, a 25 °C e 1,0 atm. Ocorreu uma reação química até atingir o
equilíbrio representado pela equação
N2H4(g) ΔH < 0
N2(g) + 2 H2(g)
Analisando as informações anteriores é correto afirmar que, no equilíbrio,
a) as concentrações dos componentes são iguais.
b) as velocidades das reações direta e inversa são iguais.
c) a velocidade da reação direta é o dobro da velocidade Dan reação inversa.
d) a velocidade da reação direta é a metade da velocidade da reação inversa.
11. (Ufsc) Considere o sistema em equilíbrio
2NO(g) + 2CO(g)
N2(g) + 2CO2(g)
∆H= -747kJ.
Assinale a(s) proposição VERDADEIRA(S).
01. A adição de um catalisador favorece a formação dos produtos.
02. Aumentando-se a pressão total sobre o sistema, o equilíbrio não será deslocado.
04. A formação de N2(g) será favorecida se aumentamos a pressão total sobre o sistema.
08. A diminuição da temperatura desloca o equilíbrio para a direita.
16. Aumentando-se a pressão parcial do CO2, o equilíbrio desloca-se para a esquerda.
32. A constante de equilíbrio Kp da reação em termos de pressões parciais, é dado pela
expressão: Kp=[p(N2)].[p(CO2)]2 / [p(NO)]2.[p(CO)]2
12. O pentacloreto de fósforo é um reagente muito importante em Química Orgânica. Ele é
preparado em fase gasosa pela reação
PCl3(g) + Cl2(g) ⇌ PCl5(g)
Um frasco de 3 L contém as seguintes quantidades no equilíbrio, a 200 ºC: 0,120 mol de PCl5;
0,600 mol de PCl3; e 0,0120 mol de Cl2. Calcule o valor da constante de equilíbrio, a essa
temperatura.
13.
(PUC-RJ)
O
gráfico
mostra
a
variação
das
concentrações de H2, I2 e HI, durante a reação de 1 mol de
H2 com 1 mol de I2 num balão de 1 L a uma temperatura
de 100ºC, em função do tempo. A equação da reação é:
H2(g) + I2(g) ⇌ 2 HI(g)
Qual é a constante de equilíbrio dessa reação?
14. (UFV-MG) Considere uma reação hipotética:
A+B⇌C+D
O gráfico da variação da concentração dos reagentes e
produtos, em função do tempo, a
uma dada temperatura, é mostrado abaixo.
A constante de equilíbrio para a reação é:
a) 4
b) 1/16
c) 1/4
d) 6
e) 16
15. (UFMG) 0,80 mol/L de A é misturado com 0,80 mol/L de B. Esses dois compostos reagem
lentamente, produzindo C e D, de acordo com a reação A + B ⇌ C + D. Quando o
equilíbrio é atingido, a concentração de C é medida, encontrando-se o valor 0,60 mol/L.
Qual o valor da constante de equilíbrio Kc dessa reação?
16. PUC-MG) Um mol de H2 e um mol de Br2 são colocados em um recipiente de 10 L de
capacidade, a 575ºC. Atingindo-se o equilíbrio, a análise do sistema mostrou que 0,20
mol de HBr está presente. Calcule o valor de Kc, a 575ºC, para a reação
H2(g) + Br2(g) ⇌ 2 HBr(g)












