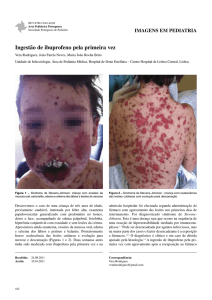
9
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE BIOCIÊNCIAS
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS
MESTRADO EM CIÊNCIAS BIOLÓGICAS
DIEGO DE SOUSA DANTAS
ESTUDO IN SILICO DA INTERAÇÃO DA ALBUMINA DE SORO HUMANO COM O
IBUPROFENO
NATAL – RN
2013
DIEGO DE SOUSA DANTAS
ESTUDO IN SILICO DA INTERAÇÃO DA ALBUMINA DE SORO HUMANO COM O
IBUPROFENO
Dissertação apresentada ao Programa
de
Pós-Graduação
em
Ciências
Biológicas da Universidade Federal do
Rio Grande do Norte, como exigência
parcial para obtenção do título de
Mestre em Ciências Biológicas com área
de concentração: Biologia Funcional e
Estrutural. Linha de Pesquisa: Biofísica.
ORIENTADOR: Prof. Dr. Umberto Laino
Fulco
NATAL-RN
2013
Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial do Centro de
Biociências
Dantas, Diego de Sousa.
Estudo in silico da interação da albumina de soro humano com o
ibuprofeno / Diego de Sousa Dantas. – Natal, RN, 2013.
79 f.: il.
Orientador: Prof. Dr. Umberto Laino Fulco.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do
Norte. Centro de Biociências. Programa de Pós-Graduação em Ciências
Biológicas.
1. Modelagem molecular – Dissertação. 2. Albumina de soro humano –
Dissertação 3. Ibuprofeno – Dissertação. I. Fulco, Umberto Laino. II.
Universidade Federal do Rio Grande do Norte. III. Título.
RN/UF/BSE-CB
CDU 577.2
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE BIOCIÊNCIAS
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS
MESTRADO EM CIÊNCIAS BIOLÓGICAS
A dissertação intitulada “Estudo in silico da interação da albumina de soro humano
com o ibuprofeno” foi aceita pelo programa de Pós-Graduação em Ciências
Biológicas, do centro de Ciências Biológicas, da Universidade Federal do Rio Grande
do Norte, defendida por Diego de Sousa Dantas, julgada e aprovada pelos membros
da banca:
__________________________________________________
Prof. Dr. Umberto Laino Fulco (Orientador)
Departamento de Biofísica e Farmacologia - UFRN
__________________________________________________
Prof. Dr. Eudenilson Lins Albuquerque
Departamento de Biofísica e Farmacologia - UFRN
__________________________________________________
Prof. Dr. Maurizio Serva
Departamento de Biofísica e Farmacologia - UFRN
__________________________________________________
Prof. Dr. Valder Nogueira Freire
Departamento de Física - UFC
Pelo amor incondicional e exemplos de
caráter e perseverança, dedico esse
trabalho à minha mãe!
AGRADECIMENTOS
A conclusão de mais uma etapa na minha vida, não significa o término de algo,
mas a recompensa devida pelo esforço e dedicação, que não teriam sido os mesmos
sem o apoio e influencia de vocês. Por isso, gostaria de agradecer...
A Deus por me mostrar que tudo acontece no momento certo e que com ele o
caminho nem sempre é mais fácil, mas a recompensa é maior.
A minha mãe, Antonia Maria de Sousa, que é meu maior exemplo de vida, e que sofreu
com a dor da distância.
A meu irmão, Jeysibel Dantas, que nos momentos de fraqueza, me levantou e me
mostrou que era possível seguir em frente.
Ao meu orientador Umberto Laino Fulco pela confiança em mim depositada, desde a
aceitação da orientação até a conclusão desse trabalho.
Ao prof. Eudenilson Lins Albuquerque, pela cultura e conhecimento científico;
Ao prof. Valder Freire pela proposição do trabalho, bem como pelas sugestões sempre
pertinentes e bem-vindas.
As professoras Eunice André e Vanessa Rachetti, pelas contribuições para o
engrandecimento do trabalho.
Aos meus amigos de laboratório, que me foram tão importantes durante todo o
período, mas principalmente no início, quando tudo era novo e difícil: Aranthya
Hevelly, Gabriela Ourique, Jefferson Caio, Jéssica Azevedo, Jéssica Viana, José Xavier,
Jonas Ivan, Katy, Raquel Rodrigues, Raniere da Mata e Edvan Moreira.
Aos meus familiares e amigos que, por conta desse meu projeto foram obrigados a
conviver com minha ausência física, em especial a Rejane Ferreira, Renan Cavalcanti,
Josemberg Dantas, Josebel Dantas, Alana Garcia, Deniele Lós, Izabel Dantas, Felipe
Figueiredo e Júnior Marinho.
Aos meus mestres de graduação: profa. Cláudia Holanda, que me ensinou a ser
Humano; as profas. Alba Lúcia, Alecsandra Tomaz e Railda Shelsea, que sempre me
incentivaram a seguir a carreira acadêmica e vibraram comigo em cada conquista.
Aos mestres e funcionários da Faculdade de Ciências da Saúde do Trairí, que dividiram
comigo os momentos de aflição e felicidade.
Aos meus queridos alunos do Curso de Fisioterapia, pelo feedback e demonstrações de
incentivo.
A Ana Beatriz, seu Lusimar e Dona Rosário, que me acolheram como família em Natal.
A Alexsandro Coura, companheiro de apartamento e do saber científico, com quem
comecei a desbravar o novo e com quem aprendi grandes lições;
Ao meu brother, Diego Neves Araújo, que acompanhou todos os meus passos e com
quem compartilho o mesmo ideal científico.
Aos alunos do PPGENF, que me permitiram ser o agregado-mor, em especial a Ana
Angélica, Cecília, Gabi, Manu, Isabelle e aos demais amigos, Arthur e Marcelo, que fiz
através dessa galera massa.
Ao meu amigo Paulo André, pelas noites de estudo, pelas farras, conversas, sonhos,
enfim por tudo!
As amigas Hylarina Diniz e Thalita Rolim, pelo exemplo de dedicação e
responsabilidade.
A Rhu e Dyla, meus amores, que também preencheram meus dias com muita alegria.
Ao amigo Ítalo Morais, pelo ombro amigo e palavras de incentivo.
Aos amigos, Thiago Araujo, Arthur Barbosa, Glaucio Tavares, Francisco Júnior, Karol
Hannah, Marcio Gutemberg, Rodrigo Lima, Daniela Garcia e Julinho Neto, por terem
modificado meus dias e amizade substancial.
Ao amigo Tertuliano Avellar pelo apoio, paciência e incentivo.
A Silmara Dantas e Lívia Oliveira, pessoas iluminadas, pelo encontro de almas.
E a todas as pessoas que não citei, mas que contribuíram para o meu crescimento
pessoal e execução desse trabalho.
A todos vocês o meu muito obrigado!
“O mundo inteiro se abre quando vê
passar alguém que sabe aonde vai!”
Antoine de Saint-Exupery
RESUMO
Na atualidade, os métodos computacionais vêm sendo cada vez mais utilizados para
auxiliar a biologia molecular na caracterização de sistemas biológicos, principalmente
quando esses possuem relevância para a saúde humana. O ibuprofeno é um
antiinflamatório não-esteroidal de larga utilização na clínica. Uma vez na corrente
sanguínea, boa parte do ibuprofeno fica ligada a albumina de soro humano, a principal
proteína do plasma sanguíneo, diminuindo a sua biodisponibilidade e necessitando de
maiores doses para a produção de seu efeito antiinflamatório. Este estudo teve por
objetivo caracterizar, através da energia de interação, como ocorre a ligação do
ibuprofeno à albumina e estabelecer quais os principais aminoácidos e interações
moleculares envolvidas no processo. Para tal desenvolveu-se um estudo in silico, com
utilização de cálculos de mecânica quântica, baseada na Teoria do Funcional da
Densidade (DFT), com aproximações do Gradiente Generalizado (GGA) para descrição
dos efeitos de correlação e troca. A energia de interação de cada aminoácido do sítio
de ligação, com o ligante foi calculada com base no método de fragmentação
molecular com capas conjugadas (MFCC). Além da energia, foram calculadas as
distâncias, tipos de interações moleculares e grupos atômicos envolvidos. Os modelos
teóricos utilizados foram satisfatórios e demonstraram uma descrição mais precisa
com a utilização da constante dielétrica ε=40. Os achados corroboram com a literatura
colocando o sítio Sudlow I (I-FA3) como o principal sítio de ligação e o sítio I-FA6 como
sítio secundário. Contudo, difere quanto à identificação dos aminoácidos mais
importantes, que por meio da energia de interação, em ordem decrescente de energia,
são: Arg410, Lys414, Ser 489, Leu453 e Tyr411 para o Sítio I-FA3 e Leu481, Ser480,
Lys351, Val482 e Arg209 para o sítio I-FA6. A quantificação da energia de interação e a
descrição dos aminoácidos mais importantes abre caminhos para novos estudos que
visem a manipulação da estrutura do ibuprofeno, no sentido de diminuir a interação
desse com a albumina, e consequentemente aumentar a sua distribuição.
PALAVRAS-CHAVE: modelagem molecular; energia de interação; fragmentação
molecular com capas conjugadas; albumina de soro humano; ibuprofeno.
ABSTRACT
Currently, computational methods have been increasingly used to aid in the
characterization of molecular biological systems, especially when they relevant to
human health. Ibuprofen is a nonsteroidal antiinflammatory or broadband use in the
clinic. Once in the bloodstream, most of ibuprofen is linked to human serum albumin,
the major protein of blood plasma, decreasing its bioavailability and requiring larger
doses to produce its antiinflamatory action. This study aimes to characterize, through
the interaction energy, how is the binding of ibuprofen to albumin and to establish
what are the main amino acids and molecular interactions involved in the process. For
this purpouse, it was conducted an in silico study, by using quantum mechanical
calculations based on Density Functional Theory (DFT), with Generalized Gradient
approximation (GGA) to describe the effects of exchange and correlation. The
interaction energy of each amino acid belonging to the binding site to the ligand was
calculated the using the method of molecular fragmentation with conjugated caps
(MFCC). Besides energy, we calculated the distances, types of molecular interactions
and atomic groups involved. The theoretical models used were satisfactory and show a
more accurate description when the dielectric constant ε = 40 was used. The findings
corroborate the literature in which the Sudlow site I (I-FA3) is the primary binding site
and the site I-FA6 as secondary site. However, it differs in identifying the most
important amino acids, which by interaction energy, in order of decreasing energy, are:
Arg410, Lys414, Ser 489, Leu453 and Tyr411 to the I-Site FA3 and Leu481, Ser480,
Lys351, Val482 and Arg209 to the site I-FA6. The quantification of interaction energy
and description of the most important amino acids opens new avenues for studies
aiming at manipulating the structure of ibuprofen, in order to decrease its interaction
with albumin, and consequently increase its distribution.
KEY-WORDS: Molecular modeling; Binding energy; Molecular fragmentation with
conjugated caps; Human serum albumin; Ibuprofen.
LISTA DE ILUSTRAÇÕES
Figura 1: Esquema representativo da estrutura da Albumina de Soro Humano,
destacando seus subdomínios e as pontes dissulfídicas ..............................20
Figura 2: Estrutura da albumina de soro humano evidenciando seus domínios e
subdomínios. Subdomínio IA (azul escuro), IB (Azul ciano), IIA (Verde), IIB
(Verde limão), IIIA (amarelo) e IIIB (vermelho) ............................................21
Figura 3: Estrutura da Albumina de Soro Humano,com visualização para sítios de
ligação dos ácidos graxos (AF), numerados de 1 a 8. ...................................23
Figura 4: Síntese das interações da ASH com alguns fármacos. .....................................25
Figura 5: Representação planar do ibuprofeno com destaque para suas cadeias. ........26
Figura 6: Esquema simplificado da síntese de tromboxano e prostaglandinas, via
ciclooxigenase 1 e 2 respectivamente, mostrando a ação inibitória do
ibuprofeno sobre ambas as ciclooxigenases, e consequentemente sobre
ambos os processos. .....................................................................................29
Figura 7: Imagens da Interface do software Materials Studio® com os parâmetros
selecionados para o processo de otimização de geometria. .......................46
Figura 8: Representação gráfica para as equações envolvidas no cálculo da energia de
interação entre o resíduo (Ri), em vermelho, e o fármaco ou ligante (Li), em
laranja, através da utilização das capas, constituídas de cinco aminoácidos
à direita, em verde, Ci*, e à esquerda, em azul Ci. ............................................................ 49
Figura 9: Imagem da tela do script, mostrando a configuração dos parâmetros e as
categorias escolhidas, vermelho e azul respectivamente. Os parâmetros
antecedidos pelo símbolo #, em verde, não foram selecionados para as
otimizações. ..................................................................................................50
Figura 10: Nomeclatura, estrutura química e classificação dos vinte tipos de
aminoácidos. .................................................................................................55
Figura 11: Albumina de soro humano, mostrando o ibuprofeno nos seus sítios de
ligação. ..........................................................................................................56
Figura 12: Representação planar do ibuprofeno com destaque para suas cadeias em A
e mapa eletrostático do ibuprofeno, evidenciando a região i como mais
eletronegativa em B .....................................................................................57
Figura 13: Curva de protonação (pKa) do ibuprofeno, mostrando que sua forma neutra
ocorre até um pH de 4,91, e acima disso, ele passa a ocorrer na forma
desprotonada................................................................................................58
Figura 14: Curvas de convergência energética do sistema variando por raio em
diferentes constantes dielétricas parra os dois sítios, acima o
comportamento energético para uma constante dielétrica de zero e abaixo
para uma constante de quarenta. Os aminoácidos com energias mais
negativas em um raio de 12 Å do centroide do fármaco estão destacados.60
Figura 15: Energia total do sistema em diferentes raios e constantes dielétrica. ..........62
Figura 16: Energias de interação e contatos intermoleculares dos resíduos que mais
contribuem para a estabilidade do ibuprofeno no sítio I-FA3 e I-FA6,
respectivamente. As barras horizontais rachuradas e pretas expressam a
energia de interação do resíduo com o ibuprofeno, utilizando uma
constante dielétrica de zero e quarenta, respectivamente. No canto direito
da figura, em verde, encontram-se os valores da menor distância entre os
resíduos e o ibuprofeno, e ao lado de cada barra está identificado a região
do fármaco que interage com o resíduo. .....................................................66
Figura 17: Esquema representativo das principais interações químicas que acontecem
no sítio I-FA3. ................................................................................................68
Figura 18: Interações moleculares que acontecem nas diferentes regiões do
Ibuprofeno no sítio I-FA3. .............................................................................69
Figura 19: Interações moleculares que acontecem nas diferentes regiões do
Ibuprofeno no sítio I-FA6. .............................................................................70
Figura 20: Representação tridimensional dos sítios de ligação I-FA3 com o ibuprofeno e
principais resíduos. .......................................................................................72
Figura 21: Representação tridimensional dos sítios de ligação I-FA6 com o ibuprofeno e
principais resíduos. .......................................................................................73
Figura 22: Ilustração do sítio de interação I-FA3 (a cima) e I-FA6 (abaixo) com o
ibuprofeno e os principais resíduos próximos e pós-próximos....................74
Figura 23: Isosuperfícies de potencial eletrostático para os resíduos mais atrativos e
repulsivos para os sítios I-FA3 e I-FA6. .........................................................75
LISTA DE TABELAS
Tabela 1: Estatísticas de refinamento cristalográfico para diferentes ligantes
associados a Albumina de Soro Humano, com destaque para as
propriedades do cristal que contem o Ibuprofeno. ........................................44
Tabela 2: Dados da interação entre os resíduos e o ibuprofeno no sítio I-FA3. .............63
Tabela 3: Dados da interação entre os resíduos e o ibuprofeno no sítio I-FA6. .............64
LISTA DE SIGLAS E ABREVIATURAS
AG –ÁCIDO GRAXO
AINES - ANTIINFLAMATÓRIOS NÃO ESTEROIDAIS
ASH - ALBUMINA DE SORO HUMANO
COX-1 - CICLOOXIGENASE 1
COX-2 - CICLOOXIGENASE 2
DFT - TEORIA DO FUNCIONAL DA DENSIDADE
DRBE - DESENHO RACIONAL DE FÁRMACOS BASEADOS EM ESTRUTURAS
EXC - ENERGIA DE TROCA-CORRELAÇÃO (EXC)
FMO – FRAGMENTAÇÃO DE ORBITAL MOLECULAR
GGA - APROXIMAÇÃO DO GRADIENTE GENERALIZADO
IBP - IBUPROFENO
LDA - APROXIMAÇÃO DE DENSIDADE LOCAL
MFCC – FRAGMENTAÇÃO MOLECULAR COM CAPAS CONJUGADAS
PDB – BANCO DE DADOS DE PROTEÍNAS
SUMÁRIO
1 INTRODUÇÃO ...................................................................................................... 16
1.1 ALBUMINA DE SORO HUMANO .................................................................................19
1.2 IBUPROFENO..............................................................................................................26
1.3 OBJETIVOS .................................................................................................................30
REFERÊNCIAS ...................................................................................................................31
2 TEORIA QUÂNTICA APLICADA À SIMULAÇÃO COMPUTACIONAL ........................... 35
2.1 TEORIA DO FUNCIONAL DA DENSIDADE ...................................................................36
2.1.1 Teoremas de Hohenberg e Kohn .................................................................... 37
2.1.2 Equações de Kohn-Sham ................................................................................ 39
2.2 APROXIMAÇÕES PARA ENERGIA DE TROCA E CORRELAÇÃO ....................................40
REFERÊNCIAS ...................................................................................................................42
3 MATERIAL E MÉTODO ..................................................................................................43
3.1 TIPOLOGIA DO ESTUDO .............................................................................................43
3.2 OBTENÇÃO DAS ESTRUTURAS CRISTALOGRÁFICAS ..................................................43
3.3 ESTADO DE PROTONAÇÃO DO LIGANTE ...................................................................44
3.4 OTIMIZAÇÃO DOS HIDROGÊNIOS ..............................................................................45
3.5 ESTABELECENDO OS LIMITES DO SÍTIO DE LIGAÇÃO ................................................46
3.6 CÁLCULOS REALIZADOS .............................................................................................47
3.7 PARÂMETROS DA SIMULAÇÃO COMPUTACIONAL ...................................................49
REFERÊNCIAS ...................................................................................................................53
4 BIOQUÂNTICA DA INTERAÇÃO DO IBUPROFENO COM A ALBUMINA DE SORO
HUMANO ............................................................................................................... 55
REFERÊNCIAS ...................................................................................................................77
5 CONSIDERAÇÕES FINAIS E PERSPECTIVAS ............................................................. 78
16
1 INTRODUÇÃO
Um dos maiores desafios da atualidade para a biologia molecular é entender
como ocorrem os mecanismos de reconhecimento receptor-ligante. Além disso, tal
entendimento é ponto chave para o sucesso na descoberta e planejamento de novos
fármacos. Dentre as várias metodologias existentes, a obtenção de uma descrição
acurada e automatizada através dos processos computacionais é motivada em virtude
da possibilidade de redução de custos e tempo no desenvolvimento de novos
medicamentos.
A palavra fármaco vem do grego phármakon e significa substância química
empregada como medicamento. O fármaco corresponde a uma micromolécula que
atua no organismo, modulando a resposta biológica por atuar como agonista, ligandose e ativando o receptor, ou antagonista ligando-se ao receptor e bloqueando a ligação
de outra substância a esse receptor ou ao pelo menos ao mesmo sítio (MAGALHAES;
BARBOSA; DARDENNE, 2007).
A necessidade de processos mais sistemáticos, a necessidade de novas drogas
terapêuticas, bem como o avanço de técnicas experimentais para identificação,
isolamento e preparação de proteínas impulsionaram o surgimento do paradigma do
Desenho Racional de Fármacos Baseados em Estruturas (DRBE).
Assim, a área de simulação computacional vem despertando o interesse de
vários pesquisadores, por permitir um estudo teórico prévio, baseado em
conhecimentos físicos sobre as interações receptor-ligante, economizando tempo e
recursos gastos no processo de desenho de fármacos (KUNTZ, 1992; HE; MERZ, 2010).
Metodologias de docking receptor-ligante são amplamente utilizadas dentro do
DRBE, seja para a descoberta de novas moléculas bioativas, através da triagem virtual,
ou para a otimização e refinamento de compostos protótipos já identificados. A figura
1 traz um esquema das etapas do DRBE que vão desde a identificação de um alvo
terapêutico, a seleção das estruturas tridimensionais, tratamento computacionais,
testes in vitro, in vivo e clínicos e ao final o desenvolvimento de um novo fármaco.
17
Durante o processo de reconhecimento molecular, o receptor e o ligante
sofrem mudanças conformacionais, que implica no tratamento de centenas de
milhares de graus de liberdade, por parte de algoritmos. Além disso, o reconhecimento
molecular é um processo altamente dinâmico e complexo, envolvendo um grande
número de interações intermoleculares entre o ligante, a molécula receptora e o
solvente (MAGALHAES; BARBOSA; DARDENNE, 2007).
Atualmente, métodos sofisticados de simulação computacional se apropriam
da química quântica para descrição desses complexos. Devido à alta precisão na
estimativa da afinidade de ligação fármaco-receptor, investigações quânticas estão se
tornando cada vez mais importantes e populares em pesquisas com fármacos
baseados no paradigma do DRBE. Evidenciam-se, assim, os estudos que quantificam as
contribuições individuais de cada resíduo do receptor para a energia de interação total
do sistema, os quais permitem o desenho de novos derivados do ligante com ação
inibitória mais eficiente, resistência a mutações e com menos efeitos adversos
(MAGALHAES; BARBOSA; DARDENNE, 2007).
Infelizmente, essas pesquisas são limitadas pelo tamanho do sistema.
Convencionalmente, apenas um modelo bastante pequeno, aproximadamente 20-200
átomos (o que corresponde ao ligante e até 20 aminoácidos do receptor), é
explicitamente estudado de forma puramente quântica. Contudo, recentemente, o
elevado custo computacional relacionado ao tratamento de um macrossistema é
superado por técnicas de separação e fatiamento do mesmo - Fragment-based
Methods (CHEN; ZHANG; ZHANG, 2004).
A ideia central desses métodos é dividir o bioreceptor em uma série de
pequenos fragmentos para predizer as propriedades do sistema como um todo, a
partir dos cálculos quânticos (energéticos) convencionais direcionados em seus
subsistemas.
Dessa forma, pode-se quantificar e comparar energias de ligação de vários
fármacos dentro de uma mesma classe terapêutica (receptor comum). Com isso, é
possível identificar o fármaco que mais fortemente interage no sítio de ligação, o qual
18
provavelmente será aquele de mais intensa e duradoura atividade farmacológica.
Dados experimentais de IC50 comprovam tal estimativa em diferentes sistemas.
A albumina de soro humano (ASH) se configura como um importante marcador
da atividade farmacocinética de várias moléculas. Por isso, em estudos clínicos ou
estudos que busquem o desenvolvimento de novos fármacos, é importante
determinar a afinidade da ligação com a albumina de soro humano, para aperfeiçoar o
comportamento farmacocinético desses, uma vez que grande parte dos fármacos fica
ligados à albumina de soro humano e, portanto, não desempenham sua função
(COLMENAREJO, 2003).
O ibuprofeno foi escolhido como fármaco de interesse em virtude de sua larga
utilização na clínica médica, sendo considerado um medicamento indispensável à
saúde humana (WHO, 2010). Além disso, seus impactos vão além da simples resolução
de patologias, já sendo comprovado cientificamente seus danos à ecossistemas
aquáticos, em virtude da adsorção do fármaco no meio ambiente (SARAVANAN et al.,
2012).
Embora exista uma ampla variedade de dados cristalográficos relativos à
ligação de diferentes fármacos à albumina, o número de trabalhos nos quais se faz
uma análise no escopo da biofísica molecular destas ligações é bastante limitado.
Dessa forma, objetivou-se nesse trabalho, descrever como ocorre a interação
entre o ibuprofeno e a albumina de soro humano, em uma perspectiva teórica através
de simulações de dinâmica molecular e cálculos baseados na teoria do Funcional de
Densidade (DFT).
Para isso, quantificou-se as energias de interação e as distâncias de ligação e
comparou-se o efeito de diferentes constantes dielétricas para a descrição do sistema.
Além disso, esse trabalho objetivou a descrição comparativa dos dois sítios de ligação
do ibuprofeno à albumina de soro humano.
19
1.1 ALBUMINA DE SORO HUMANO
O nome albumina possui origem alemã e deriva do termo albumen, usado
geralmente para indicar proteínas, que por sua vez, deriva da palavra latina albus, que
faz referência a parta branca do ovo, rica em proteínas. Biologicamente, a palavra
albumina refere-se a um grupo proteico heterogêneo, que além de agrupar o
componente proteico da clara do ovo, inclui a albumina do soro, albumina do leite e
proteínas urinárias (FANALI et al., 2012).
A albumina de soro humano é uma proteína altamente abundante no plasma
humano (0,6 mM), compreendendo 50-60% do total de proteínas plasmática em
humanos e pertence também a uma família de proteínas homólogas que possuem
características estruturais distintas e propriedades de ligação com ligantes peculiares,
da qual também fazem parte a α-fetoproteina, afamina e a proteína ligadora de
vitamina D (SIMARD et al., 2006; FASANO et al., 2007).
A albumina de soro humano é sintetizada por uma cópia única de gene, o ALB,
localizado no braço longo do cromossomo 4, próximo ao centrômero, na posição q1122. Esse gene possui 15 éxons e 14 íntrons.
O processo de síntese se inicia no citoplasma dos hepatócitos na forma de prépro-albumina que é clivada cotraducionalmente para remover o pré-peptídeo, no
lúmen do retículo endoplasmático, e em seguida, no complexo de Golgi, é clivada para
a retirada o pro-peptídeo e secretada no sangue, onde possui um período de meia vida
de 28-36 dias (GALIANO et al., 1999; ROCHE et al., 2008).
Ao contrário da albumina sérica de outras espécies, a albumina de soro
humano é normalmente não glicosilada, uma vez que não possui o tripepitídeo
aceitador (Asn-X-Thr/Ser) para a N-glicosilação, embora em indivíduos diabéticos e em
algumas formas variantes, ocorre o aumento de uma forma glicosilada não enzimática
(COLMENAREJO et al., 2003; FANALI et al., 2012 ).
A albumina de soro humano consiste em uma macromolécula monomérica com
um peso molecular de 66,438 Da, contendo 585 aminoácidos, 17 pontes dissulfeto e
uma cisteína livre na posição 34. Embora seja monomérica, a albumina possui três
20
domínios em α-hélice (68%) separados por loops extensos e desordenados, sem
nenhum elemento de folha beta (FALANI et al., 2012). São eles: Domínio I (resíduo1195), domínio II (196-383) e domínio III (384-585) (SUGIO et al., 1999).
A estrutura secundária da albumina de soro humano revela subdomínios de αhélices. Os subdomínios A são compostos por seis α-hélices, estando quatro
agrupadas, formando um cluster (a-h1 a a-h4), ladeados por duas α-hélices curtas (ah5 e a-h6). Os subdomínios B, por sua vez, correspondem a um cluster de quatro αhélices (b-h1 a b-h4) (SUGIO et al., 1999) (Figura 1).
Figura 1: Esquema representativo da estrutura da Albumina de Soro Humano,
destacando seus subdomínios e as pontes dissulfídicas.
Fonte:SUGIO et al., 1999.
21
O Domínio III, que se projeta a partir de subdomínio IIB, forma um conjunto em
forma de Y com os domínios II e III, interage apenas com subdomínio IIB. Domínios I e
III são separados por um grande canal criado pelos subdomínios IB, IIIA, IIIB e estão
ligadas por poucos contatos. Tal montagem confere à ASH, com dimensões
aproximadas de 80x80x 30 Å, um formato de coração (COLMENAREJO, 2003; ASCENZI;
FASANO, 2010).
Figura 2: Estrutura da albumina de soro humano evidenciando seus domínios e
subdomínios. Subdomínio IA (azul escuro), IB (Azul ciano), IIA (Verde), IIB (Verde
limão), IIIA (amarelo) e IIIB (vermelho).
Fonte: Dados da pesquisa
22
O primeiro relato de correlação fisiopatológica da ASH foi feito por Hipócrates
400 a.c. quando o mesmo associou a presença de albumina na urina, ao aspecto
espumoso, apresentado por pacientes com doença renal. Contudo, hoje se sabe que a
albumina de soro humano é um biomarcador valioso de muitas doenças incluindo
câncer, artrite reumatoide, isquemia, obesidade pós-menopausal e doenças que
necessitam de monitoramento do controle glicêmico (FANALI et al., 2012).
Em virtude da sua enorme capacidade de ligação, a albumina funciona como
bolsão carreador de muitos componentes endógenos e exógenos, sendo o principal
carreador de ácidos graxos, afeta a atividade farmacocinética de muitas drogas,
promove alterações metabólicas em alguns ligantes, atua como principal antioxidante
do plasma humano e ainda apresenta propriedades pseudo-enzimáticas (ROCHE, 2008;
FANALI et al., 2012).
Abordando especificamente sua relação com os ácidos graxos (AG), a albumina
de soro humano está ligada a mais do que 99% dos ácidos graxos não esterificados
presentes no sangue e atua no transporte passivo dos AGs pela circulação sanguínea,
graças à alta afinidade da albumina com essas moléculas e à presença de múltiplos
sítios de ligação e ligações cooperativas que contribuem para a sua solubilização
(PETITPAS et al., 2001; COLMENAREJO et al., 2003).
Além disso, a ASH apresenta uma distribuição uniforme nos vários tecidos, e
desempenha um segundo papel de remoção dos AG a partir de células doadoras,
minimizando os efeitos das taxas variáveis de produção de ácidos graxos (PETERS,
1996; SIMARD et al., 2005).
Além de ser utilizada clinicamente no tratamento de situações clínica severas,
incluindo hipovolemia, choque, queimaduras, traumas, hemorragias, insuficiência
hepáticas agudas e crônicas, a albumina também é administrada em procedimentos
clínicos como circulação extracorpórea, hemodiálise, suporte nutricional e resuscitação
(FANALI et al., 2012).
Já na biotecnologia, a albumina vem sendo empregada para a fabricação de
adesivos cirúrgicos, biomateriais, na biocromatografia, no aprisionamento de ligantes
e para a fusão de proteínas (FANALI et al., 2012).
23
Um ponto crucial no entendimento dos múltiplos papéis e possíveis aplicações
da ASH corresponde ao estudo de como ocorre a sua ligação aos diferentes ligantes.
A partir da estrutura cristalográfica da albumina de soro humano com o ácido
mirístico (PDB 1bj5) Curry e colaboradores (1998) identificaram cinco sítios de ligação
para os ácidos graxos, um no subdomínio IB (FA1), um entre o subdomínio IA e IIA
(FA2), dois sítios no subdomínio IIIA (FA3 e FA4) e outro no domínio IIIB (FA5). Em
adição a esses, Petitpas et al. (2001), usando novas imagens cristalográficas,
encontraram dois sítios adicionais, um entre os subdomínios IIA e IIB (FA6), um no
subdomínio IIA (FA7) e outro no subdomínio IA (FA8) (Figura 3).
Baseado na diversidade bioquímica e nas estruturas cristalográficas observa-se
que os ácidos graxos de cadeia média e os de cadeia longa possuem afinidade
específica para alguns sítios de ligação (BHATTACHARYA; CURRY; FRANKS, 2000).
Figura 3: Estrutura da Albumina de Soro Humano,com visualização para sítios de
ligação dos ácidos graxos (AF), numerados de 1 a 8.
Fonte: Adaptado de BHATTACHARYA; CURRY; FRANKS, 2000.
24
Os ácidos de cadeia longa possuem maior afinidade para a ligação com os cinco
sítios de ligação descritos para o ácido mirístíco, pois esses consistem em longos bolsos
hidrofóbicos onde as caudas de polimetileno se ligam por interações hidrofóbicas,
juntamente com as faces básicas e polares da cadeia lateral, onde os grupos
carboxilato interagem através de pontes salinas e pontes de hidrogênio. Enquanto os
ácidos graxos de cadeia média demonstram preferência pelos sítios localizados nos
subdomínios IIA e IIIA (COLMENAREJO, 2003).
Além dos ácidos graxos, a albumina de soro humano também se liga e
transporta substâncias endógenas, a exemplo da bilirubina hepática, sais biliares,
hormônios esteróides, hematina, triptofano, tiroxina, algumas vitaminas, alguns sais
metálicos, como o zinco (COLMANAREJO, 2003; GUO et al., 2009 VUSSE, 2009).
Em virtude da sua alta concentração no plasma sanguíneo, a albumina de soro
humano também apresenta um papel de destaque na farmacocinética.
Dos quatro processos farmacocinéticos básicos (absorção, distribuição,
metabolismo e excreção), a distribuição é um dos processos controlados pela ASH, que
por se ligar a essas substâncias hidrofóbicas, contribui para uma distribuição
homogênea, aumentando o tempo de meia vida do fármaco, por impedir que eles
sejam metabolizados precocemente (SIMARD et al., 2006).
Os sítios de ligação da ASH para os fármacos foram descobertos por Sudlow, e
por isso são denominados Sudlow 1 ou sítio da Warfarina, sítio localizado no
subdomínio IIA, e que apresenta afinidade por compostos carregados negativamente e
heterocíclicos grande; e Sudlow 2 ou sítio indolbenzodiazepínico, localizado no
subdomínio IIIA, que se liga preferencialmente a ácidos carboxílicos aromáticos
pequenos (FANALI et al., 2012).
Além dos sítios Sudlow 1 e 2, os sítios menores, a exemplo dos oito sítios de
ligação para os ácidos graxos, também podem se ligar à fármacos, permitindo ligações
múltiplas e simultânea, resultando em uma maior capacidade para a ligação de drogas
(GHUMAN et al., 2005). Uma síntese dos sítios de ligação a alguns fármacos está
representada na figura 4.
25
Figura 4: Síntese das interações da ASH com alguns fármacos.
Fonte: GHUMAN et al., 2005.
Embora a albumina de soro humano apresente uma estrutura tridimensional
bem estabilizada, a mesma em virtude da grande quantidade de aminoácidos
carregados negativamente e positivamente em seu interior, sofre isomerizações
conformacionais reversíveis de acordo com a mudança do pH, o que pode provocar
prejuízos na interação e transporte de outras moléculas (ASCENZI;FASANO, 2010).
De acordo com o pH, a albumina pode assumir a forma expandida (E), que é
composta por 35% de α-hélice; em um pH maior do que 2,7, sofre transição para a
forma rápida (F), composta por 45% de α-hélice, em um pH por volta de 4,3 a 8,0 sofre
transição para o estado normal (N). Acima do pH 8,0 a albumina muda sua
conformação para a forma básica (B) (CARTER; HO, 1994; ASCENZI;FASANO, 2010).
26
1.2 IBUPROFENO
O ibuprofeno (IBP) ou [(R, S) 2-[4-(2-metilpropil)fenil]ácido propanôico,
conforme nomeclatura IUPAC (DRUGBANK, 2012) é uma droga antiinflamatória não
esteroidal, derivada do ácido propriônico e largamente utilizada e tolerada pelos
pacientes (DEWLAND; READER; BERRY, 2009).
Introduzida no mercado para comercialização em 1974 (MUSA; ERIKSSON,
2007), devido ao seu grande consumo em escala mundial, da ordem de centenas de
toneladas por ano, o ibuprofeno é considerado atualmente como um dos
medicamentos essenciais à vida humana (WHO, 2010).
No tocante às características estruturais, podemos dividir o ibuprofeno em três
regiões: a cadeia lateral ácida (região i), a cadeia central, representada pelo anel
benzênico (região ii) e a cadeia lateral hidrofóbica (região iii) (Figura 5).
Figura 5: Representação planar do ibuprofeno com destaque para suas cadeias.
Fonte: Dados da pesquisa
A cadeia lateral ácida representa a região mais importante da molécula e
associada com a sua atividade biológica antiinflamatória, isso porque, esta região
27
encontra-se associada à lipofilicidade e à energia de desprotonação (MUSA; ERIKSSON,
2007).
Além de apresentar uma estrutura linear, a estrutura química do ibuprofeno é
flexível graças à ausência de ligações de hidrogênio, deixando o grupamento carboxila
sempre livre e voltado para fora do plano que contém o anel (OKULIK; JUBERT, 2006).
É um ácido fraco (pka 4.91) e pouco solúvel em água ou soluções levemente
ácidas, por isso ocorre geralmente na forma desprotonada em condições fisiológicas
(MUSA; ERIKSSON, 2007; NAYAK; JAIN, 2011).
Com relação às propriedades farmacocinéticas o Ibuprofeno é rapidamente
absorvido após a administração por via oral, devido a alta solubilidade em lipídios na
forma não ionizada, sendo conduzida por difusão passiva pelo sistema gastrointestinal
e apresentando uma biodisponibilidade de 80% a 90% (GRAHAM; WILLIAMS, 2004).
O ibuprofeno, que geralmente é administrado em uma mistura racêmica, sofre
conversão da sua forma R-ibuprofeno, para a forma mais ativa S-ibuprofeno, e é
oxidado principalmente pelo citocromo P45O para posterior eliminação pelo sistema
renal (GRAHAM; WILLIAMS, 2004).
Essa rápida absorção do ibuprofeno é o que o torna um dos medicamentos
mais elegíveis para crises dolorosas, bem como é ponto de inúmeros estudos que
tentam modificar suas formulações.
Na literatura são descritas várias formulações a exemplo do ibuprofeno
combinado com arginato, ibuprofeno associado a lisina, ibuprofeno sódico diidratado,
ibuprofeno associado a poloxamer, e todas essas novas formulações ainda não tão
populares no comércio, possuem tempo de absorção menor do que sua forma ácida
(DEWLAND; READER; BERRY, 2009).
Na clínica sua utilização ocorre em larga escala, sendo utilizado no tratamento
de dores musculares, cefaleia, dor de dente, dismenorreia, estados febris, artrite
reumatoide, osteoartrose, pós-operatórios odontológicos e cuidados neonatais. Além
desses benefícios estudos apontam uma possível ação antitumoral desempenhada por
esse fármaco, embora seu mecanismo de ação ainda não esteja totalmente
28
compreendido (MUSA; ERIKSSON, 2007; ADATIA; RAINSFORD; KEAN, 2012; JOHNSTON
et al., 2012).
Uma vez na corrente sanguínea, grande parte do ibuprofeno liga-se
reversivelmente e covalentemente às proteínas plasmáticas, principalmente à
albumina de soro humano (GRAHAM; WILLIAMS, 2004).
Devido a sua meia-vida curta, o pico de concentração plasmática e efeito
analgésico máximo são observados cerca de 1,5-2 horas após a administração oral,
havendo uma correlação positiva entre os níveis plasmáticos de ibuprofeno e a
diminuição da dor, especialmente uma hora após a sua administração (DEWLAND;
READER; BERRY, 2009; CHEN et al., 2012).
A ligação do ibuprofeno com a albumina de soro humano acaba provocando
uma diminuição na distribuição dessa droga, pois parte da mesma fica ligada nos
bolsões hidrofóbicos da albumina (GHUMAN et al., 2005). Contudo essa ligação é
saturável e pode ser revertida com o aumento da dose empregada (ALBERT et
al.,1984).
Em contrapartida, nos fluídos cerebrais o ibuprofeno acaba possuindo
concentrações maiores do que quando comparado ao plasma sanguíneo, devido a
ausência das proteínas de ligação no fluido cerebrospinal normal (BANNWARTH et al.,
1995).
Além disso, o ibuprofeno pode ainda estar ligado às proteínas teciduais, a
exemplo da actina, de maneira reversível, porém com ligações mais fracas do que
quando ligado a albumina de soro humano (GRAHAM; WILLIAMS, 2004).
Assim como outras drogas antiinflamatórias não esteroidais (AINEs), o
ibuprofeno atua por reduzir a biosíntese de prostaglandinas através da inibição não
seletiva das ciclooxigenases, inibindo tanto a ciclooxigenase 1 (COX-1) e a
ciclooxigenase 2 (COX-2) (RAO; KNAUS, 2008; HALEN et al., 2009) (Figura 6).
As prostaglandinas são hormônios sintetizados a partir de ácidos graxos, via
ácido araquidônico, e funcionam como mediadores fisiológicos e patológicos
implicados em vários processos, entre eles a dor, inflamação, câncer, glaucoma,
osteoporose, doença cardiovascular, estresse e asma (RAO; KNAUS, 2008).
29
Dessa forma ao inibir a formação das prostaglandinas, via inibição da Cox-2, os
AINEs desempenham seus efeitos analgésicos, antipiréticos e antiinflamatório
(DEWLAND; READER; BERRY, 2009). Porém em contrapartida, a inibição da atividade
da COX-1, altera dramaticamente a produção dos prostanóides, isoenzimas protetoras
da mucosa gástrica, reguladoras do fluxo sanguíneo e indutoras de agregação
plaquetária (MUSA; ERIKSSON, 2007).
Figura 6: Esquema simplificado da síntese de tromboxano e prostaglandinas, via
ciclooxigenase 1 e 2 respectivamente, mostrando a ação inibitória do ibuprofeno sobre
ambas as ciclooxigenases, e consequentemente sobre ambos os processos.
Fonte: arquivo do pesquisador
Em virtude das suas inúmeras aplicações na clínica humana e da sua venda não
necessitar de receituário médico, os AINEs de modo geral, e entre eles o ibuprofeno,
acabam sendo utilizados por longos períodos pela população humana.
Fato preocupante e que tem chamado a atenção dos pesquisadores, para
sintetizar novas formulações mais eficientes, pois a administração prolongada de
30
AINEs apresentam diversos efeitos colaterais indesejados, sendo os mais importantes
as irritações e ulcerações gastrointestinais, inicialmente atrelada apenas aos efeitos da
inibição da COX-1, mas relacionada a inibição de ambas as ciclooxigenases
(VONKEMAN; VAN DE LAAR, 2010; TAKEUCHI, 2012)
Além dos efeitos adversos que causam no organismo, as altas dosagens
utilizadas essas drogas já são facilmente detectáveis no meio ambiente, interferindo
em todo o contexto ambiental e estando cientificamente já relacionada a
desequilíbrios ambientais, por exemplo, em ambientes aquáticos (SARAVANAN et al.,
2012 Dado que reforça a necessidade e urgência de pesquisas que venham a diminuir
a dosagem necessária e maior eficiência da droga.
1.3 OBJETIVOS
1.3.1 Objetivo geral
Descrever através de métodos quânticos como ocorre a interação da albumina
de soro humano com o ibuprofeno.
1.3.2 Objetivos específicos
Quantificar, por meio de cálculos quânticos, a energia e a distância de interação
entre os aminoácidos e diferentes regiões do fármaco;
Avaliar o efeito da constante dielétrica na descrição e convergência energética
do sistema biológico;
Comparar a interação nos dois diferentes sítios de ligação
31
REFERÊNCIAS
ADATIA, A.; RAINSFORD, K. D.; KEAN, W. F. Osteorthritis of the knee and hip. Part II:
therapy with ibuprofen and a review of clinical trials. J Pharm Pharmacol, v. 64, n. 5, p:
626-36, 2012.
ASCENZI, P.; FASANO, M. Allostery in a monomeric protein: the case of human serum
albumin. Biophys. Chem. v. 148, p: 16-22, 2010.
BANNWARTH, R.; LAPICQUE, F.; PEHOURCQ, F.; GILLET, P.; SCHAEVERBEKE, T.;
LABORDE, C. et al. Stereoselective disposition of ibuprofen enantiomers in human
cerebrospinal fluid. British journal of clinical Pharmacology, v. 40, p: 266-269, 1995.
BHATTACHARYA, A. A.; CURRY, S.; FRANKS, N. P. Binding of the general anesthesic
propofol and halothane to human serum albumin: Anatomy of drug site I. J Biol Chem,
v. 276, 2000.
CARTER, D. C.; HO, J. X. Structure of serum albumin. Adv Protein Chem, v. 45, 1994.
CHEN, L. et al. Improved dissolution and anti-inflamatory effect of ibuprofen by solid
dispersion. Front. Med. v.6, n.2, p:195-203, 2012.
COLMENAREJO, G. In silico prediction of Drug-Binding Strengths to Human Serum
Albumin. Medical Research Review. v. 23, n. 3, 2003.
DEWLAND, P. M.; READER, S.; BERRY, P. Bioavailability of ibuprofen following oral
administrations of standard ibuprofen, sodium ibuprofen or ibuprofen acid
incorporating poloxamer in healthy volunteers. BMC Clinical Pharmacology, v.9, n. 19,
2009.
DRUGBANK. Open data drug & drug target database. Ibuprofen. Disponível em:
<http://www.drugbank.ca/drugs/DB01050> Acesso em: 18.10.2012
FANALI; G. et al. Human Serum albumin: From bench to bedside. Molecular Aspects of
Medicine, v. 33,p: 209-90, 2012.
FASANO, M.; FANALI, G.; LEBOFFE, L.; ASCENZI, P. Heme binding to albuminoid
proteins is the result of recent evolution. IUBMB Life, v.59,p: 436–440, 2007.
32
GALIANO, M.; KRAGH-HANSEN, U.; TARNOKY, A. L.; CHAPMAN, J. C.; CAMPAGNOLI, M.;
MINCHIOTTI, L. Genetic variants showing apparent hot-spots in the human serum
albumin gene. Clinica Chimica Acta, v. 289, 1999.
GHUMAN, J.; ZUNSZAIN, P. A.; PETITPAS, I.; BHATTACHARYA, A. A.; OTAGIRI, M.;
CURRY, S. Structural basis of the drug-binding specificity of human serum album. J.
Mol. Biol, v. 353, 2005.
GRAHAM, G. G.; WILLIAMS, K. M. Metabolism and pharmacokinetics of ibuprofen.
In:RAINSFORD, K. D. (org.) Aspirin and related drugs. London: CRC Press, 2004. DOI:
10.1201/9780203646960.ch5
GUO; S.; SHI, X.; YANG, F.; CHEN, L.; MEEHAN, E. J.; BIAN, C.; HUANG, M.Structural
basis of transport of lysophospholipds by human serum albumin. Biochem. J., v. 423,
p: 23-30, 2009.
HALEN, P. K. et al. Prodrug Designing of NSAIDs. Mini-reviews in Medicinal Chemistry,
v. 9, n. 1, p. 124–139, 2009
HE, X.; MERZ, K. M. Divide and conquer Hartree-Fock Calculations on proteins. J. Chem.
Theory Comput., v. 6, n. 2, 2010.
JOHNSTON, P. G.; GILLAM-KRAKAUER, M.; FULLER, M. P.; REESE, J. Evidence-based use
of indomethacin and ibuprofen in the neonatal intensive care unit. Clin Perinatol, v.
39, n. 1, p: 111-36, 2012.
KUNTZ, I. D. Structure-based strategs for drug design and discovery. Sciense, v. 257, p.
1078-1082, 1992.
MAGALHAES, C. S.; BARBOSA, H. J. C.; DARDENNE, L. E. Método de Docking receptorligante para o desenho racional de compostos bioativos. In: MORGON, N. H.;
COUTINHO, K. (orgs) Métodos de química teórica e modelagem molecular. São Paulo:
Editora Livraria da Física, 2007.
MUSA, K. A. K.; ERIKSSON, L. A.Theoretical study of ibuprofen phototoxicity. J. Phys.
Chem. B , v. 111, p:13345-13352, 2007.
NAYAK A, JAIN A. In vitro and in vivo study of poly(ethylene glycol)conjugated
ibuprofen to extend the duration of action. Sci Pharm, v.79, n. 2, p.359-373, 2011.
33
OKULIK, N.; JUBERT, A. H. Theoretical study on the structure and reactive sites of three
non-steroidal anti-inflammatory drugs: ibuprofen, Naproxen and Tolmetin acids.
Journal of Molecular Structure: Theochem, v. 769, p:135-141, 2006.
PETERS, T. (Org). All about Albumin: Biochemistry, Genetics and Medical Applications.
Academic Press: San Diego and London, 1996.
PETITPAS, I.; GRUNE, T.; BATTACHARYA, A. A.; CURRY, S. Crystal structure of human
serum albumin complexed with monounsaturated and polyunsaturated fatty acids. J
Mol Biol, v. 314, 2001.
RAO, P. N. P.; KNAUS, E. E. Evolution of nonsteroidal anti-inflammatory drugs(NSAIDs):
Cyclooxygenase (COX) inhibition and beyond. Journal of Pharmacy and
Pharmaceutical Sciences, v. 11, n. 2, S, p. 81–110, 2008.
ROCHE, M.; RONDEAU, P.; SINGH, N. R.;TARNUS, E.; BOURDON, E. The antioxidant
properties of serum albumin. FEBS Lett, v. 582,p: 1783–1787, 2008.
SARAVANAN, M. et al. Effects of ibuprofen on hematological, biochemical and
enzymological parameters of blood in na Indian major cap Cirrhinus mrigala.
Environmental toxicology and pharmacology. v. 34, p:14-22, 2012.
SIMARD, J. R.; ZUNSZAIN, P. A.; HA, C. E.; YANG, J. S.; BHAGAVAN, N. V.; PETITPAS, I.;
CURRY, S.; HAMILTON, J. A. Location high-affinity fatty acid-binding sites on albumin by
x-ray crystallography and NMR spectroscopy. PNAS. v.12, n. 50, 2005.
SUGIO, S; KASHIMA, A.; MOCHIZUKI, S.; NODA, M.; KOBAYASHI, K. Crystal structure of
human serum albumina at 2.5 Å resolution. Protein Engineering. v. 12, n. 6, 1999.
VONKEMAN, H. E.; VAN DE LAAR, M. A. F. J. Nonsteroidal Anti-Inflammatory Drugs:
Adverse Effects and Their Prevention. Seminars in Artrritis and rheumatism, v. 39, n.4,
p. 294–312, 2010.
VUSSE, G. J. V. D. Albumin as fatty acid transporter. Drug Metab. Pharmacokinet, v.24,
n.4, p: 300-307, 2009.
WORLD HEALTH ORGANIZATION (WHO),
Medicines,
16th
list,
March
2010. WHO Model List of Essential
2010.
Disponível
<http://www.who.int/medicines/publications/essentialmedicines/en/index.html>
em:
.
34
Acesso
em:
10.03.2012
35
2 TEORIA QUÂNTICA APLICADA À SIMULAÇÃO COMPUTACIONAL
Nesse capítulo será descrito de maneira breve o formalismo quântico
empregado nas simulações computacionais e que, portanto, fundamentam o método
utilizado neste trabalho.
Métodos que utilizam a mecânica quântica têm sido desenvolvidos ao longo
das últimas décadas e aplicados com sucesso no estudo das propriedades químicas
para moléculas de tamanho pequeno e médio (HE; MERZ, 2010).
O objetivo central da química quântica é resolver a equação de Schrödinger ou
alguma equação análoga de mecânica quântica. As soluções da equação de
Schrödinger descrevem o estado quântico de um sistema, possuindo a informação de
onde pode-se derivar outras propriedades físicas do sistema. De modo prático, a
resolução dessa equação é extremamente difícil e inviável muitas vezes, a depender do
número de elétrons envolvidos, sendo necessário o desenvolvimento de métodos de
aproximação (CASTRO; CANUTO, 2007).
Dentre as várias teorias que fundamentam métodos quânticos, nesse trabalho
foi utilizado a Teoria do Funcional da Densidade (DFT). Isso porque, os cálculos usando
DFT são geralmente muito mais precisos do que os métodos semi-empíricos, além
disso, permitem a aplicação de simulações em sistemas relativamente maiores, por
exemplo, modelos de sítios ativos da ordem de 100 átomos ou mais (LONSDALE;
RANAGHAN, MULHOLHAND, 2010).
Uma outra vantagem dessa teoria é a possibilidade de encontrar a densidade
eletrônica que minimiza a energia do sistema, para uma dada configuração nuclear.
Esse processo inicial minimiza os custos computacionais, pois, a densidade eletrônica é
resolvida de uma maneira simplificada, em dependência de apenas três coordenadas
espaciais, ao invés de 3N coordenadas, para N elétrons, como utilizam outros métodos
de mecânica quântica.
36
2.1 TEORIA DO FUNCIONAL DA DENSIDADE
A Teoria do Funcional da Densidade (DFT) do inglês, density functional theory,
nas últimas décadas vem se configurando como um dos principais métodos de estudo
da estrutura eletrônica de sólidos e moléculas.
Problemas que antes eram resolvidos através de métodos ab initio HartreeFock ou pós-Hartree-Fock, são agora trabalhados usando-se o DFT, o que possibilita
maior concordância dos estudos teóricos com os dados experimentais disponíveis
(HOLTHAUSEN, 2001).
Parte desse atrativo da DFT está no fato de que sistemas de tamanho
moderado a grande, com mais de 20 átomos, podem ser estudados, com precisão
química aceitável, a um custo computacional bem menor daquele obtido utilizando-se
métodos correlacionados tradicionais, a exemplo da teoria de pertubação e coupled
cluster. Além disso, outro fator que vem impulsionando a utilização do DFT é o
desenvolvimento de funcionais de troca-correlação mais precisos e algoritmos
eficientes de integração numérica (DUARTE; ROCHA, 2007).
O uso da densidade eletrônica – ρ(r)- como variável básica na descrição de um
sistema eletrônico remonta ao início do século XX, quando Drude aplicou a teoria dos
gases a um metal, considerado como um gás homogêneo de elétrons, com o objetivo
de desenvolver a sua teoria sobre a condução térmica e elétrica (MORGON;
CUSTODIO, 2005).
Desde então, vários modelos foram propostos e aperfeiçoados, a exemplo
Drude, Sommerfeld, Thomas, Fermi, Dirac; até que o uso da densidade eletrônica
como variável básica foi rigorosamente legitimada com a publicação de dois teoremas
por Hohenberg e Kohn, em 1964, que forneceram os fundamentos da Teoria do
Funcional da Densidade moderna e fez com que Walter Kohn fosse agraciado com o
Prêmio Nobel de Química em 1998.
A partir do formalismo de Hohenberg e Kohn, conceitos importantes na
descrição química – tais como potencial químico, maciez e dureza, além dos princípios
dos ácidos e bases duros e macios de Pearson, e o da equalização da
37
eletronegatividade, de Sanderson, são definidos de uma maneira exata a partir dessa
teoria (DUARTE; ROCHA, 2007).
Em 1965, Kohn e Sham estabeleceram uma forma de contornar o problema de
se encontrar o funcional de energia cinética exato – o método KS- que permitiu assim,
realizar cálculos DFT. O desenvolvimento da metodologia computacional para fazer
cálculos DFT leva, invariavelmente, as equações matemáticas semelhantes às
equações Hartree-Fock-Roothan.
Contudo, diferentemente de ouitros métodos, a exemplo dos semi-empíricos,
que tentam tanto quanto possível, se aproximar do método Hartree-Fock, a DFT
relaciona-se com a solução exata do problema de muitos elétros e seus cálculos devem
ser interpretados à sua luz.
2.1.1 Teoremas de Hohemberg e Kohn
O primeiro teorema de Hohenberg-Kohn (HK) estabelece que o potencial
externo é um funcional único de ρ(r) além de uma constante aditiva. De uma forma
mais simples, esse teorema demonstra que a densidade eletrônica de um sistema
determina o potencial externo
e o número de elétrons, N, e consequentemente,
o Hamiltoniano do sistema. No esquema abaixo está representada a interdependência
das variáveis básicas do teorema de HK.
Como a energia do sistema é calculada mediante a resolução da equação de
Schrodinger, HBOѱ = Eѱ, a energia de um sistema eletrônico é determinada pela
densidade eletrônica ρ(r), ou seja:
38
E = Ev*ρ+.
(1)
O índice v é colocado para explicitar a dependência com o potencial externo
.
O segundo teorema estabelece que havendo qualquer aproximação da
~
~
~
densidade eletrônica (r), de modo que (r) ≥ 0 e (r)dr = N, a energia total
será sempre maior ou igual a energia exata do sistema, ou seja:
~
E[ + ≥ E*ρ+ = E0,
(2)
sendo E0 a energia fundamental do sistema.
Pode-se então definir um funcional universal
F = ˆ V e
,
(3)
pois T e Ve aplicam-se universalmente a todos os sistemas eletrônicos.
Os dois teoremas de HK mostram como se pode determinar o estado
fundamental de um sistema com um dado potencial externo, usando-se a densidade
eletrônica tridimensional como variável básica, em vez de se utilizar a função de onda
de N-elétrons, que é muito mais complexa (DUARTE; ROCHA, 2007).
Para a maioria dos problemas químicos em que o cálculo da estrutura
eletrônica é requerido, o potencial externo é facilmente determinado, ou então, uma
aproximação razoável pode ser proposta a partir do conhecimento do sistema
químico.
O que se objetiva é a densidade eletrônica e as propriedades eletrônicas que
podem ser calculadas a partir dela. O segundo teorema de HK, fornece a estratégia
para se resolver esse problema: procura-se a densidade eletrônica de um determinado
sistema eletrônico com um dado potencial externo
vibracional.
, utilizando-se o princípio
39
2.1.2 Equações de Kohn-Sham
Os teoremas de Hohenberg-Kohn possibilitam a abordagem de um sistema
usando a densidade eletrônica como variável básica. Contudo, esses teoremas não
estabelecem um procedimento para o cálculo de energias.
Para resolver o problema, em 1965, W. Kohn e L. J. Sham, propuseram um
conjunto de equações, denominadas, equações de Kohn-sham, através das quais
demostraram que existe uma equivalência entre as densidades eletrônicas do sistema
real e de um sistema modelo de elétrons não-interagentes (independentes)
submetidos ao potencial efetivo,Vef, que reproduz as condições do sistema interagente.
Dessa forma, obtém-se a densidade eletrônica desse sistema não-interagente e
a correlacionamos com o sistema real. A densidade pode ser expressa em termos dos
orbitais Ψi(r) para um elétron, que são conhecidos como os orbitais de Kohn-Sham.
,
(4)
em que a soma é realizada para todos os N elétrons. Como não sabe-se a densidade
exata, de acordo com o segundo teorema de Hohenberg e Kohn, a energia será dada
pela equação abaixo:
.
(5)
No esquema Kohn-Sham, a densidade eletrônica exata do estado fundamental
de um sistema de elétrons que interagem é gerada a partir da solução de um problema
40
auxiliar do sistema de elétrons que não interagem, definido para fornecer a mesma
densidade do estado fundamental.
As equações KS, assim como as equações Hartree-Fock, geram equações de um
elétron que descrevem sistemas de muitos elétrons. Além disso, as equações KS, em
princípio são exatas, uma vez que incorporam totalmente os efeitos da correlação
eletrônica – troca e correlação - e as soluções delas equivalem, formalmente, à
resolução exata do problema variacional da DFT.
2.2 APROXIMAÇÕES PARA ENERGIA DE TROCA E CORRELAÇÃO
Embora a Teoria do Funcional da Densidade, composta pelos teoremas de
Hohenberg-Kohn e pelas equações de Kohn-Sham, ser exata, essa teoria ainda não
consegue determinar com exatidão a Energia de troca e correlação (E xc), requerendo
uma aproximação para o tratamento das interações de troca e correlação eletrônicas
(DUARTE; ROCHA, 2007).
A energia de troca e correlação (Exc) contribui com uma pequena fração para a
energia total do sistema, mas, para uma descrição precisa de ligação entre átomos,
isso se torna crucial (PERDEW; BURKE; ERNZERHOF, 1996).
Ao longo dos anos têm sido desenvolvidas várias aproximações, com
complexidade crescente, que conferem cada vez mais precisão aos dados encontrados.
A primeira aproximação para energia de troca e correlação e com menor
complexidade é a aproximação da densidade local (LDA), do inglês, density local
approximation, proposta por Kohn e Sham em 1965 no mesmo artigo em que são
descritas as equações auto-consistentes.
A LDA está baseada no paradigma mais utilizado em Física do Estado Sólido, o
gás homogêneo de elétrons. Dessa forma, considera a energia de troca e correlação
para um sistema de densidade como sendo a energia de troca e correlação para um
gás de elétrons uniforme com a mesma densidade que é conhecida de forma precisa.
Além disso, nessa aproximação, a energia de troca e correlação de um elétron em um
dado ponto depende da densidade eletrônica nesse ponto, ao invés de depender da
41
densidade eletrônica em todos os pontos do espaço (DUARTE; ROCHA, 2007; LEACH,
2001).
A LDA é muito utilizada no estado de sólidos metálicos, pois além de eficiente,
possui um baixo custo computacional. Contudo, para átomos e moléculas com
distribuição eletrônica é altamente não-homogênea, torna-se uma péssima
aproximação.
Na tentativa de corrigir os erros proveniente da não-homogeneidade da
densidade eletrônica no espaço, principalmente em sistemas biológicos, nos quais não
se verifica a homogeneidade necessária para a utilização do LDA, outras aproximações
foram propostas.
Um avanço foi introduzir a dependência com o gradiente da densidade na
expressão do funcional levando a origem da aproximação do gradiente generalizado
(GGA), do inglês, Generalized Gradient Approximation.
Embora o uso do GGA melhore consideravelmente a descrição das ligações, em
especial as ligações de hidrogênio, sem que haja um aumento proibitivo do custo
computacional, a descrição de ligações fracas, a exemplo das interações de van der
Waals ainda permanece problemática (MORGON; CUSTODIO, 1995).
Existem
também
os
funcionais
híbridos
assim
denominados
por
corresponderem a uma mistura do termo de troca de Hartree-Fock no funcional de
troca da DFT, a partir de dados experimentais para sistemas moleculares conhecidos,
contendo parâmetros ajustáveis. Os funcionais híbridos mais conhecidos são: PBE,
BLYP, BP86, B3LYP e PW91.
Como se pode perceber a grande vantagem do DFT é a implementação
computacional eficiente da correlação eletrônica, que possibilita serem os sistemas
complexos razoavelmente bem descritos. Além disso, com o DFT é possível calcular
propriedades elétricas, magnéticas, estruturais e químicas, como potencial químico,
eletronegatividade, geometria molecular no equilíbrio, ligações químicas, gradientes
de energia, espectros vibracionais entre outros, a partir da sua densidade eletrônica
(DUARTE, 2001).
42
REFERÊNCIAS
DUARTE, H. A. D. Índices De Reatividade Química A Partir Da Teoria Do Funcional De
Densidade: Formalismo e Perspectivas. Química Nova, v. 24, p. 501-508, 2001.
DUARTE, H. A.; ROCHA, W. R. Teoria do Funcional da Densidade. In: MORGON, N. H.;
COUTINHO, K. (orgs) Métodos de química teórica e modelagem molecular. São Paulo:
Editora Livraria da Física, 2007.
HE, X.; MERZ, K. M. Divide and conquer Hartree-Fock Calculations on proteins. J. Chem.
Theory Comput., v. 6, n. 2, 2010.
HOLTHAUSEN, M.C. A Chemist’s Guide to Density Functional Theory. New York:
Wiley-VCH, 2001.
LEACH, A. R. Molecular Modeling: Principles and Applications. 2. ed. New Jersey:
Prentice Hall, 2001.
LONSDALE, R.; RANAGHAN, K. E.; MULHOLLAND, A. J. Computational enzymology.
Chem. Commum, v. 46, p: 2354-2372, 2010.
MORGON, N. H.; CUSTÓDIO, R. Teoria do Funcional de Densidade. Química Nova, v.
18, p. 44-55, 1995.
PERDEW, J. P.; BURKE, K.; ERNZERHOF, M. Generalized Gradient Approximation Made
Simple. Physical Review Letters, v. 77, 3865-3868, 1996.
43
3 MATERIAL E MÉTODO
Esse capítulo abordará os aspectos metodológicos utilizados nesse trabalho e
sempre que necessário uma breve fundamentação teórica do método.
3.1 TIPOLOGIA DO ESTUDO
O estudo caracteriza-se como in silico, uma vez que todo o ambiente e
as moléculas foram analisados por simulações computacionais e interpretados com
base em cálculos quânticos.
3.2 OBTENÇÕES DAS ESTRUTURAS CRISTALOGRÁFICAS
O primeiro passo para o estudo in silico, consiste na obtenção de estruturas
cristalográficas, que serão utilizadas como inputs para a realização dos cálculos, e
estão disponíveis, gratuitamente, no site do Research Collaboratory for Structural
Bioinformatics – Protein Data Bank (PDB).
Atualmente no banco de dados da RCSB/PDB estão disponíveis sessenta e seis
imagens cristalográficas da albumina de soro humano, que pode ser encontrada em
sua forma livre, sem ligantes, (PDB Nº 1AO6, 1BMO, 1E78) ou complexada a diferentes
ligantes. Para esse estudo foi utilizado o PDB de n° 2BXG por corresponder à única
estrutura cristalográfica da ASH com o ibuprofeno (GHUMAN et al., 2005).
Para a elaboração da imagem cristalográfica Ghuman et al. (2005) utilizaram a
técnica de difração de raios-X, na qual um feixe de ondas eletromagnéticas incide no
cristal e interage com os elétrons dos átomos do cristais, estes entram em ressonância
com a radiação gerando ondas com a mesma energia da onda incidente e se
espalhando isotropicamente. As propriedades cristalográficas obtidas para a albumina
de soro humano estão apresentadas na tabela 1.
44
O PDB escolhido apresenta uma resolução de 2.70 Å e é formado por um
dímero de duas cadeias idênticas, nomeadas A e B. Nesse trabalho optou-se por
utilizar a cadeia A.
Tabela 1: Estatísticas de refinamento cristalográfico para diferentes ligantes associados
a Albumina de Soro Humano, com destaque para as propriedades do cristal que
contem o Ibuprofeno.
Fonte: Ghuman et al., 2005.
3.3 ESTADO DE PROTONAÇÃO DO LIGANTE
Levando-se em consideração que a interação do Ibuprofeno com a Albumina de
Soro Humano ocorre no sangue humano, fluído com pH fisiológico variando de 7,35 a
7,45, foi necessário realizar estudo sobre o estado de protonação do ibuprofeno para
confrontá-lo com o do cristal de Ghuman et al. (2005).
Para tal estudo foi utilizado o software Marvin Sketch 5.3.2, utilizando como
parâmetros a temperatura ambiente (306 K), adotando um padrão de duas casas
decimais para os valores da fração molar e o solvente simulado pela constante
dielétrica da água.
45
3.4 OTIMIZAÇÃO DOS HIDROGÊNIOS
Apenas cristais de alta resolução (menor do que 1,20 Å) oferecem suporte para
visualização dos átomos de hidrogênio, isso porque, os átomos de hidrogênio
apresentam grande mobilidade na cadeia proteica e por isso muitas vezes não são
identificados ou identificados de modo incorreto nos arquivos de coordenadas
cristalográficas. A fim de resolver tal situação, à estrutura inicial (PDB) foram
adicionados os hidrogênios em suas devidas posições, e todas as ligações foram
mantidas em ressonância, utilizando o software Materials Studio®.
Após a adição dos hidrogênios, os átomos não-hidrogênio, incluindo os do
ligante, são mantidos fixos, enquanto os átomos de hidrogênio serão otimizados
utilizando o módulo “forcite” do Materials Studio®.
Essa primeira otimização foi realizada utilizando-se mecânica clássica baseada
no campo de força COMPASS, do inglês Condensed-phase Optimized Molecular
Potentials for Atomistic Simulation Studies, tendo como tolerâncias de convergência
2,0 x 10-5 Kcal/mol para a variação total da energia, 1,0x10-3 Kcal Å-1 mol -1 para a força
máxima por átomo e 1,0 x 10-5 Å para o deslocamento atômico máximo.
A otimização de geometria de maneira clássica visa encontrar o estado de
equilíbrio o sistema, utilizando para isso a minimização da energia potencial do
sistema, a partir do ajuste das coordenadas atômicas.
O COMPASS consiste no primeiro campo de força ab initio de alta qualidade,
capaz de predizer com precisão e simultaneamente as propriedades de fase gasosa, a
exemplo das estruturais e vibracionais, e da fase condensada, como equações de
estado e energias de coesão, para uma variedade de moléculas covalentes, incluindo
produtos orgânicos e moléculas inorgânicas pequenas e polímeros (ACCELRYS, 2008).
A parametrização para essa técnica foi completamente validada usando vários
métodos de cálculo, incluindo métodos experimentais e dinâmicas moleculares
extensas de líquidos, cristais e polímeros (SUN, 1998; SUN et al., 1998; RIGBY et al.,
1998).
46
Para o cálculo da otimização foi utilizada a versão mais recente dessa técnica,
que superou o COMPASS 26 e COMPASS27, pela inclusão dos parâmetros para grupos
sulfatos e sulfonatos (ACCELRYS, 2008).
Figura 7: Imagens da Interface do software Materials Studio® com os parâmetros
selecionados para o processo de otimização de geometria.
Fonte: Dados da Pesquisa
3.5 ESTABELECENDO OS LIMITES DO SÍTIO DE LIGAÇÃO
Após a determinação do centroide (centro de massa) do ibuprofeno, foram
traçados raios crescentes em direção ao interior da proteína.
O primeiro raio com
47
resíduo presente corresponde a 3,0 Å para o primeiro sítio de ligação, aqui
denominado de I-FA3 e de 4,0 Å para o segundo sítio, denominado I-FA6. A partir
desses raios continuou-se avaliando a energia de ligação dos resíduos presentes em
raios crescentes até os 12,0 Å, no qual se observou a convergência da energia do
sistema para os dois sítios de ligação. A convergência energética do sistema foi
observada quando o valor da energia total de um raio variou menos de dez por cento
quando comparada a energia total do raio anterior.
Dessa forma, para os dois sistemas foi necessário varrer 12,0 Å do centro de
massa do ibuprofeno, o que resultou em 65 aminoácidos para o sítio I-FA3 e 48
aminoácidos para I-FA6.
3.6 DETERMINANDO A ENERGIA DE INTERAÇÃO
Para o cálculo da energia de interação foi utilizado o método de fragmentação
molecular com capas conjugadas (MFCC) que consiste na decomposição dos
aminoácidos em fragmentos, onde a esses são adicionados capas para manter a
valência do fragmento estudado (ZHANG; ZHANG, 2003).
Este método tem sido aplicado para a obtenção das energias de interação de
proteínas com água (ZHANG; CHEN; ZHANG, 2003), drogas (ZHANG et al., 2004; XIANG;
ZHANG; ZHANG, 2004) e DNA com ligantes (CHEN; ZHANG, 2004).
Usando essa abordagem, a energia de interação de uma proteína e uma dada
estrutura pode ser obtida por cálculo de mecânica quântica das energias de interação
entre a molécula e fragmentos de proteínas individuais e seus capas conjugadas (HE;
ZANG, 2005; CHEN; ZHANG, 2007).
A energia de interação E(Li−Ri) entre a molécula do ligante (Li) e o resíduo de
aminoácido (Ri), é dada por:
E (L − Ri) = [E1 - E2] - [E3 - E4]
E (L − Ri) = [E (Li − CiRiCi*) − E(CiRiCi*)] – [E(Li − CiCi*) - E(CiCi*)]
(6)
48
Onde: Ci corresponde às capas conjugadas que estão acopladas ao resíduo pelo
grupamento amina e Ci* pelo carboxil.
Dessa forma, em um primeiro momento são realizados cálculos levando em
consideração cada aminoácido e em seguida é feito o somatório das energias dos
aminoácidos presentes em um mesmo raio. Como forma de manter a valência de cada
aminoácido tornando os cálculos mais fidedignos, para cada aminoácido foi utilizada
como blindagem os aminoácidos vizinhos ao resíduo de interesse e esses representam
as capas.
Na literatura não há um número rígido para a quantidade de resíduos que
devem funcionar como capas. Após vários testes, observou-se que para a proteína em
estudo, em virtude do grande número de aminoácidos carregados, foram necessários
cinco resíduos compondo a capa para normalizar os valores encontrados. Sendo assim,
para cada aminoácido analisado, também incluimos nas simulações os seus cinco
vizinhos à direita e os cinco resíduos vizinhos à esquerda.
No lado direito da Eq. (1), o termo E(Li − CiRiCi*) corresponde a energia total do
sistema formado pelo ligante e pelo resíduo com as capas do lado carboxil (Ci*) e do
lado amino terminal (Ci) do aminoácido; o termo E(CiRiCi*) refere-se a energia do
resíduo com as capas conjugadas; o terceiro termo E(Li − CiCi*) é a energia total do
sistema sem a energia do resíduo e por fim, por fim o quarto termo corresponde a
energia formada pelo conjunto de capas. A figura 8 apresenta um esquema das etapas
necessárias para o cálculo da energia.
A energia total de cada ligante é obtida somando as energias de ligação de cada
um dos resíduos de aminoácidos levados em consideração na definição do sítio ativo.
Após o cálculo da energia individual, também foi calculado a distância de cada resíduo
(Ri) ao ibuprofeno, a fim de se conhecer os grupos atômicos envolvidos nas interações
moleculares.
49
Figura 8: Representação gráfica para as equações envolvidas no cálculo da energia de
interação entre o resíduo (Ri), em vermelho, e o fármaco ou ligante (Li), em laranja,
através da utilização das capas, constituídas de cinco aminoácidos à direita, em verde,
Ci*, e à esquerda, em azul Ci.
Fonte: Dados da pesquisa
3.7 SIMULAÇÃO COMPUTACIONAL
Após a otimização da estrutura inicial, e preparação das estruturas com base no
método do MFCC, a segunda otimização foi realizada utilizando-se o módulo Dmol3 do
software Materials Studio®, que utiliza parâmetros da Teoria do Funcional da
Densidade (DFT).
Todos os cálculos de otimização com Dmol3, foram realizados com script
desenvolvido especificamente para esse fim, permitindo a definição de diferentes
parâmetros conforme mostrado na figura 9.
O DFT foi escolhido, tendo em vista sua melhor acurácia para descrição de
estruturas eletrônicas de sólidos e moléculas, com número de átomos superior a vinte,
com precisão química aceitável e custo computacional, muitas vezes, equivalente a
50
uma fração do que era obtido com outros métodos tradicionais a exemplo do HartreeFock e pós Hartree-Fock (DUARTE; ROCHA, 2007).
Figura 9: Imagem da tela do script, mostrando a configuração dos parâmetros e as
categorias escolhidas, vermelho e azul respectivamente. Os parâmetros antecedidos
pelo símbolo #, em verde, não foram selecionados para as otimizações.
Fonte: Dados da Pesquisa
Para maior exatidão na descrição energética do sistema, foi utilizada a
aproximação de gradiente generalizado (GGA). Porém, a forma exata da Exc não é
conhecida e pode nunca ser, em uma fórmula matemática fechada. Portanto, desde o
aparecimento da DFT, tipos de aproximações para Exc têm sido utilizados. Existem
muitos funcionais de aproximação com níveis de complexidade variáveis.
51
O módulo do Dmol3 permite a utilização de duas formas de aproximação para
esses cálculos, contudo foi utilizado a aproximação do gradiente generalizado (GGA)
com o funcional PBE, em detrimento da aproximação de densidade local (LDA), pelo
fato de em sistemas com densidade eletrônica (ρ) heterogênica, a exemplo dos
sistemas biológicos, os cálculos baseados no LDA não oferecerem precisão, levando a
erros de forma não-sistemática, nos comprimentos e energias de ligação e o GGA, em
contrapartida, oferece um avanço nos cálculos por introduzir a dependência com o
gradiente da densidade ρ(r) na expressão do funcional (PERDEW; BURKE; ERNZERHOF,
1996; DUARTE; ROCHA, 2007).
Para garantir a qualidade da descrição das energias atômicas, o programa foi
configurado na precisão Fine durante a integração numérica da Hamiltoniana do
sistema. Além disso, não foi considerada a simetria nos cálculos e utilizada a carga
formal do sistema e com multiplicidade automática.
Forças não covalentes, tais como ligações de hidrogênio e interações de van der
Waals, são cruciais para a formação, a estabilidade e função das biomoléculas e
materiais, contudo, atualmente a sua exata contabilização só é realizada mediante
funções de alto nível quântico ou pelo método de Monte Carlo. Como forma de
resolver as forças de dispersão para DFT, existem correções semi-empíricas a serem
empregadas durante os cálculos e que estão disponíveis no módulo Dmol3 (ACCELRYS,
2008). Das possibilidades apresentadas pelo programa, utilizou-se a correção Grimme,
por suportar um maior número de dispersão de átomos de maneira diferente
(GRIMME, 2006).
Para a expansão dos orbitais eletrônicos de Kohn-Sham foi utilizado o conjunto
de bases DNP, do inglês Doble Numerical Plus Polarization, levando em consideração
todos os elétrons explícitos e spin restritos. O DNP é muito preciso e comparável ao
conjunto de base gaussiano 6-311+G(3df,2pd), que apresenta funções de polarização,
difusão e eficaz correlação eletrônica (INADA; ORITA, 2008). E o número de interações
máximas por ciclos foi estabelecido em 1000.
A fim de tentar mimetizar o ambiente eletrostático no qual se encontra a
proteína in vivo, e estimar os efeitos energéticos, a exemplo da polarização
52
eletrostática, promovida pelo solvente não incluídos na estrutura cristalográfica, a
constante dielétrica foi levada em consideração nos cálculos (SCHUTZ; WARSHEL,
2001).
A constante dielétrica (ε) é implementada através do funcional COSMO, do
inglês Conductor-like Screening Model, o qual calcula a energia eletrostática e efeito de
polarização dos constituintes do sistema, por simular um meio contínuo, uniforme e
polarizável e que para o cálculo com proteínas deve-se estabelecer um valor
intermediário por volta de 40 (SCHUTZ; WARSHEL, 2001; WARSHEL et al., 2006).
Contudo, para efeito comparativo, empregamos constantes dielétricas de zero,
representando um meio não polarizável, e a constante dielétrica de quarenta,
representando um meio parcialmente polarizável.
53
REFERÊNCIAS
ACCELRYS: Materials Studio Release Notes, Release 5.0. San Diego: Accelrys Software,
2008.
CHEN, X. H.; ZHANG, D. W.; ZHANG, J. Z. H. Fractionation of peptide with disulfide
bond for quantum mechanical calculation of interaction energy with molecules.
Journal of chemical Physics, v. 120, n. 2, 2004.
CHEN, X. H.; ZHANG, J. Z. H. Theoretical method for full ab initio calculation of
DNA/RNA-ligand interaction energy. Journal of Chemical Physics, v. 120, n. 24, 2004.
CHEN, X.; ZHANG, J. Z. A non-derivative MFCC optimization study of cyclohexapeptide
monohydrate. Chinese Journal of Chemical Physics, v. 20, n.4, 2007.
DUARTE, H. A.; ROCHA, W. R. Teoria do Funcional da Densidade. In: MORGON, N. H.;
COUTINHO, K. (orgs) Métodos de química teórica e modelagem molecular. São Paulo:
Editora Livraria da Física, 2007.
GHUMAN, J.; ZUNSZAIN, P. A.; PETITPAS, I.; BHATTACHARYA, A. A.; OTAGIRI, M.;
CURRY, S. Structural basis of the drug-binding specificity of human serum album. J.
Mol. Biol, v. 353, 2005.
GRIMME, S. Semiempirical GGA-Type Density Functional Constructed with a LongRange Dispersion Correction. J. Comput. Chem., v. 27,p.1787, 2006.
HE, X.; ZANG, J.Z.H. A new method for direct calculation of total energy of protein. J.
Chem. Phys. v. 122, 2005.
INADA, Y.; ORITA, H. Efficiency of numerical basis sets for predicting the binding
energies of hydrogen bonded complexes: evidence of small basis set superposition
error compared to Gaussian basis sets. Journal of Computational Chemistry, v. 29, n.
2, p. 225–232, 2008.
MUSA, K. A. K.; ERIKSSON, L. A.Theoretical study of ibuprofen phototoxicity. J. Phys.
Chem. B , v. 111, p:13345-13352, 2007.
NAYAK A, JAIN A. In vitro and in vivo study of poly(ethylene glycol)conjugated
ibuprofen to extend the duration of action. Sci Pharm, v.79, n. 2, p.359-373, 2011.
54
PERDEW, J. P.; BURKE, K.; ERNZERHOF, M. Generalized Gradient Approximation Made
Simple. Physical Review Letters, v. 77, 3865-3868, 1996.
RIGBY, D.; SUN, H.; EICHINGER, B. E. Computer simulations of poly(ethylene oxides):
Forcefield, PVT diagram and cyclization behavior, Polym. Int., v. 44, p.311-330, 1998.
SCHUTZ, C. N.; WARSHEL, A. What are the dielectric ‘‘constants’’ of proteins and how
to validate electrostatic models? Proteins, v. 44, p. 400–417, 2001.
SUN, H. COMPASS: An ab Initio Forcefield Optimized for Condensed-Phase Applications
- Overview with Details on Alkane and Benzene Compounds, J. Phys. Chem. B, v.
102,p.7338, 1998.
SUN, H.; REN, P.; FRIED, J. R. The COMPASS Forcefield: Parameterization and Validation
for Polyphosphazenes Comput. Theor. Polym. Sci., v. 8, 1998
WARSHEL, A. et al. Modeling electrostatic effects in proteins. Biochimica et Biophysica
Acta, v. 1764, n.11, p. 1647-1676, 2006.
XIANG, Y.; ZHANG, D. W.; ZHANG, J. Z. H. Fully quantum mechanical energy
optimization of protein-ligand structure. Journal of Computacional Chemistry, v. 25, n.
12, 2004.
ZHANG, D. W.; XIANG, Y.; GAO, A. M.; ZHANG, J. Z. H. Quantum mechanical map for
protein-ligand binding with application to b-trypsin/benzamidine complex. J of Chem
Phys. V. 120, n.3, 2004.
ZHANG, D. W.; ZHANG, J. Z. H. Molecular fractionation with conjugate caps for full
quantum mechanical calculation of protein-molecule interaction energy. J of Chem
Phys. V. 119, n.7, 2003.
55
4 BIOQUÂNTICA DA INTERAÇÃO DO IBUPROFENO COM A ALBUMINA DE SORO
HUMANO
As proteínas correspondem a um polímero de aminoácidos formados por meio
de ligações peptídicas entre o grupamento carboxil de um aminoácidos e o
grupamento amina do aminoácido subsequente, com a liberação de uma molécula de
água. Na natureza, existe uma diversidade de vinte aminoácidos, subdivididos em
hidrofóbicos, polares neutros e polares carregados, que se combinam em diferentes
proporções para formar as diferentes moléculas proteicas existentes (DAVID;
MICHAEL, 2010).
Figura 10: Nomeclatura, estrutura química e classificação dos vinte tipos de
aminoácidos.
Aminoácidos polares
ácidos
Fonte: Adaptado de (http://e-escola.ist.utl.pt/topico.asp?hid=600)
56
A Albumina de soro humano (ASH) é uma molécula com 585 resíduos, dos quais
a Cys, Leu, Glu, Arg e Lys são os mais abudantes, Met, Gly, Ile ocorrem em menor
número e apenas um Trp na posição 214 (FANALI et al., 2012).
O grande número de resíduos ionizados confere a ASH uma alta carga total
(215 íons por molécula a um pH 7,0), o qual facilita a sua solubilidade. Além disso, os
resíduos de aminoácidos ácidos superam em número os aminoácidos básicos,
resultando em uma carga total negativa de -15 no pH 7,0 (FANALI et al., 2012).
A albumina de soro humano apresenta dois sítios de ligação para o ibuprofeno,
aqui nomeados de I-FA3, correspondente ao sítio localizado no domínio IIIA; e o sítio IFA6, localizado na junção do domínio IIA e IIB. Os sítios foram nomeados, levando-se
em consideração a proximidade com os respectivos sítios de ligação para os ácidos
graxos presentes na albumina (Figura 12).
Figura 11: Albumina de soro humano, mostrando o ibuprofeno nos seus sítios de
ligação.
Fonte: Dados da pesquisa.
57
Os fármacos, independente de sua ação como agonista ou antagonista, se ligam
aos receptores através de regiões específicas da macromolécula proteica, conhecida
como sítio de ligação ou sítio ativo, que geralmente é caracterizado por uma cavidade
ou bolsão (MAGALHAES; BARBOSA; DARDENNE, 2007).
Na molécula da albumina de soro humano, o ibuprofeno pode se ligar a dois
sítios de interação, o sítio I-FA3, seu sítio preferencial a partir de dados experimentais
e o sítio I-FA6. Nesses dois sítios a interação ocorre através do grupamento carboxil
que possui uma maior eletronegatividade (Figura 12). Na literatura, análises utilizando
o gaussian, mostram que as regiões negativas para o ibuprofeno são os oxigênios do
grupamento carboxil (OKULIK; JUBERT, 2006)
Figura 12: Representação planar do ibuprofeno com destaque para suas cadeias em A
e mapa eletrostático do ibuprofeno, evidenciando a região i como mais eletronegativa
em B
A
B
Fonte: Dados da pesquisa
58
Um passo inicial para o estudo da interação fármaco-receptor corresponde ao
estudo do estado de protonação do ligante, no caso, o fármaco no pH do meio em que
acontece a interação.
Figura 13: Curva de protonação (pKa) do ibuprofeno, mostrando que sua forma neutra
ocorre até um pH de 4,91, e acima disso, ele passa a ocorrer na forma desprotonada.
Fonte: Dados da pesquisa
Como se pode perceber pela figura acima, na faixa do pH existem dois estados
de protonação, a forma neutra que ocorre até o pH de 4,91 e a forma desprotonada,
que a partir do pH de 7,0 corresponde a 100% da fração molar, dados que corroboram
os estudos de Musa, Eriksson (2007) e Nayak e Jain (2011).
Tratando especificamente da descrição do sítio de ligação, iremos começar a
descrever a interação do ibuprofeno com a albumina de soro humano pelo sítio
descrito na literatura como sítio Sudlow-II, e aqui nomeado de I-FA3. Esse sítio é
composto por seis hélices, e formado pelo conjunto dos sítios de ligação para ácidos
graxos (FA3 e FA4). Este sítio é composto por uma região apolar ocupada pelo
metileno dos ácidos graxos ligado ao sítio FA3 e por uma porção polar que interage
59
com a proção de carboxilato de ácidos graxos ligados à FA4 (CARTER; HO, 1994;
PETITPAS et al., 2001; GHUMAN et al., 2005; FANALI et al., 2012).
Devido ao estreito túnel hidrofóbico criado pela cauda do metileno dos ácidos
graxos, esse sítio apresenta preferência de ligação por carboxilatos aromáticos com
conformação estendida e os fármacos estão presentes na região central desse sítio,
interagindo com o grupo hidroxila do Tyr411, e os aminoácidos Arg410 e Ser489
contribuem para essa ligação, através de pontes salinas e ligações de hidrogênio
(GHUMAN et al., 2005; FANALI et al., 2012).
O ibuprofeno ligante prototípico desse sítio apresenta uma constante de
equilíbrio de dissociação de 1,0 x10-6 M, em condições fisiológicas e foi cristalizado
com a Albumina de Soro Humano apenas uma vez por Ghuman et al. (2005).
Segundo os autores nesse sítio, os principais aminoácidos para a ligação seriam
representados pela Tyr411, Arg410, Ser489 e Lys414. Embora os autores citem a
Lys414 como um importante aminoácido para a ligação do IBP ao sítio I-FA3, com base
no que eles observaram não há interação direta desse aminoácido com o fármaco em
questão.
O sítio secundário de ligação do Ibuprofeno à albumina de soro humano
corresponde ao I-FA6, sítio localizado na transição entre o subdomínio IIA e IIB. Os
dados cristalográficos mostram que os resíduos de 209 a 223, compõem o loop que
realiza parte da entrada do sítio I-FA6, e esse sofre alteração conformacional, para
liberar o sítio, e a ligação do ibuprofeno ao sítio ocorre por meio da interação do grupo
carboxil com a cadeia lateral da Lys351 e Ser480, e com o grupamento amida da
Leu481 e Val482. (GHUMAN et al, 2005; SIMARD et al., 2006).
No paradigma atual da biofísica computacional, uma proteína pode ser descrita
como um conjunto de estados conformacionais com estruturas similares e
energeticamente equivalentes, e o ligante “seleciona”, através da maior afinidade,
uma das conformações preexistentes da proteína.
A fim de observar o diferente comportamento das energias de interação dos
resíduos de aminoácidos com o ligante, os cálculos foram feitos de duas formas, uma
considerando uma constante dielétrica nula (ε=0) e outro considerando uma constante
60
dielétrica (ε), considerada intermediária entre o nulo e a água. A curva energética dos
sistemas está representada na figura 14.
Figura 14: Curvas de convergência energética do sistema variando por raio em
diferentes constantes dielétricas parra os dois sítios, acima o comportamento
energético para uma constante dielétrica de zero e abaixo para uma constante de
quarenta. Os aminoácidos com energias mais negativas em um raio de 12 Å do
centroide do fármaco estão destacados.
Fonte: Dados da Pesquisa
61
Ao analisarmos a figura 14, podemos observar que quando empregamos uma
constante dielétrica igual a zero, a curva de convergência energética para ambos os
sítios apresentam-se irregulares, ora apresentando caráter descendente, ora caráter
ascendente. Fato que não acontece quando empregamos uma constante dielétrica
ε=40, ambas as curvas, próximo ao raio de 8,0 Å, passam a apresentar padrão
descendente regular, mostrando que nessas condições temos a convergência
energética do sistema, e assim, a constante dielétrica intermediária (ε=40) é
satisfatória para a descrição do sistema.
Os valores totais de energia para cada sistema variaram de acordo com a
constante, sendo verificados menores valores para a ε=40; contudo, independente da
constante utilizada , os mesmos foram maiores para o sítio I-FA3 evidenciando que a
ligação do ibuprofeno a esse sítio é mais forte do que quando comparado ao sítio IFA6. Para o sítio os valores totais de energia em um raio de 12 Å, foi de -260,06
Kcal/mol (ε=0) e – 60,07 Kcal/mol (ε=40), já para o sítio I-FA6 foram obtidos os valores
-220,12 Kcal/mol (ε=0) e -52,20 Kcal/mol (ε=40).
Além disso, como já se era de esperar, as diferentes constantes modificam a
energia de interação individual de cada aminoácido, alterando consequentemente
aqueles que são tidos como os mais importantes para alcançar o mínimo de energia.
Enquanto que quando temos ε=0, para o sítio I-FA3, destacam-se os aminoácidos
Arg410, Arg485, Lys414, Lys432 e Arg348, quando utilizamos ε=40, se mantêm a
Arg410, Ser489, Lys414, Lys432 e Arg348, aparecendo a Ser489 no lugar da Arg485.
Para o sítio I-FA6, ocorre uma alteração ainda maior, quando temos ε=0, os
resíduos mais importantes são Lys351, Arg209, Lys212, Lys323 e Arg218, com ε=40,
destaca-se ainda a Val482, Leu 481, Ser480, Arg484.
Os valores energéticos calculados, para todos os resíduos compreendidos em
um raio de 12 Å, com ε=0 e ε=40 e expressos em kcal/mol, estão expressos nas tabelas
2 e 3. Em azul os resíduos com energia positiva e em vermelho os com energia
negativa. Além disso, as tabelas 2 e 3, trazem outras informações importantes para
avaliação da afinidade do resíduo com o ligante, a exemplo do grupo atômico do
fármaco que interage com o resíduo e a distância dessa interação. Outra forma de
62
observar o diferente comportamento da energia em função da constante dielétrica
está representada na figura 15.
Figura 15: Energia total do sistema em diferentes raios e constantes dielétrica.
Fonte: Dados da Pesquisa
Através da figura acima, podemos perceber que a energia total nos diferentes
raios, quando considerado ε=0, para os raios de 5 Å e 8 Å é maior no sítio I-FA6, do que
no sítio I-FA3, só sendo corretamente caracterizada no raio de 12 Å, quando a energia
total do I-FA3 é maior. Fato que não acontece quando se emprega a constante ε=40,
pois em todos os raios apresentados a energia do I-FA3 é mais negativa. Dessa forma,
a constante dielétrica de 40, consegue já em raios menores a exemplo de 5 Å, mostrar
que a interação do ibuprofeno no sítio I-FA3 é maior.
63
Tabela 2: Dados da interação entre os resíduos e o ibuprofeno no sítio I-FA3
r (Å)
Resíduo
Grupo Atômico
d (Å)
Energia (ε=0)
Energia (ε=40)
3.0
4.5
5.0
Leu453
Asn391
Leu387
Ile388
Phe403
Leu407
Arg410
Leu430
Val433
Ala449
Arg485
Tyr411
Ser489
Gly431
Gly434
Glu450
Cys392
Tyr452
Leu457
Phe395
Lys414
Cys437
Cys438
Pro384
Gln390
Leu394
Asn429
Val456
Lys389
Ser427
Lys432
Ser454
Phe488
Asn386
Gln404
Val426
Ser435
Arg445
Met446
Cys448
Glu393
Ala406
Lys436
Asp451
Pro486
Glu383
Gln385
Arg428
Val455
Arg348
Glu396
Arg484
Ala490
Ser342
Val344
Leu398
Glu400
Leu408
Pro447
Gln397
Gly399
Asn458
Leu460
Cys487
Leu491
iii(C5)
iii(C2)
ii(C12)
iii(C5)
iii(C2)
ii(C10)
i(C1)COO(-)
ii(C9)
iii(C5)
iii(C5)
i(C7)
i(C1)COO(-)
i(C7)
ii(C10)
iii(C4)
iii(C5)
iii(C4)
iii(C5)
i(C7)
iii(C4)
i(C1)COO(-)
iii (C4)
iii (C4)
ii(C13)
Ii(C13)
ii(C2)
iii(C3)
ii(C9)
iii(C2)
ii(C9)
iii(C4)
iii(C5)
i(C7)
ii(C13)
ii(C10)
ii(C9)
iii(C4)
iii(C5)
iii(C5)
iii(C5)
iii(C4)
i (C1)COO(-)
iii(C4)
iii(C5)
i(C7)
i(C7)
ii(C13)
ii(C10)
iii(C5)
i(C7)
iii(C4)
i(C7)
i(C7)
iii(C5)
i(C7)
iii(C2)
iii(C4)
i(C1)COO(-)
iii(C5)
iii(C4)
iii(C4)
i(C6)
i(C6)
i(C7)
i(C7)
1.80
2.17
1.89
2.67
2.61
3.59
1.98
2.83
1.90
2.09
2.42
1.88
1.41
4.79
2.18
5.04
3.64
4.45
4.16
4.06
2.47
3.70
3.41
6.47
6.15
6.22
6.46
6.36
6.45
6.53
5.40
7.25
3.65
6.98
7.67
6.87
4.89
5.71
6.08
5.81
7.04
7.87
5.32
7.20
5.61
6.57
8.06
8.35
8.68
8.31
7.41
6.33
5.61
9.56
9.48
9.16
7.95
8.72
8.22
9.36
8.98
10.22
8.31
6.37
6.37
-6.70
-1.58
-0.80
-0.22
-3.53
-0.58
-84.85
-4.62
-2.93
0.24
-37.44
5.45
-15.81
-0.52
-0.42
30.51
0.79
-2.15
-0.48
-0.96
-81.41
-0.78
0.37
0.94
-0.25
-0.49
1.29
-2.20
-23.94
1.25
-39.63
-0.26
0.35
0.12
-2.12
0.66
-1.37
-23.97
-0.31
-0.65
28.69
0.19
-0.85
25.03
0.08
32.79
0.24
-35.47
-1.23
-36.30
20.96
-27.59
0.35
0.11
0.21
-1.86
30.00
3.50
-0.26
0.26
-0.40
-1.28
-0.97
1.05
1.72
-4.54
-0.96
-0.74
-1.34
-2.81
-2.72
-16.50
-3.16
-2.70
-0.04
-1.57
-1.38
-7.72
0.14
-0.17
1.02
-0.03
-0.30
-1.25
-1.41
-9.16
-0.05
-0.03
0.05
-0.07
-0.09
-0.10
-0.20
-0.64
0.04
-0.99
-0.02
-0.45
-0.04
0.04
-0.03
-0.02
-0.67
-0.01
-0.01
0.66
0.01
-0.04
0.69
0.04
1.07
0.05
-0.77
-0.10
-0.88
0.64
-0.81
0.18
-0.07
-0.04
-1.00
0.84
0.13
-0.01
-0.01
0.00
-0.07
-0.11
0.18
-0.03
5.5
6.5
7.0
7.5
8.0
8.5
9.0
9.5
10.0
10.5
11.0
11.5
12.0
64
Tabela 3: Dados da interação entre os resíduos e o ibuprofeno no sítio I-FA6.
r (Å)
Resíduo
Grupo Atômico
d (Å)
Energia (ε=0)
Energia (ε=40)
4.0
Lys351
Ala210
Ala213
Leu347
Val482
Arg209
Ala350
Glu354
Leu331
Trp214
Leu327
Arg348
Leu481
Phe206
Phe211
Lys212
Thr352
Asp324
Val344
Thr355
Ser480
Gly207
Glu208
Ala217
Val343
Leu346
Leu349
Asn483
Ser202
Ala215
Val216
Gly328
Tyr353
Tyr319
Phe330
Leu345
Glu479
Lys323
Glu358
Arg484
Leu203
Lys205
Arg218
Thr356
Leu380
i(C1)COO(-)
i(C7)
iii(C5)
ii(C10)
i(C1)COO(-)
iii(C5)
iii(C4)
iii(C2)
iii(C4)
ii(C13)
iii(C4)
ii(C10)
i(C1)COO(-)
i(C7)
i(C7)
iii(C5)
iii(C2)
iii(C5)
ii(C9)
iii(C2)
i(C1)COO(-)
i(C7)
iii(C5)
iii(C3)
ii(C9)
iii(C4)
iii(C4)
i(C1)COO(-)
i(C7)
iii(C5)
iii(C5)
iii(C4)
iii(C4)
iii(C4)
iii(C4)
ii(C10)
i(C1)COO(-)
iii(C4)
ii(C13)
i(C1)COO(-)
i(C7)
i(C7)
iii(C3)
iii(C2)
iii(C2)
1.72
2.52
2.40
2.48
1.54
2.00
1.81
2.88
2.91
5.71
2.33
5.99
2.53
2.58
6.46
5.85
5.85
4.68
6.62
6.15
3.38
5.85
7.26
6.82
7.54
5.89
5.67
3.71
6.39
8.06
6.02
4.71
5.11
6.30
4.87
8.52
5.56
6.30
8.56
5.68
8.18
6.69
9.90
8.64
10.07
-108.03
-3.38
-3.61
1.61
-11.01
-46.87
-2.63
32.94
-1.09
-1.96
-2.49
-30.07
-19.40
0.09
1.14
-32.93
0.50
31.60
1.91
-1.68
-19.35
1.69
38.85
-0.50
1.59
0.50
-0.01
2.29
0.43
-0.50
-0.38
0.56
-0.92
0.95
-0.49
2.22
33.79
-33.79
21.83
-38.93
-0.86
-1.31
-31.78
-1.53
0.33
-8.17
-2.97
-2.27
-0.90
-4.62
-3.29
-0.92
0.57
-0.65
-0.27
-1.69
-1.10
-13.02
-1.50
-0.07
-1.18
-0.05
0.61
0.04
-0.11
-9.60
0.29
1.07
-0.06
0.02
-0.04
-0.01
0.32
-0.01
0.00
-0.06
-0.06
-0.14
0.03
-0.08
0.09
0.45
-1.30
0.78
-1.44
-0.03
-0.15
-0.79
-0.09
0.03
4.5
5.0
5.5
6.0
7.0
7.5
8.0
8.5
9.0
9.5
10.0
11.0
11.5
65
Após a análise dos diferentes valores para os métodos empregados, é hora de
caracterizar os principais resíduos por sítio de ligação.
A
descrição
receptor-ligante
depende
da
complementariedade
de
características estruturais e físico-químicas das moléculas interagentes visando a
identificação do arranjo conformacional preferencial, correspondendo à maior energia
livre de interação (TEAGUE, 2003; MAGALHÃES; BARBOSA; DARDENNE, 2007).
A alta afinidade de um ligante por um sito-receptor pode ser estabelecida com
base nos seguintes critérios: alto nível de complementariedade estérica entre o ligante
e o sítio ativo e de propriedades associadas às superfícies de contato entre a proteína
e o ligante, raramente há interações repulsivas entre o ligante e a proteína e o ligante
geralmente se liga em uma conformação energeticamente favorável, previsível pela
alta energia de interação (MAGALHÃES; BARBOSA; DARDENNE, 2007).
Levando em consideração os critérios expostos, através de cálculos quânticos,
baseados no DFT, estimou-se a energia de interação de cada resíduo com o ligante,
utilizando uma constante dielétrica de zero e quarenta e as principais energias estão
sumarizadas no gráfico tipo BIRD, que corresponde a um acrônimo do inglês para: sítio
de ligação, energia de interação e domínio dos resíduos (Figura 16).
A figura 16 apresenta um comparativo do valor energético de interação
individual, calculados com diferentes constantes. Os resíduos Leu453, Phe403, Arg410,
Leu430, Arg485, Tyr411, Ser489, Lys489, Lys414, lys432, Glu383, Arg348 e Glu400
foram listados, por corresponderem aos doze resíduos com maiores energias dentre os
analisados no sítio I-FA3.
66
Figura 16: Energias de interação e contatos intermoleculares dos resíduos que mais
contribuem para a estabilidade do ibuprofeno no sítio I-FA3 e I-FA6, respectivamente. As
barras horizontais rachuradas e pretas expressam a energia de interação do resíduo com o
ibuprofeno, utilizando uma constante dielétrica de zero e quarenta, respectivamente. No
canto direito da figura, em verde, encontram-se os valores da menor distância entre os
resíduos e o ibuprofeno, e ao lado de cada barra está identificado a região do fármaco que
interage com o resíduo.
ENERGIA (Kcal/mol)
ENERGIA (Kcal/mol)
67
Levando-se em consideração os valores obtidos com a constante dielétrica de
quarenta, por razões aqui já apresentadas, percebe-se que os resíduos Glu383 e
Glu400, apresentam energia repulsiva, e, portanto não são importantes para a
interação direta do fármaco ao sítio. Porém ao observara estrutura cristalográfica do
sítio percebe-se que os resíduos de ácido Glutâmico (Glu) são importantes para a
estabilização de resíduos como a Arginina, que apresentam forte interação com o
ibuprofeno no sítio.
Em contrapartida, os resíduos que apresentam interações próximas com o
fármaco, e altos valores negativos de energia, caracterizando energia atrativa são
considerados importantes para a descrição da interação nesse sítio Em ordem
decrescente de importância, estabelecida pelos valores energéticos, estão a Arg410 (16,50 Kcal/mol), Lys414 (-9,16), Ser489 (-7,72 Kcal/mol), Leu453 (-4,54 Kcal/mol) e
Tyr411 (-1,38 Kcal/mol).
Como mencionado anteriormente o único trabalho que realiza um estudo da
interação do ibuprofeno a albumina de soro humano, coloca os resíduo como Tyr411,
Arg 410 e Ser489 como mais importantes, ainda que sem estabelecer os valores
energéticos de interação. Então os achados corroboram parte do que foi descrito por
Ghuman et al. (2005), a Arg410 e a Ser489 são sim resíduos importantes, em virtude
das suas ligações. A Tyr411 fica em 5ª posição pela ordem energética, embora
apresente uma ligação cátion π entre o seu anel e o anel do ibuprofeno.
Porém merece destaque o papel da Lys414 que apresenta a segunda maior
energia de interação e estabelece interações diretas e de curto alcance com o
ibuprofeno (Figura 17), e da Leu453, quarta maior energia, mas que foram
desprezadas nos estudos pioneiros de Ghuman et al. (2005).
68
Figura 17: Esquema representativo das principais interações químicas que acontecem
no sítio I-FA3.
Fonte: (http://www.rcsb.org/pdb/explore/explore.do?structureId=2bxg)
A figura 17 mostra em linha tracejada preta as interações polares, ponte de
hidrogênio e pontes salinas, que acontecem entre a Lys414, Arg410 e Tyr411 com o
ibuprofeno, e a linha contínua verde as interações hidrofóbicas verificadas. Uma visão
detalhada das interações moleculares que acontecem no sítio I-FA3 é apresentada nas
figuras 18 e 20.
Assim como para o sítio I-FA3, a figura 16 apresenta um comparativo do valor
energético de interação individual dos resíduos, calculados com diferentes constantes.
Os resíduos Lys351, Val482, Arg209, Arg348, Leu481, Lys212, Ser480, Glu208, Glu479,
Lys323, Arg484, Arg218 foram listados, por corresponderem aos doze resíduos com
maiores energias dentre os analisados no sítio I-FA6.
Mais uma vez os resíduos de ácido glutâmico, Glu208 e Glu479, apresentam
energia repulsiva, e, portanto não são importantes para a interação direta do fármaco
ao sítio, mas atuam na estabilização do próprio sítio de ligação.
Em contrapartida, apresentam as maiores energias atrativas os resíduos: Leu
481 (-13,02 Kcal/mol), Ser480(-9,60 Kcal/mol), Lys351 (-8,17 Kcal/mol), Val 482 (-4,62
Kcal/mol) e Arg209 (-3,29 kcal/mol). Nesse caso, os dados corroboram os relatos de
Ghuman et al. (2005).
69
Figura 18: Interações moleculares que acontecem nas diferentes regiões do
Ibuprofeno no sítio I-FA3.
Fonte: Dados da pesquisa.
70
A figura 18 mostra que o grupamento carboxil do ibuprofeno interage com a
hidroxila da Tyr411 e com os grupamentos amina da Lys414 e Arg410, isso a nível de
região I. Na região II, ocorre uma interação entre hidrogênios da cadeia lateral da
Leu430 e da Leu387 com o anel do IBP e na região III, ocorre interações com o
grupamento os hidrogênios de cadeia lateral da Ile388, Ala449, Val433 e com os
hidrogênios do anel da Phe 403.
Figura 19: Interações moleculares que acontecem nas diferentes regiões do
Ibuprofeno no sítio I-FA6.
Fonte: Dados da pesquisa.
71
Analisando a figura 19, podemos observar que diferente do que foi descrito por
Ghuman et al. (2005), o grupo carboxila do IBP, presente na região I, interage com o
grupamento amida da Val482 e Leu481, amina da Lys351 e hidroxil da Ser480. Na
região II, ocorre interação entre o anel e a cadeia lateral da Leu 347 e na região III pela
ligação do esqueleto carbônico com a hidroxila da Glu354, e cadeia lateral da Leu327,
Leu331 e Ala213.
Como pode-se perceber a figura 20 A apresenta o Ibuprofeno no sítio I-FA3 com
os seis aminoácidos mais importantes para a descrição do sítio. Em B é mostrada as
distâncias de interação entre Arg410, Leu 453, Lys414 e Tyr411 e em C, as distâncias
entre a Ser489 e a Leu430 e o ibuprofeno. Em todos os casos as interações destacadas
apresentam o comprimento de ligação menor do que 2,5 Å, representando interações
de hidrogênio quimicamente viáveis.
Através da figura 21 A apresenta o Ibuprofeno no sítio I-FA6 com os cinco
aminoácidos mais importantes para a descrição do sítio (Arg209, Lys351, Leu481,
Ser480 e Val482). Em B é mostrada as distâncias entre Ser480, Lys351 e Arg209 as
respectivas regiões de interação e em C as distâncias de interação para outros dois
resíduos (Val482 e Leu481).
Em todos os casos as interações destacadas apresentam o comprimento de
ligação menor do que 2,5 Å, representando interações de hidrogênio quimicamente
viáveis.
Uma outra forma de classificar os resíduos, está relacionada à distância em que
esses se encontram em relação ao centro de massa do fármaco. Tal análise foi
realizada para ambos os sítios e encontra-se graficamente representada na figura 22.
As figuras mostram o ibuprofeno no centro e os resíduos classificados como próximos,
distantes 6 Å do centro de massa do ibuprofeno e os resíduos pós-próximos que
situam-se entre 6 e 12 Å do centro de massa do ibuprofeno para ambos os sítios.
72
Figura 20: Representação tridimensional dos sítios de ligação I-FA3 com o ibuprofeno e
principais resíduos.
A
B
C
Fonte: Dados da pesquisa.
73
Figura 21: Representação tridimensional do sítio de ligação I-FA6 com o ibuprofeno e
principais resíduos.
I-FA6
A
B
C
I-FA6
I-FA6
Fonte: Dados da pesquisa.
74
Figura 22: Ilustração do sítio de interação I-FA3 (a cima) e I-FA6 (abaixo) com o
ibuprofeno e os principais resíduos próximos e pós-próximos.
Fonte: Dados da pesquisa
75
Os mapas de potencial eletrostático são obtidos de maneira clássica e em
estudos biológicos servem para demonstrar os sítios com maior probabilidade de
ataque eletrofílico, bem como auxiliar no reconhecimento de ligações de hidrogênio.
Dessa forma, as regiões que apresentam valores negativos correspondem as regiões
de ataque eletrofílicos.
Um panorama geral de como se processam as interações por meio da
eletronegatividade pode ser obtida através da figura 23, a qual apresenta os principais
resíduos atrativos e repulsivos por sítios de ligação e as suas devidas posições em
relação ao Ibuprofeno.
Figura 23: Isosuperfícies de potencial eletrostático para os resíduos mais atrativos e
repulsivos para os sítios I-FA3 e I-FA6.
Fonte: Dados da Pesquisa
76
Analisando o mapa eletrostático do ibuprofeno no sítio I-FA3, percebemos que
a região carboxil encontra-se voltada para regiões atrativas da Lys414 e Arg410 e
regiões repulsivas da Ser489. De modo análogo, observamos que no sítio I-FA6 o
ibuprofeno fica com o seu grupamento mais eletronegativo voltado para regiões
menos eletronegativas da Lys351, Leu 481 e Val 482.
77
REFERÊNCIAS
CARTER, D. C.; HO, J. X. Structure of serum albumin. Adv Protein Chem, v. 45, 1994.
DAVIES, N. L.; MICHAEL, M. C. Princípios de Bioquímica de Lehninger. 5. ed. São Paulo:
Artmed, 2010.
FANALI; G. et al. Human Serum albumin: From bench to bedside. Molecular Aspects of
Medicine, v. 33,p: 209-90, 2012.
GHUMAN, J.; ZUNSZAIN, P. A.; PETITPAS, I.; BHATTACHARYA, A. A.; OTAGIRI, M.;
CURRY, S. Structural basis of the drug-binding specificity of human serum album. J.
Mol. Biol, v. 353, 2005.
MAGALHAES, C. S.; BARBOSA, H. J. C.; DARDENNE, L. E. Método de Docking receptorligante para o desenho racional de compostos bioativos. In: MORGON, N. H.;
COUTINHO, K. (orgs) Métodos de química teórica e modelagem molecular. São Paulo:
Editora Livraria da Física, 2007.
OKULIK, N.; JUBERT, A. H. Theoretical study on the structure and reactive sites of three
non-steroidal anti-inflammatory drugs: ibuprofen, Naproxen and Tolmetin acids.
Journal of Molecular Structure: Theochem, v. 769, p:135-141, 2006.
PETITPAS, I.; GRUNE, T.; BATTACHARYA, A. A.; CURRY, S. Crystal structure of human
serum albumin complexed with monounsaturated and polyunsaturated fatty acids. J
Mol Biol, v. 314, 2001.
ROCHE, M.; RONDEAU, P.; SINGH, N. R.;TARNUS, E.; BOURDON, E. The antioxidant
properties of serum albumin. FEBS Lett, v. 582,p: 1783–1787, 2008.
SIMARD, J. R.; ZUNSZAIN, P. A.; HAMILTON, J. A.; CURRY, S. location of high and low
afinity fatty acid binding sites on human serum albumin revealed by NMR drugcompetition analysis. J. mol. Biol. 361, p: 336-351, 2006.
TEAGUE, S. J. Implications of protein flexibility for drug discovery. Nature reviews Drug
Discovery, v.2, p. 527-541, 2003.
78
4 CONSIDERAÇÕES FINAIS E PERSPECTIVAS
As análises realizadas permitem assegurar que os métodos quânticos, baseados
na Teoria do Funcional da Densidade, por meio de suas aproximações e correções, é
um método eficiente para a descrição de sistemas biológicos, visto que oferece uma
riqueza de detalhes com principal destaque para as energias individuais de interação,
permitindo apontar de maneira objetiva os principais resíduos para a interação.
Baseado nesses valores de energia observou-se que a utilização de uma
constante dielétrica intermediária é eficiente para a correta descrição do sistema,
como também, que os sítios de ligação da albumina de soro humano para o
ibuprofeno são totalmente diferentes, tanto em composição, como em grandeza
energética.
Outro achado relevante do estudo corresponde às diferentes ligações e seus
valores energéticos, presentes nos dois sítios presentes na mesma molécula de
albumina do soro humano, o que ilustra a diversidade biológica para diferentes
ligações em uma mesma estrutura proteica.
A partir do estudo quântico, observamos que os achados corroboram com a
literatura colocando o sítio Sudlow I (I-FA3) como o principal sítio de ligação e o sítio IFA6 como sítio secundário, visto que a energia de interação total no primeiro sítio é
maior do que no segundo.
Contudo, difere dos dados disponíveis na literatura, incluindo o próprio estudo
originário do PDB, quanto a identificação dos aminoácidos mais importantes, que por
meio da energia de interação, em ordem decrescente de energia, são: Arg410, Lys414,
Ser 489, Leu453 e Tyr411 para o Sítio I-FA3 e Leu481, Ser480, Lys351, Val482 e Arg209
para o sítio I-FA6.
A quantificação da energia de interação e a descrição dos aminoácidos mais
importantes abrem caminhos para novos estudos que visem a manipulação da
estrutura do ibuprofeno ou da albumina de soro humano, compreendendo a
importância das pontes dissulfídicas para estabilização da sua estrutura, o efeito do pH
na conformação tridimensional, bem como as alterações estruturais associada e o
79
efeito nessa interação fármaco-receptor provocados por mutações nos aminoácidos
constituintes da albumina de soro humano.
Além disso, pode-se realizar o estudo por meio de simulação quântica de
outros fármacos de função análoga ao ibuprofeno e sua ligação/interação com a
albumina, bem como, analisar, por exemplo, como ocorre a interação do ibuprofeno
com as ciclooxigenases, a fim de estabelecer bases estruturais do mecanismo de
inibição da via das ciclooxigenases promovida por esse fármaco.