IEE ASSIS BRASIL- QUÍMICA – 3º ANO ENSINO MÉDIO POLITÉCNICO - 2015
Química Orgânica estudo dos compostos do carbono com propriedades específicas.
O átomo de carbono é considerado especial pela sua capacidade em formar ligações com
outros átomos e dar origem a longas cadeias carbônicas. Tudo se deve à tetravalência do
carbono, ele pode se unir formando quatro ligações, sendo que os átomos participantes podem
ser
de
carbono
ou
de
outros
elementos
(heteroátomos).
Os heteroátomos mais comuns são: Nitrogênio (N), Oxigênio, Enxofre (S) e Fósforo (P).
Exemplo:
O átomo de Oxigênio não está localizado entre carbonos e sim acima deles, formando uma
ramificação, sendo assim não pode ser considerado como heteroátomo.
1)Classificação dos átomos numa cadeia carbônica:
Em uma cadeia, cada carbono é classificado de acordo com o número de outros átomos de
carbono ligados a ele.
Carbono primário: Ligado diretamente a apenas 1 outro carbono.
Carbono secundário: Ligado diretamente a 2 outros carbonos.
Carbono terciário: Ligado diretamente a 3 outros carbonos.
Carbono quaternário: Ligado diretamente a 4 outros carbonos.
2)propriedades dos compostos orgânicos:
Combustibilidade: é a propriedade que um composto tem de se queimar. A maioria das
substâncias que sofrem combustão é de origem orgânica. É por isso que dizemos que compostos
orgânicos são ótimos combustíveis.
Exemplos:
- O gás que utilizamos na cozinha (GLP) é composto por hidrocarbonetos, portanto é orgânico.
- O álcool combustível dos automóveis - etanol de fórmula (CH3CH2OH) - é de origem
orgânica.
Temperatura de fusão e de ebulição
À temperatura ambiente, os compostos orgânicos se encontram nos três estados físicos: sólido,
líquido e gasoso.
1
Exemplos:
- Gás butano (C4H10): o gás usado em isqueiros tem temperaturas de fusão (-138 °C) e ebulição
(0 °C) baixas.
- Etanol: líquido combustível com temperatura de fusão (-117 °C) e ebulição (78,3 °C).
Solubilidade em água
Essa propriedade se relaciona com a polaridade da molécula orgânica.
Compostos orgânicos apolares: são praticamente todos insolúveis em água. Seguindo a regra:
“Semelhante dissolve semelhante”, vemos a razão. Como a água é polar, ela não dissolve
compostos apolares como gasolina, querosene, óleo diesel, etc.
Compostos orgânicos polares: esses podem ser dissolvidos na água. Exemplos: açúcar, álcool
comum, acetona etc
Fórmula molecular e estrutural : CH3- CH3
- C2H6
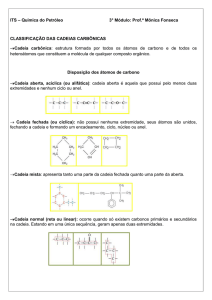
3)Classificação das cadeias orgânicas:
A)Quanto ao fechamento da cadeia:
3.1)cadeia aberta, acíclica ou alifática possui pelo menos duas extremidades ou pontas, não
há nenhum encadeamento, fechamento, ciclo ou anel nela. Exemplos:
3.2)cadeia fechada ou cíclicanão possui nenhuma extremidade ou ponta, seus átomos são
unidos, fechando a cadeia e formando um encadeamento, ciclo, núcleo ou anel. Exemplos:
3.3)cadeia mistaapresenta tanto uma parte da cadeia fechada quanto uma parte da aberta.
Exemplos:
B)quanto à disposição dos átomos de carbono na cadeia carbônica:
3.1)cadeia normal, reta ou linearocorre quando só existem carbonos primários e
secundários na cadeia. Estando em uma única sequência, geram apenas duas extremidades ou
pontas. Exemplos:
2
3
3.2-)cadeia ramificada são aquelas que possuem três ou mais extremidades, com carbonos
terciários ou quaternários. Exemplos:
C)Quanto ao tipo de ligação entre os carbonos:
3.1-cadeia saturada classificação dada para aquelas cadeias que possuem somente ligações
simples entre os carbonos. Exemplos:
3.2- cadeia insaturadacadeias que possuem pelo menos uma ligação dupla ou tripla entre os
carbonos. Exemplos:
D)quanto à natureza dos átomos que compõem a cadeia carbônica:
3.1)cadeia homogêneasão aquelas que não possuem nenhum heteroátomo entre os carbonos,
ou seja, essas cadeias são constituídas somente por carbonos. Exemplos:
3.2- cadeia heterogêneanesse caso há algum heteroátomo entre os carbonos, que
normalmente são o oxigênio (O), o nitrogênio (N), o fósforo (P) e o enxofre (S). Exemplos:
D)quanto ao aparecimento de um anel aromático na cadeia carbônica:
3.1 –cadeia aromáticasão as que apresentam em sua estrutura pelo menos um anel
benzênico, também denominado anel aromático (C6H6). Exemplos:
3.2- cadeia não aromática ou alicíclicassão as cadeias fechadas que não apresentam um anel
benzênico em sua estrutura. Exemplos:
E- quanto a ligação entre átomos de carbono:
3.1) Cadeia Saturada: quando apresenta somente ligações simples entre os átomos de carbono.
Essas ligações são denominadas sigma (σ).
3.2) Cadeia Insaturada: quando apresenta pelo menos uma ligação dupla (=) ou então uma
tripla (≡). As ligações presentes são conhecidas como ligações pi (π).
fonte: http://www.infoescola.com/quimica-organica
Exercícios:
1) A substancia responsável pelo sabor característico da laranja, apresenta a seguinte estrutura
simplificada:
O
║
C─C
│
O─C─C─C─C─C─C─C─C
a)qual o numero de hidrogênios presentes nessa substancia?
b)classifica os carbonos presentes nesta estrutura.
c)essa molécula apresenta algum heteroátomo?
4
2) O composto orgânico de fórmula plana abaixo possui:
CH3 —CCH3 —CH — CH2 — CH3
|
|
CH3
CH3
Determina o numero de carbonos secundários:
3) No composto:
H3C
|
CH — CH — CH2 — CH — CH3
|
|
|
H3C
CH3
CH3
as quantidades totais de átomos de carbono primário, secundário e terciário são,
respectivamente, iguais a:
4 Completa com as ligações necessárias H2C …. C …. CH …. CH2 …. CH2 …. C …. N:
5) ) A prednisona é um glicocorticoide sintético de potente ação antirreumática, antiinflamatória e antialérgica, cujo uso, como de qualquer outro derivado da cortisona, requer
uma série de precauções em função dos efeitos colaterais que pode causar. Os pacientes
submetidos a esse tratamento devem ser periodicamente monitorados, e a relação entre o
benefício e reações adversas deve ser um fator preponderante na sua indicação.
Fórmula estrutural da prednisona
Com base na fórmula estrutural apresentada anteriormente,responde: a) qual o número de
átomos de carbono terciários que ocorrem em cada molécula da prednisona?b)fórmula
molecular da estrutura?
06. O composto H3 C − C − O − C − CH3
H2
H2
possui, em sua estrutura, uma cadeia que pode ser classificada como?
5
07. Para aliviar uma simples dor de cabeça , costumamos utilizar analgésicos ,
que são medicamentos que combatem a dor sem causar inconsciência ou
insensibilidade. Muitos são os exemplos de analgésicos usados no dia a dia. Como
exemplo podemos citar o ácido acetilsalicílico ( AAS ) e o paracetamol que são os
princípios ativos de muitos dos compostos . A fórmula estrutural do paracetamol
aparece abaixo representada.
A respeito deste composto e de sua cadeia, julgue os itens que se seguem
O
H
││ │
H–O–
-----N – C – C – H
│
H
(1)Apresenta um total de 9 átomos de hidrogênio..
(3)Podemos classificar a cadeia deste anestésico como mista , insaturada e
heterogênea.
(4)Na porção aromática da cadeia , não existem carbonos terciários.
Fonte:
www.mundoeducacao.com
6