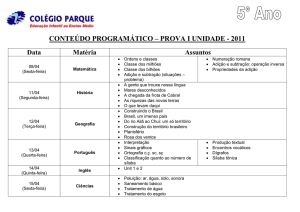
Instituto de Química – USP
Reatividade de Compostos Orgânicos
QFL-0342 (2016)
Adição Eletrofílica
Massuo Jorge Kato ([email protected])
http://www2.iq.usp.br/docente/majokato/index.dhtml?pagina=699&chave=z
2L
QFL-0343 Reatividade em química orgânica (MJK, 2016)
Reações de adição eletrofílica em compostos insaturados.
1) Nomenclatura, hibridização e estruturas (E/Z) de alcenos;
2) Estabilidade relativa de alcenos; calores de hidrogenação catalítica;
3) Estruturas, estabilidade relativa e rearranjos de carbocátions (Q8);
4) Regiosseletividade (regioquímica) das adições HY (HX; H2O; H2SO4) (Q2 – Q5, Q7, Q8);
reações de HY em presença de peróxidos (vide estabilidade de radicais) (Q3, Q6, Q7);
Orientações Markovnikov e Anti-Markovnikov;
5) Métodos alternativos importantes para a obtenção de álcoois:
oximercuração/desmercuração (Q11) e hidroboração/oxidação/hidrólise (Q-3)
6) Adições de X2 e competições com outros nucleófilos; (Q1)
7) Oxidações parciais de olefinas [epoxidação (Q10); hidroxilações] e clivagens oxidativas
(Q12 – Q16).
Tópicos correlacionados:
Reações de eliminação (E1 e E2) formando alcenos;
Reações de substituição nucleofílica (SN1 e SN2)
Propriedades espectrofotométricas e espectroscópicas de compostos
insaturados;
3
Sugestões de estudo:
O ideal dar uma olhada antes das aulas e observar qual é a essência dos tópicos;
Escreva as reações envolvidas pois isso é essencial para o estudo da química
orgânica;
Jamais deixe a matéria acumular, pois cada tópico serve de base para o seguinte;
Os exercícios servem como guia para os estudos; tente descobrir qual é a
essência do problema;
Discuta a matéria dentro dos grupos tentando deixar claro o princípio envolvido
em cada tópico.
4
Instituto de Química – USP
Reatividade de Compostos Orgânicos
QFL-0342 (2016)
Adição Eletrofílica
5
Hidrogenação catalítica de alcenos
H
H
C
C
H
H C
C
H2
c a t a lis a d o r
h id ro g ê n io a b s o rv id o n a
s u p e rf íc ie d o c a t a lis a d o r
c o m p le x o
c a t a lis a d o r- a lc e n o
H
C
H
C
C
H
C
+
H
c a t a lis a d o r
re g e n e ra d o
in s e rç ã o d e h id ro g ê n io n a
d u p la lig a ç ã o c a rb o n o - c a rb o n o
BOTH HYDROGENS ADD TO THE SAME SIDE OF THE DOUBLE BOND
not
observed
H
X
CH3
CH3
CH3
anti
addition
H
CH3
CH3
CH3
H
H
syn
addition
Reações de adição eletrofílica versus reação radicalar
Compare os resultados em A e B e pense a respeito dos mecanismos envolvidos
A
B
Em A ocorre uma adição ao H+ (eletrófilo) formando as duas alternativas de carbocátions
O que rege a estabilidade de carbocátions?
Estabilidades Relativas de Carbocátions
Somente para
lembrar
10
Estabilidade de Carbocátions:
Mecanismos de Deslocalização de Elétrons: Hiperconjugação
11
Three main structural factors that help to stabilize carbocations:
1. Neighboring carbon atoms.
2. Neighboring carbon-carbon multiple bonds
3. Neighboring atoms with lone pairs.
This phenomenon is
common in
Mass spectrometry
(in amines, alcohols,
aldehydes and wherever
Are atoms adjacente
with lone electrons)
Regioquímica da Adição
Qual produto é formado preferencialmente?
16
A regioquímica é definida pelo mecanismo e
pela estabilidade do intermediário
carbocátion
mais estável
17
Etapa Determinante da Velocidade:
Formação do Carbocátion
18
Regra de Markovnikov
Enunciado preliminar: O eletrófilo se adiciona preferencialmente ao carbono sp2 da
ligação C=C o qual possui maior número de hidrogênios.
Em uma reação regiosseletiva, há a formação de um isômero constitucional como
produto majoritário ou único produto da reação.
19
Reações de adição eletrofílica versus reação radicalar
Compare os resultados em A e B e pense a respeito dos mecanismos envolvidos
A
B
No caso B, o mecanismo envolve a formação de radicais
B
Formação de Radicais
Radicais são formados pela quebra homolítica de reações relativamente
fracas.
Peróxidos:
Halogênios:
Mecanismo de Adição de HBr a Alquenos na Presença de Peróxido:
Etapas de Iniciação
Mecanismo de Adição de HBr a Alquenos na Presença de Peróxido:
Etapas de Propagação
Mecanismo de Adição de HBr a Alquenos na Presença de Peróxido:
Etapas de Terminação
Estabilidade Relativa de Radicais e carbocátions
26
Adição de HBr a Alquenos:
O Efeito de Peróxidos
Adição Markovnikov
Adição anti-Markovnikov
(regioquímica comparada com a
Obtida pela reação iônica)
27
O que as orientações Markovnikov e antiMarkovnikov têm em comum?
Produto
Markovnikov
Produto
Anti-Markovnikov
28
Adição de Água à Alquenos
Mecanismo da adição de água catalisada por ácido:
29
Formação de
carbocátions é
a etapa determinante
na velocidade das reações
Alceno + HCl
Hidratação do Propeno
30
Adição de álcool catalisada por ácido
Mecanismo da adição de álcool catalisada por ácido:
31
Porém, quando carbocátions mais estáveis podem ser formados
as reações de adição eletrofilica.
Migração 1,2 de hidreto:
carbocátion
mais estável
32
Migração 1,2 de metila:
carbocátion
mais estável
33
E nesse caso?
34
Como se explica essa conversão?
35
Os rearranjos de carbocátions limitam a aplicação das
hidratações de alcenos catalisadas por ácidos.
Solução: Oximercuriação/Demercuriação
36
Adição de Água por Oximercuriação
Mecanismo da oximercuriação
?
H20
37
Adição de Água por Oximercuriação
Mecanismo da oximercuriação
Adição Markovnikov
Adição Markovnikov
adição anti
38
Adição de Água por Oximercuriação
Mecanismo da oximercuriação
Adição Markovnikov
Adição Markovnikov
adição anti
39
Desmercuriação por Redução
O mecanismo da reação é complicado envolvendo hidretos de mercúrio e espécies
radicalares. Por isso, o passo de redução não é estereospecífico.
Com isso o processo total de mercuriação / desmercuriação é uma transformação não
estereospecífica, mas altamente regiosseletiva.
40
Adição de Água por Hidroboração – Oxidação
Comparação entre hidratação ácida e hidroboração:
Produto Markovnikov
Produto
anti-Markovnikov
Características da hidroboração:
i)
A adição é “anti-Markovnikov”;
ii) Hidroboração/oxidação é um método importante
para a preparação de alcoóis.
H. C. Brown; Prêmio Nobel de
Química em 1979
41
Mecanismo da Hidroboração
hidrogênio
entra como
hidreto
centro
eletrofílico
Adição SIN
concertada com
regioquímica
42
Estados de Transição para Adição de BH3 e
HBr
Adição
“Anti-Markovnikov”
Adição
Markovnikov
reação pericíclica
43
Mecanismo da Hidroboração:
Formação de Dialquil e Trialquil Boranas
44
Mecanismo da Oxidação:
Substituição do Boro por OH
rearranjo
hidrólise
45
Estereoquímica da Hidroboração-Oxidação
adição sin
46
Reações de Adição com Br2
Íon Bromônio como Intermediário
(Adição anti)
47
Adição de halogênios à alcenos
48
Evidência Experimental para o Íon
Bromônio
X
Br-
49
A bromação ocorre por uma adição anti:
Mecanismo:
Íon Bromônio versus Carbocátion “aberto”
Por que a estrutura íon bromônio é mais estável que a do carbocátion?
Quais as consequências para a estereoquímica da reação?
51
Evidência Experimental para o Íon
Bromônio
Estereoquímica da Adição de Bromo
produto trans
O produto cis
não é formado
Reação de Hidratação
Reação de hidratação: Na presença de um catalisador ácido,
água é adicionada a alquenos fornecendo alcoóis.
As reações acima são equilíbrios.
Como o equilíbrio pode ser deslocado para favorecer o alqueno? E
para favorecer o álcool?
Adição de Bromo ao cis- e trans-2-Buteno
Estereoquímica dos produtos: produtos treo,
eritro, racêmicos, meso
54
Quais produtos são formados, quais as configurações e as relações entre os produtos?
55
Estereoquímica da Adição de Bromo
Adição Anti
b
a
+
Br2
+
CH3
Br
Br
Br
CH3
Br
adição anti
CH3
Br
a
b
CH3
(a,a)
Br
Br
Br
Br
Br
Br
CH3
CH3
Br
CH3
(e,e)
Br
CH3
Qual a relação estereoquímica
entre os dois isômeros em a) e b)
Br
CH3
Br
(e,e)
Br
(a,a)
56
Adição de Br2 na presença de água
Mecanismo para formação de Haloidrina:
Porque se forma este regioisômero e não o outro possível?
57
Adição de Br2 na presença de MeOH
Como a regiosseletividade da reação abaixo pode ser interpretada?
Notar que a unidade eletrofílica fica no carbono menos substituído da ligação
dupla
58
Estados de Transição quando da Adição Nucleofílica de
Água ao Íon Bromônio
O que importa é a maior ou menor estabilização do caráter de carbocátion!
59
Velocidade Relativa da Reação de Alquenos
Velocidades relativas da bromação:
Compatível com íon bromônio ou carbocátion?
60
Hidroboração – Oxidação de Alquinos
Hidroboração de Alquinos Terminais
CH3 CH3
CH3 CH3
CH3CH2C
CH
+
CH3CH
CH3CH
CH
2
-
HO , H2O2
H2O
BH
CH
2
C
C
B
H
C
H
C
CH2CH3
O
CH2CH3
H
HO
cetona
CH3CH2CH2CH
H
aldeído
61
Clivagem da Ligação C=C com KMnO4
Sob aquecimento em meio básico ou em meio ácido
a frio, o KMnO4 cliva a ligação dupla C=C.
62
Clivagem Oxidativa de Alquenos por Ozonólise
muito instável
(um pouco) mais estável
63
Clivagem dos Ozonetos
condições redutivas
condições oxidativas
64
Ozonólise de Alquenos: Exemplos
65
Epoxidação (Formação de Oxaciclopropanos)
i) A partir de haloidrinas
Estrutura?
ii) Reações de epoxidação são normalmente realizadas com perácidos. O mais
usado é o m-CPBA.
66
Oxidação de Alquenos com Perácidos
Mecanismo da Epoxidação:
Mecanismo Geral: Transferência de “oxigênio eletrofílico”
67
Estereospecificidade da Reação de Epoxidação
68
Reações dos Epóxidos
Hidrólise de epóxidos:
Como pode ser explicada a formação do produto nas reações abaixo?
69