UNIVERSIDADE DE FORTALEZA – UNIFOR
CONFORTO TÉRMICO E O CICLO DE CARNOT: A IMPORTANCIA NO
ENSINO DA TERMODINÂMICA.
Autores: Einstein Maia do Amaral, Neuryane Pereira dos Santos.
RESUMO
Uma condição para se obter conforto térmico é que o corpo esteja em equilíbrio
térmico, ou seja, a quantidade de calor ganho deve ser igual à quantidade de calor cedido para
o ambiente. Condição necessária, mas não suficiente para que haja o tal conforto térmico. Isso
pode ser explicado pela eficiência do sistema termorregulador, que consegue manter o
equilíbrio térmico do organismo numa ampla faixa de combinações das variações pessoais e
ambientais. Assim, o conforto térmico num determinado ambiente pode ser definido como a
sensação de bem estar experimentada por uma pessoa, como resultado de uma combinação
satisfatória neste ambiente com suas variáveis ambientais, tais como a temperatura radiante
média, a umidade relativa do ar, a temperatura e velocidade do vento com a atividade
desenvolvida e ainda, a vestimenta utilizada (Ruas, 2001).
A partir do estudo da termodinâmica, entende-se que energia pode ser transferida
através de interações entre um sistema e sua vizinhança. Essas interações incluem a
transferência de energia por calor e trabalho, assim como a transferência de energia associada
com escoamento de massa. A termodinâmica lida com os estados inicial e final que delimitam
processos durante os quais as interações ocorrem e também com as quantidades líquidas de
transferência de energia por calor e trabalho para os processos.
A energia, uma vez que existe, não pode ser aniquilada, pode somente mudar de
forma, eis o Princípio de Conservação da Energia correspondente à 1ª Lei da Termodinâmica.
Palavras – chave: Conforto térmico, Termodinâmica, Ciclo de Carnot.
Universidade de Fortaleza – UNIFOR.
Rodrigo Alves Patrício: Coordenador monitoria CCT. Email: [email protected]
Einstein Maia do Amaral: Professor. Email: [email protected]
Neuryane Pereira dos Santos: Aluna e Monitora. Email: [email protected]
SUMÁRIO
Resumo
................................................................................................................... 1
Conforto térmico
....................................................................................................... 3
Primeira Lei da Termodinâmica
Energia dos Ciclos
....................................................................................................... 5
Segunda Lei da Termodinâmica
Ciclo de Carnot
............................................................................... 4
............................................................................... 6
....................................................................................................... 7
Temperatura ................................................................................................................... 9
Mudança de Estado ....................................................................................................... 10
Anexo .............................................................................................................................. 12
Referências
................................................................................................................... 14
2
CONFORTO TÉRMICO
Segundo a definição da American Society of Heating, Refrigerating and AirConditioning Engineers, Inc. (ASHRAE) – Standart 55 – 92: “Conforto Térmico é a condição
da mente que expressa a satisfação com o meio térmico”. Segundo Fanger (1970): “a
Neutralidade térmica é a condição de que uma pessoa não prefira nem mais ‘calor’ e nem
mais ‘frio’ no ambiente ao seu redor”.
A busca frequente deste conforto térmico entre as pessoas está relacionada com o
funcionamento do organismo humano, um mecanismo complexo, que seu funcionamento
possa ser comparado a de uma máquina térmica que produz calor conforme sua atividade. O
ser humano precisa liberar calor, em quantidade suficiente, para que sua temperatura interna
se mantenha em torno de 37°C (homeotermia). Quando as trocas de calor entre o corpo
humano e o ambiente ocorrem sem muito esforço (processo espontâneo), a sensação térmica
do indivíduo é o de ter alcançado o conforto térmico e a sua capacidade de trabalho chega a
ser máxima (se compararmos com o ciclo motor, entende-se por máxima eficiência térmica).
Contudo, se as condições térmicas ambientais causam sensações de frio ou de calor é porque
o organismo está perdendo mais ou menos calor necessário (Frota e Schiffer, 2003), e a
homeotermia atua pra manter a temperatura corporal constante.
Os estudos sobre conforto térmico visam analisar e tentar estabelecer as condições
necessárias para a avaliação e a concepção de um ambiente termicamente adequado às
atividades e ocupações humanas, bem como encontrar e estabelecer alguns métodos e
princípios para uma detalhada análise térmica de um ambiente.
A satisfação do homem ou o seu bem-estar em se sentir termicamente confortável, o
desempenho reduzido do ser humano que possivelmente possa estar relacionado ao
desconforto causado por calor ou frio e a conservação de energia são tópicos a serem
considerados para o conforto térmico, pois devido à crescente mecanização e industrialização
da sociedade, as pessoas passam grande parte do tempo em ambientes refrigerados
artificialmente e tudo isso pode ser um dos grandes motivos para seguir estudo relacionado ao
conforto térmico. Podendo levar em consideração algumas variáveis ambientais tais como a
temperatura, os ventos, a umidade do ar e radiação solar.
Alguns destes fatores mencionados para a sensação de conforto térmico corporal e
análise ambiental térmica adequada para a realização das atividades (as atividades
intelectuais, manuais e perceptivas, geralmente apresentam um melhor rendimento quando
3
realizadas em conforto térmico) serão detalhados baseados nos princípios e corolários da
Termodinâmica, enfatizando a primeira e segunda lei da termodinâmica e seus ciclos, com
maior importância no ciclo de Carnot.
Com objetivo de determinar as condições de conforto ou de desconforto térmico em
ambientes reais junto com o desempenho de atividades rotineiras, alguns tópicos foram
desenvolvidos baseados no estudo de Termodinâmica, na temperatura, no equilíbrio Térmico,
condução, convecção, radiação, evaporação e condensação e outros.
PRIMEIRA LEI DA TERMODINÂMICA
Tendo noção básica do que seja a energia e que já lidamos com ela, uma ideologia
simples é que a energia pode ser armazenada nos sistemas sob várias formas, também pode
ser convertida de uma forma à outra e transferida entre os sistemas. Para os sistemas fechados,
a energia pode ser transferida por trabalho e por transferência de calor. A quantidade total de
energia é conservada em todas as transformações e transferências. E será feita uma tentativa
de relação entre os sistemas e sua vizinhança com o organismo humano e o meio externo com
intuito de entender a sensação térmica.
Na mecânica, quando um corpo ao se deslocar de uma posição a outra e sofre a ação
de uma força resultante, o trabalho dessa força é encontrado fazendo-se o produto escalar do
vetor força pelo vetor deslocamento do corpo ao longo dessa trajetória. Este trabalho pode ser
considerado como uma transferência de energia para o corpo, onde ela é armazenada como
energia potencial gravitacional e/ou energia cinética. A partir daqui, entender que a energia é
conservada, fará um momento importante e facilitador para seguir a análise em engenharia.
Para a engenharia termodinâmica, os conceitos de energia cinética, energia potencial
gravitacional e a conservação de energia são ampliados para levar em conta outras variações
de energia, como a energia interna do sistema, e inclui-las para que os sistemas façam
interações com sua vizinhança, isso com observação experimental.
Até então, as interações entre o sistema e sua vizinhança foi exemplificado como
trabalho. No entanto, sistemas fechados também podem interagir com suas vizinhanças, de
uma maneira que não pode ser categorizada como trabalho, mas essa interação será chamada
de transferência de energia por calor. Em bases experimentais, é sabido que as transferências
de energia por calor são induzidas apenas como um resultado de uma diferença de
temperatura entre o sistema e sua vizinhança e que elas ocorrem apenas na direção do
4
decréscimo de temperatura. A partir daqui, o leitor terá que referenciar quem será o sistema e
sua vizinhança. Exemplificando, se o corpo humano for o sistema, sua vizinhança será tudo
externo ao corpo, se o sistema for um ambiente fechado, sua vizinhança será tudo externo ao
ambiente fechado. Assim, será mais claro uma notação para a sensação térmica em questão.
Assim, o primeiro passo em uma análise termodinâmica é definir o sistema. Somente
após a fronteira do sistema ter sido especificada e entendida é que possíveis interações de
calor e vizinhança podem ser consideradas, pois estão sempre avaliadas na fronteira deste
sistema. Entendendo-se calor como energia em conceito termodinâmico, pois a energia que é
transferida e armazenada, não o calor.
ENERGIA DOS CICLOS
Quando um sistema em um dado estado inicial passa por uma sequência de processos
e finalmente retorna a esse estado, o sistema executou um ciclo termodinâmico. Tanto a
primeira quanto à segunda lei da termodinâmica têm origem nos estudos dos ciclos. Portanto,
os ciclos serão considerados sob ponto de vista do princípio da conservação de energia.
O balanço de energia para um sistema qualquer submetido a um ciclo termodinâmico
assume forma onde a variação de energia é igual diferença entre as quantidades líquidas da
transferência de energia por calor do ciclo e a transferência de energia por trabalho realizado
pelo ciclo. O sistema retornando a sua condição inicial após o ciclo, não haverá essa variação
líquida em sua energia. Logo, a variação de energia será nula e consequentemente, as parcelas
das transferências de energia por calor e trabalho serão iguais, expressando assim uma
equação para o princípio de conservação de energia e que deve satisfazer por todo o ciclo
termodinâmico.
De modo grosseiro, pode-se comparar o corpo humano como ciclo motor e o
ambiente, um lugar para o ciclo de refrigeração e bombas de calor. Tomando cuidado nos
referenciais para entrar numa análise e prosseguir os processos entre o sistema e sua
vizinhança. É aconselhável que escolha antes, um sistema por vez.
Nos ciclos motor, de refrigeração e bomba de calor, em cada caso, os sistemas passam
por um ciclo enquanto se comunica termicamente com dois corpos, um quente e outro frio.
Esses corpos estão localizados na vizinhança do sistema que percorre o ciclo e que há também
uma quantidade líquida de energia trocada com a vizinhança sob a forma de trabalho.
5
Os sistemas que passam por ciclos que fornecem uma transferência líquida de energia
sob a forma de trabalho para sua vizinhança são denominados ciclo motor. Ou seja, a saída
líquida de trabalho é igual à transferência líquida de calor para o ciclo.
Para este ciclo, ainda pode-se obter uma eficiência térmica como razão de uma
𝑄𝑠𝑎í𝑑𝑎
extensão da conversão de energia de calor para trabalho. Veja na equação: 𝜂 = 1 − 𝑄
𝑒𝑛𝑡𝑟𝑎𝑑𝑎
.
Uma vez que a energia é conservada, a eficiência térmica jamais poderá ser maior do
que a unidade ou 100%.
Para os outros ciclos, a energia que entra no sistema é transferida por calor submetido
a um ciclo a partir do corpo frio e a energia descarregada a partir do sistema para o corpo
quente e feita por transferência de calor. Para realizar essas trocas de calor é necessário um
trabalho líquido de entrada no sistema. Esses ciclos de refrigeração e bomba de calor tem
mesma forma de descrição, mas objetivos diferentes. O objetivo do ciclo de refrigeração é
resfriar um espaço ou manter a temperatura no interior de uma residência, ou de um prédio,
ou outros, mas levando em consideração que a temperatura tem que se manter abaixo da
temperatura ambiente. O objetivo da bomba de calor é manter a temperatura no interior de
uma residência, ou de uma construção, ou outro meio, acima da temperatura da vizinhança ou
fornecer aquecimento para certos processos industriais que ocorrem a temperaturas elevadas.
Até o momento, pode-se entender com mais precisão a sensação térmica a ser atingida
por uma pessoa, fazendo uma analogia aos argumentos mencionados.
SEGUNDA LEI DA TERMODINÂMICA
Para os processos espontâneos, existe uma direção definida. E para retornar ao estado
inicial mesmo alcançando as suas condições, o sentido inverso da direção espontânea não
ocorre com a mesma espontaneidade, precisando assim de um auxilio. Percebe-se que nem
todos os processos consistentes com o princípio da conservação de energia podem ocorrer.
Dai surge um princípio de orientação útil a ser seguido, fornecido pela segunda lei da
termodinâmica.
Com a segunda lei, será fornecido meios para determinar o máximo trabalho teórico e
permitir que haja avaliação quantitativa dos fatores que impedem de se obter este máximo.
A segunda lei da termodinâmica e as deduções a partir dela são úteis por fornecer
meios para:
1 – previsão da direção dos processos;
6
2 – estabelecimento das condições de equilíbrio;
3 – determinação do melhor desempenho teórico dos ciclos, motores e outros
equipamentos;
4 – avaliação quantitativa dos fatores que impedem a obtenção do melhor nível de
desempenho teórico;
5 – definir uma escala de temperatura independente das propriedades de qualquer
substância termométrica;
6 – desenvolver meios para a avaliação das propriedades tais como a energia interna
(u) e a entalpia (h) em função das propriedades que são mais fáceis de obter
experimentalmente.
Tais pontos relatados podem ser vistos como aspectos da segunda lei da
termodinâmica, todas dependentes e relacionadas.
Importante ressaltar, que cada processo em que uma consequência da segunda lei
tenha sido testada direta ou indiretamente através de experimentos, ela foi infalivelmente
confirmada. Assim, a base da segunda lei da termodinâmica é a evidência experimental.
CICLO DE CARNOT
O ciclo de Carnot fornece um exemplo específico de um ciclo de potência reversível
operando entre dois reservatórios térmicos. O sistema que executa o ciclo sofre uma série de
quatro processos internamente reversíveis: dois processos adiabáticos alternados com dois
processos isotérmicos.
Obviamente que o leitor não irá comparar diretamente ou facilmente o corpo humano
como uma máquina a vapor, mas com o meio ou máquina que execute o ciclo de potência,
será mais fácil.
Num motor a vapor visto na figura 1, há quatro elementos a serem observados para os
processos adiabáticos e isotérmicos. Ver figura 1 no anexo.
À medida que a água escoa através da caldeira, ocorre uma mudança de fase de líquido
para vapor a uma temperatura constante TH como resultado da transferência de calor a partir
de um reservatório quente. A pressão também permanece constante. O vapor se expande
adiabaticamente ao sair da caldeira através da turbina e é desenvolvido trabalho. A
temperatura cai para temperatura TC do reservatório frio e há um decréscimo correspondente
na pressão. À medida que o vapor passa através do condensador, uma transferência de calor
7
para o reservatório frio ocorre e parte do vapor se condensa a uma temperatura constante T C.
A temperatura permanece constante novamente, assim como a pressão também, à medida que
a água passa através do condensador. A bomba ou compressor recebe uma mistura bifásica
líquido-vapor do condensador e a retorna adiabaticamente para o estado da entrada da
caldeira. Durante este processo, que exige um trabalho de entrada para elevar a pressão, a
temperatura aumenta de TC para TH.
Para qualquer outro processo, independente do tipo de dispositivo ou do fluido de
trabalho realizado, o ciclo de Carnot sempre possuirá os mesmos quatro processos
internamente reversíveis: dois processos adiabáticos alternados com dois processos
isotérmicos.
Se um ciclo de potência de Carnot for operado na direção oposta, as magnitudes de
todas as transferências de energia permanecem as mesmas, porém as transferências de energia
estarão opostamente direcionadas. Tal ciclo poderá ser considerado um ciclo de refrigeração
ou bomba de calor.
A eficiência térmica deve ser menor do que 100% e deve ser aplicada a todos os ciclos
de potência independentes dos seus detalhes de operação. Considerando isto como um
corolário da segunda lei, há também outro, o Corolário de Carnot: como nenhum ciclo de
potência pode possuir uma eficiência térmica de 100% é preciso investigar a eficiência teórica
máxima para sistemas submetidos a ciclos de potência operando entre dois reservatórios a
diferentes temperaturas. Mencionando dois corolários de Carnot:
1 – a eficiência térmica de um ciclo de potência irreversível é sempre menor do que a
eficiência térmica de um ciclo de potência reversível quando operando entre os mesmos
reservatórios térmicos;
2 – todos os ciclos de potência reversíveis operando entre os mesmos reservatórios
térmicos possuem a mesma eficiência térmica.
A escala termodinâmica de temperatura denominada escala Kelvin é definida tal que a
razão entre duas temperaturas seja a mesma razão das transferências de calor absorvido e
rejeitado, respectivamente, por um sistema percorrendo m ciclo reversível operando entre dois
𝑄
reservatórios a essas temperaturas. Veja na equação: (𝑄 𝐶 ) 𝑐𝑖𝑐𝑙𝑜 𝑟𝑒𝑣𝑒𝑟𝑠í𝑣𝑒𝑖𝑠 =
𝐻
𝑄𝑠𝑎í𝑑𝑎
Substituindo na equação 𝜂 = 1 − 𝑄
𝑒𝑛𝑡𝑟𝑎𝑑𝑎
𝑇𝐶
𝑇𝐻
.
, resultará uma expressão para a eficiência
térmica de um sistema que percorre um ciclo de potência reversível operando entre dois
8
𝑇
reservatórios a temperaturas TH e TC: 𝜂𝑚á𝑥 = 1 − 𝑇 𝐶 , que é conhecida como eficiência de
𝐻
Carnot.
Importante que o leitor consiga interpretar e ampliar sua visão para tantos conceitos e
aplicações para tais ciclos e associar as necessidades em questão.
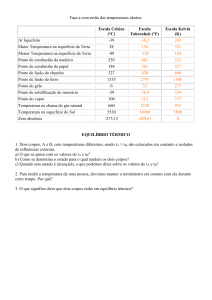
TEMPERATURA
Quando dois sistemas estão em equilíbrio térmico, dizemos que têm a mesma
temperatura. Reciprocamente, a temperatura é a propriedade dos sistemas que permanece
constante quando eles estão em equilíbrio térmico. Por exemplo, suponha que os dois
sistemas sejam gases que inicialmente tenham diferentes temperaturas, pressões e volumes. Se
os colocarmos em contato e esperarmos tempo suficiente para que atinjam equilíbrio térmico,
em geral nem as pressões nem os volumes serão iguais, mas suas temperaturas serão sempre
iguais. A noção de temperatura só pode ser introduzida na termodinâmica através deste
raciocínio baseado em equilíbrio térmico.
Apesar de a temperatura ter um significado usual que nos é familiar, é necessário darlhe um significado preciso para ter valor como medida científica. Nossa noção intuitiva de
temperatura não é confiável; por exemplo, suponha que você esteja dentro de casa, sentado
uma cadeira que tem partes de pano, madeira e metal. Toque as várias partes de decida qual é
a “mais fria”, isto é, qual está à temperatura mais baixa. Provavelmente você irá concluir que
as partes de metal são mais frias. Entretanto, esperamos que a cadeira, estando há muito
tempo no interior da casa, tenha entrado em equilíbrio térmico como o ar e, portanto, esteja
toda ela à mesma temperatura que o ar. De fato, o que você está verificando, quando toca a
parte de metal, não é apenas a temperatura, mas também a capacidade dessa parte de remover
calor da sua mão que, presumivelmente, está a uma temperatura mais alta. Sua mão neste caso
dá uma medida subjetiva de temperatura, que é incorreta. Além, disso, este julgamento
mudará com o tempo que sua mão e o metal se aproximam do equilíbrio térmico um com o
outro.
Existe uma grandeza escalar chamada temperatura, que é uma propriedade de todos
os sistemas termodinâmicos em equilíbrio térmico. Dois sistemas estão em equilíbrio térmico
se e somente se suas temperaturas são iguais.
Esta definição da Lei zero-ésima, define o conceito de temperatura como sendo a
propriedade macroscópica de um sistema que será igual à de outro quando estiverem em
9
equilíbrio térmico. Ela nos permite construir e utilizar termômetros para medir a temperatura
de um sistema, porque sabemos que um termômetro em contato térmico com um sistema
atingirá com ele uma temperatura comum.
Abrangendo conhecimento envolvendo diferenças de temperatura, para calcular a
transferência de energia sob forma de calor, alguns métodos são baseados por experimentos.
Alguns processos de transferência de calor são realizados por condução, convecção e
radiação. A condução se refere à transferência de energia através de um meio na qual existe
uma diferença de temperatura. A convecção se refere à transferência de energia entre uma
superfície e um fluido em movimento ou em repouso com temperaturas diferentes. E a
radiação térmica representa a troca líquida de energia entre superfícies a diferentes
temperaturas por meio de ondas eletromagnéticas independentes de qualquer meio
interveniente.
MUDANÇA DE ESTADO
O estudo das mudanças de estado desempenha um papel importante no entendimento
dos fatores que determinam o conforto térmico. Na figura 2 é apresentado um esquema
mostrando a terminologia básica usada para as mudanças ou transformações de estado. O caso
que mais importa diretamente são as mudanças líquido – gás (vapor) e gás – líquido, isto é,
evaporação e condensação respectivamente. Ver figura 2 no anexo.
Outra maneira e mais interessante de se descrever as mudanças de estado, ou
mudanças de fase, são os diagramas de fase (figura 3). São gráficos que mostram o
comportamento da equação de estado de uma dada substância, indicando em que domínios de
pressão, volume e temperatura os diferentes estados da matéria podem ser encontrados. A
equação de estado de uma substância pura é descrita matematicamente através da relação
encontrada entre a pressão (p), volume (V) e temperatura (T): f(p, V, T) = 0.
Se considerar uma interface água - ar atmosférico, algumas moléculas estão
continuamente voltando para o espaço acima e algumas estão retornando para a superfície.
Quanto mais quente for a água mais moléculas libertam-se da sua superfície. Deste modo a
taxa de escape das moléculas da superfície líquida depende da temperatura, ou seja, a
quantidade de água que pode ser evaporada dependerá da temperatura.
Naturalmente, o ar atmosférico não é confinado a um só espaço de modo que ele
dificilmente se torna saturado com vapor de água, mesmo a pouca altura acima de uma grande
10
quantidade de água. Ou seja, na maioria das vezes a pressão de vapor de água na atmosfera é
menor do que a pressão de vapor saturada. Uma forma de se avaliar o estado do ar
atmosférico quanto à quantidade de vapor de água em face ao estado saturado é a umidade do
ar dada pela relação: UR = (PVAPOR / PVAPOR SATURADO) * 100.
Um dos fatores importantes para o controle da intensidade da evaporação é a umidade
relativa. Quanto mais afastado da saturação estiver o ar, ou seja, quanto mais seco estiver o ar,
maior a evaporação. O papel do vento no aumento da intensidade da evaporação é válido.
Quando o vento sopra sobre a lâmina de água ajuda a remover as camadas de ar em contato
direto com a água. Se não houver vento, essas camadas tendem a ficar saturadas em relação às
camadas vizinhas uma vez que a única forma de homogeneização do vapor produzido é por
difusão molecular. Esse processo lento acaba por retardar a evaporação. Com o vento as
camadas de contato com a lâmina de água são mecanicamente removidas permitindo a
renovação por ar mais seco. Da mesma forma reconhecemos a função desse mesmo processo
quando consideramos a ação refrescante do vento no corpo molhado ou suado, por aumentar a
intensidade da evaporação e a consequente perda corporal de calor, o calor de evaporação
(sensação causada pelo Conforto térmico).
Ao longo do dia, a pressão de vapor tende em geral a se manter inalterada. A umidade
relativa do ar tende a mudar ao longo do dia em função do ciclo diurno de aquecimento pela
radiação solar alterando a pressão de vapor saturado com a temperatura. Ao contrário, a
mudança repentina da pressão de vapor é em geral uma boa indicação da entrada de uma nova
massa de ar.
11
ANEXO:
Figura 1. Ciclo de Carnot de motor a vapor e diagrama p-v executado pela circulação
de água em regime permanente. http://slideplayer.com.br/slide/1848278/. Acesso: 27/ 04/
016. Curso de Termodinâmica Aplicada. O Ciclo de Carnot em um sistema com mudança de
fase. Slide 6.
Figura 2. Mudanças de estado físico. http://pt.slideshare.net/LaraTavares/aulas-04-e05-as-mudanas-de-estado-fsico-1-ano. Acesso: 27 / 04 / 2016. Aulas 4 e 5 As mudanças de
estado físico – 1º ano. Slide 4.
12
Figura 3. Gráfico tridimensional qualitativo mostrando a superfície f(p, V, T) = 0 (equação
de estado) para a substância água. Gráfico Superfície p-v-T da água. Capítulo 4. Livro
Introdução à Engenharia de sistemas térmicos: termodinâmica, Mecânica dos fluidos e
Transferência de calor. MORAN, M. J.; SHAPIRO, H.N.; MUNSON, B.R.; DEWITT . Acesso:
10 / 04 / 2016.
13
REFERÊNCIAS:
BEJAN, Adrian. Transferência de Calor. Tradução de Euryclides de Jesus Zerbini; Richard
Santilli Ekman Simoes. São Paulo: Edgard Blucher, 1996.
INCROPERA, Frank P. Fundamentos de transferência de calor e de massa. Colaboração de
David P Dewitt. 4.ed. Rio de Janeiro: Livros Técnicos e Científicos, 1998.
LIMA, E. C.; AMORIM, H. S. Conforto térmico como proposta de contextualização para o
ensino de termodinâmica. Universidade Federal do Rio de Janeiro. Instituto de Física. Pós
graduação em ensino de Física. Rio de Janeiro. 2012.
MORAN, M. J.; SHAPIRO, H.N.; MUNSON, B.R.; DEWITT, D.P. Introdução à engenharia
de sistemas térmicos: termodinâmica, mecânica dos fluidos e transferência de calor. Rio de
Janeiro: LTC, 2005.
OZISIK, M. Necati. Transferência de Calor: Um texto básico. Rio de Janeiro: Guanabara
Koogan, 1990.
RESNICK, R; HALLIDAY, D; KRANE, K. Física 2. 4.ed. Rio de Janeiro: LTC S.A., 1996.
14