Reações químicas
Profe. Cristiane Rangel
8ª série
Ciências
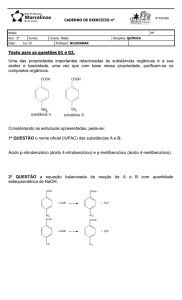
As reações químicas não ocorrem apenas em laboratórios e indústrias, ocorrem
também no dia a dia.
• Como se pode saber que uma reação
química aconteceu?
• Hidrogênio e oxigênio formam água. Você
sabe escrever e balancear a reação química
que representa esse fenômeno?
MARTYN F. CHILLMAID / SCIENCE PHOTO LIBRARY / LATINSTOCK
Reações químicas
2
CHARLES D. WINTERS / PHOTO RESEARCHERS, INC. / LATINSTOCK
Nem sempre a mistura de duas substâncias forma um novo produto. Alguns fatores
podem ser observados para verificar se um transformação química realmente
aconteceu. São evidências de reações químicas:
• Mudança de cor
• Aumento da temperatura
• Liberação de gases
• Formação de um sólido (quando se misturam dois
líquidos incolores)
3
Pode-se usar uma equação química para representar uma reação química:
Fe(s) + S(s)
FeS(s)
reagentes
produto
A seta entre as duas partes indica que houve uma transformação química. As letras
minúsculas entre parênteses indicam o estado físico de cada substância: sólido (s),
líquido (l) ou gasoso (g).
KLN ARTES GRÁFICAS / ARQUIVO
DA EDITORA
Existem outras formas de representar uma reação química:
2 moléculas de
hidrogênio
1 molécula de
oxigênio
2 moléculas de
água
4
Observe a reação a seguir:
H2+O2
H2O
KLN ARTES GRÁFICAS / ARQUIVO
DA EDITORA
Se contarmos o número de átomos de cada elemento nos reagentes e produtos,
perceberemos que a equação não está correta. A equação não está balanceada.
reação não balanceada
reação balanceada
5
Para balancear uma equação química é preciso encontrar números inteiros que,
colocados antes de cada substância, tornem igual o número de átomos nas duas
partes da equação. Esses números são coeficientes.
Vamos balancear a equação a seguir:
Na + CI2
NaCI (equação não balanceada)
Há 2 átomos de cloro no primeiro membro da equação, mas apenas
1 átomo no segundo. Colocamos o coeficiente 2 antes do NaCl para balancear os
átomos de cloro.
Na + CI2
2NaCI
Porém, ficamos com 2 átomos de sódio no segundo membro e apenas
1 no primeiro. Adicionando o coeficiente 2 na frente do Na, balanceamos a
equação.
2Na(s) + CI2(g)
2NaCI(s)
Equação balanceada!
6
Tipos de reação química
reservatório de água
Decomposição
gás hidrogênio
pilhas
CLAÚDIO CHIYO / ARQUIVO DA EDITORA
A eletrólise é uma reação que consiste em
decompor a água utilizando um aparelho
que permite a passagem de corrente
elétrica. Esse tipo de reação é chamada de
reação de decomposição ou análise.
gás oxigênio
2AgBr → 2Ag + Br2
2Cu(NO3)2 → 2CuO + 4NO2 + O2
7
Adição
Quando duas ou mais substâncias formam
um única substância, temos uma reação de
adição ou síntese. Veja um exemplo:
N2(g) + 3H2(g)
2NH3(g)
C + O2 → CO2
Cao + H2O → Ca(OH)2
LESTER V. BERGMAN / CORBIS / CORBIS / LATINSTOCK
Reação simples
Quando mergulhamos um fio de cobre numa
solução de nitrato de prata, o cobre toma o
lugar da prata, formando nitrato de cobre e
prata. Essa reação é uma reação de simples
troca ou deslocamento.
Zn + H2SO4 → ZnSO4 + H2
Fe + CuSO4 → FeSO4 + Cu
9
Em uma reação do nitrato de chumbo com iodeto de
potássio, as duas substâncias compostas em questão
trocam elementos entre si. Por isso, esse tipo de reação
é chamada de reação de dupla troca ou permutação.
2KI(aq) + Pb(NO3)2(aq)
2KNO3(aq) + PbI2(s)
HCl + NaOH → NaCl + H2O
FeS + 2HCl
→ FeCl2 + H2S
CHARLES D. WINTERS / PHOTO RESEARCHERS, INC. / LATINSTOCK
Dupla troca
As leis das reações químicas
Durante uma reação química não há
aumento nem diminuição da massa total.
Em um sistema fechado, a soma da massa
dos reagentes é igual à soma das massas
dos produtos.
FOTOS: MARTYN F. CHILLMAID / SCIENCE
PHOTO LIBRARY / LATINSTOCK
Lei da conservação da massa
Veja o exemplo da reação do cloreto de
sódio com o nitrato de prata:
11
NaCl(aq) + AgNO3(aq)
NaNO3(aq) + AgCl(s)
“Na natureza nada se cria, nada se perde; tudo se transforma.”
Descoberta pelo cientista francês Antoine Lavoisier, no final do século
XVII. Por este motivo, esta lei ficou conhecida como Lei de Lavoisier ou Lei
da Conservação da Massa.