ANDREZZA SOSSAI RODRIGUES DE CARVALHO
EFEITO DA ATIVIDADE FÍSICA EM UM MODELO EXPERIMENTAL DE
MIASTENIA GRAVE EM RATOS
Monografia apresentada a Universidade
Federal de São Paulo – Escola Paulista
de medicina para a obtenção do título de
Especialista
em
Intervenções
Fisioterapêuticas
em
Doenças
Neuromusculares
SÃO PAULO
2004
ANDREZZA SOSSAI RODRIGUES DE CARVALHO
EFEITO DA ATIVIDADE FÍSICA EM UM MODELO EXPERIMENTAL DE
MIASTENIA GRAVE EM RATOS
Monografia apresentada a Universidade
Federal de São Paulo – Escola Paulista de
Medicina para a obtenção do título de
Especialista
em
Intervenções
Fisioterapêuticas
em
Doenças
Neuromusculares
SÃO PAULO
2004
CARVALHO, Andrezza Sossai Rodrigues de.
Efeito da atividade física em um modelo experimental de miastenia grave
em ratos/ Andrezza Sossai Rodrigues de Carvalho – São Paulo, 2004.
x, 36f.
Monografia (Especialização) – Universidade Federal de São Paulo – Escola
Paulista
de
Medicina.
Programa
de
pós-graduação
em
Intervenção
Fisioterapêutica em Doenças Neuromusculares.
Título em inglês: The effects of physical activity in an experimental model the
myasthenia gravis in rats.
1. Miastenia Grave. 2. Modelo experimental. 3. Atividade Física.
UNIVERSIDADE FEDERAL DE SÃO PAULO
ESCOLA PAULISTA DE MEDICINA
DEPARTAMENTO DE NEUROLOGIA/NEUROCIRURGIA
CHEFE DO DEPARTAMENTO: Profa Dra. Débora Amado Scerni
COORDENADORES DO CURSO DE ESPECIALIZAÇÃO EM INTERVENÇÕES
FISIOTERAPÊUTICAS NAS DOENÇAS NEUROMUSCULARES:
Prof. Dr. Acary Souza Bulle de Oliveira, Ms. Francis Meire Fávero Ortensis
ANDREZZA SOSSAI RODRIGUES DE CARVALHO
EFEITO DA ATIVIDADE FÍSICA EM UM MODELO EXPERIMENTAL DE
MIASTENIA GRAVE EM RATOS
PRESIDENTE DA BANCA: Prof. Dr. Alexandre Valotta da Silva
BANCA EXAMINADORA: Prof. Dr. Mario Mariano
Ms. Francis Meire Fávero Ortensis
APROVADA EM: ____/___/___.
DEDICATÓRIA
Ao meu tão querido e amado pai Décio, por todo esforço e
amor dedicados a mim todos os dias de minha vida.
A minha amada mãe Marcelina (in memória), pelo
exemplo de mulher que levarei por toda minha vida e por
todas as lembranças e ensinamentos deixados por ela.
AGRADECIMENTOS
Primeiramente agradeço a Deus, pela saúde, tranqüilidade e perseverança
concedidas a mim para a realização deste trabalho e por ser minha fortaleza
nos momentos de dificuldade.
Ao tão paciente Mestre, Dr. Alexandre Valotta da Silva, pelos ensinamentos,
dedicação e entusiasmo durante a realização deste trabalho.
A todos do Laboratório de Neurologia Experimental da UNIFESP, por terem
me recebido e, cada qual, cooperado para meu aprendizado frente a um novo
desafio.
Aos professores Mario Mariano e José Daniel Lopes, Laboratório de
Imunologia UNIFESP, por sempre estarem dispostos a me auxiliar durante toda a
realização do projeto.
A professora Maria Aparecida Juliano, Laboratório Biofísica da UNIFESP, e a
Juliana Carlota, Laboratório de Psicobiologia da UNIFESP, pelo auxilio e
colaboração prestados a mim.
Ao instituto Carlo Besta Milão, pela tão importante e grande colaboração.
Aos queridos amigos que fizeram parte, mesmo que indiretamente, de todo o
trabalho; sempre interessados e confiantes de que tudo daria certo.
SUMÁRIO
DEDICATÓRIA..........................................................................................................vi
AGRADECIMENTO..................................................................................................vii
LISTA.........................................................................................................................ix
RESUMO...................................................................................................................x
1. INTRODUÇÃO.......................................................................................................1
1.1. Definição e Histórico...........................................................................................1
1.2. História natural e fisiopatologia da miastenia grave...........................................4
1.3. Procedimentos diagnósticos...............................................................................9
1.4. Formas de classificação da miastenia grave....................................................11
1.5. Terapêutica para a miastenia grave.................................................................13
1.6. Terapias complementares.................................................................................15
1.7. Miastenia grave experimental...........................................................................18
2. OBJETIVOS.........................................................................................................24
2.1 Objetivos gerais.................................................................................................24
2.2 Objetivos específicos.........................................................................................24
3. MATERIAL E MÉTODO.......................................................................................25
4. RESULTADOS PRELIMINARES E PERSPECTIVAS.........................................28
5. REFERÊNCIAS BIBLIOGRÁFICAS.....................................................................29
ABSTRACT..............................................................................................................35
LISTA DE ABREVIATURAS
ACF
adjuvante completo de Freud
ACh
acetilcolina
AChE
acetilcolinesterase
AChR
receptor de acetilcolina
JNM
junção neuromuscular
MG
miastenia grave
MGAE
miastenia grave autoimune experimental
TAChR
receptor de acetilcolina purificado do órgão elétrico da enguia
RESUMO
A Miastenia Grave é caracterizada por uma alteração na transmissão nervomúsculo, decorrente da deficiência de receptores de acetilcolina na junção
neuromuscular. A terapia medicamentosa para a miastenia grave auto-imune
proporciona apenas alívio sintomático, que raramente é completo, não alterando a
evolução da doença. O presente projeto de pesquisa tem por objetivo estudar os
efeitos da atividade física, como uma terapia adjuvante, sobre a sintomatologia e a
evolução da miastenia grave através da utilização de um modelo experimental em
ratos da linhagem Lewis. Para tanto, os animais do grupo experimental serão
imunizados através da injeção subcutânea de uma emulsão contendo o receptor
de acetilcolina purificado (TAChR) ou um peptídeo sintético com a seqüência
imunogênica da molécula do receptor. Após a imunização, os animais serão
pesados e avaliados do ponto de vista motor (teste de campo aberto) a cada sete
dias. Decorridos 30 dias da imunização, os animais serão submetidos a atividade
física em esteira rolante por trinta minutos durante trinta dias consecutivos. Como
controles, serão utilizados ratos não imunizados e ratos imunizados não
submetidos ao programa de atividade física. Estamos certos de que a utilização de
um
modelo
experimental
de
MG
trará
uma
grande
contribuição
desenvolvimento da fisioterapia aplicada às doenças neuromusculares.
ao
1. INTRODUÇÃO
1.1. DEFINIÇÃO E HISTÓRICO
Muitas doenças interrompem a transmissão entre os neurônios e suas
células-alvo, sendo a miastenia grave (MG) uma delas. A MG é caracterizada
por uma alteração na transmissão nervo-músculo, decorrente da deficiência de
receptores de acetilcolina (AChR) na junção neuromuscular (JNM) (1-2).
O primeiro caso de miastenia foi descrito em 1877 por Wilks, entretanto, já
em 1672, Willis relatou uma doença que apresentava características
semelhantes às da MG (1- 2).
Durante muito tempo, a doença ficou conhecida como síndrome de ErbGoldflam. Apenas em 1895, Jolly empregou o termo MG, juntamente com o
termo “pseudoparalítico”; que demonstrava a ausência de lesão estrutural à
necropsia, sendo o primeiro a provar que a estimulação farádica repetida do
nervo motor poderia diminuir a fraqueza muscular e ainda, curiosamente,
sugeriu o uso da fisostigmina como forma de tratamento. Mais tarde Reman
(1932) e Walker (1934) demonstraram o valor deste fármaco na MG (1-3).
Por volta de 1900, alguns neurologistas descreveram características
clínico-patológicas importantes da doença, como a relação entre a MG e a
glândula do timo, e a proposta de que algum agente causava fraqueza
muscular. Nessa época, ainda não se considerava a existência de uma base
auto-imune para a doença, apesar da observação de infiltrados linfocitários nos
músculos em exames póst-mortem (1, 4).
Em 1905, Buzzard demonstrou que a fraqueza muscular, os infiltrados
linfocitários e as lesões tímicas eram causadas por um agente tóxico,
estabelecendo uma relação entre a MG e as doenças de Graves e Addison (1).
Por volta da metade da década de 1930, duas descobertas ajudaram a
identificar a MG como uma doença da transmissão neuromuscular. Walker
descobriu que inibidores da acetilcolinesterase (AChE) revertem os sintomas da
MG e Dale, Feldberg e Vogt demonstraram que a transmissão na JNM se dá
através de um mediador químico que foi denominado acetilcolina (ACh) (5, 6).
Ainda nessa época, houve o reconhecimento de que aproximadamente 15%
dos pacientes adultos com MG apresentavam um tumor benigno no timo, sendo
Blalock (1939) (7) o primeiro a afirmar que os sintomas dos pacientes miastênicos
melhoravam após a remoção do timoma. Após esse achado, Blalock e Harvey
(1950) descobriram que a remoção do timo era benéfica também para pacientes
miastênicos que não apresentavam timoma (4).
Entre 1940 e 1960, Harvey e colaboradores (8) descreveram
detalhadamente as bases fisiológicas da doença. Descobriu-se que na MG a
amplitude dos potenciais de ação compostos provocados diminuem
rapidamente, diferentemente do músculo humano normal. Essa anormalidade
na amplitude dos potenciais de ação assemelha-se ao padrão induzido pela dtubocurarina (curare) em músculo normal, onde há bloqueio dos receptores
colinérgicos e conseqüentemente inibição da ação da Ach na JNM.
A concepção de que a MG é decorrente de um transtorno imunológico foi
proposta em 1960 por Simpson, seu argumento baseava-se na presença de
anormalidades tímicas nos pacientes miastênicos e a associação da MG com
outras doenças auto-imunes, tais como artrite reumatóide, lupus eritematoso
sistêmico ou hipertireoidismo. Também sugeriu que os anticorpos competiam
diretamente com o AChR, bloqueando a transmissão neuromuscular (9, 2).
A descoberta crucial surgiu com Chang e Lee (1966) (10), que isolaram e
caracterizaram o AChR. Esses químicos estavam preocupados com um
problema de saúde pública local em Taiwan – as picadas de cobras venenosas
– e descobriram que uma das toxinas que eles isolaram do veneno, a alfabungarotoxina, causava paralisia por se ligar, de maneira irreversível, aos
AChR na placa motora.
Em 1973 e nos anos seguintes, a natureza auto-imune da doença foi
estabelecida especificamente por Fambrough e Drachman
(11)
, que usaram alfa-
bungarotoxina radioativa para marcar AChR em placas motoras humanas e
encontraram menos sítios de ligação no músculo miastênico do que nos controles.
1.2. HISTÓRIA NATURAL E FISIOPATOLOGIA DA MIASTENIA GRAVE
A MG pode ser considerada uma doença rara, porém tem se observado um
aumento na sua prevalência, que pode ser atribuído a uma maior acurácia
diagnóstica. Atualmente, a prevalência da MG é cerca de 20 casos por 100.000
habitantes nos Estados Unidos da América, sendo que a expectativa de vida dos
pacientes é quase normal. Esta doença manifesta-se em qualquer raça, idade e
sexo, sendo que os casos familiares são raros. A doença apresenta um pico de
incidência entre 20-30 anos para mulheres e entre 60-70 para homens. Assim,
antes dos 40 anos, a MG é três vezes mais freqüente no sexo feminino, enquanto
que na velhice a incidência é maior no sexo masculino. Como citado
anteriormente, 15% dos pacientes adultos com MG apresentam tumor benigno do
timo, predominando, dentre estes, indivíduos do sexo masculino de meia idade
(12-
13) .
Há diferentes formas clínicas de MG. A miastenia do recém-nascido,
decorrente da passagem transplacentária de anticorpos contra AChR, é
caracterizada por déficit na sucção, choro fraco, flacidez dos membros e, em
alguns casos, insuficiência respiratória. Esses sintomas duram dias ou semanas,
mas as crianças recuperam suas funções após esse período. A miastenia
congênita é uma forma heterogênea e não auto-imune. Pesquisadores da
miastenia grave congênita descobriram que, neste tipo de miastenia, há (1)
deficiência de AChE na placa motora; (2) liberação reduzida de ACh pelos
terminais; (3) capacidade alterada dos AChR de interagirem com a mesma ou (4)
número reduzido de AChR. Há ainda a miastenia de origem medicamentosa,
como aquela observada nos pacientes que recebem d-penicilamina para
tratamento de artrite reumatóide, cuja manifestação clínica desaparece logo que a
medicação é suspensa. A forma mais comum é a miastenia auto-imune, na qual
há a ação de anticorpos contra os AChR na JNM. A maneira como se inicia a
produção de anticorpos contra os AChR ainda é desconhecida. Uma possibilidade
é que a ocorrência de uma infecção viral poderia alterar as propriedades da
superfície da placa motora, tornando-a imunogênica; outra possibilidade é que
antígenos virais ou bacterianos compartilhem epítopos com o AChR, de modo
que, quando uma pessoa é infectada, os anticorpos gerados contra o organismo
estranho também podem reconhecer o AChR (2, 4, 13-14).
Apesar de não ter sido comprovada a maneira como se inicia a produção de
anticorpos, estes parecem interferir na interação da ACh com seus receptores. Na
MG, os anticorpos ligam-se aos AChR induzindo sua internalização e degradação.
Assim, quando a ACh é liberada na JNM, a chance da molécula de ACh encontrar
um receptor antes de ser hidrolisada pela AChE torna-se menor visto que a
densidade de AChR está reduzida
(4, 14)
. Além disso, algumas mudanças
morfológicas, tais como a alteração na geometria da placa motora, a redução das
dobras juncionais e o alargamento da fenda sináptica, levam à difusão da ACh
para longe da fenda e diminuem ainda mais a probabilidade da ACh interagir com
receptores funcionais ainda presentes. Todas essas mudanças interferem na
transmissão nervo-músculo, já que a ACh torna-se menos eficaz na estimulação
da placa motora e, como resultado, o músculo esquelético enfraquece (4, 15).
O início da doença costuma ser insidioso, mas há casos de evolução
razoavelmente rápida, que pode ser desencadeada por distúrbios emocionais ou
infecciosos, geralmente de origem respiratória. A ocorrência de casos agudos
pode também ser observada na gravidez, puerpério ou ainda durante
procedimentos anestésicos (1-2).
A fraqueza da MG quase sempre afeta músculos cranianos, sendo que 50%
dos indivíduos apresentam diplopia transitória e ptose assimétrica por fraqueza
dos músculos extraoculares (2, 14, 16).
Outros sintomas comuns estão relacionados à fraqueza dos músculos da
face, levando a um aspecto inexpressivo da mímica, impossibilidade de soprar ou
assobiar e queda da mandíbula (14, 16).
Fraqueza muscular decorrente do comprometimento bulbar é comum e pode
produzir regurgitação nasal de líquidos, engasgo com alimentos e secreções,
disfagia e um som anasalado da voz (17). A fraqueza dos músculos laríngeos pode
causar abdução anormal das cordas vocais e, após conversação prolongada, a
voz desaparece gradualmente. Esses músculos são acometidos em 80% dos
casos, mas em apenas 5 a 10% dos pacientes são os primeiros ou únicos
músculos envolvidos (18).
A fraqueza dos músculos tensores do tímpano pode fazer com que os tons
fiquem abafados, bem como a debilidade do estapédio pode causar hiperacusia
(18-19)
A fraqueza da musculatura cervical faz com que a manutenção da cabeça
seja cansativa. Dentre os músculos do tronco, os sacroespinhais são os mais
acometidos. Freqüentemente há fraqueza dos músculos proximais dos membros
produzindo dificuldade, por exemplo, para subir escadas e levantar os braços. Os
membros quase nunca são afetados isoladamente (18-19).
Nos casos mais avançados, todos os músculos são afetados inclusive o
diafragma, os músculos abdominais e intercostais, bem como os esfíncteres
externos da bexiga e do intestino. Quando há envolvimento dos músculos
respiratórios a ponto de provocar uma ventilação inadequada, diz-se que o
paciente está “em crise”. Tais crises podem ser provocadas por infecção
respiratória, procedimento cirúrgico ou mesmo sem motivo aparente. A fraqueza
dos músculos respiratórios nos pacientes com MG normalmente é sintomática,
dependendo da gravidade da doença, pode variar desde uma dispnéia em
repouso até uma dispnéia decorrente de esforço intenso. Em pacientes com MG, o
volume corrente normalmente é baixo devido à redução da capacidade inspiratória
e do volume de reserva expiratória. Com esta alteração do volume pulmonar, pode
haver áreas de atelectasia que mudam a relação ventilação-perfusão e levam a
uma conseqüente hipoxemia. A hipercapnia também pode ocorrer como resultado
da hipoventilação secundária à fadiga dos músculos inspiratórios, resultando em
um aumento do trabalho respiratório
(20)
. A fraqueza dos músculos expiratórios
resulta em debilidade do reflexo da tosse com conseqüente comprometimento da
retirada eficaz de secreções (21).
Os músculos enfraquecidos na MG sofrem atrofia, mas os reflexos
tendinosos estão geralmente preservados. Estes músculos podem ficar doloridos,
em especial os músculos dos olhos e da região cervical, mas raramente a dor é
uma queixa importante (1 ).
Segundo Chaudlhuri e Behan (2004)
(22)
e Rowland (2003)
(4)
, outro sinal
clínico importante é a fadiga anormal decorrente da estimulação repetitiva dos
nervos, que produz uma resposta decrescente do potencial de ação motor
provocado. A atividade repetida ou persistente de um grupo muscular influencia
em seu poder de contração conduzindo-o a uma paresia progressiva, sendo que o
repouso restaura, parcialmente, a força muscular. Porém, a percepção de fadiga é
subjetiva, devido à sobreposição entre a noção leiga de cansaço e o sintoma
clínico relevante da fadiga. Assim, os pacientes com MG geralmente queixam-se
de fraqueza e não de fadiga no sentido de cansaço ou falta de energia.
Remissões espontâneas podem ocorrer, mas, remissões longas e completas
são raras. As remissões espontâneas, que são significativas, ocorrem durante os
primeiros três anos da doença (2).
1.3. PROCEDIMENTOS DIAGNÓSTICOS
O diagnóstico da MG geralmente é clínico, a partir dos sinais e sintomas da
doença. Entretanto, em pacientes que apresentam fraqueza focal de certos grupos
musculares, o diagnóstico pode ser difícil. Por este motivo é realizado um teste
farmacológico com uma droga anticolinesterásica (piridostigmina) que, por inibir a
AChE, aumenta a probabilidade de ligação da ACh com os AChR remanescentes,
produzindo melhora da força muscular. O teste Tensilon é realizado através da
injeção intravenosa de cloreto de endorfônio. Inicialmente, cerca de 1 a 2mg da
substância são injetados durante 15 segundos, se ocorrer melhora dos sinais
clínicos, o teste é considerado positivo. Caso não ocorra melhora em 30
segundos, o paciente recebe uma dose adicional de 8 a 9mg e....?????. A
resposta à aplicação é avaliada a partir de um ou mais parâmetros como (1) o
grau de ptose, (2) os movimentos oculares, e (3) a força de aperto manual. Os
possíveis efeitos colaterais colinérgicos da substância incluem fasciculação, rubor,
lacrimejamento, náuseas, vômito, cólicas abdominais e diarréia
(15-16, 23)
. O
eletrodiagnóstico pode revelar características anormais nos pacientes com MG.
Em uma transmissão neuromuscular normal, a amplitude do potencial de ação não
sofre mudança ?????, mas na MG a redução na amplitude da resposta é rápida e
maior que 10 a 15%. O teste é positivo em quase todos os pacientes, desde que
dois ou mais músculos distais e proximais sejam examinados. A medicação
anticolinesterásica deve ser suspensa pelo menos seis horas antes do teste. Os
choques elétricos são feitos em uma freqüência de 3-5Hz e os potenciais de ação
dos músculos são registrados (14, 16).
Anticorpos
contra
os
AChR
podem
ser
detectados
no
soro
de
aproximadamente 80% dos pacientes miastênicos através do método Elisa
(Enzyme-Linked Immunosorbent Assay). Entretanto, o nível medido de anticorpos
contra os AChR, não se correlaciona com a intensidade da doença em muitos dos
pacientes (2, 14, 23).
1.4. FORMAS DE CLASSIFICAÇÃO DA MIASTENIA GRAVE
Em 1958, Osserman propôs a primeira classificação clínica da MG e em
1971, separou a MG do adulto da MG pediátrica, dividindo a classificação do
adulto em quatro grupos (15, 24).
Grupo I: fatigabilidade e debilidade nos músculos oculares externos.
Estes pacientes apresentam um alto risco de desenvolver a MG tardia (40%). De
acordo com Engel (1994) (2) a incidência deste grupo é de 15-20%.
Grupo IIA: MG de forma generalizada e pouco intensa. Há o
comprometimento dos músculos cranianos, das extremidades inferiores e do
tronco poupando-se os músculos respiratórios. Os sintomas normalmente
respondem aos anticolonesterásicos e a mortalidade é baixa. Segundo Engel
(1994) (2) sua incidência é de 30%.
Grupo IIB: MG de forma generalizada e moderadamente intensa. Há a
presença de diplopia, ptose palpebral, disartria, disfagia, dificuldade para soprar,
debilidade dos músculos das extremidades e intolerância aos exercícios. Sua
incidência, de acordo com Engel (1994) (2), é de 20%.
Grupo III: MG aguda e fulminante. Inicia-se bruscamente alcançando sua
maior gravidade antes de seis meses. Apresenta grande afecção bulbar e
alteração dos músculos respiratórios o que pode levar a necessidade de
ventilação
mecânica.
Não
apresenta
resposta
muito
eficaz
aos
anticolinesterásicos. Os pacientes apresentam várias crises e alta mortalidade. A
presença de timoma pode eventualmente ser observada. Sua incidência, segundo
Engel (1994) (2), é de 11%.
Grupo IV: MG tardia. A doença torna-se generalizada no primeiro ou
segundo ano após o estabelecimento do quadro. A presença de timoma é mais
freqüente neste grupo e o prognóstico é pior. Segundo Engel (1994)
(2)
é
observado em 9% dos casos.
Outros autores tais como Compston e colaboradores (1980)
(25)
e Limburg e
colaboradores (1983) (26) classificam a MG de acordo com a presença ou ausência
de timoma:
Tipo I: presença de timoma, sem relação com sexo. A MG usualmente é
intensa.
Tipo II: não há presença de timoma e ocorre predominantemente em
mulheres antes dos 40 anos.
Tipo III: não há presença de timoma e ocorre predominantemente em
homens após os 40 anos.
1.5. TERAPÊUTICA PARA A MIASTENIA GRAVE
A terapia atual para a MG auto-imune proporciona algum benefício, mas não
é ideal. As drogas anticolinesterásicas são usadas para o alívio sintomático, que
raramente é completo, não alterando a evolução da doença. Essas drogas
permitem
à
ACh
uma
disponibilidade
maior
na
fenda
sináptica
e
conseqüentemente uma maior probabilidade de se fixarem aos receptores
remanescentes, levando a uma duração maior do impulso nervoso. O ajuste da
dosagem e da freqüência deve ser adequado às necessidades do paciente ao
longo do dia. Por exemplo, os pacientes com fraqueza dos músculos da
mastigação e deglutição, podem beneficiar-se tomando a medicação antes das
refeições, de modo que a melhora da força coincida com o horário da refeição. A
dosagem excessiva pode provocar aumento da fraqueza e efeitos colaterais como
diarréia, cólicas abdominais, náusea e salivação
(14, 19).
Corticosteróides podem
ainda ser utilizados quando os pacientes não apresentam boas respostas ao uso
dos anticolinesterásicos. O mecanismo de ação dos corticóides na MG não é
conhecido, entretanto sabe-se que essas drogas reduzem a produção linfocitária e
diminuem o tamanho do timo. Nas primeiras duas semanas da terapia com
corticosteróides, os pacientes tendem a piorar e correm o risco de apresentar
insuficiência respiratória grave, devendo estar em ambiente hospitalar. A melhora
aparece após a segunda semana de terapia (14, 27).
A plasmaferese tem sido usada terapeuticamente em pacientes com MG
auto-imune. O plasma, que contém os anticorpos patogênicos, é mecanicamente
separado das células sangüíneas. Após este processo, as células sangüíneas
retornam ao paciente em um meio líquido adequado. Essa técnica não está isenta
de efeitos colaterais, que incluem mal estar geral, alterações no sistema
cardiovascular e suscetibilidade aumentada às infecções. Apresenta grande valia
quando utilizada para preparar o paciente para a timectomia, por produzir uma
redução, em curto prazo, nos anticorpos contra os AChR, ou no tratamento de
episódios mais graves (crises)
(14, 27)
. Ainda não é claro porque a timectomia é
benéfica. Cerca de 75% dos pacientes com MG apresentam anormalidades no
timo; sendo 65% hiperplasia e 10-15% timoma epitelial. A remoção cirúrgica de
timoma e a timectomia são dois procedimentos distintos que devem ser
diferenciados. No caso de timoma, a remoção cirúrgica é necessária devido à
possibilidade de disseminação. Na ausência de um tumor, há evidência de que até
85% dos pacientes melhoram após a timectomia e 35% podem ter remissão,
mesmo sem drogas, mas essa melhora pode começar após um período de 1 a 10
anos. A timectomia está recomendada para pacientes com MG generalizada
desde a época da puberdade até, pelo menos, os 55 anos, porém há
controvérsias se a timectomia deve ser recomendada como regra para crianças,
adultos acima de 55 anos e pacientes com fraqueza limitada dos músculos
oculares (2, 14).
Esses tratamentos têm permitido uma melhoria no prognóstico para os
pacientes com MG. Em alguns casos, a remissão da doença pode ocorrer, mas a
estabilização ou a progressão é o resultado mais freqüente (4).
1.6. TERAPIAS COMPLEMENTARES
Alguns trabalhos propõem o treinamento da musculatura respiratória como
tratamento coadjuvante da MG. Keenan e colaboradores (1995)
(28)
realizaram um
estudo com dezessete pacientes (nove homens e oito mulheres) com o objetivo de
avaliar a força dos músculos respiratórios (pressão inspiratória e expiratória
máxima), resistência e espirometria, antes e vinte minutos após a administração
de neostigmina, comparando os pacientes a indivíduos normais (grupo controle).
Quatro dos pacientes apresentava apenas envolvimento ocular e os treze
restantes apresentavam graus variados de MG generalizada. Os autores não
encontram diferenças, nos parâmetros avaliados, entre os indivíduos com
envolvimento isolado da musculatura ocular e o grupo controle, mesmo após a
administração de neostigmina. Os pacientes com MG generalizada apresentavam
redução da força (pressão inspiratória e expiratória máxima) e da resistência dos
músculos respiratórios quando comparado ao grupo controle e após a
administração da neostigmina, foi observado um aumento significativo da pressão
inspiratória máxima e tendência para aumentar a pressão expiratória máxima nos
pacientes com MG generalizada. Não foi observada mudança em relação a
resistência dos músculos respiratórios, após a aplicação de neostigmina, quando
comparada ao grupo controle. Os autores concluíram que pacientes com
envolvimento isolado da musculatura ocular apresentavam força normal dos
músculos respiratórios e os pacientes com MG generalizada apresentavam
redução da força e da resistência dos músculos respiratórios, sendo que com a
administração da neostigmina houve um aumento significativo da pressão
inspiratória máxima nesses pacientes, significando que o treinamento da
musculatura
respiratória,
principalmente
dos
músculos
inspiratórios,
em
associação à neostigmina melhora a força desses músculos. Em um outro estudo,
Weiner e colaboradores (1998)
(20)
buscaram determinar os efeitos do treinamento
dos músculos respiratórios através de espirometria e classificação da dispnéia em
pacientes com MG generalizada. Dezoito pacientes foram divididos em dois
grupos. O grupo A incluiu dez pacientes com MG moderada que treinaram tanto a
musculatura inspiratória quanto a expiratória. O grupo B incluiu oito pacientes com
MG intensa que treinaram apenas a musculatura inspiratória. A conclusão desse
estudo foi que o treino isolado da musculatura inspiratória ou combinado com o
treino da musculatura expiratória melhora a força e a resistência dos músculos
respiratórios em pacientes com MG. Esta melhora da performance da musculatura
respiratória está associada com a melhora da função pulmonar e redução da
dispnéia.
Um estudo realizado por Eva-Lena e colaboradores (1993) (29) teve o objetivo
de determinar se pacientes com MG leve poderiam aumentar sua força muscular
ou resistência a fadiga com o treinamento físico. Para isso, onze pacientes foram
selecionados aleatoriamente, sendo dez mulheres e um homem. Realizaram
exercícios de contração muscular isométrica máxima repetida, com duração de
dois a quatro segundos e dez segundos de descanso nos membros superior e
inferior, usando como controle os membros superior e inferior contralaterais. Para
o teste de fadiga, os pacientes foram submetidos a contrações máximas com
duração de três segundos e dois segundos de descanso. Os testes foram
realizados em três grupos musculares, (1) extensores do joelho; (2) flexores do
cotovelo e (3) extensores do cotovelo. Todos os pacientes relataram que
ganharam melhor força e resistência à fadiga durante o período de treinamento e
dois pacientes disseram melhorar sua disposição para as atividades de vida diária,
relatando que suas distâncias de caminhadas tinham aumentado, porém, esses
resultados não foram acompanhados pelos autores. A medida de força muscular
máxima mostrou que a extensão do joelho aumentou em relação ao lado não
treinado, enquanto a força muscular máxima na flexão e extensão do cotovelo,
mostrou apenas pequenas mudanças. A variação da fatigabilidade em cada
paciente impediu conclusões adicionais e, quando comparada com o lado não
treinado, mostrou apenas pequenas diferenças. Os autores concluíram que o
treinamento muscular isométrico pode ser executado seguramente na MG leve
produzindo certa melhora na força muscular sem efeitos colaterais negativos.
Esses estudos mostram que tanto o treinamento da musculatura respiratória
quanto o treinamento isométrico de determinados grupos musculares do corpo,
como terapia complementar, podem ser benéfico para pacientes com MG por
reduzir os sintomas da dispnéia, retardar as crises respiratórias, a necessidade de
ventilação mecânica e por produzir certa melhora na força muscular dos grupos
treinados. Porém a relação entre o exercício físico e a evolução da MG ainda não
está clara devido a subjetividade das informação e a carência de parâmetros mais
objetivos e uniformes para a avaliação dos pacientes.
1.7. MIASTENIA GRAVE EXPERIMENTAL
Considerando as dificuldades e limitações do estudo envolvendo seres
humanos, alguns autores têm descrito modelos experimentais de MG em animais
de laboratório. Tais modelos tem sido utilizados, principalmente, na investigação
de novas terapias medicamentosas para a MG. Em 1959, Nachmanson∗ teve a
idéia de usar o órgão elétrico do peixe (Torpedo californica), como uma rica fonte
de AChR, mas naquela época não havia métodos específicos para sua
purificação, marcação ou avaliação de sua atividade
(30).
A partir da década de 70,
a estrutura bioquímica, a localização e a quantificação dos AChR passou a ser
investigada (31).
As variações estruturais dos AChR são, razoavelmente, pequenas entre as
espécies. Os AChR
fazem parte de uma grande família de canais iônicos,
portões-ligantes de neurotransmissores. O poro do canal por onde os íons fluem e
os sítios ligantes para a ACh, que regulam a abertura do poro, são todos formados
por uma única macromolécula. Estudos bioquímicos indicam que o AChR é uma
glicoproteina de membrana formada por cinco subunidades: duas subunidades
alfa, uma beta, uma gama e uma delta. A ACh apresenta grande afinidade ao
terminal amino da subunidade alfa do receptor. O terminal amino de cada
subunidade fica exposto na superfície extracelular da membrana
Akabas (1995)
(36)
(30, 35)
. Karlin e
, demonstraram a presença de dois sítios ligantes para a ACh
em cada canal. Esses sítios encontram-se entre as subunidades alfa-gama e alfadelta e, para que o canal se abra de forma eficaz, uma molécula de ACh deve se
∗
Nachmanson, D. Chemical and molecular basis of nerve activity. New York: Academic Press, 1959
ligar a cada um esses sítios permitindo, assim, o influxo de sódio, potássio e
cálcio. As variações estruturais dos AChR são, razoavelmente, pequenas entre as
espécies, portanto, sendo as subunidades alfa aquelas que reconhecem e se
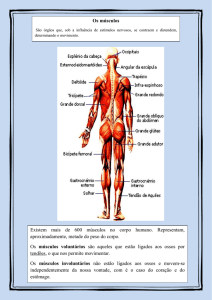
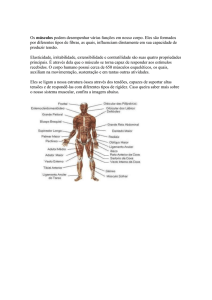
ligam a ACh, na MGAE a indução acontecerá nestes sítios de ligação (desenho 1).
Em 1973, Patrick e Lindstron
(32)
injetaram AChR purificados do órgão
elétrico do peixe Torpedo californica, que está relacionado ao músculo esquelético
de vertebrados superiores, em coelhos, para a obtenção de anticorpos para o
estudo das propriedades dos AChR. Surpreendentemente, a produção de
anticorpos, pelos coelhos, foi acompanhada pelo surgimento de sintomas
parecidos com os da MG, sendo a fraqueza revertida com a aplicação de AChE.
Lennon e colaboradores
(33)
descreveram um modelo de MG em ratos e
porcos da índia e observaram que a MGAE é similar à doença humana nas
manifestações clínicas, imunopatológica e histológica. Essas características
compreendem (1) a redução da amplitude dos potenciais da placa motora; (2) a
redução das dobras juncionais; (3) a perda dos AChR e
(4) a deposição de
anticorpos nos locais pós-juncionais onde houve a perda dos AChR.
Além da indução por meio dos AChR purificados do órgão elétrico da enguia
(TAChR), anticorpos humanos também causam sintomas da MG. Linfócitos-B de
pacientes com MG mantidos em cultura produzem anticorpos para os AChR e ao
injetando-se repetidamente o soro de pacientes em camundongos, é possível
reproduzir as anormalidades eletrofisiológicas nos animais (4, 34).
Devido a MGAE ser similar à doença humana nas manifestações clínicas e
imunopatológicas (quadro 1), representa um modelo muito usado para a
observação de sua evolução clínica e para a investigação de novas imunoterapias
(37-39)
.
As características da MGAE podem variar (1) entre as espécies; (2) entre as
cepas estudadas; (3) de acordo com a origem do AChR e (4) a depender do uso
de adjuvantes mas o modelo foi claramente estabelecido e o uso de AChR
sintetizados produzem anticorpos contra os AChR da JNM (2, 30).
Mesmo sendo possível utilizar diferentes animais para a indução de MGAE,
melhores respostas são observadas quando se utiliza o modelo em ratos da cepa
Lewis (quadro 2), mais especificamente em fêmeas. Esses animais são
imunizados com idade entre 6-8 semanas de vida, através da aplicação na pata
traseira de uma emulsão contendo TAChR purificado ou peptídeo sintético com a
seqüência de aminoácidos imunogênica (DGDFAIVKFTKVLLDYTGHI).
Nesse modelo três fases da MGAE têm sido observadas em ratos Lewis:
aguda, latente e crônica. Após a imunização, os ratos passam por duas fases de
fraqueza muscular. A primeira, transitória, é a fase aguda, com fraqueza iniciando
entre 7 e 11 dias após a indução, com recuperação após três ou quatro dias. Esta
fraqueza afeta, predominantemente, os membros superiores, cabeça, pescoço e
músculos laríngeos e respiratórios. Os animais adotam uma postura onde a
cabeça tende voltar-se para baixo e muitas vezes o queixo e o cotovelo ficam
sobre o chão; há presença de giba no dorso do animal e as coxas ficam
parcialmente abduzidas. Ocorre também incontinência urinária e dificuldade para
engolir. Quando há tentativa de deambulação, movimentos espásticos da cabeça
e dos quatro membros são observados (30, 33, 39).
O uso do adjuvante completo de Freud (ACF), favorece a indução da fase
aguda na MGAE, mas, pode ser que a mesma não ocorra (30, 33, 39).
Na fase latente é observada uma estabilização tanto do quadro de fraqueza
quanto das posturas adotadas na fase aguda. Apresenta uma duração que vai
desde o término da fase aguda até o início da fase crônica. Ambas as fases,
aguda e latente, são caracterizadas por desintegração das dobras juncionais e
invasão de macrófagos para a remoção dos fragmentos. A fagocitose, realizada
pelos macrófagos, aumenta os efeitos da destruição dos AChR pelos anticorpos.
Com o término da fase aguda, os macrófagos deixam a JNM e, após dois a três
dias, gradualmente há regeneração das dobras juncionais e a concentração dos
AChR aumenta.(40-41).
A fase crônica, progressiva, é a segunda fase de fraqueza muscular e inicia
entre 28 e 30 dias após a imunização, sendo normalmente precedida, um ou dois
dias, por perda de peso e sinal de doença respiratória crônica que piora com o
tempo
(33, 40)
. Os anticorpos estão presentes na membrana pós-sináptica em
grandes quantidades, iguais às observadas nas fases aguda e passiva. Mesmo os
macrófagos não sendo atraídos ou ativados observa-se a degeneração
progressiva das dobras juncionais. O conteúdo muscular de AChR diminui e
aproximadamente 70% dos receptores remanescentes estão ligados a anticorpos
(40-41)
. Esses aspectos da fase crônica são semelhantes àqueles observados na
MG humana crônica (42).
Baggi e colaboradores (2003)
(37)
determinaram a intensidade da doença em
ratos através de uma escala para a mensuração da fraqueza muscular. Nessa
escala a pontuação clínica foi baseada na presença de (1) espasmos, (2) giba na
região dorsal, (3) força muscular e (4) fatigabilidade. Para a avaliação da
fatigabilidade muscular, os animais são colocados sobre a grade da gaiola, o
examinador puxa o animal pela cauda e pontua a preensão das patas. Essa
pontuação pode variar do nível 0 ao nível 4, sendo que no nível 0 a força é normal,
no nível 1 há um médio decréscimo da força, no nível 2 há um início de fraqueza,
no nível 3 o animal encontra-se em estado agonizante e no nível 4 o animal evolui
para o óbito. Do ponto de vista laboratorial, a MGAE pode ser confirmada através
do teste de cloreto de endorfônio e da estimulação repetitiva do nervo (EMG).
Como já citado, os estudos experimentais apenas buscam a descoberta de
novas estratégias imunoterapêuticas, observando assim a necessidade do
desenvolvimento de um modelo experimental que nos traga respostas quanto os
efeitos da atividade física sobre a fraqueza e a fadiga muscular.
2. OBJETIVOS
2.1 OBJETIVO GERAL
O presente projeto de pesquisa tem por objetivo estudar os efeitos da
atividade física sobre a sintomatologia e a evolução da MG através da utilização
de um modelo experimental em ratos da cepa Lewis.
2.2 OBJETIVOS ESPECÍFICOS
2.2.1 Verificar se a atividade física aeróbia, em solo, influencia as
manifestações e o curso da doença;
2.2.2 Verificar se a atividade física aeróbia, em meio aquático, influencia as
manifestações e o curso da doença;
2.2.3 Verificar se há diferenças entre os efeitos da atividade física aeróbia
em solo e em meio aquático;
2.2.4 Verificar se a atividade física modifica a suscetibilidade ao modelo
3. MATERIAL E MÉTODOS
3.1
Animais e antígenos: para o experimento, serão utilizados ratos
Lewis entre 8-9 semanas de vida, sendo 8 machos e 6 fêmeas. Os animais serão
obtidos do biotério da Universidade de Campinas (UNICAMP) e mantidos no
biotério da disciplina de neurologia experimental da Universidade Federal de São
Paulo. O TAChR (T97-116 - ) será enviado pelo Instituto Neurológico Carlo Besta,
Milão – Itália.
3.2
Protocolo de imunização: duas amostras, contendo 450 microgramas
de TAChR serão dissolvidas, cada uma, em 1.25 mililitros de água destilada. Será
preparada uma emulsão acrescentando a esta mistura 1.75 mililitros de ACF.
Antes da aplicação, os animais serão anestesiados, de forma intraperitonial, com
1.5 mililitros de dopalem e 3.0 mililitros de rompum. A aplicação será realizada em
quatro locais diferentes do dorso, dois proximais as patas dianteiras e dois
proximais as patas traseiras, com uma quantia de 0.2 mililitros por animal.
3.3
Evolução clínica: os animais poderão apresentar três fases distintas
de evolução clínica: aguda, crônica e passiva. Poderão não desenvolver a fase
aguda, apresentando somente a fase crônica da doença.
3.4
Avaliação da atividade motora: será realizada, a cada sete dias,
através do teste de campo aberto, Open Field, precedendo a atividade física. Este
é um teste que avalia a atividade exploratória do animal, ou seja, todas as
atividades relacionadas à obtenção de informação acerca do ambiente, estas
abrangem tanto as respostas reflexas imediatas, que estão relacionadas com
atenção, quanto as respostas voluntárias típicas.(43) Este tipo de aparelho foi
originalmente descrito por Hall (1941)∗ como uma arena circular para testar a
emocionalidade do rato frente a um ambiente não familiar. A medida do estado
emocional, geralmente, tinha como parâmetro as taxas de ambulação e
defecação. A taxa de ambulação é obtida a partir do número de setores
desenhados no chão do aparelho que são ultrapassados pelo animal. O registro
pode ser realizado de forma manual (com uma folha quadriculada que produz o
trajeto que o animal percorre) ou através de programas de computadores. Os
tempos de imobilidade, autolimpeza e o comportamento de levantar-se nas patas
traseiras; podem ser obtidos por registro em um cronômetro manual simples.
3.5
Treinamento físico: será realizado no inicio da fase crônica, trinta
dias após a indução. A atividade será feita em esteira rolante durante trinta
minutos, por trinta dias consecutivos.
3.6
A pesquisa bibliográfica foi realizada, tanto no acervo da
UNIFESP quanto em acervo próprio. Os artigos foram pesquisados usando as
bases (1) Literatura científica Latino-America e do Caribe em Ciências da Saúde
(LILACS); Literatura internacional em Ciências da Saúde – 1966-2004 (MEDLINE);
Scientific Electronic Library OnLine (SciELO) e Pubmed .
∗
Hall, CS. Temperament: A survey of animal studies. Psychol. Bull. 1941; 38:909-943.
4. RESULTADOS PRELIMINARES E PERSPECTIVAS
Até o presente momento, vinte ratos da linhagem Lewis foram adquiridos do
biotério da Unicamp, sendo que 14 foram imunizados com TAChR (cortesia Dr.
Fúlvio baggi). Nenhum dos animais desenvolveu os sinais característicos da fase
aguda e não houve ainda manifestações da fase crônica do modelo. O Início do
programa de atividade física está previsto para o mês de dezembro.
Apesar da descrição clássica do modelo incluir as fases agudas, latente e
crônica, é descrito que os animais poderão, eventualmente, não desenvolver a
fase aguda, apresentando somente a fase crônica da doença (27, 32, 36).
Durante a execução do projeto, alguns pontos merecerão atenção especial,
dentre eles: (1) possível reação infalmatória nas patas decorrente da injeção; (2)
possível variação na resposta imunológica conforme o local de injeção (patas X
dorso); (3) possível utilização de vias alternativas para imunização (p. ex. injeção
diretamente no baço); (4) possível necessidade de adequar o protocolo de
atividade física conforme a evolução e gravidade da doença; e (5) possíveis
manifestações ainda não descritas na literatura.
Apesar das dificuldades inerentes ao desenvolvimento de um modelo
inédito no país, acreditamos que a rede de colaboradores de altíssimo nível com
quem temos tido o privilégio de trabalhar, propiciará o bom êxito de nosso projeto.
Além disso, estamos certos de que a utilização de um modelo experimental de MG
trará uma grande contribuição ao desenvolvimento da fisioterapia aplicada às
doenças neuromusculares.
5. REFERÊNCIAS BIBLIOGRÁFICAS
Adams, RD. et al. Miastenia grave e distúrbios correlatos da transmissão
neuromuscular. In: Adams, RD; Victor, M. Neurologia. Traduzido por: Amaury José
da Cruz Junior et al. 6º ed. Rio de Janeiro: Mac Graw Hill; 1998. p.957-968.
Engel, AG. Acquired autoimmune myasthenia gravis. In: Engel, AG;
Franzini-Armstrong. Myologi. 2ºed. [S.L]: Mc Graw Hill; 1994. p.1769-1797.
Gomes, MM da. Doenças. In: Gomes, M.M. da. Marcos históricos da
neurologia. Rio de Janeiro: Científica Nacional; 1997. p.79-114.
Rowland, LP. Doença da transmissão química na sinapse neuromuscular:
Miastenia grave. In: Kandel, ER, Schwartz, JH, Jessel, TM. Princípios da
neurociência. Traduzido por: Andréa da Silva Torrão. 4a ed. São Paulo: Manole;
2003. p.298-308.
Dale, HH, Fedberg, W, Vogt, M. Release of acetylcholine at voluntary motor
nerve endings. J. Physiol 1936; 86:353-380.
Walker, MB. Treatment of myasthenia gravis with scostigmine. Lancet 1934;
1:1200-1201.
Blalock, A, Masson, MF, Morgan HJ, Riven SS. Myasthenia gravis end
tumors of the thymic region: Report of case in which the tumor was removed. Ann.
Surg 1939; 110: 544-561.
Harvey, AM, Lilienthal, JL Jr., Talbot, SA. Observation on the nature of
myasthenia gravis the phenomena of facilitation and depression of neuromuscular
transmission. Bull Jhons Hopkins Hosp. 1941; 69:547-565
Simpson, JA. Myasthenia gravis: A new hypothesis. Scot. Med. J. 1960;
5:419-422.
Chang, CC, Lee, CY. Electrophysiological study of neuromuscular blocking
action of cobra neurotoxin. Br J. Pharm. Chemother 1966; 28:172-181.
Frambrough, DM, Drachamn, DB. Neuromuscular junction in myasthenia
gravis: Decreased acetylholine receptors. Sciene 1973; 182:293-295.
Phillips II, LH. The epidemiology of myasthenia gravis. Ann. N.Y. Acad. Sci
2003; 998:407-412.
Penn, AS, ROWLAND, LP. Myasthenia gravis. In: ROWLAND, L. P. Merritt’s
neurology. 10ºed Philadelphia: Lippincott Willians e Wilkinkns; 2000. p.721-726
Drachman, DB. Myasthenia gravis and other diseases of the neuromuscular
junction. In: Fauci, AS et al. Harrison’s principles of internal medicine. 15ºed. [S.L]:
Mc Graw Hill; 2001. p.2515-2520.
Mora, A, Cortès, C, Mateo, EM, Pla, M, Cabarrocas, E. Miastenia grave. Rev.
Esp. Anestesiol. Reanim 1990; 37:284-290.
Zuleta, JJ, Fanbug, BL. Respiratory dysfunction in myasthenia gravis. Clinics
in Chest Medicine 1994; 15:683-671.
Calcaterra, TC, Steern, F. The otolatingologist’s role in myasthenia gravis.
American Academy of Ophthalmology and Otolaringology 1972; 76:308. 1972.
Cambier, J, Masson, M, Dehen, H. Patologia muscular. In: Cambier, J,
Masson, M, Dehen, H. Manual de neurologia. Traduzido por: Sergio Augusto
Pereira Noris. Rio de Janeiro: Masson do Brasil; 1980. p.518-536.
Jacobs-Burleigh, A. Synapse e transmissão sináptica. In: Ekman-Lundy, L.
Neurociência: Fundamentos para a reabilitação. Traduzido por: Charles Alfred
Esbérard. Rio de Janeiro: Granabara Koogan; 2000. p. 33-42.
Weiner, P. et al. Respiratory muscle training in patients with moderate to
severe myasthenia gravis. Can. J. Neurol. Sci 1998; 25:236-241.
Arora, NS, Gal, TJ. Cough dynamics during progressive expiratory muscle
weakness in healthy curarized subjects. J. Appl. Physiol 1981; 51:494.
Chaudhuri, A, Obehan, P. Fatigue in neurological disorders. The Lancet
2004; 363:978-987. 2004.
Bennett, JC, Plum, F. Neurologia. In: Bennett, JC, Plum, F. Neurologia. Cecil
tratado de medicina interna. Traduzido por:Maria de Fátima Azevedo. 20ºed. Rio
de Janeiro:Guanabara Koogan;1997. p.2394-2397.
Osserman, KE, Genkis, G. Studies in myasthenia gravis: review of a twentyyear experience in over 1200 patients. MT Sinai J. Méd. 1971; 38:497-537.
Compston, DA, Vicent, A, Newsom-Davis, J, et al. Clinical, pathological, HLA
antigen and immunological evidence for heterogeneity in myasthenia gravis. Brain
1980; 103:579.
Limburg, PC, Hummel-Tapel, E, et al. Antiacetylcholine receptor antibodien in
myasthenia gravis. Part I. Relation to clinical parameters im 250 patients. J.
Neurol. Sci. 1983; 58:357-362.
Oliveira, ABS de, Gabbai, AA. Doenças neuromusculares. In: Prado, FC,
Ramos, JA, Valle, JR do. Atualização terapêutica: Manual prático de diagnóstico e
tratamento. 20ºed. São Paulo: Artes Médicas; 2001. p.815-826.
Kennan, SP. et al. Ventilatory muscle strength and endurance in myasthenia
gravis. Eur. Respir. J. 1995; 8:1130-1135.
Lena-Eva, L, Lindberg, C, Andersen, O. Physical training effects in
myasthenia gravis. Arch Phys Med Rehabil. 1993; 74:1178-1180.
Lindastrom, J. Experimental autoimmune myasthenia gravis. Journal of
Nerology, Neurosurgery, and Psychiatry 1980; 43:568-576.
Kiefer, H, Lindstrom, J, Lennox, ES, Singer, SJ. Photo-affinity labeling of
specific acetylcoline binding sites on membranes. Proc Natl Acad Sci. 1970;
67:1688-1694.
Patrick, J, Lindstrom, J. Autoimmune response to acetylcholine receptor.
Science 1973; 180:871-873.
Lennon,
VA,
Lindstrom,
J,
Seybold,
ME.
Experimental
auto-imune
myasthenia: A model of myasthenia gravis in rats and guinea pigs. J. Exp. Med.
1975; 141:365-1375.
Lindstrom, J. An assay for antibodies to human acetylcholine receptor in
serum from patients with myasthenia gravis. J. Clin. Immunol & Immunopath 1977;
7:36-43.
Lindstrom, JM. Nicotinic acetylcholine receptors of muscle and nerves:
Comparison of their structures, functional roles and vulnerability to pathology. Ann.
NY. Acad. Sci. 2003; 998:41-52
Karlin, A. Akabas, MH. Toward a structural basis for the function of nicotinic
acetylcholine receptors and the cousis. Neuron 1995; 15:1231-1244.
Baggi, F. et al. Immunization with rat, but not Torpedo-derived 97-116 peptide
of the Ach alfa-subunit induces experimental myasthenia gravis in Lewis rat. Ann.
NY. Acad. Sci 2003; 998:391-394.
Baggi, F. et al. Breakdown of tolerance to a self-peptide of acetulcholine
receptor alfa-subunit induces experimental myasthenia gravis in rats. The journal
of Immunology 2004; 172:2697-2703.
Guo-Bao, X, Hans, L. Rat model as tool to develop new immunotherapies.
Immunological Reviews 2001; 184:117-128.
Lindstrom, JM, Einarson, B, Lennon, VA, Seybold, ME. Pathological
mechanisms in EAMG I: Imunogenicity of syngenic muscle acetylcholine receptor
and quantitative extraction of receptor and anti-body receptor complexes for
muscles of rats with experimental autoimmune myasthenia gravis. J. Exp. Med.
1976; 144:726-738.
Lindstrom, JM, Engel, AG, Seybold, ME, Lennon, VA, Lambert, EH.
Pathological mechanisms in EAMG II: Passive transfer of experimental
autoimmune myasthenia gravis in rats with anti-acetylcholine receptor antibodies.
J. Exp. Med. 1976; 144:739-753.
Engel, AG, Lindstrom, JM, Lambert, EH, Lennon, VA. Ultraestructural
localization of the acetylcholine receptor in myasthenia gravis and its experimental
autoimmune model. Neurology 1977; 27:307-315.
Nahas, TR. O teste do campo aberto. In: Gilberto, FX. Técnicas para o
estudo do sistema nervoso. Plêiade: São Paulo; 1999. p197-215.
ABSTRACT
Myasthenia Gravis is caracterized by na alteration in nerve-muscle transmission,
deriving from acetilcolina receptors deficiency in the neuromuscular junction. The
medicine terapy for autoimmune myasthenia gravis provides just symptomatic
relief, witch rarely is complete, do not changing disease’s evolution. The present
research project has the goal to study the effects of physical activity, like an
adjunctive therapy, on the symptoms and the myasthenia gravis evolution through
the use of a experimental model in rats of Lewis lineage. To this, the animals of
experimental group will be immunizes through an emulsion subcutaneous injection
containing the purified acetilcoline receptor (TAChR) or a synthetic peptide with the
receptor molecule immunogenic sequence. After the immunization, the animal will
be weighted and evalued under the motor point or view (open fied test) each seven
days. Elapsed 30 days from immunization, the animals will be sumitted to physical
activity in a rolling mat for thirty minutes during thirty consecutive days. Like
controls, wil be used not immunized rats and not submitted to the physical activity
program. We are right that the utilization of a experimental myasthenia gravis
model will bring a great contribution to development of physiotherapy applied to
neuromuscular diseases.