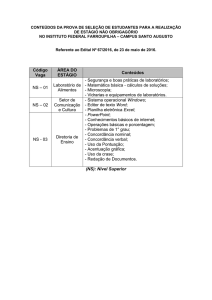
REDE
Capacitação
em
Eventos
LABORATORIAL
DE DENGUE
Área de Produção Editorial e Gráfica
Núcleo de Comunicação
Secretaria de Vigilância em Saúde
23 e 24 de junho de 2010
CGLAB/SVS/MS
[email protected]
27 de outubro de 2011
ESTRUTURA ORGANIZACIONAL DA CGLAB
Coordenação-Geral
Coordenação-Geral Adjunta
Coordenação de
Administração e
Planejamento
GT Administração
GT Planejamento,
Monitoramento e Avaliação
GT Infraestrutura, Insumos e
Tecnologia de Equipamentos
Coordenação de
Laboratórios de Vigilância
em Saúde Ambiental,
Ecologia e Saúde do
Trabalhador
GT Saúde Ambiental
GT Saúde do Trabalhador
GT Entomologia e
Reservatórios de Interesse
da Saúde
Coordenação de
Laboratórios de Vigilância
Epidemiológica
GT Virologia
GT Bacteriologia
GT Parasitologia
GT Micologia e Outras
Etiologias
Coordenação de
Desenvolvimento
Institucional
GT Tecnologia da Informação
GT Ações Estratégicas e
Projetos Especiais
GT Biossegurança e Gestão
da Qualidade
COMPETÊNCIA DA CGLAB
Coordenar, normalizar e supervisionar as sub-redes de
laboratórios
pertencentes
ao
Sistema
Nacional
de
Laboratórios de Saúde Pública , nas atividades de
Vigilância Epidemiológica e Vigilância Ambiental.
Portaria Ministerial nº 15, de 03 de janeiro de 2002
Republicada como Portaria nº 2031 em 2004
Dispõe sobre a organização do Sistema Nacional de
Laboratórios de Saúde Pública - SISLAB
É composto de um conjunto de redes de
laboratórios, organizadas em sub-redes, por :
agravos ou programas
grau de complexidade das atividades, de forma hierarquizada;
atividades relacionadas à vigilância epidemiológica, vigilância
ambiental em saúde, vigilância sanitária e assistência médica.
SISLAB
REDES
DE VIGILÂNCIA
EPIDEMIOLÓGICA
DE VIGILÂNCIA
AMBIENTAL EM
SAÚDE
NACIONAIS
DE VIGILÂNCIA
SANITÁRIA
DE ASSISTÊNCIA
Centros Colaboradores
Laboratórios de Referência Nacional
Laboratórios de Referência Regional
Laboratórios de Referência Estadual
Laboratórios de Referência Municipal
Laboratórios Locais
Laboratórios de Fronteiras
Participar de
cooperações
internacionais
Controlar a
qualidade das análises
nas sub- redes
de laboratórios
Realizar
procedimentos
diagnósticos de alta
complexidade
Capacitar
recursos humanos
Laboratório de
Referência Nacional
Desenvolver estudos
diagnósticos
e pesquisas
Participar na
elaboração
de manuais e normas
técnicas
Disponibilizar ao MS
relatórios técnicos
periódicos
Encaminhar ao LRN,
amostras inconclusivas,
e as de complementação
de diagnósticos
Controlar a
qualidade das análises
LACEN da sua região
Capacitar
recursos humanos
Laboratório de
Referência Regional
Realizar
procedimentos
diagnósticos de maior
complexidade
Assessorar, acompanhar
e avaliar as atividades dos
LACEN da sua região
Disponibilizar ao LRN
relatórios técnicos
periódicos
Rede de Laboratórios de Dengue no Brasil
•
Laboratório de Referência Nacional
INSTITUTO EVANDRO CHAGAS-IEC
Região Norte + Piauí + Maranhão
•
Laboratório de Referência Regional
LACEN/PE- Região Nordeste
Laboratório de Referência Regional
LACEN/DF - Região Centro – Oeste
Laboratório de Referência Regional
FUNDAÇÃO OSWALDO CRUZ -FIOCRUZ/RJ
Região Sudeste + Bahia
Laboratório de Referência Regional
INSTITUTO ADOLFO LUTZ-IAL
Região Sul + São Paulo
Laboratórios Estaduais - LACEN
Coordenar a
rede de laboratórios
públicos e privados
Controlar a
qualidade das análises
na rede
de laboratórios
Complementar
diagnóstico
Capacitar
recursos humanos
Laboratório Estadual
de
Saúde Pública
Encaminhar
amostras ao LRR
Habilitar
laboratórios para
integrar
a rede estadual
Disponibilizar
Informações ao MS
por meio
relatórios
Rede de Laboratórios Estaduais
RR
AP
AM
PA
MA
CE
RN
PB
PI
PE
AC
RO
AL
TO
SE
BA
MT
DF
GO
MG
MS
ES
SP
RJ
PR
SC
Laboratório Central de Saúde Pública - LACEN
RS
Definir, organizar
e coordenar a rede
de laboratórios
Supervisionar e
assessorar a rede
de laboratórios
Realizar análises
básicas
Capacitar
recursos humanos
Laboratórios de
Referência
Municipal
Encaminhar
amostras ao LACEN
Habilitar
laboratórios para
integrar
a rede municipal
Disponibilizar
Informações ao LACEN
por meio
relatórios
Desenvolver estudos,
pesquisas e ensino de
interesse do gestor
nacional
Colaborar no
desenvolvimento
científico e
tecnológico das
unidades da rede
Centro Colaborador
Realizar
procedimentos
diagnósticos de alta
complexidade
Capacitar
recursos humanos
Disponibilizar ao MS
relatórios técnicos
periódicos
DIAGNÓSTICO LABORATORIAL
LRN e CC:
Exames de alta complexidade
LRR:
Confirmação das amostras,
técnicas mais avançadas
LACEN:
Sorologia (27), Isolamento (19), RT-PCR (10)
Laboratórios Municipais:
Sorologia
Obs: As metodologias desenvolvidas em cada estado podem variar, conforme a condição técnica
instalada nos laboratórios.
Em caso de surto, 10 % das amostras devem ser processadas no laboratório, e o fechamento das
outras amostras será critério epidemiológico
SITUAÇÃO ATUAL DA REDE DE DENGUE
• 1 Laboratório de Referência (IEC/PA) e 5 Laboratórios de Referência
Regional (IAL/SP, FIOCRUZ/RJ, LACEN/DF, LACEN/PE e IEC/PA)
• 27 LACEN e 117 Laboratórios Municipais realizam sorologia para
dengue
• 17 LACEN e 2 Institutos realizam Isolamento Viral
(GO, MS, DF, CE, PE, BA, AL, MG, RJ, SP, TO, PR, RR, RN, AP, ES,
RO, IEC/PA e FIOCRUZ/RJ)
• 8 LACEN e 2 Institutos realizam RT-PCR
(CE, GO, PE, RS, RJ, DF, MG IAL/SP, IEC/PA e FIOCRUZ/RJ)
PRINCIPAIS
Capacitação
em Eventos
TÉCNICAS
LABORATORIAIS
Área de Produção Editorial e Gráfica
Núcleo de Comunicação
Secretaria de Vigilância em Saúde
23 e 24 de junho de 2010
PARA DENGUE
SOROTIPOS DE DENGUE ISOLADOS
POR UF, 2011
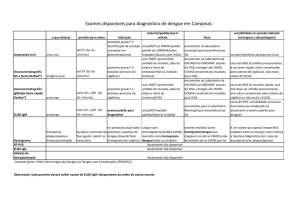
VIGILÂNCIA LABORATORIAL
Diagnóstico Sorológico
Diagnóstico Virológico
UF
Examinados
Positivos
% positividade
Inoculados
Positivos
% positividade
DEN 1
DEN 2
DEN 3
DEN 4
GO
13042
6628
50,8
1701
313
18,4
302
10
1
0
DF
4089
1512
37,0
271
92
33,9
89
2
1
0
MS
8135
3400
41,8
496
62
12,5
60
2
0
0
MT
1717
313
18,2
90
4
4,4
3
1
0
0
RS
2372
600
25,3
125
53
42,4
50
1
0
2
PR
39467
17375
44,0
499
243
48,7
228
12
0
3
SC
783
133
17,0
4
1
25,0
1
0
0
0
SP
73907
36496
49,4
3161
1707
54,0
1623
46
7
31
RJ-FIOCRUZ
288
126
43,8
1031
363
35,2
264
85
0
14
RJ
12540
7049
56,2
762
188
24,7
172
16
0
0
MG
30621
12893
42,1
847
85
10,0
77
5
1
2
ES
24324
15826
65,1
1118
582
52,1
511
63
8
0
AC
5035
2065
41,0
125
45
36,0
44
0
1
0
AP
1330
566
42,6
1
0
0,0
0
0
0
0
AM
7316
4336
59,3
349
128
36,7
31
53
0
44
PA
8561
3346
39,1
588
110
18,7
70
29
0
11
RO
1915
731
38,2
103
3
2,9
2
1
0
0
RR
1.120
298
26,6
56
7
12,5
2
3
0
2
TO
6856
3152
46,0
243
26
10,7
16
10
0
0
AL
966
366
37,9
81
6
7,4
6
0
0
0
BA
39063
17708
45,3
2534
786
31,0
595
86
3
102
CE
34097
18656
54,7
1149
290
25,2
283
1
4
2
MA
3678
1802
49,0
198
29
14,6
24
2
0
3
PB
6136
3895
63,5
183
9
4,9
6
1
1
0
PE
7179
4646
64,7
1225
58
4,7
31
21
4
2
PI
3564
1830
51,3
394
68
17,3
63
1
0
4
RN
5992
3919
65,4
647
240
37,1
184
48
0
8
SE
2963
1388
46,8
8
4
50,0
4
0
0
0
TOTAL
347056
171055
49,3
17989
5502
30,6
4741
499
31
230
* Dados atualizados até setembro 2011
DIAGNÓSTICO LABORATORIAL
Pesquisa de Vírus
Isolamento: Cultura de células C6/36 ou Inoculação em
camundongos recem-nascidos.
Detecção de ácido nucléico: RT-PCR
Pesquisa de Anticorpos
Ensaio imunoenzimático: MAC-ELISA, Elisa IgG, Elisa IgM
Inibição da hemaglutinação (IH)
Kits Comerciais
Exame Histopatológico e Detecção de Antígeno por Imunohistoquímica
ISOLAMENTO VIRAL
É a técnica padrão ouro (gold standard) para diagnóstico virológico.
Permite a identificação do sorotipo viral (DEN 1, DEN 2, DEN 3 e DEN 4).
A replicação do vírus é evidenciada pela produção de efeito citopático, ou
seja, alterações na morfologia celular.
A técnica possui grande sensibilidade (capaz de detectar quantidades
mínimas do vírus).
A coleta do material deve ser feita na fase aguda da doença ou seja no
período de viremia.
ISOLAMENTO VIRAL EM CULTURA DE
CÉLULAS C6/36
A
B
A – Sangue, soro (fase aguda)
B – suspensão de tecido (óbito)
Imunofluorescência direta
(A) células não inoculadas
(B) células infectadas - VFA
REAÇÃO EM CADEIA DA POLIMERASE
TRANSCRIPTASE REVERSA (RT-PCR)
• É uma técnica de biologia molecular altamente específica e
sensível.
• Permite a detecção e a amplificação gênica sequencial de
fragmentos de DNA do vírus. .
Identifica os sorotipos virais da dengue.
REVERSE TRANSCRIPTASE - POLIMERASE
CHAIN REACTION (RT-PCR)
1 - Negativo
2 - Dengue 1
3 - Dengue 2
4 - Dengue 3
5 - Dengue 4
6 - Negativo
7 - Água
8 - Peso molecular
IDENTIFICAÇÃO
1
2
3
4
5
6
7
8
VISUALIZAÇÃO
Fonte: Lanciotti et al., 1991
FATORES QUE INTERFEREM NO SUCESSO DAS
TÉCNICAS DE ISOLAMENTO VIRAL E RT-PCR
Coleta do material feita fora do período de viremia.
Manipulação inadequada da amostra (contaminação).
Termolabilidade do vírus
Armazenamento fora das condições ideais.
Longo período de transporte da amostra até o LACEN
Ausência de informações importantes para o direcionamento da técnica a
ser executada: data de início dos sintomas; data da coleta
KITS COMERCIAIS
1. KIT ELISA IGM
- Ensaio imunoenzimático
- Amostras de soro coletadas após o 5º dia de início dos
sintomas
2. KIT ELISA NS1
- Ensaio imunoenzimático para detecção qualitativa do
antígeno NS1
- Amostras de soro até o 3º dia de início dos sintomas
- Triagem para o isolamento viral
MAC - ELISA
Considerada técnica padrão-ouro para captura de Anticorpos IgM
Anticorpos IgM são capturados do soro do paciente para a parede
dos poços da placa por um anticorpo “anti IgM humana”
O anticorpo IgM capturado é colocado para reagir com antígeno do
VDEN.
Se a IgM investigada estiver presente, o respectivo antígeno se liga
à
mesma.
A
presença
do
complexo
antígeno-anticorpo
é
demonstrado pelo sistema revelador do teste (conjugado e
substrato)
Permite realizar o diagnóstico presuntivo de infecções recente ou
ativa
MAC ELISA
Microplaca para teste de ELISA
Anti-IgM humana
IgM humana (soro do paciente)
Antígeno
Conjugado ( peroxidase)
Substrato (Sistema ABTS)
FATORES QUE INTERFEREM NO SUCESSO
DA TÉCNICA DE MAC ELISA
Coleta do material feita no período de viremia ocasionando
resultados falso-negativos.
Em caso de infecção secundária o sistema imune do paciente
responde com uma quantidade de IgM muitas vezes indetectável.
Manipulação inadequada da amostra(contaminação).
Armazenamento fora das condições idéias (desnaturação de
proteínas).
Sensibilidade e Especificidade do kit.
SENSIBILIDADE DA TÉCNICA DE
ISOLAMENTO/SOROLOGIA
ELISA
Isolamento
0
2
4
Dias pós-infecção
6
8
10
INIBIÇÃO DE HEMAGLUTINAÇÃO
É utilizado em infecções secundárias, onde a produção do IgM ocorre
em níveis baixos.
É um teste simples e rápido e pode ser utlizado para qualquer vírus
que cause hemaglutinação.
A técnica é baseada na capacidade que as proteínas (hemaglutininas)
existentes na superfície do DENV, tem de aglutinar hemácias de
ganso e humanas do grupo O. A presença de anticorpos específicos
na
amostras
de
soro
do
paciente
irá
inibir
a
capacidade
hemaglutinante do vírus.
O teste deve ser realizado em amostras pareadas
O soro teste é incubado em diferentes diluições contra uma
quantidade fixa de vírus.
INIBIÇÃO DE HEMAGLUTINAÇÃO
Anticorpos anti-VDEN
Anticorpo não específico
Antígeno do VDEN
Hemácias de Ganso
HEMAGLUTINAÇÃO
INIBIÇÃO DA
HEMAGLUTINAÇÃO
IMUNOHISTOQUÍMICA
O objetivo principal é o encontro e localização
topográfica de antígenos nos tecidos ou
células.
Tem sua maior aplicação no estudo de
doenças infecciosas e neoplásicas.
COLETA DE AMOSTRAS
CONCEITO
CONCEITO
CONCEITO
Paciente com Suspeita
de Dengue
Coletar amostra
Sangue Total/Soro
Isolamento -Pesquisa do
vírus
Sangue Total/Soro
Sorologia –Pesquisa de
Anticorpos
A partir do 5º dia
1º ao 5º dia de doença
Conservar a –70ºC
Conservar a –20ºC
Positivo IgM
Confirmado por Lab.
Negativo IgM
Descartado
COLETA, CONSERVAÇÃO
CONCEITO E TRANSPORTE
DE AMOSTRAS PARA PESQUISA DE VÍRUS
Espécime/Coleta
Sangue* (soro)/
até 5 dias após o
início dos sintomas
Tecidos (óbito)/
Ideal: 8 hs
Máximo: 24 hs
Tipo de
Análise
Conservação/
Transporte
-70 °C/
Gelo seco
Isolamento viral
PCR
-70 °C/
Gelo seco
Isolamento viral
PCR
* Retração do coágulo: 2 - 6 horas a 4° C.
COLETA, CONSERVAÇÃO E TRANSPORTE DE
AMOSTRAS PARA PESQUISA DE ANTICORPOS
Espécime/
Coleta
Conservação
/ Transporte
Tipo de
Análise
-20° C/
Gelo seco ou comum
Detecção de
anticorpos IgM
(MAC-ELISA)
1ª amostra: até 7 dias
-20° C/
2ª amostra: 14° - 30° dias Gelo seco ou comum
(após o início dos sintomas)
Detecção de
anticorpos IgG
(IH, ELISA)
Sangue* (soro)/
> 5 dias após o
início dos sintomas
Sangue* (soro)/
* Retração do coagulo: 2 - 24 horas à temperatura ambiente.
EXAME HISTOPATOLÓGICO
Espécime/
Coleta
Tecidos (óbito)
Ideal: 8 hs
Máximo: 24 hs
Conservação/
Transporte
Temperatura
ambiente/
Formalina
tamponada
Tipo de
Análise
Histopatologia
Imunohistoquimica
FLUXO DE ENVIO DA AMOSTRA
FLUXO DE ENVIO DE INFORMAÇÕES
CGLAB
Programa
Laboratórios de Referência Nacional
Laboratório de Referência Regional
Laboratório de Referência Estadual LACEN
Vig. Epidemiológica Estadual
Laboratório de Referência Municipal
Vig. Epidemiológica Municipal
Unidade Básica/Laboratório
Local/Unidades Hospitalares
Laboratório de
Saúde Pública
Vigilância em
Saúde
Assistência em
Saúde
Ações em Saúde
OBRIGADA !!!
[email protected]
61-32138264